In-situ-Abfangmethode zur Metallierung funktionalisierter Arene und Heteroarene mit TMPLi in Gegenwart von ZnCl2 und anderen Metallsalzen†
M. Sc. Annette Frischmuth
Department Chemie, Ludwig-Maximilians-Universität München, Butenandtstraße 5-13, Haus F, 81377 München (Deutschland)
Search for more papers by this authorDr. Maitane Fernández
Department Chemie, Ludwig-Maximilians-Universität München, Butenandtstraße 5-13, Haus F, 81377 München (Deutschland)
Search for more papers by this authorM. Sc. Nadja M. Barl
Department Chemie, Ludwig-Maximilians-Universität München, Butenandtstraße 5-13, Haus F, 81377 München (Deutschland)
Search for more papers by this authorM. Sc. Florian Achrainer
Department Chemie, Ludwig-Maximilians-Universität München, Butenandtstraße 5-13, Haus F, 81377 München (Deutschland)
Search for more papers by this authorProf. Dr. Hendrik Zipse
Department Chemie, Ludwig-Maximilians-Universität München, Butenandtstraße 5-13, Haus F, 81377 München (Deutschland)
Search for more papers by this authorDr. Guillaume Berionni
Department Chemie, Ludwig-Maximilians-Universität München, Butenandtstraße 5-13, Haus F, 81377 München (Deutschland)
Search for more papers by this authorProf. Dr. Herbert Mayr
Department Chemie, Ludwig-Maximilians-Universität München, Butenandtstraße 5-13, Haus F, 81377 München (Deutschland)
Search for more papers by this authorProf. Dr. Konstantin Karaghiosoff
Department Chemie, Ludwig-Maximilians-Universität München, Butenandtstraße 5-13, Haus F, 81377 München (Deutschland)
Search for more papers by this authorCorresponding Author
Prof. Dr. Paul Knochel
Department Chemie, Ludwig-Maximilians-Universität München, Butenandtstraße 5-13, Haus F, 81377 München (Deutschland)
Department Chemie, Ludwig-Maximilians-Universität München, Butenandtstraße 5-13, Haus F, 81377 München (Deutschland)Search for more papers by this authorM. Sc. Annette Frischmuth
Department Chemie, Ludwig-Maximilians-Universität München, Butenandtstraße 5-13, Haus F, 81377 München (Deutschland)
Search for more papers by this authorDr. Maitane Fernández
Department Chemie, Ludwig-Maximilians-Universität München, Butenandtstraße 5-13, Haus F, 81377 München (Deutschland)
Search for more papers by this authorM. Sc. Nadja M. Barl
Department Chemie, Ludwig-Maximilians-Universität München, Butenandtstraße 5-13, Haus F, 81377 München (Deutschland)
Search for more papers by this authorM. Sc. Florian Achrainer
Department Chemie, Ludwig-Maximilians-Universität München, Butenandtstraße 5-13, Haus F, 81377 München (Deutschland)
Search for more papers by this authorProf. Dr. Hendrik Zipse
Department Chemie, Ludwig-Maximilians-Universität München, Butenandtstraße 5-13, Haus F, 81377 München (Deutschland)
Search for more papers by this authorDr. Guillaume Berionni
Department Chemie, Ludwig-Maximilians-Universität München, Butenandtstraße 5-13, Haus F, 81377 München (Deutschland)
Search for more papers by this authorProf. Dr. Herbert Mayr
Department Chemie, Ludwig-Maximilians-Universität München, Butenandtstraße 5-13, Haus F, 81377 München (Deutschland)
Search for more papers by this authorProf. Dr. Konstantin Karaghiosoff
Department Chemie, Ludwig-Maximilians-Universität München, Butenandtstraße 5-13, Haus F, 81377 München (Deutschland)
Search for more papers by this authorCorresponding Author
Prof. Dr. Paul Knochel
Department Chemie, Ludwig-Maximilians-Universität München, Butenandtstraße 5-13, Haus F, 81377 München (Deutschland)
Department Chemie, Ludwig-Maximilians-Universität München, Butenandtstraße 5-13, Haus F, 81377 München (Deutschland)Search for more papers by this authorDiese Forschung wurde von der Deutschen Forschungsgesellschaft finanziert (SFB749, B2). Wir danken zudem der BASF AG (Ludwigshafen) und Rockwood Lithium GmbH (Frankfurt) für die großzügige Bereitstellung von Chemikalien.
Abstract
Zugabe von TMPLi zu Mischungen einer aromatischen oder heteroaromatischen Verbindung und eines Metallsalzes, beispielsweise MgCl2, ZnCl2 oder CuCN, bei −78 °C führt zunächst zu einer Lithiierung des Arens gefolgt von einer Transmetallierung mit dem Metallsalz zu funktionalisierten Mg-, Zn- bzw. Cu-Organometallverbindungen. Diese In-situ-Abfangmethode ermöglicht die schnelle Metallierung einer Vielzahl an empfindlichen Pyridinen (mit Nitro-, Ester-, oder Cyangruppen) und gestattet die Herstellung kinetischer Regioisomere funktionalisierter Arene und Heterocyclen, die durch übliche Metallierungsreagentien wie TMPMgCl⋅LiCl oder TMPZnCl⋅LiCl nicht zugänglich sind.
Supporting Information
As a service to our authors and readers, this journal provides supporting information supplied by the authors. Such materials are peer reviewed and may be re-organized for online delivery, but are not copy-edited or typeset. Technical support issues arising from supporting information (other than missing files) should be addressed to the authors.
| Filename | Description |
|---|---|
| ange_201403688_sm_miscellaneous_information.pdf4 MB | miscellaneous_information |
Please note: The publisher is not responsible for the content or functionality of any supporting information supplied by the authors. Any queries (other than missing content) should be directed to the corresponding author for the article.
References
- 1
- 1aJ. Clayden, Organolithiums: Selectivity for Synthesis, Elsevier, Oxford, 2002;
- 1bV. Snieckus, Chem. Rev. 1990, 90, 879;
- 1cP. Beak, V. Snieckus, Acc. Chem. Res. 1982, 15, 306;
- 1dM. Schlosser, Organometallics in Synthesis, 3. Aufl. (Hrsg.: ), Wiley, New York, 2013, Kap. 1;
- 1eT.-L. Ho in Fieser and Fieser’s Reagents for Organic Synthesis, Wiley, Hoboken, 2011 und frühere Bände;
- 1fR. E. Mulvey, S. D. Robertson, Angew. Chem. 2013, 125, 11682; Angew. Chem. Int. Ed. 2013, 52, 11470;
- 1gC. Unkelbach, D. F. O’Shea, C. Strohmann, Angew. Chem. 2014, 126, 563;
10.1002/ange.201306884 Google ScholarAngew. Chem. Int. Ed. 2014, 53, 553;
- 1hA. Salomone, F. M. Perna, A. Falcicchio, S. O. N. Lill, A. Moliterni, R. Michel, S. Florio, D. Stalke, V. Capriati, Chem. Sci. 2014, 5, 528.
- 2
- 2aC. L. Kissel, B. Rickborn, J. Org. Chem. 1972, 37, 2060;
- 2bM. W. Rathke, R. Kow, J. Am. Chem. Soc. 1972, 94, 6854.
- 3
- 3aR. E. Mulvey, F. Mongin, M. Uchiyama, Y. Kondo, Angew. Chem. 2007, 119, 3876; Angew. Chem. Int. Ed. 2007, 46, 3802;
- 3bA. Harrison-Marchand, F. Mongin, Chem. Rev. 2013, 113, 7470;
- 3cE. Crosbie, A. R. Kennedy, R. E. Mulvey, S. D. Robertson, Dalton Trans. 2012, 41, 1832;
- 3dY. Kondo, M. Shilai, M. Uchiyama, T. Sakamoto, J. Am. Chem. Soc. 1999, 121, 3539;
- 3eF. Mongin, A. Bucher, J. P. Bazureau, O. Bayh, H. Awad, F. Trécourt, Tetrahedron Lett. 2005, 46, 7989.
- 4
- 4aL. Gupta, A. C. Hoepker, K. J. Singh, D. B. Collum, J. Org. Chem. 2009, 74, 2231;
- 4bY. Ma, A. C. Hoepker, L. Gupta, M. F. Faggin, D. B. Collum, J. Am. Chem. Soc. 2010, 132, 15610;
- 4cD. R. Armstrong, A. R. Kennedy, R. E. Mulvey, J. A. Parkinson, S. D. Robertson, Chem. Sci. 2012, 3, 2700.
- 5
- 5aA. Krasovskiy, V. Krasovskaya, P. Knochel, Angew. Chem. 2006, 118, 3024;
10.1002/ange.200504024 Google ScholarAngew. Chem. Int. Ed. 2006, 45, 2958;
- 5bW. Lin, O. Baron, P. Knochel, Org. Lett. 2006, 8, 5673;
- 5cM. Mosrin, P. Knochel, Org. Lett. 2008, 10, 2497;
- 5dM. Mosrin, T. Bresser, P. Knochel, Org. Lett. 2009, 11, 3406;
- 5eC. Despotopoulou, L. Klier, P. Knochel, Org. Lett. 2009, 11, 3326.
- 6
- 6aG. C. Clososki, C. J. Rohbogner, P. Knochel, Angew. Chem. 2007, 119, 7825;
10.1002/ange.200701487 Google ScholarAngew. Chem. Int. Ed. 2007, 46, 7681;
- 6bC. J. Rohbogner, G. C. Clososki, P. Knochel, Angew. Chem. 2008, 120, 1526;
10.1002/ange.200703382 Google ScholarAngew. Chem. Int. Ed. 2008, 47, 1503;
- 6cM. Mosrin, N. Boudet, P. Knochel, Org. Biomol. Chem. 2008, 6, 3237;
- 6dP. Knochel, M. Mosrin, M. Petrera, Synthesis 2008, 3697.
- 7
- 7aM. Mosrin, P. Knochel, Org. Lett. 2009, 11, 1837;
- 7bT. Bresser, M. Mosrin, G. Monzon, P. Knochel, J. Org. Chem. 2010, 75, 4686;
- 7cG. Monzon, P. Knochel, Synlett 2010, 304;
- 7dT. Bresser, G. Monzon, M. Mosrin, P. Knochel, Org. Process Res. Dev. 2010, 14, 1299.
- 8
- 8aS. H. Wunderlich, P. Knochel, Angew. Chem. 2007, 119, 7829;
10.1002/ange.200701984 Google ScholarAngew. Chem. Int. Ed. 2007, 46, 7685;
- 8bS. H. Wunderlich, P. Knochel, Chem. Commun. 2008, 6387;
- 8cM. Mosrin, P. Knochel, Chem. Eur. J. 2009, 15, 1468.
- 9B. Haag, M. Mosrin, I. Hiriyakkanavar, V. Malakhov, P. Knochel, Angew. Chem. 2011, 123, 9968;
10.1002/ange.201101960 Google ScholarAngew. Chem. Int. Ed. 2011, 50, 9794.
- 10
- 10aM. Jaric, B. A. Haag, A. Unsinn, K. Karaghiosoff, P. Knochel, Angew. Chem. 2010, 122, 5582;
10.1002/ange.201002031 Google ScholarAngew. Chem. Int. Ed. 2010, 49, 5451;
- 10bS. M. Manolikakes, M. Jaric, K. Karaghiosoff, P. Knochel, Chem. Commun. 2013, 49, 2124;
- 10cK. Groll, S. M. Manolikakes, X. M. du Jourdin, M. Jaric, A. Bredihhin, K. Karaghiosoff, P. Knochel, Angew. Chem. 2013, 125, 6909;
10.1002/ange.201301694 Google ScholarAngew. Chem. Int. Ed. 2013, 52, 6776;
- 10dA. Unsinn, S. H. Wunderlich, A. Jana, K. Karaghiosoff, P. Knochel, Chem. Eur. J. 2013, 19, 14687;
- 10eT. Klatt, D. Sustac, T. Leon, P. Knochel, Org. Lett. 2014, 16, 1232.
- 11
- 11aT. D. Krizan, J. C. Martin, J. Am. Chem. Soc. 1983, 105, 6155;
- 11bM. Lysen, J. Kristensen, M. Lysén, P. Vedsø, M. Begtrup, Org. Lett. 2001, 3, 1435;
- 11cH. M. Hansen, M. Begtrup, J. L. Kristensen, J. Org. Chem. 2006, 71, 2518;
- 11dP. E. Eaton, R. M. Martin, J. Org. Chem. 1988, 53, 2728.
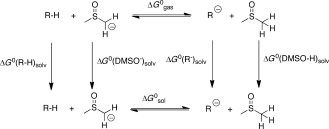
- 12C-H-Aziditäten wurden gemäß des Protokolls von Guo und Mitarbeitern berechnet[18] und beinhalten Gasphasen-Freie-Energie-Berechnungen mit dem B3LYP-Hybrid-Funktional in Kombination mit dem 6–311++G(2df,2p)-Basissatz. Lösungsmitteleffekte wurden dann durch Einzelpunktberechnungen mit dem SMD-Kontinuum-Solvationsmodell[20] für DMSO in Kombination mit der B3LYP/6-31G(d)-Theorie bestimmt. Die Ausgleichswerte für einen Referenz-Datensatz mit bekannten pKs-Werten und somit die verlässlichsten Ergebnisse wurden unter Verwendung von DMSO als Referenz mit pKs=+35.1[19] erhalten. Da fast alle metallorganischen Transformationen in THF durchgeführt werden, wurden die erhaltenen pKs-Werte in DMSO auf THF mithilfe der Streitwieser-Linearkorrelation korrigiert[21] (siehe die Hintergrundinformationen). Der thermochemische Zyklus für die pKs-Berechnung von Kohlenwasserstoff R-H unter Verwendung des DMSO-Anions als Referenzbase in DMSO-Lösungen ist hier gezeigt:
- 13M. C. Whisler, S. MacNeil, V. Snieckus, P. Beak, Angew. Chem. 2004, 116, 2256;
10.1002/ange.200300590 Google ScholarAngew. Chem. Int. Ed. 2004, 43, 2206.
- 14
- 14aA. Seggio, F. Chevallier, M. Vaultier, F. Mongin, J. Org. Chem. 2007, 72, 6602;
- 14bJ.-M. L'Helgoual'ch, A. Seggio, F. Chevallier, M. Yonehara, E. Jeanneau, M. Uchiyama, F. Mongin, J. Org. Chem. 2008, 73, 177;
- 14cK. Snégaroff, S. Komagawa, F. Chevallier, P. C. Gros, S. Golhen, T. Roisnel, M. Uchiyama, F. Mongin, Chem. Eur. J. 2010, 16, 8191;
- 14dF. Chevallier, Y. S. Halauko, C. Pecceu, I. F. Nassar, T. U. Dam, T. Roisnel, V. E. Matulis, O. A. Ivashkevich, F. Mongin, Org. Biomol. Chem. 2011, 9, 4671;
- 14eP. García-Álvarez, R. E. Mulvey, J. A. Parkinson, Angew. Chem. 2011, 123, 9842;
10.1002/ange.201104297 Google ScholarAngew. Chem. Int. Ed. 2011, 50, 9668.
- 15Die Regioselektivität ist gewissermaßen abhängig vom Metallsalz und dem Elektrophil, das für die In-situ-Abfangmethode verwendet wurde. Siehe die Hintergrundinformationen.
- 1613C-NMR-Experimente zeigten die gleichen Zinkspezies für beide Experimente. Für Details, siehe die Hintergrundinformationen.
- 17Unter Verwendung von TMPLi in Anwesenheit von MgCl2 und anschließendem Abfangen mit Iod erhält man das 2-Cyan-3-iodpyridin mit 72 % Ausbeute; alternativ dazu ergeben die Metallierung mit TMPLi bei −78 °C und das Abfangen mit Iod eine Ausbeute von 53 %. T. Cailly, F. Fabis, S. Lemaître, A. Bouillon, S. Rault, Tetrahedron Lett. 2005, 46, 135.
- 18K. Shen, Y. Fu, J.-N. Li, L. Liu, Q.-X. Guo, Tetrahedron 2007, 63, 1568.
- 19A. V. Marenich, C. J. Cramer, D. G. Truhlar, J. Phys. Chem. B 2009, 113, 6378.
- 20W. S. Matthews, J. E. Bares, J. E. Bartmess, F. G. Bordwell, F. J. Cornforth, G. E. Drucker, Z. Margolin, R. J. McCallum, G. J. McCallum, N. R. Vanier, J. Am. Chem. Soc. 1975, 97, 7006.
- 21A. Streitwieser, D. Z. Wang, M. Stratakis, A. Facchetti, R. Gareyev, A. Abbotto, J. A. Krom, K. V. Kilway, Can. J. Chem. 1998, 76, 765.
Citing Literature
This is the
German version
of Angewandte Chemie.
Note for articles published since 1962:
Do not cite this version alone.
Take me to the International Edition version with citable page numbers, DOI, and citation export.
We apologize for the inconvenience.




