Metall oder kein Metall: Das ist hier die Frage!†
Dipl.-Chem. Michael Schwarz
Universität Regensburg, Institut für Organische Chemie, Universitätsstraße 31, 93053 Regensburg (Deutschland) http://www-oc.chemie.uni-regensburg.de/reiser
Search for more papers by this authorCorresponding Author
Prof. Dr. Oliver Reiser
Universität Regensburg, Institut für Organische Chemie, Universitätsstraße 31, 93053 Regensburg (Deutschland) http://www-oc.chemie.uni-regensburg.de/reiser
Universität Regensburg, Institut für Organische Chemie, Universitätsstraße 31, 93053 Regensburg (Deutschland) http://www-oc.chemie.uni-regensburg.de/reiserSearch for more papers by this authorDipl.-Chem. Michael Schwarz
Universität Regensburg, Institut für Organische Chemie, Universitätsstraße 31, 93053 Regensburg (Deutschland) http://www-oc.chemie.uni-regensburg.de/reiser
Search for more papers by this authorCorresponding Author
Prof. Dr. Oliver Reiser
Universität Regensburg, Institut für Organische Chemie, Universitätsstraße 31, 93053 Regensburg (Deutschland) http://www-oc.chemie.uni-regensburg.de/reiser
Universität Regensburg, Institut für Organische Chemie, Universitätsstraße 31, 93053 Regensburg (Deutschland) http://www-oc.chemie.uni-regensburg.de/reiserSearch for more papers by this authorWir danken der Studienstiftung des deutschen Volkes für finanzielle Unterstützung (Stipendium für M.S.).
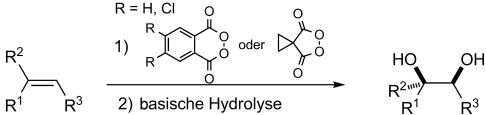
Graphical Abstract
Dihydroxylierung mit Peroxiden: Das 1,2-Dihydroxy-Strukturmotiv, erhältlich aus einer CC-Bindung, ist in organischen Verbindungen weit verbreitet. Fortschritte im Bereich der syn-Dihydroxylierung von Alkenen mit cyclischen Acylperoxiden erweitern den Anwendungsbereich dieser Umsetzung auf eine Vielzahl an Olefinen. Die Anwendungsmöglichkeiten und Einschränkungen sowie ein Mechanismus dieser Methode werden diskutiert.
References
- 1aP. S. Bailey, Chem. Rev. 1958, 58, 925–1010;
- 1bS. G. Van Ornum, R. M. Champeau, R. Parizia, Chem. Rev. 2006, 106, 2990–3001;
- 1cT. I. Zvereva, V. G. Kasradze, O. B. Kazakova, O. S. Kukovinets, Russ. J. Org. Chem. 2010, 46, 1431–1451;
- 1dT. M. K. Shing in Comprehensive Organic Synthesis, Bd. 7 (Hrsg.: ), Pergamon, Oxford, 1991, S. 703–716;
- 1eE. Block, A. L. Schwan in Comprehensive Organic Synthesis, Bd. 4 (Hrsg.: ), Pergamon, 1991, S. 344–348;
- 1fM. B. Smith, J. March in March’s Advanced Organic Chemistry, 6. Aufl., Wiley, Hoboken, 2006, S. 1152–1154;
10.1002/0470084960 Google Scholar
- 1gJ. A. Keith, P. M. Henry, Angew. Chem. 2009, 121, 9200–9212;
10.1002/ange.200902194 Google ScholarAngew. Chem. Int. Ed. 2009, 48, 9038–9049.
- 2aQ.-H. Xi, H.-Q. Qe, C.-P. Ye, Z.-M. Liu, K.-X. Su, Chem. Rev. 2005, 105, 1603–1662;
- 2bE. N. Jacobsen, W. Zhang, A. R. Muci, J. R. Ecker, L. Deng, J. Am. Chem. Soc. 1991, 113, 7063–7064;
- 2cR. Irie, K. Noda, Y. Ito, N. Matsumoto, T. Katsuki, Tetrahedron Lett. 1990, 31, 7345–7348;
- 2dT. Katsuki, Coord. Chem. Rev. 1995, 140, 189–214;
- 2eT. Katsuki, K. B. Sharpless, J. Am. Chem. Soc. 1980, 102, 5976–5978;
- 2fE. N. Jacobsen, I. Markó, W. S. Mungall, G. Schröder, K. B. Sharpless, J. Am. Chem. Soc. 1988, 110, 1968–1970;
- 2gH. C. Kolb, M. S. VanNieuwenhze, K. B. Sharpless, Chem. Rev. 1994, 94, 2483–2547;
- 2hK. B. Sharpless, W. Amberg, M. Beller, H. Chen, J. Hartung, Y. Kawanami, D. Lübben, E. Manouri, Y. Ogino, T. Shibata, T. Ukita, J. Org. Chem. 1991, 56, 4585–4588;
- 2iG. Li, H.-T. Chang, K. B. Sharpless, Angew. Chem. 1996, 108, 449–452; Angew. Chem. Int. Ed. Engl. 1996, 35, 451–454;
- 2jO. Reiser, Angew. Chem. 1996, 108, 1406–1408;
10.1002/ange.19961081207 Google ScholarAngew. Chem. Int. Ed. Engl. 1996, 35, 1308–1309.
- 3Osmium-freie Dihydroxylierungen: C. J. R. Bataille, T. J. Donohoe, Chem. Soc. Rev. 2011, 40, 114–238, zit. Lit.
- 4aJ. O. Edwards, R. H. Pater, R. Curci, F. Di Furia, Photochem. Photobiol. 1979, 30, 63–70;
- 4bR. Curci, M. Fiorentino, L. Troisi, J. Org. Chem. 1980, 45, 4758–4760;
- 4cR. Curci, M. Fiorentino, M. R. Serio, J. Chem. Soc. Chem. Commun. 1984, 155–156;
- 4dS. E. Denmark, Z. Wu, Synlett 1999, 847–859;
- 4eM. Frohn, Y. Shi, Synthesis 2000, 1979–2000;
- 4fY. Tu, Z.-X. Wang, Y. Shi, J. Am. Chem. Soc. 1996, 118, 9806–9807;
- 4gZ.-X. Wang, Y. Tu, M. Frohn, J.-R. Zhang, Y. Shi, J. Am. Chem. Soc. 1997, 119, 11224–11235.
- 5Detaillierte Reaktionsbedingungen siehe Lit. [4g]. Shi et al. konnten ebenfalls die asymmetrische Induktion leicht erhöhen, indem sie die Temperatur und das Lösungsmittel wechselten. Da dies keinen Einfluss auf die katalytische Aktivität hat, ist es nicht in Schema 1 gezeigt.
- 6
- 6aC. Döbler, G. M. Mehltretter, U. Sundermeier, M. Beller, J. Organomet. Chem. 2001, 621, 70–76;
- 6bL. Ahrgren, L. Sutin, Org. Process Res. Dev. 1997, 1, 425–427;
- 6cX. Lu, Z. Xhu, G. Yang, Org. Process Res. Dev. 2000, 4, 575–576.
- 7G. B. Haxel, J. B. Hedrick, G. J. Orris, “Rare Earth Elements—Critical Resources for High Technology” in U.S. Geological Survey Fact Sheet087-2, 2002.
- 8
- 8aF. D. Greene, J. Am. Chem. Soc. 1956, 78, 2246–2250;
- 8bF. D. Greene, J. Am. Chem. Soc. 1956, 78, 2250–2254;
- 8cF. D. Greene, W. W. Rees, J. Am. Chem. Soc. 1958, 80, 3432–3437;
- 8dF. D. Greene, J. Am. Chem. Soc. 1959, 81, 1503–1506;
- 8eF. D. Greene, W. W. Rees, J. Am. Chem. Soc. 1960, 82, 890–893;
- 8fF. D. Greene, W. W. Rees, J. Am. Chem. Soc. 1960, 82, 893–896.
- 9Vgl. I. Saito, R. Nagata, K. Yuba, T. Matsuura, Tetrahedron Lett. 1983, 24, 1737–1740.
- 10C. Yuan, A. Axelrod, M. Varela, L. Danysh, D. Siegel, Tetrahedron Lett. 2011, 52, 2540–2542.
- 11J. C. Griffith, K. M. Jones, S. Picon, M. J. Rawling, B. M. Kariuki, M. Campbell, N. C. O. Tomkinson, J. Am. Chem. Soc. 2010, 132, 14409–14411.
- 12Diese Ergebnisse sind in Einklang mit DDK-Experimenten von Tomkinson et al.[11]
- 13M. Schwarz, P. Kreitmeier, O. Reiser, unveröffentlichte Ergebnisse.
Citing Literature
This is the
German version
of Angewandte Chemie.
Note for articles published since 1962:
Do not cite this version alone.
Take me to the International Edition version with citable page numbers, DOI, and citation export.
We apologize for the inconvenience.