Kurze Synthese von Tetrahydropyranen durch eine Oxa-Michael-Tsuji-Trost-Tandemreaktion†
Liang Wang
Institut für Organische Chemie, Ruprecht-Karls-Universität Heidelberg, Im Neuenheimer Feld 270, 69120 Heidelberg (Deutschland), Fax: (+49) 6221-54-4205
Search for more papers by this authorDr. Pengfei Li
Institut für Organische Chemie, Ruprecht-Karls-Universität Heidelberg, Im Neuenheimer Feld 270, 69120 Heidelberg (Deutschland), Fax: (+49) 6221-54-4205
Search for more papers by this authorCorresponding Author
Prof. Dr. Dirk Menche
Institut für Organische Chemie, Ruprecht-Karls-Universität Heidelberg, Im Neuenheimer Feld 270, 69120 Heidelberg (Deutschland), Fax: (+49) 6221-54-4205
Institut für Organische Chemie, Ruprecht-Karls-Universität Heidelberg, Im Neuenheimer Feld 270, 69120 Heidelberg (Deutschland), Fax: (+49) 6221-54-4205Search for more papers by this authorLiang Wang
Institut für Organische Chemie, Ruprecht-Karls-Universität Heidelberg, Im Neuenheimer Feld 270, 69120 Heidelberg (Deutschland), Fax: (+49) 6221-54-4205
Search for more papers by this authorDr. Pengfei Li
Institut für Organische Chemie, Ruprecht-Karls-Universität Heidelberg, Im Neuenheimer Feld 270, 69120 Heidelberg (Deutschland), Fax: (+49) 6221-54-4205
Search for more papers by this authorCorresponding Author
Prof. Dr. Dirk Menche
Institut für Organische Chemie, Ruprecht-Karls-Universität Heidelberg, Im Neuenheimer Feld 270, 69120 Heidelberg (Deutschland), Fax: (+49) 6221-54-4205
Institut für Organische Chemie, Ruprecht-Karls-Universität Heidelberg, Im Neuenheimer Feld 270, 69120 Heidelberg (Deutschland), Fax: (+49) 6221-54-4205Search for more papers by this authorDiese Arbeit wurde von der Deutschen Forschungsgemeinschaft (SFB 623 “Molekulare Katalysatoren: Struktur und Funktionsdesign”) großzügig finanziell unterstützt. Wir danken Prof. Dr. G. Helmchen für hilfreiche Diskussionen und Vorschläge.
Graphical Abstract
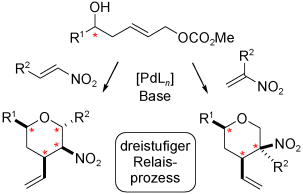
Eine neuartige Dominosequenz ermöglicht den raschen Aufbau von mehrfach substituierten Tetrahydropyranen. Der sequenzielle Eintopfprozess erzeugt bis zu drei neue stereogene Zentren, einschließlich eines vierfach substituierten Kohlenstoffzentrums, in besonders kurzer und konvergenter Weise aus einfachen Ausgangsmaterialien.
Supporting Information
Detailed facts of importance to specialist readers are published as ”Supporting Information”. Such documents are peer-reviewed, but not copy-edited or typeset. They are made available as submitted by the authors.
| Filename | Description |
|---|---|
| ange_201003304_sm_miscellaneous_information.pdf2.8 MB | miscellaneous_information |
Please note: The publisher is not responsible for the content or functionality of any supporting information supplied by the authors. Any queries (other than missing content) should be directed to the corresponding author for the article.
References
- 1Übersicht zu Tandemreaktionen mit binären katalytischen Systemen: J.-C. Wasilke, S. J. Obrey, R. T. Baker, G. C. Bazan, Chem. Rev. 2005, 105, 1001.
- 2Ausgewählte Übersichten über Dominoreaktionen:
- 2aI. Ryu, N. Sonoda, Chem. Rev. 1996, 96, 177;
- 2bP. J. Parsons, C. S. Penkett, A. J. Shell, Chem. Rev. 1996, 96, 195;
- 2cL. F. Tietze, G. Brasche, K. M. Gericke, Domino Reactions in Organic Synthesis, Wiley-VCH, Weinheim, 2006.
- 3Übersicht über Oxa-Michael-Reaktionen: C. F. Nising, S. Bräse, Chem. Soc. Rev. 2008, 37, 1218.
- 4Ausgewählte Kaskadenreaktionen unter Beteiligung allylischer Substitutionen:
- 4aB. M. Trost, D. M. T. Chan, J. Am. Chem. Soc. 1983, 105, 2315;
- 4bT. Fujinami, T. Suzuki, M. Kamiya, S. Fukuzuka, S. Sakai, Chem. Lett. 1985, 199;
- 4cB. M. Trost, S. R. Angle, J. Am. Chem. Soc. 1985, 107, 6123;
- 4dJ.-G. Shim, Y. Yamamoto, J. Org. Chem. 1998, 63, 3067;
- 4eJ.-G. Shim, Y. Yamamoto, Tetrahedron Lett. 1999, 40, 1053;
- 4fK.-Y. Lee, Y.-H. Kim, M.-S. Park, C.-Y. Oh, W.-H. Ham, J. Org. Chem. 1999, 64, 9450;
- 4gD. C. Butler, G. A. Inman, H. Alper, J. Org. Chem. 2000, 65, 5887;
- 4hM. Amador, X. Ariza, J. Garcia, S. Sevilla, Org. Lett. 2002, 4, 4511;
- 4iB. M. Trost, S. M. Silverman, J. P. Stambuli, J. Am. Chem. Soc. 2007, 129, 12 398;
- 4jR. Shintani, S. Park, W.-L. Duan, T. Hayashi, Angew. Chem. 2007, 119, 6005; Angew. Chem. Int. Ed. 2007, 46, 5901;
- 4kR. Shintani, M. Murakami, T. Tsuji, H. Tanno, T. Hayashi, Org. Lett. 2009, 11, 5642.
- 5Beispiele:
- 5aT. L. B. Boivin, Tetrahedron 1987, 43, 3309;
- 5bM. C. Elliott, E. Williams, J. Chem. Soc. Perkin Trans. 1 2001, 2303;
- 5cF. P. Marmsäter, F. G. West, Chem. Eur. J. 2002, 8, 4347;
- 5dK. J. Hale, M. G. Hummersone, S. Manaviazar, M. Frigerio, Nat. Prod. Rep. 2002, 19, 413;
- 5eL. O. Haustedt, I. V. Hartung, H. M. R. Hoffmann, Angew. Chem. 2003, 115, 2815; Angew. Chem. Int. Ed. 2003, 42, 2711.
- 6Übersicht: P. A. Clarke, S. Santos, Eur. J. Org. Chem. 2006, 2045.
- 7Beispiel: W. J. Morris, D. W. Custar, K. A. Scheidt, Org. Lett. 2005, 7, 1113.
- 8Aktuelles Beispiel in einer Totalsynthese: A. B. Smith, S. Dong, J. B. Brenneman, R. J. Fox, J. Am. Chem. Soc. 2009, 131, 12 109.
- 9Übersichten:
- 9aL. F. Tietze, G. Kettschau, J. A. Gewert, A. Schuffenhauer, Curr. Org. Chem. 1998, 2, 19;
- 9bK. A. Jørgensen, Angew. Chem. 2000, 112, 3702; Angew. Chem. Int. Ed. 2000, 39, 3558.
- 10A. G. Dossetter, T. F. Jamison, E. N. Jacobsen, Angew. Chem. 1999, 111, 2549; Angew. Chem. Int. Ed. 1999, 38, 2398.
- 11Repräsentative Literaturstelle: R. Jasti, J. Vitale, S. D. Rychnovsky, J. Am. Chem. Soc. 2004, 126, 9904.
- 12Beispiel in einer Totalsynthese: F. Hilli, J. M. White, M. Rizzacasa, Org. Lett. 2004, 6, 1289.
- 13Beispiel in einer Totalsynthese: I. Paterson, D. Y.-K. Chen, M. J. Coster, J. L. Acena, J. Bach, K. R. Gibson, L. E. Keown, R. M. Oballa, T. Trieselmann, D. J. Wallace, A. P. Hodgson, R. D. Norcross, Angew. Chem. 2001, 113, 4179; Angew. Chem. Int. Ed. 2001, 40, 4055.
- 14Beispiel: L. Boulard, S. Bouz, J. Cossy, X. Franck, B. Figadere, Tetrahedron Lett. 2004, 45, 6603.
- 15Beispiel: P. A. Clarke, M. Grist, M. Ebden, C. Wilson, Chem. Commun. 2003, 1560.
- 16
- 16aB. M. Trost, H. Yang, G. Wuitschik, Org. Lett. 2005, 7, 4761;
- 16bB. M. Trost, M. R. Machacek, B. D. Faulk, J. Am. Chem. Soc. 2006, 128, 6745.
- 17
- 17aI. C. Stewart, R. G. Bergman, D. F. Toste, J. Am. Chem. Soc. 2003, 125, 8696;
- 17bJ. E. Murtagh, S. H. McCooey, S. J. Connon, Chem. Commun. 2005, 227;
- 17cD. J. Buchanan, D. J. Dixon, F. A. Hernandez-Juan, Org. Lett. 2004, 6, 1357.
- 18Weiterführende Übersichten:
- 18aB. M. Trost, M. L. Crawley, Chem. Rev. 2003, 103, 2921;
- 18bG. Helmchen, A. Dahnz, P. D. Jbon, M. Schelwies, R. Weihofen, Chem. Commun. 2007, 675.
- 19Erste Untersuchungen mit alternativen elektronenziehenden Gruppen, einschließlich Estern, β-Dicarbonylverbindungen oder Sulfonaten, waren weniger vielversprechend.
- 20Homoallylische Alkohole des Typs 6 sind in zwei Stufen leicht zugänglich durch Allylierung und Kreuzmetathese, z. B.:
 Die Allylierung wurde durchgeführt gemäß: D. J. Hart, K. Kanai, J. Org. Chem. 1982, 47, 1555. Ähnliche Kreuzmetathesen:
Die Allylierung wurde durchgeführt gemäß: D. J. Hart, K. Kanai, J. Org. Chem. 1982, 47, 1555. Ähnliche Kreuzmetathesen:
- 20aD. L. Comins, J. M. Dinsmore, L. R. Marks, Chem. Commun. 2007, 4170;
- 20bA. K. Chatterjee, F. D. Toste, T. L. Choi, R. Grubbs, Adv. Synth. Catal. 2002, 344, 634. Vollständige Details sind in den Hintergrundinformationen zu finden.
- 21Alle Nitroolefine wurden leicht durch basenkatalysierte Kondensation von Nitroalkanen mit den entsprechenden Aldehyden erhalten: A. Duursma, A. J. Minnaard, B. L. Feringa, Tetrahedron 2002, 58, 5773. Vollständige Details sind in den Hintergrundinformationen zu finden.
- 22Alternative Basen: KHMDS, NaHMDS oder LiOtBu.
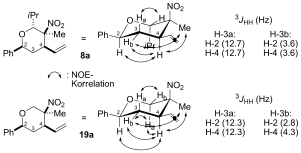
- 23In allen Fällen wurde die Stereochemie durch NMR-Spektroskopiemethoden zugewiesen (NOE=Kern-Overhauser-Effekt), z. B.:
- 24Typische Reaktionsbedingungen umfassten die Behandlung einer Lösung des entsprechenden Homoallylalkohols (1 Äquiv.) und des Nitroolefins (1.5 Äquiv.) in THF bei −78 °C mit [Pd2(dba)3] (5 Mol-%), PPh3 (20 Mol-%) und LiOtBu (1.5 Äquiv.) und Rühren der Reaktionsmischung bei Raumtemperatur bis zum kompletten Umsatz (ca. 2 h). Vollständige Details sind in den Hintergrundinformationen zu finden.
- 25Typische Reaktionsbedingungen umfassten die Behandlung einer Lösung des entsprechenden Homoalyllalkohols (1 Äquiv.) und des Nitroolefins (2 Äquiv.) in THF bei −78 °C mit [{Pd(Allyl)Cl}2] (10 Mol-%), PPh3 (30 Mol-%) und LiHMDS (1.5 Äquiv.) und Rühren der Reaktionsmischung bei Raumtemperatur bis zum kompletten Umsatz (ca. 2 h). Vollständige Details sind in den Hintergrundinformationen zu finden.
- 26Praktischerweise kann die wässrige Aufarbeitung auch bei 0 °C erfolgen, wobei die Produkte mit ähnlichen Ausbeuten erhalten werden.
Citing Literature
This is the
German version
of Angewandte Chemie.
Note for articles published since 1962:
Do not cite this version alone.
Take me to the International Edition version with citable page numbers, DOI, and citation export.
We apologize for the inconvenience.