Synthese des Dibismuten-Komplexes [{μ-η2-(cis-Me3SiCH2Bi)2}{W(CO)5}2] aus Cyclobismutanen und [W(CO)5(thf)]
Lucia Balázs
Universität Bremen Institut für Anorganische und Physikalische Chemie 28334 Bremen (Deutschland) Fax: (+49) 421-218-4042
Search for more papers by this authorHans Joachim Breunig Prof. Dr.
Universität Bremen Institut für Anorganische und Physikalische Chemie 28334 Bremen (Deutschland) Fax: (+49) 421-218-4042
Search for more papers by this authorEnno Lork Dr.
Universität Bremen Institut für Anorganische und Physikalische Chemie 28334 Bremen (Deutschland) Fax: (+49) 421-218-4042
Search for more papers by this authorLucia Balázs
Universität Bremen Institut für Anorganische und Physikalische Chemie 28334 Bremen (Deutschland) Fax: (+49) 421-218-4042
Search for more papers by this authorHans Joachim Breunig Prof. Dr.
Universität Bremen Institut für Anorganische und Physikalische Chemie 28334 Bremen (Deutschland) Fax: (+49) 421-218-4042
Search for more papers by this authorEnno Lork Dr.
Universität Bremen Institut für Anorganische und Physikalische Chemie 28334 Bremen (Deutschland) Fax: (+49) 421-218-4042
Search for more papers by this authorGraphical Abstract
Die Flügel der Schmetterlingsstruktur sind weit ausgebreitet in 2 (R = Me3SiCH2), einem Komplex mit einem Dibismuten-Liganden, der als Vier-Elektronen-Donor side-on zwei Wolframatome verbrückt. 2 entsteht bei der Umsetzung von den im Gleichgewicht stehenden Alkylbismut-Fünf- und Dreiringen der Cyclobismutane 1 mit [W(CO)5(thf)].
References
- 1 Als Folge der Spin-Bahn-Kopplung spalten die 6p-Orbitale in ein p(1/2)- und zwei p(3/2)-Orbitale auf. Das erste ist kugelsymmetrisch und wird ebenso wie das 6s-Orbital durch relativistische Effekte energetisch abgesenkt. Es sollte daher neben dem inerten s-Elektronenpaar auch ein inertes p-Elektronenpaar vorliegen und BiI in der Konfiguration 6s2, 6p(1/2)2, 6p(3/2)0 stabil sein: P. Pyykkö, Chem. Rev. 1988, 88, 563–594.
- 2 Chemistry of Arsenic, Antimony and Bismuth ( ), Blackie Academic, London, 1998.
- 3
- 3a N. Tokitoh, Y. Arai, R. Okazaki, S. Nagase, Science 1977, 277, 78–80;
- 3b N. Tokitoh, J. Organomet. Chem. 2000, 611, 217–227;
- 3c B. Twamley, C. D. Sofield, M. M. Olmstead, P. P. Power, J. Am. Chem. Soc. 1999, 121, 3357–3367.
- 4a
H. J. Breunig, R. Rösler, E. Lork, Angew. Chem. 1998, 110, 3361–3363;
10.1002/(SICI)1521-3757(19981116)110:22<3361::AID-ANGE3361>3.0.CO;2-O Google ScholarAngew. Chem. Int. Ed. 1998, 37, 3175–3177;10.1002/(SICI)1521-3773(19981204)37:22<3175::AID-ANIE3175>3.0.CO;2-M CAS PubMed Web of Science® Google Scholar
- 4b G. Linti, W. Köstler, Z. Anorg. Allg. Chem. 2002, 628, 63–66.
- 5
- 5a The Chemistry of Inorganic Homo- and Heterocycles, Vol. 2 ( ), Academic Press, London, 1987;
- 5b H. J. Breunig, R. Rösler, Chem. Soc. Rev. 2000, 29, 403–410;
- 5c A. Silvestru, H. J. Breunig, K. H. Ebert, R. Kaller, J. Organomet. Chem. 1995, 501, 117–121.
- 6
- 6a K. H. Whitmire, Adv. Organomet. Chem. 1998, 42, 1–145;
- 6b J. Borm, L. Zsolnai, G. Huttner, Angew. Chem. 1983, 95, 1018; Angew. Chem. Int. Ed. Engl. 1983, 22, 977;
- 6c H. Lang, O. Orama, G. Huttner J. Organomet. Chem. 1985, 291, 293–309;
- 6d K. B. Dillon, V. C. Gibson, J. A. K. Howard, L. J. Sequeira, J. W. Yao, Polyhedron 1996, 15, 4173–4177;
- 6e D. Fenske, H. Schottmüller, Z. Anorg. Allg. Chem. 1998, 624, 443–451.
- 7
- 7a G. Huttner, U. Weber, L. Zsolnai, Z. Naturforsch. B 1982, 37, 707–710;
- 7b A. M. Arif, A. H. Cowley, N. C. Norman, M. Pakulski, J. Am. Chem. Soc. 1985, 107, 1062–1063;
- 7c A. M. Arif, A. H. Cowley, N. C. Norman, M. Pakulski, Inorg. Chem. 1986, 25, 4836–4840;
- 7d W. J. Evans, S. L. Gonzales, J. W. Ziller, J. Am. Chem. Soc. 1991, 113, 9880–9882;
- 7e W. Clegg, N. A. Compton, R. J. Errington, G. A. Fischer, N. C. Norman, T. B. Marder, J. Chem. Soc. Dalton Trans. 1991, 2887–2895.
- 8 R. E. Schulz, Dissertation, Universität Bremen, Shaker Verlag, Aachen, 1996.
- 9
- 9a δ=4.45 ppm (CH2); für die CH3-Gruppen kommen mehrere Signale im Bereich δ=0.07–0.24 ppm in Frage.
- 10 c(1 a):c(1 b)=0.3 im Bereich von −15 bis −80 °C, 0.95 bei 5 °C, 2 bei 25 °C. Der Wert 0.3 wird auch an einer bei −60 °C hergestellten und untersuchten Lösung des Festkörpers gefunden. Die Gleichgewichtseinstellung findet nur oberhalb von −15 °C statt.
- 11 Kristallstrukturanalyse von 2 (C18H10Bi2O10Si2W2): Mr=1240.20, Kristallgröße 0.5×0.4×0.35 mm3, monoklin, Raumgruppe C2/c, a=22.809(5), b=8.622(2), c=18.381(4) Å, β=124.20(3)°, V=2.9897(12) nm3, Z=4, ρber.=2.755 Mg m−3, μ=19.529 mm−1. Ein Einkristall wurde mit Kel-F-Öl an einem Glasfaden fixiert und auf einem STOE-IPDS-Diffraktometer bei −100 °C gemessen. Mit Graphit-monochromatisierter MoKα-Strahlung (0.71073 Å) wurden 20 417 Reflexe aufgenommen (2.16<θ<26.06°). Nach dem Mitteln verblieben 2863 Reflexe (Rint.=0.0732), und die Struktur wurde mit Direkten Methoden gelöst. Die Verfeinerungen konvergierten nach einer empirischen Absorptionskorrektur (DIFABS) bei wR2=0.0550 (Verfeinerung gegen F 2) für alle 20 417 Reflexe und 160 Variablen (R1=0.0218 für 2863 Reflexe mit I>2σ(I)). Schweratome wurden anisotrop und H-Atome nach einem Reitermodell mit einem gemeinsamen isotropen Temperaturfaktor verfeinert. Max./min. Restelektronendichte: 1.317/−0.842 e Å−3. Die Strukturlösung und -verfeinerung wurde mit dem SHELX-97-Programmpaket[15] durchgeführt und die graphische Darstellung mit dem Diamond-Programm erhalten.[16] CCDC-175881 enthält die ausführlichen kristallographischen Daten zu dieser Veröffentlichung. Die Daten sind kostenlos über www.ccdc.cam.ac.uk/conts/retrieving.html erhältlich (oder können bei folgender Adresse in Großbritannien angefordert werden: Cambridge Crystallographic Data Centre, 12, Union Road, Cambridge CB2 1EZ; Fax: (+44) 1223-336-033; oder [email protected]).
- 12a F. Calderazzo, R. Poli, G. Pelizzi, J. Chem. Soc. Dalton Trans. 1984, 2365–2369;
- 12b
A. Kuczkowski, S. Schulz, M. Nieger, Angew. Chem. 2001, 113, 4351–4353;
10.1002/1521-3757(20011119)113:22<4351::AID-ANGE4351>3.0.CO;2-P Google ScholarAngew. Chem. Int. Ed. 2001, 40, 4222–4225.10.1002/1521-3773(20011119)40:22<4222::AID-ANIE4222>3.0.CO;2-L CAS PubMed Web of Science® Google Scholar
- 13a N. J. Holmes, W. Levason, M. Webster, J. Organomet. Chem. 1997, 545–546, 111–115;
- 13b R. E. Bachman, K. H. Whitmire, Inorg. Chem. 1995, 34, 1542–1551.
- 14 G. Balazs, H. J. Breunig, E. Lork, Z. Anorg. Allg. Chem. 2001, 627, 2666–2668.
- 15 G. M. Sheldrick, SHELX-97, Universität Göttingen, 1997.
- 16 DIAMOND – Visual Crystal Structure Information System, CRYSTAL IMPACT, Postfach 1251, 53002 Bonn.
Citing Literature
This is the
German version
of Angewandte Chemie.
Note for articles published since 1962:
Do not cite this version alone.
Take me to the International Edition version with citable page numbers, DOI, and citation export.
We apologize for the inconvenience.



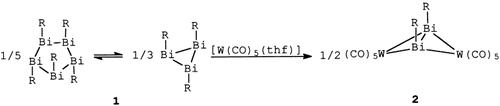
114:13<>1.0.co;2-j.cover.gif)
