Ein allgemeiner Ansatz für die modulare Synthese von Polyketid-Bausteinen durch die Hydroxy-gesteuerte Nitriloxid-Cycloaddition nach Kanemasa
Jeffrey W. Bode
Laboratorium für Organische Chemie ETH-Zentrum Universitätstraße 16, 8092 Zürich (Schweiz) Fax: (+41) 1-632-13-28
Search for more papers by this authorNina Fraefel
Laboratorium für Organische Chemie ETH-Zentrum Universitätstraße 16, 8092 Zürich (Schweiz) Fax: (+41) 1-632-13-28
Search for more papers by this authorDieter Muri
Laboratorium für Organische Chemie ETH-Zentrum Universitätstraße 16, 8092 Zürich (Schweiz) Fax: (+41) 1-632-13-28
Search for more papers by this authorErick M. Carreira Prof. Dr.
Laboratorium für Organische Chemie ETH-Zentrum Universitätstraße 16, 8092 Zürich (Schweiz) Fax: (+41) 1-632-13-28
Search for more papers by this authorJeffrey W. Bode
Laboratorium für Organische Chemie ETH-Zentrum Universitätstraße 16, 8092 Zürich (Schweiz) Fax: (+41) 1-632-13-28
Search for more papers by this authorNina Fraefel
Laboratorium für Organische Chemie ETH-Zentrum Universitätstraße 16, 8092 Zürich (Schweiz) Fax: (+41) 1-632-13-28
Search for more papers by this authorDieter Muri
Laboratorium für Organische Chemie ETH-Zentrum Universitätstraße 16, 8092 Zürich (Schweiz) Fax: (+41) 1-632-13-28
Search for more papers by this authorErick M. Carreira Prof. Dr.
Laboratorium für Organische Chemie ETH-Zentrum Universitätstraße 16, 8092 Zürich (Schweiz) Fax: (+41) 1-632-13-28
Search for more papers by this authorDiese Arbeit wurde von der ETH-Zürich sowie von den Firmen Hoffmann-LaRoche, Merck und Novartis unterstützt. J.W.B. dankt der National Science Foundation (USA) für ein Promotionsstipendium. Wir danken Boehringer-Ingelheim für eine großzügige Spende an (R)-3-Buten-ol.
Graphical Abstract
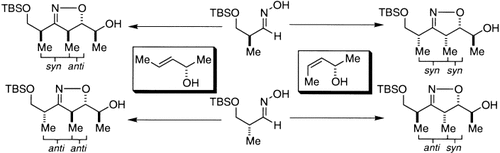
Von leicht zugänglichen Verbindungen einfach und in einer Stufe zu allen möglichen Polypropionat-Diastereomeren! Die gezeigte allgemeine Methode zur diastereoselektiven Synthese von syn-, anti- und Methylketon-Aldolprodukten basiert auf einer MgII-vermittelten, Hydroxy-gesteuerten Nitriloxid-Cycloaddition. Die freie Hydroxygruppe des Cycloaddukts eröffnet viele Möglichkeiten zum raschen Aufbau von komplexen Polyketiden. TBS=tBuMe2Si.
Supporting Information
Hintergrundinformationen zu diesem Beitrag sind im WWW unter http://www.angewandte.de zu finden oder können beim Autor angefordert werden.
Please note: The publisher is not responsible for the content or functionality of any supporting information supplied by the authors. Any queries (other than missing content) should be directed to the corresponding author for the article.
References
- 1 Methoden zur Synthese von Polyketiden:
- 1a R. W. Hoffmann, Angew. Chem. 1987, 99, 503; Angew. Chem. Int. Ed. Engl. 1987, 26, 489;
- 1b „The Total Synthesis of Macrolides“: J. W. Bode, E. M. Carreira in The Chemical Synthesis of Natural Products ( ), Sheffield Academic Press, London, 2000, S. 40–62.
- 2 Neuere molekularbiologische Methoden zur modularen Synthese von Polyketiden:
- 2a D. E. Cane, C. T. Walsh, C. Khosla, Science 1998, 282, 63;
- 2b L. Katz, Chem. Rev. 1997, 97, 2557;
- 2c C. Khosla, Chem. Rev. 1997, 97, 2577.
- 3 Polyketidsynthesen mit chiralen Auxiliaren: D. A. Evans, J. V. Nelson, T. R. Taber, Top. Stereochem. 1982, 13, 1.
- 4 Synthese von Polypropionatuntereinheiten durch substrat- und reagenskontrollierte Aldolreaktionen: I. Paterson, J. A. Channon, Tetrahedron Lett. 1992, 33, 797.
- 5 Übersichten:
- 5a
„Stereoselective Aldol Reactions in the Synthesis of Polyketide Natural Products“: I. Paterson, C. J. Cowden, D. J. Wallace in Modern Carbonyl Chemistry ( ), Wiley-VCH, Weinheim, 2000, S. 249–297;
10.1002/9783527613267.ch09 Google Scholar
- 5b C. J. Cowden, I. Paterson, Org. React. 1997, 51, 1.
- 6 Polyketidsynthesen mit chiralen Allylierungsreagentien:
- 6a „Recent Application of the Allylation Reaction to the Synthesis of Natural Products“: S. R. Chemler, W. R. Roush in Modern Carbonyl Chemistry ( ), Wiley-VCH, Weinheim, 2000, S. 404–490;
- 6b R. W. Hoffman in Stereocontrolled Organic Synthesis ( ), Blackwell, Cambridge, 1994, S. 259–274.
- 7 Chirale Allenylmetallreagentien:
- 7a J. A. Marshall, S. Xie, J. Org. Chem. 1995, 60, 7230;
- 7b J. A. Marshall, Z.-H. Lu, B. A. Johns, J. Org. Chem. 1998, 63, 817.
- 8
- 8a Epoxidöffnungen: D. Boschelli, T. Takemasa, Y. Nishitani, S. Masamune, Tetrahedron Lett. 1985, 26, 5239;
- 8b Hetero-Diels-Alder-Reaktionen: D. C. Myles, S. J. Danishefsky, Pure Appl. Chem. 1989, 61, 1235;
- 8c Hydroborierungen: M. R. Johnson, T. Nakata, Y. Kishi, Tetrahedron Lett. 1979, 20, 4343.
- 9
- 9a Übersicht: D. P. Curran, Adv. Cycloaddit. 1988, 1, 129;
- 9b D. P. Curran, J. Am. Chem. Soc. 1982, 104, 4024;
- 9c K. Torssell, O. Zeuthen, Acta Chem. Scand. Ser. B 1978, 32, 118.
- 10 Neuere Anwendungen von konvergenten Nitriloxid-Cycloadditionen:
- 10a G. J. McGarvey, J. A. Mathys, K. J. Wilson, J. Org. Chem. 1996, 61, 5704;
- 10b W. Zheng, J. A. DeMattei, J.-P. Wu, J. J.-W. Duan, L. R. Cook, H. Oinuma, Y. Kishi, J. Am. Chem. Soc. 1996, 118, 7946;
- 10c J. W. Bode, E. M. Carreira, J. Am. Chem. Soc. 2001, 123, im Druck.
- 11
- 11a Grignard-Reaktionen: D. P. Curran, J. Zheng, J. Chem. Soc. Perkins Trans. 1 1991, 2613;
- 11b Alkylierungen: V. Jäger, R. Schohe, E. F. Paulus, Tetrahedron Lett. 1983, 24, 5501;
- 11c A. P. Kozikowski, A. K. Ghosh, J. Am. Chem. Soc. 1982, 104, 5788;
- 11d Aldolreaktionen: D. P. Curran, J.-C. Chao, J. Am. Chem. Soc. 1987, 109, 3037;
- 11e A. Kamimura, S. Manumo, Tetrahedron Lett. 1990, 31, 5053.
- 12
- 12a C. J. Easton, C. M. M. Hughes, G. P. Savage, G. W. Simpson, Adv. Heterocycl. Chem. 1994, 60, 261;
- 12b K. G. B. Torssell, Nitrile Oxides, Nitrones, and Nitronates in Organic Chemistry, VCH, Weinheim, 1988;
- 12c A. P. Kozikowsi, Acc. Chem. Res. 1984, 17, 410.
- 13 S. Kanemasa, M. Nishiuchi, A. Kamimure, K. Hori, J. Am. Chem. Soc. 1994, 116, 2324.
- 14 Für die In-situ-Herstellung der Magnesiumalkoxide wird eine Lösung von EtMgBr (3.0 M in Et2O) verwendet.
- 15 Synthese des entsprechenden Aldehyds:
- 15a A. Gaucher, J. Ollivier, J. Marguerite, R. Paugam, J. Salaün, Can. J. Chem. 1994, 72, 1312.
- 15b Im Unterschied zu den entsprechenden Aldehyden, welche sich leicht zersetzen, können die Oxime über längere Zeit aufbewahrt werden.
- 16
- 16a Mehrere Synthesen der chiralen Olefine 3 und 4 in beiden enantiomeren Formen wurden publiziert. Für unsere Zwecke wurden sie aus enantiomerenreinem 2-Hydroxy-3-pentin hergestellt, das nach der Methode von Noyori zugänglich ist: K. Matsumura, S. Hashiguchi, T. Ikariya, R. Noyori, J. Am. Chem. Soc. 1997, 119, 8738;
- 16b für eine andere Vorschrift siehe: O. Hamed, P. M. Henry, Organometallics 1997, 16, 4903.
- 17 In allen Fällen wird das Cycloaddukt syn zur bestehenden Hydroxygruppe gebildet. Die von Kanemasa bereits bestimmte Diastereoselektivität der Cycloaddition von syn:anti=99:1 konnten wir durch die Kristallstrukturanalyse eines Derivates von 6 und mit einer synthetischen Anwendung von 12[11c] bestätigen.
- 18 Die Verwendung der leicht zugänglichen Enantiomere der Allylalkohole 3 and 4 bietet einen direkten Zugang zu den enantiomeren Polypropionat-Bausteinen.
- 19 Polypropionatsynthesen durch iterative Festphasen-Aldolreaktionen:
- 19a I. Paterson, J. P. Scott, J. Chem. Soc. Perkin Trans. 1 1999, 1003;
- 19b
I. Paterson, M. Donghi, K. Gerlach, Angew. Chem. 2000, 112, 3453;
Angew. Chem. Int. Ed. 2000, 39, 3315.
10.1002/1521-3773(20000915)39:18<3315::AID-ANIE3315>3.0.CO;2-9 CAS PubMed Web of Science® Google Scholar
- 20 Synthese von verwandten Isoxazolinen durch enzymatische Racematspaltung an der Festphase: J. A. López-Pelegrín, P. Wentworth, F. Sieber, W. A. Metz, K. D. Janda, J. Org. Chem. 2000, 65, 8527.
- 21
- 21a Wir vermuten, dass die Möglichkeit der Dimerisierung und Polymerisation von Alkinylnitriloxiden ihre Anwendung bislang stark eingeschränkt haben.
- 21b Das Oxim 13 ist eine leicht zugängliche, bekannte Verbindung (L. P. Safronova, A. S. Medvedeva, N. S. Vyazankin, J. Gen. Chem. USSR Engl. Transl. 1983, 53, 1177), die jedoch nicht über einen längeren Zeitraum aufbewahrt werden kann.
- 22
- 22a D. P. Curran, J. Am. Chem. Soc. 1983, 105, 5826;
- 22b D. P. Curran, S. A. Scanga, C. J. Fenk, J. Org. Chem. 1984, 49, 3474.
- 23 Neuere Anwendungen:
- 23a I. Paterson, G. J. Florence, K. Gerlach, J. P. Scott, Angew. Chem. 2000, 112, 385; Angew. Chem. Int. Ed. 2000, 39, 277;
- 23b K. Tatsuda, Y. Koguchi, M. Kase, Bull. Chem. Soc. Jpn. 1988, 61, 2525;
- 23c C. Esteve, M. Ferreró, P. Romea, F. Urpí, J. Vilarrasa, Tetrahedron Lett. 1999, 40, 5083.
- 24 Das Iodid 17 wurde duch Oxidation von 6, anschließende Wittig-Olefinierung, Entschützung und Überführung in das Iodid in 65 % Gesamtausbeute hergestellt. Das Keton 18 wurde durch Oxidation von 5 in 91 % Ausbeute erhalten.
Citing Literature
This is the
German version
of Angewandte Chemie.
Note for articles published since 1962:
Do not cite this version alone.
Take me to the International Edition version with citable page numbers, DOI, and citation export.
We apologize for the inconvenience.



113:11<>1.0.co;2-#.cover.gif)
