Aus einem Übergangszustand wird ein Energieminimum – die Natur der chemischen Bindung in Diplumbylenen RPbPbR (R=H, Ar)
Yu Chen M. Sc.
Fachbereich Chemie Philipps-Universität Marburg Hans-Meerwein-Straße, 35039 Marburg (Deutschland) Fax:(+49) 6421-282-5566
Search for more papers by this authorMichael Hartmann Dr.
Fachbereich Chemie Philipps-Universität Marburg Hans-Meerwein-Straße, 35039 Marburg (Deutschland) Fax:(+49) 6421-282-5566
Search for more papers by this authorMichael Diedenhofen Dr.
Fachbereich Chemie Philipps-Universität Marburg Hans-Meerwein-Straße, 35039 Marburg (Deutschland) Fax:(+49) 6421-282-5566
Search for more papers by this authorGernot Frenking Prof. Dr.
Fachbereich Chemie Philipps-Universität Marburg Hans-Meerwein-Straße, 35039 Marburg (Deutschland) Fax:(+49) 6421-282-5566
Search for more papers by this authorYu Chen M. Sc.
Fachbereich Chemie Philipps-Universität Marburg Hans-Meerwein-Straße, 35039 Marburg (Deutschland) Fax:(+49) 6421-282-5566
Search for more papers by this authorMichael Hartmann Dr.
Fachbereich Chemie Philipps-Universität Marburg Hans-Meerwein-Straße, 35039 Marburg (Deutschland) Fax:(+49) 6421-282-5566
Search for more papers by this authorMichael Diedenhofen Dr.
Fachbereich Chemie Philipps-Universität Marburg Hans-Meerwein-Straße, 35039 Marburg (Deutschland) Fax:(+49) 6421-282-5566
Search for more papers by this authorGernot Frenking Prof. Dr.
Fachbereich Chemie Philipps-Universität Marburg Hans-Meerwein-Straße, 35039 Marburg (Deutschland) Fax:(+49) 6421-282-5566
Search for more papers by this authorTheoretische Untersuchungen von anorganischen Verbindungen. 15. Mitteilung. Diese Arbeit wurde von der Deutschen Forschungsgemeinschaft und vom Fonds der Chemischen Industrie unterstützt. Wir danken Prof. M. Weidenbruch für hilfreiche Vorschläge. – 14. Mitteilung: Y. Chen, M. Hartmann, G. Frenking, Eur. J. Inorg. Chem., im Druck.
Graphical Abstract
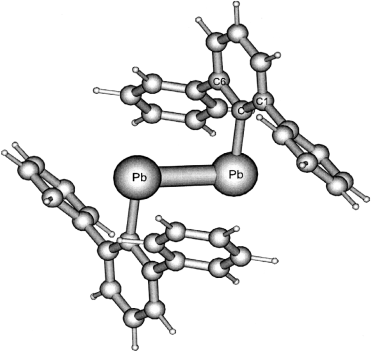
Quantenchemische Rechnungen auf dem B3LYP-Niveau zeigen, dass die beiden sterisch anspruchsvollen Substituenten Ar*=2,6-Ph2C6H3 in Ar*PbPbAr* die gezeigte trans-gewinkelte Gleichgewichtsstruktur als niedrigst liegendes Energieminimum erzwingen. In Ar*PbPbAr* liegt keine Pb-Pb-π-Bindung vor. Bei den Energieminima der Stammverbindungen PhPbPbPh und HPbPbH handelt es sich dagegen um zweifach verbrückte Strukturen.
References
- 1
- 1a Adv. Organomet. Chem. 1996, 39 (Hrsg.: F. G. A. Stone, R. West);
- 1b
P. Jutzi, Angew. Chem. 2000, 112, 3953;
10.1002/1521-3757(20001103)112:21<3953::AID-ANGE3953>3.0.CO;2-5 Google ScholarAngew. Chem. Int. Ed. 2000, 39, 3797.10.1002/1521-3773(20001103)39:21<3797::AID-ANIE3797>3.0.CO;2-8 CAS PubMed Web of Science® Google Scholar
- 2 R. Okazaki, R. West, Adv. Organomet. Chem. 1996, 39, 232;
- 2b P. B. Hitchcock, M. F. Lappert, S. J. Miles, A. J. Thorne, J. Chem. Soc. Chem. Commun. 1984, 480;
- 2c K. M. Baines, W. G. Stibbs, Adv. Organomet. Chem. 1996, 39, 275;
- 2d D. E. Goldberg, D. H. Harris, M. F. Lappert, K. M. Thomas, J. Chem. Soc. Chem. Commun. 1976, 261;
- 2e M. Stürmann, M. Weidenbruch, K. W. Klinkhammer, F. Lissner, H. Marsmann, Organometallics 1998, 17, 4425;
- 2f
M. Weidenbruch, Eur. J. Inorg. Chem. 1999, 373.
10.1002/(SICI)1099-0682(199903)1999:3<373::AID-EJIC373>3.0.CO;2-D CAS Web of Science® Google Scholar
- 3 P. P.Power, J. Chem. Soc. Dalton Trans. 1998, 2939.
- 4
- 4a R. S. Grev, Adv. Organomet. Chem. 1991, 33, 125;
- 4b B. T. Colegrove, H. F. Schaefer, J. Am. Chem. Soc. 1991, 113, 1557;
- 4c R. Stegmann, G. Frenking, Organometallics 1995, 14, 5308;
- 4d K. Kobayashi, S. Nagase, Organometallics 1997, 16, 1489;
- 4e Z. Palágyi, H. F. Schaefer, E. Kapuy, J. Am. Chem. Soc. 1993, 115, 6901;
- 4f A. J. Boone, D. H. Magers, J. Leszczynski, Int. J. Quantum Chem. 1998, 70, 925.
- 5 Y.-K. Han, C. Bae, Y. S. Lee, S. Y. Lee, J. Comput. Chem. 1998, 19, 1526.
- 6
- 6a M. Cordonnier, M. Bogey, C. Demuynck, J.-L. Destombes, J. Chem. Phys. 1992, 97, 7984;
- 6b M. Bogey, H. Bolvin, C. Demuyneck, J.-L. Destombes, Phys. Rev. Lett. 1991, 66, 413.
- 7 L. Pu, B. Twamley, P. P. Power, J. Am. Chem. Soc. 2000, 122, 3524.
- 8 L. Pauling, The Nature of the Chemical Bond, 3. Aufl., Cornell University Press, Ithaca, 1960, S. 256.
- 9 W. Kutzelnigg, Angew. Chem. 1984, 96, 262; Angew. Chem. Int. Ed. Engl. 1984, 23, 272.
- 10 Die Geometrien wurden auf dem B3LYP-Niveau[11] mit einem quasi-relativistischen Pseudopotential[12] und einem (31/31/1)-Valenzbasissatz für Pb sowie 6-31G(d)-Basissätzen für C und H (6-31G(d,p) bei Pb2H2) berechnet. Die Schwingungsspektren der optimierten Geometrien haben wir mit analytischen zweiten Ableitungen berechnet. Die Moleküle Pb2H2 und Pb2Ph2 wurden auch auf dem MP2-Niveau berechnet.[13] Da die MP2- und die B3LYP-Ergebnisse in den meisten Fällen sehr ähnlich waren, geben wir nur Letztere an; die MP2-Werte werden nur bei größeren Abweichungen von den B3LYP-Ergebnissen diskutiert. Alle Rechnungen wurden mit dem Programmpaket Gaussian 98[14] durchgeführt.
- 11a A. D. Becke, J. Chem. Phys. 1993, 98, 5648;
- 11b C. Lee, W. Yang, R. G. Parr, Phys. Rev. B 1988, 3, 785.
- 12 A. Bergner, M. Dolg, W. Küchle, H. Stoll, H. Preuß, Mol. Phys. 1993, 80, 1431.
- 13a C. Møller, M. S. Plesset, Phys. Rev. 1934, 46, 618;
- 13b J. S. Binkley, J. A. Pople, Int. J. Quantum Chem. 1975, 9, 229.
- 14 Gaussian 98 (Revision A.1), M. J. Frisch, G. W. Trucks, H. B. Schlegel, G. E. Scuseria, M. A. Robb, J. R. Cheeseman, V. G. Zakrzewski, J. A. Montgomery, R. E. Stratmann, J. C. Burant, S. Dapprich, J. M. Millam, A. D. Daniels, K. N. Kudin, M. C. Strain, O. Farkas, J. Tomasi, V. Barone, M. Cossi, R. Cammi, B. Mennucci, C. Pomelli, C. Adamo, S. Clifford, J. Ochterski, G. A. Petersson, P. Y. Ayala, Q. Cui, K. Morokuma, D. K. Malick, A. D. Rabuck, K. Raghavachari, J. B. Foresman, J. Cioslowski, J. V. Ortiz, B. B. Stefanov, G. Liu, A. Liashenko, P. Piskorz, I. Komaromi, R. Gomperts, R. L. Martin, D. J. Fox, T. Keith, M. A. Al-Laham, C. Y. Peng, A. Nanayakkara, C. Gonzalez, M. Challacombe, P. M. W. Gill, B. G. Johnson, W. Chen, M. W. Wong, J. L. Andres, M. Head-Gordon, E. S. Replogle, J. A. Pople, Gaussian, Inc., Pittsburgh, PA, 1998.
- 15 Auf dem MP2-Niveau ist 1H(B) ein Energieminimum, das 15.9 kcal mol−1 höher liegt als 1H(A).
- 16 Rechnungen für Pb2H2 im elektronischen Triplett-Zustand ergaben Strukturen die energetisch höher liegen als 1H(A).
- 17 Die geringere Energiedifferenz zwischen 1Ph(D1) und 1Ph(D2) wird wahrscheinlich durch die Abstoßung zwischen den π-Elektronen der Phenylsubstituenten und den Pb-Pb-π-Elektronen (in 1Ph(D1)) bzw. den freien Elektronenpaaren der Bleiatome (in 1Ph(D2)) verursacht. Da die Phenylringe in 1Ph(D1) um 90° aus der Molekülebene herausgedreht sind, besteht keine konjugative Wechselwirkung zwischen den π-Elektronen der Phenylsubstituenten und der Pb-Pb-π-Bindung. Die planare Form 1Ph(D1) ist ein Sattelpunkt noch höherer Ordnung (i=3), der um 4.3 kcal mol−1 höher liegt als die in Abbildung 6 gezeigte Struktur. Die Phenylringe von 1Ph(D2) liegen in der Molekülebene. Die berechnete Struktur, bei der die Phenylringe von 1Ph(D2) um 90° gedreht sind, liegt 8.2 kcal mol−1 höher als die planare Form.
- 18 R. Pietschnig, R. West, D. R. Powell, Organometallics 2000, 19, 2724.
- 19
K. P. Huber, G. Herzberg, Constants of Diatomic Molecules, Van Nostrand Reinhold, New York, 1979.
10.1007/978-1-4757-0961-2_2 Google Scholar
- 20 M. Lewerenz, P. J. Bruna, S. D. Peyerimhoff, R. J. Buenker, Mol. Phys. 1983, 49, 1.
- 21 Anmerkung bei der Korrektur (25. April 2001): Nach Einreichen dieser Arbeit erschien eine wichtige theoretische Arbeit über Si−Si-Dreifachbindungen: K. Kobayashi, N. Takagi, S. Nagase, Organometallics 2001, 20, 234.
Citing Literature
This is the
German version
of Angewandte Chemie.
Note for articles published since 1962:
Do not cite this version alone.
Take me to the International Edition version with citable page numbers, DOI, and citation export.
We apologize for the inconvenience.



113:11<>1.0.co;2-#.cover.gif)
