Rhodium(III)-katalysierte Abfangcyclisierung zu vielfältigen 1-Aminoindolinderivaten bei Raumtemperatur†
Dr. Dongbing Zhao
Westfälische Wilhelms-Universität Münster, Organisch-Chemisches Institut, Corrensstraße 40, 48149 Münster (Deutschland)
Diese Autoren haben zu gleichen Teilen zu der Arbeit beigetragen.
Search for more papers by this authorSuhelen Vásquez-Céspedes
Westfälische Wilhelms-Universität Münster, Organisch-Chemisches Institut, Corrensstraße 40, 48149 Münster (Deutschland)
Diese Autoren haben zu gleichen Teilen zu der Arbeit beigetragen.
Search for more papers by this authorCorresponding Author
Prof. Dr. Frank Glorius
Westfälische Wilhelms-Universität Münster, Organisch-Chemisches Institut, Corrensstraße 40, 48149 Münster (Deutschland)
Westfälische Wilhelms-Universität Münster, Organisch-Chemisches Institut, Corrensstraße 40, 48149 Münster (Deutschland)Search for more papers by this authorDr. Dongbing Zhao
Westfälische Wilhelms-Universität Münster, Organisch-Chemisches Institut, Corrensstraße 40, 48149 Münster (Deutschland)
Diese Autoren haben zu gleichen Teilen zu der Arbeit beigetragen.
Search for more papers by this authorSuhelen Vásquez-Céspedes
Westfälische Wilhelms-Universität Münster, Organisch-Chemisches Institut, Corrensstraße 40, 48149 Münster (Deutschland)
Diese Autoren haben zu gleichen Teilen zu der Arbeit beigetragen.
Search for more papers by this authorCorresponding Author
Prof. Dr. Frank Glorius
Westfälische Wilhelms-Universität Münster, Organisch-Chemisches Institut, Corrensstraße 40, 48149 Münster (Deutschland)
Westfälische Wilhelms-Universität Münster, Organisch-Chemisches Institut, Corrensstraße 40, 48149 Münster (Deutschland)Search for more papers by this authorDiese Arbeit wurde von der Alexander von Humboldt-Stiftung (D.Z.), dem Europäischen Forschungsrat im Zuge des Siebten Rahmenprogramms der Europäischen Gemeinschaft (FP7 2007–2013)/ERC-Fördernummer 25936 und der DFG (Leibniz-Preis F.G., SFB858, S.V.C.) unterstützt. Wir danken C. G. Daniliuc für Röntgenkristallstrukturanalyse sowie Dr. C. Guo, Dr. M. Hopkinson, Dr. M. Boultadakis-Arapinis und T. Gensch (alle WWU Münster) für wertvolle Diskussionen.
Abstract
Wir stellen eine RhIII-katalysierte C-H-Aktivierung/Abfangcyclisierung vor, an der eine nukleophile Addition einer C(sp3)-Rh-Spezies an polarisierte Doppelbindungen beteiligt ist. Dies ist die erste intermolekulare katalytische Methode zur direkten Synthese von 1-Aminoindolinen mit großer Substratbreite und unter milden Reaktionsbedingungen.
Supporting Information
As a service to our authors and readers, this journal provides supporting information supplied by the authors. Such materials are peer reviewed and may be re-organized for online delivery, but are not copy-edited or typeset. Technical support issues arising from supporting information (other than missing files) should be addressed to the authors.
| Filename | Description |
|---|---|
| ange_201410342_sm_miscellaneous_information.pdf12.6 MB | miscellaneous_information |
Please note: The publisher is not responsible for the content or functionality of any supporting information supplied by the authors. Any queries (other than missing content) should be directed to the corresponding author for the article.
References
- 1Ausgewählte Beispiele:
- 1aE. J. Glamkowski, P. A. Eieitano, J. Med. Chem. 1979, 22, 106;
- 1bG. Cignarella, P. Sanna, J. Med. Chem. 1981, 24, 1003;
- 1cH. H. Buschmann, A. Torrens Jover, J. Mas Prio, J. R. Quintana Ruiz, A. Dordal Zueras, WO2007009687A1;
- 1dS. Thakrar, N. Pandya, H. Vala, A. Bavishi, A. Radadiya, C. Pannecouque, A. K. Shah, Chem. Biol. Interface 2012, 2, 107.
- 2Ausgewählte Beispiele:
- 2aJ. L. Stanton, M. H. Ackerman, J. Med. Chem. 1983, 26, 986;
- 2bP. Melnyk, B. Legrand, J. Gasche, P. Ducrot, C. Thal, Tetrahedron 1995, 51, 1941;
- 2cY. H. Kim, J. Y. Choi, Tetrahedron Lett. 1996, 37, 5543;
- 2dY. Kiryu, S. Itoh, K. Kaneko, H. Katayama, Chem. Pharm. Bull. 1998, 46, 1810;
- 2eA. B. Smith III, L. Kuerti, A. H. Davulcu, Org. Lett. 2006, 8, 2167;
- 2fS. Sakami, M. Maeda, K. Kawai, T. Aoki, K. Kawamura, H. Fujii, K. Hasebe, M. Nakajima, T. Endo, S. Ueno, T. Ito, J. Kamei, H. Nagase, J. Med. Chem. 2008, 51, 4404.
- 3
- 3aM. Elkhatib, L. Peyrot, R. Metz, R. Tenu, F. Elomar, H. Delalu, Int. J. Chem. Kinet. 2002, 34, 575;
- 3bM. L. Kantor, US4564677A1.
- 4Ausgewählte Beispiele:
- 4aJ.-J. Li, T.-S. Mei, J.-Q. Yu, Angew. Chem. Int. Ed. 2008, 47, 6452; Angew. Chem. 2008, 120, 6552;
- 4bJ. L. Neumann, S. Rakshit, T. Dröge, F. Glorius, Angew. Chem. Int. Ed. 2009, 48, 6892; Angew. Chem. 2009, 121, 7024;
- 4cD.-S. Wang, Q.-A. Chen, W. Li, C.-B. Yu, Y.-G. Zhou, X. Zhang, J. Am. Chem. Soc. 2010, 132, 8909;
- 4dT.-S. Mei, D. Leow, H. Xiao, B. N. Laforteza, J.-Q. Yu, Org. Lett. 2013, 15, 3058.
- 5Bislang wurde nur eine intramolekulare katalytische Methode zur Synthese von 1-Aminoindolinen mit sehr eingeschränkter Substratbreite veröffentlicht: K. Hasegawa, N. Kimura, S. Arai, A. Nishida, J. Org. Chem. 2008, 73, 6363.
- 6
- 6aT. Satoh, M. Miura, Chem. Eur. J. 2010, 16, 11212;
- 6bD. A. Colby, A. S. Tsai, R. G. Bergman, J. A. Ellman, Acc. Chem. Res. 2011, 44, 814;
- 6cF. W. Patureau, J. Wencel-Delord, F. Glorius, Aldrichimica Acta 2012, 45, 31;
- 6dG. Song, F. Wang, X. Li, Chem. Soc. Rev. 2012, 41, 3651;
- 6eS. Chiba, Chem. Lett. 2012, 41, 1554;
- 6fN. Kuhl, N. Schröder, F. Glorius, Adv. Synth. Catal. 2014, 356, 1443.
- 7
- 7aF. W. Patureau, T. Besset, N. Kuhl, F. Glorius, J. Am. Chem. Soc. 2011, 133, 2154;
- 7bK. Muralirajan, K. Parthasarathy, C.-H. Cheng, Angew. Chem. Int. Ed. 2011, 50, 4169; Angew. Chem. 2011, 123, 4255;
- 7cZ. Qi, M. Wang, X. Li, Org. Lett. 2013, 15, 5440;
- 7dY. Chen, F. Wang, W. Zhen, X. Li, Adv. Synth. Catal. 2013, 355, 353;
- 7eL. Dong, C.-H. Qu, J.-R. Huang, W. Zhang, Q.-R. Zhang, J.-G. Deng, Chem. Eur. J. 2013, 19, 16537;
- 7fT. Fukutani, N. Umeda, K. Hirano, T. Satoh, M. Miura, Chem. Commun. 2009, 5141;
- 7gB.-J. Li, H.-Y. Wang, Q.-L. Zhu, Z.-J. Shi, Angew. Chem. Int. Ed. 2012, 51, 3948; Angew. Chem. 2012, 124, 4014.
- 8Ausgewählte Beispiele zu RhIII-katalysierter dirigierter C-H-Olefinierung:
- 8aK. Ueura, T. Satoh, M. Miura, Org. Lett. 2007, 9, 1407;
- 8bF. W. Patureau, F. Glorius, J. Am. Chem. Soc. 2010, 132, 9982;
- 8cF. Wang, G. Song, X. Li, Org. Lett. 2010, 12, 5430;
- 8dF. W. Patureau, T. Besset, F. Glorius, Angew. Chem. Int. Ed. 2011, 50, 1064; Angew. Chem. 2011, 123, 1096;
- 8eT.-J. Gong, B. Xiao, Z.-J. Liu, J. Wan, J. Xu, D.-F. Luo, Y. Fu, L. Liu, Org. Lett. 2011, 13, 3235;
- 8fF. W. Patureau, C. Nimphius, F. Glorius, Org. Lett. 2011, 13, 6346;
- 8gA. S. Tsai, M. Brasse, R. G. Bergman, J. A. Ellman, Org. Lett. 2011, 13, 540;
- 8hS. H. Park, J. Y. Kim, S. Chang, Org. Lett. 2011, 13, 2372;
- 8iC. Wang, H. Chen, Z. Wang, J. Chen, Y. Huang, Angew. Chem. Int. Ed. 2012, 51, 7242; Angew. Chem. 2012, 124, 7354;
- 8jW. Zhen, F. Wang, W. Zhao, Z. Du, X. Li, Angew. Chem. Int. Ed. 2012, 51, 11819; Angew. Chem. 2012, 124, 11989;
- 8kJ. Zhang, T.-P. Loh, Chem. Commun. 2012, 48, 11232;
- 8lL. Zheng, J. Wang, Chem. Eur. J. 2012, 18, 9699;
- 8mY. Unoh, Y. Hashimoto, D. Takeda, K. Hirano, T. Satoh, M. Miura, Org. Lett. 2013, 15, 3258;
- 8nM. Brasse, J. Cámpora, J. A. Ellman, R. G. Bergman, J. Am. Chem. Soc. 2013, 135, 6427;
- 8oB. Liu, Y. Fan, Y. Gao, C. Sun, C. Xu, J. Zhu, J. Am. Chem. Soc. 2013, 135, 468;
- 8pX. Huang, J. Huang, C. Du, X. Zhang, F. Song, J. You, Angew. Chem. Int. Ed. 2013, 52, 12970; Angew. Chem. 2013, 125, 13208.
- 9
- 9aF. Kakiuchi, M. Matsumoto, K. Tsuchiya, K. Igi, T. Hayamizu, N. Chatani, S. Murai, J. Organomet. Chem. 2003, 686, 134;
- 9bH.-J. Li, P.-H. Li, L. Wang, Org. Lett. 2013, 15, 620;
- 9cK. Muralirajan, C.-H. Cheng, Chem. Eur. J. 2013, 19, 6198;
- 9dD. Zhao, Q. Wu, X. Huang, F. Song, T. Lv, J. You, Chem. Eur. J. 2013, 19, 6239;
- 9eY. Lian, R. G. Bergman, L. D. Lavis, J. A. Ellman, J. Am. Chem. Soc. 2013, 135, 7122.
- 10
- 10aT. Uemura, N. Chatani, J. Org. Chem. 2005, 70, 8631;
- 10bK. Kisseljova, O. Tsubrik, R. Sillard, S. Mäeorg, U. Mäeorg, Org. Lett. 2006, 8, 43;
- 10cO. Tsubrik, R. Sillard, U. Mäeorg, Synthesis 2006, 843.
- 11CCDC 1029702 (5 a) enthält die ausführlichen kristallographischen Daten zu dieser Veröffentlichung. Die Daten sind kostenlos beim Cambridge Crystallographic Data Centre über www.ccdc.cam.ac.uk/data_request/cif erhältlich.
- 12Wir vermuten, dass die starke Koordination von CHO an die [Rh]-Spezies den bevorzugten N-N-Bindungsbruch bedingt.
- 13N. J. Webb, S. P. Marsden, S. A. Raw, Org. Lett. 2014, 16, 4718.
- 14
- 14aJ. T. Klein, L. Davis, G. E. Olsen, G. S. Wong, F. P. Huger, C. P. Smith, W. W. Petko, M. Cornfeldt, J. C. Wilker, R. D. Blitzer, E. Landau, V. Harautunian, L. L. Martin, R. C. Effland, J. Med. Chem. 1996, 39, 570;
- 14bT. Itoh, M. Miyazaki, H. Maeta, Y. Matsuya, K. Nagata, A. Ohsawa, Bioorg. Med. Chem. 2000, 8, 1983.
- 15
- 15aB. A. Frontana-Uribe, C. Moinet, L. Toupet, Eur. J. Org. Chem. 1999, 419;
10.1002/(SICI)1099-0690(199902)1999:2<419::AID-EJOC419>3.0.CO;2-V CAS Web of Science® Google Scholar
- 15bM. Watanabe, T. Yamamoto, M. Nishiyama, Angew. Chem. Int. Ed. 2000, 39, 2501;
10.1002/1521-3773(20000717)39:14<2501::AID-ANIE2501>3.0.CO;2-T CAS PubMed Web of Science® Google ScholarAngew. Chem. 2000, 112, 2620;
- 15cF. Melkonyan, A. Topolyan, M. Yurovskaaya, A. Karchava, Eur. J. Org. Chem. 2008, 5952;
- 15dN. Halland, M. Nazare, J. Alonso, O. R′kyek, A. Lindenschmidt, Chem. Commun. 2011, 47, 1042;
- 15eE. Brachet, S. Messaoudi, J.-F. Peyrat, J.-D. Brion, M. Alami, Adv. Synth. Catal. 2012, 354, 2829;
- 15fY. Liang, K. Yu, B. Li, S. Xu, H. Song, B. Wang, Chem. Commun. 2014, 50, 6130.
- 16Y. Zhang, Q. Tang, M. Luo, Org. Biomol. Chem. 2011, 9, 4977.
- 17M. Zhu, N. Zheng, Synthesis 2011, 2223.
- 18
- 18aM. Somei, K. Ura, Chem. Lett. 1978, 707;
- 18bM. Somei, Y. Kurizuka, Chem. Lett. 1979, 127.
- 19
- 19aK. Umemura, T. Mizushima, H. Katayama, Y. Kiryu, T. Yamori, T. Andoh, Mol. Pharmacol. 2002, 62, 873;
- 19bY.-M. Zhu, Y. Kiryu, H. Katayama, Tetrahedron Lett. 2002, 43, 3577.
- 20Ein möglicher Mechanismus zur Bildung von 7 a infolge von β-Hydrideliminierung:
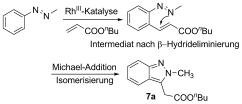
- 21
- 21aW. Jones, Acc. Chem. Res. 2003, 36, 140;
- 21bE. M. Simmons, J. F. Hartwig, Angew. Chem. Int. Ed. 2012, 51, 3066; Angew. Chem. 2012, 124, 3120.
- 22L. Li, W. W. Brennessel, W. D. Jones, Organometallics 2009, 28, 3492.
- 23D. L. Davies, O. Al-Duaij, J. Fawcett, M. Giardiello, S. T. Hilton, D. R. Russell, Dalton Trans. 2003, 4132.
- 24
- 24aC. Wang, H. Sun, Y. Fang, Y. Huang, Angew. Chem. Int. Ed. 2013, 52, 5795; Angew. Chem. 2013, 125, 5907;
- 24bD. Zhao, Z. Shi, F. Glorius, Angew. Chem. Int. Ed. 2013, 52, 12426; Angew. Chem. 2013, 125, 12652.
- 25
- 25aS. Rakshit, C. Grohmann, T. Besset, F. Glorius, J. Am. Chem. Soc. 2011, 133, 2350;
- 25bN. Guimond, S. I. Gorelsky, K. Fagnou, J. Am. Chem. Soc. 2011, 133, 6449;
- 25cT. K. Hyster, L. Knörr, T. R. Ward, T. Rovis, Science 2012, 338, 500;
- 25dB. Ye, N. Cramer, Science 2012, 338, 504;
- 25eJ. M. Neely, T. Rovis, J. Am. Chem. Soc. 2013, 135, 66;
- 25fD. Zhao, F. Lied, F. Glorius, Chem. Sci. 2014, 5, 2869.
Citing Literature
This is the
German version
of Angewandte Chemie.
Note for articles published since 1962:
Do not cite this version alone.
Take me to the International Edition version with citable page numbers, DOI, and citation export.
We apologize for the inconvenience.




