Unerwartete Bildung eines [4]Radialens und mehrerer Dendralene bei der Addition von Tetracyanoethylen an ein Tetraaryl[5]cumulen†
Johanna A. Januszewski
Department für Chemie und Pharmazie & Interdisciplinary Center for Molecular Materials (ICMM), Friedrich-Alexander-Universität Erlangen-Nürnberg (FAU), Henkestrasse 42, 91054 Erlangen (Deutschland) http://www.chemie.uni-erlangen.de/tykwinski
Search for more papers by this authorDr. Frank Hampel
Department für Chemie und Pharmazie & Interdisciplinary Center for Molecular Materials (ICMM), Friedrich-Alexander-Universität Erlangen-Nürnberg (FAU), Henkestrasse 42, 91054 Erlangen (Deutschland) http://www.chemie.uni-erlangen.de/tykwinski
Search for more papers by this authorDr. Christian Neiss
Lehrstuhl für Theoretische Chemie & Interdisciplinary Center for Molecular Materials (ICMM), Friedrich-Alexander-Universität Erlangen-Nürnberg (FAU), Egerlandstraße 3, 91058 Erlangen (Deutschland)
Search for more papers by this authorProf. Dr. Andreas Görling
Lehrstuhl für Theoretische Chemie & Interdisciplinary Center for Molecular Materials (ICMM), Friedrich-Alexander-Universität Erlangen-Nürnberg (FAU), Egerlandstraße 3, 91058 Erlangen (Deutschland)
Search for more papers by this authorCorresponding Author
Prof. Dr. Rik R. Tykwinski
Department für Chemie und Pharmazie & Interdisciplinary Center for Molecular Materials (ICMM), Friedrich-Alexander-Universität Erlangen-Nürnberg (FAU), Henkestrasse 42, 91054 Erlangen (Deutschland) http://www.chemie.uni-erlangen.de/tykwinski
Department für Chemie und Pharmazie & Interdisciplinary Center for Molecular Materials (ICMM), Friedrich-Alexander-Universität Erlangen-Nürnberg (FAU), Henkestrasse 42, 91054 Erlangen (Deutschland) http://www.chemie.uni-erlangen.de/tykwinskiSearch for more papers by this authorJohanna A. Januszewski
Department für Chemie und Pharmazie & Interdisciplinary Center for Molecular Materials (ICMM), Friedrich-Alexander-Universität Erlangen-Nürnberg (FAU), Henkestrasse 42, 91054 Erlangen (Deutschland) http://www.chemie.uni-erlangen.de/tykwinski
Search for more papers by this authorDr. Frank Hampel
Department für Chemie und Pharmazie & Interdisciplinary Center for Molecular Materials (ICMM), Friedrich-Alexander-Universität Erlangen-Nürnberg (FAU), Henkestrasse 42, 91054 Erlangen (Deutschland) http://www.chemie.uni-erlangen.de/tykwinski
Search for more papers by this authorDr. Christian Neiss
Lehrstuhl für Theoretische Chemie & Interdisciplinary Center for Molecular Materials (ICMM), Friedrich-Alexander-Universität Erlangen-Nürnberg (FAU), Egerlandstraße 3, 91058 Erlangen (Deutschland)
Search for more papers by this authorProf. Dr. Andreas Görling
Lehrstuhl für Theoretische Chemie & Interdisciplinary Center for Molecular Materials (ICMM), Friedrich-Alexander-Universität Erlangen-Nürnberg (FAU), Egerlandstraße 3, 91058 Erlangen (Deutschland)
Search for more papers by this authorCorresponding Author
Prof. Dr. Rik R. Tykwinski
Department für Chemie und Pharmazie & Interdisciplinary Center for Molecular Materials (ICMM), Friedrich-Alexander-Universität Erlangen-Nürnberg (FAU), Henkestrasse 42, 91054 Erlangen (Deutschland) http://www.chemie.uni-erlangen.de/tykwinski
Department für Chemie und Pharmazie & Interdisciplinary Center for Molecular Materials (ICMM), Friedrich-Alexander-Universität Erlangen-Nürnberg (FAU), Henkestrasse 42, 91054 Erlangen (Deutschland) http://www.chemie.uni-erlangen.de/tykwinskiSearch for more papers by this authorDiese Arbeit wurde durch die Friedrich-Alexander-Universität Erlangen-Nürnberg, die Deutsche Forschungsgemeinschaft (SFB 953, “Synthetic Carbon Allotropes”) und “Solar Technologies go Hybrid” – eine Initiative des Bayerischen Staatsministeriums für Wissenschaft, Forschung und Kunst – großzügig unterstützt. Wir danken Dr. Alexandra Griffin (Agilent Technologies) für die Bestimmung der Kristallstrukturdaten von 10 a.
Abstract
Die Verwendung von Cumulenen in chemischen Umsetzungen eröffnet die Möglichkeit, strukturell interessante und potenziell nützliche konjugierte Moleküle herzustellen. Die Cycloadditionsreaktion eines Tetraaryl[5]cumulens mit dem elektronenarmen Olefin Tetracyanoethylen liefert außergewöhnliche Produkte, darunter funktionalisierte Dendralene und Alkylidencyclobutane sowie ein symmetrisches [4]Radialen mit einer besonderen Solvatochromie, dessen λmax-Werte sich dem Nah-IR-Bereich nähern. Diese kohlenstoffreichen Produkte wurden spektroskopisch und röntgenographisch (für fünf der Verbindungen) untersucht. Auch ein möglicher Ablauf der Cycloadditionsreaktion wurde mithilfe mechanistischer und theoretischer Untersuchungen ermittelt. Die Ergebnisse unterstreichen das Potenzial von [5]Cumulenen, als Vorstufen für neuartige konjugierte Systeme zu dienen.
Supporting Information
As a service to our authors and readers, this journal provides supporting information supplied by the authors. Such materials are peer reviewed and may be re-organized for online delivery, but are not copy-edited or typeset. Technical support issues arising from supporting information (other than missing files) should be addressed to the authors.
| Filename | Description |
|---|---|
| ange_201309355_sm_miscellaneous_information.pdf1.9 MB | miscellaneous_information |
Please note: The publisher is not responsible for the content or functionality of any supporting information supplied by the authors. Any queries (other than missing content) should be directed to the corresponding author for the article.
References
- 1
- 1aH. Hopf, Classics in Hydrocarbon Chemistry, Wiley-VCH, Weinheim, 2000, Kap. 9;
- 1bH. Fischer in The Chemistry of Alkenes (Hrsg.: ), Wiley, New York, 1964, S. 1025–1159.
- 2I. E. Castelli, P. Salvestrini, N. Manini, Phys. Rev. B 2012, 85, 214110; B. Akdim, R. Pachter, ACS Nano 2011, 5, 1769–1774; C. H. Hendon, D. Tiana, A. T. Murray, D. R. Carbery, A. Walsh, Chem. Sci. 2013, 4, 4278–4284.
- 3P. Rivera-Fuentes, F. Diederich, Angew. Chem. 2012, 124, 2872–2882;
10.1002/ange.201108001 Google ScholarAngew. Chem. Int. Ed. 2012, 51, 2818–2828; S. Yu, S. Ma, Angew. Chem. 2012, 124, 3128–3167; Angew. Chem. Int. Ed. 2012, 51, 3074–3112.
- 4L. Leroyer, V. Maraval, R. Chauvin, Chem. Rev. 2012, 112, 1310–1343.
- 5A. Auffrant, F. Diederich, C. Boudon, J.-P. Gisselbrecht, M. Gross, Helv. Chim. Acta 2004, 87, 3085–3105.
- 6J. A. Januszewski, D. Wendinger, C. D. Methfessel, F. Hampel, R. R. Tykwinski, Angew. Chem. 2013, 125, 1862–1867;
10.1002/ange.201208058 Google ScholarAngew. Chem. Int. Ed. 2013, 52, 1817–1821.
- 7H. D. Hartzler, J. Am. Chem. Soc. 1971, 93, 4527–4531.
- 8Y. Kuwatani, G. Yamamoto, M. Oda, M. Iyoda, Bull. Chem. Soc. Jpn. 2005, 78, 2188–2208.
- 9N. Islam, T. Ooi, T. Iwasawa, M. Nishiuchia, Y. Kawamura, Chem. Commun. 2009, 574–576.
- 10Eine Cyclotrimerisierung an den β-Bindungen eines [5]Cumulens wurde ebenfalls beobachtet; siehe: T. Kawase, T. Minami, N. Nishigaki, S. Okano, H. Kurata, M. Oda, Angew. Chem. 2004, 117, 320–323;
10.1002/ange.200461608 Google ScholarAngew. Chem. Int. Ed. 2004, 44, 316–319.
- 11B. Bildstein, M. Schweiger, H. Angleitner, H. Kopacka, K. Wurst, K.-H. Ongania, M. Fontani, P. Zanello, Organometallics 1999, 18, 4286–4295.
- 12M. Kivala, F. Diederich, Acc. Chem. Res. 2009, 42, 235–248; S.-i. Kato, F. Diederich, Chem. Commun. 2010, 46, 1994–2006.
- 13M. Štefko, M. D. Tzirakis, B. Breiten, M.-O. Ebert, O. Dumele, W. B. Schweizer, J.-P. Gisselbrecht, C. Boudon, M. T. Beels, I. Biaggio, F. Diederich, Chem. Eur. J. 2013, 19, 12693–12704; Y.-L. Wu, F. Tancini, W. B. Schweizer, D. Paunescu, C. Boudon, J.-P. Gisselbrecht, P. D. Jarowski, E. Dalcanale, F. Diederich, Chem. Asian J. 2012, 7, 1185–1190; B. Breiten, Y.-L. Wu, P. D. Jarowski, J.-P. Gisselbrecht, C. Boudon, M. Griesser, C. Onitsch, G. Gescheidt, W. B. Schweizer, N. Langer, C. Lennartz, F. Diederich, Chem. Sci. 2011, 2, 88–93.
- 14Y. Li, M. Ashizawa, S. Uchida, T. Michinobu, Polym. Chem. 2012, 3, 1996–2005; T. Shoji, S. Ito, T. Okujima, N. Morita, Chem. Eur. J. 2013, 19, 5721–5730.
- 15M. Gholami, R. R. Tykwinski, Chem. Rev. 2006, 106, 4997–5027.
- 16Hauptliteraturquellen für Dendralene:
- 16aA. D. Payne, G. Bojase, M. N. Paddon-Row, M. S. Sherburn, Angew. Chem. 2009, 121, 4930–4933;
10.1002/ange.200901733 Google ScholarAngew. Chem. Int. Ed. 2009, 48, 4836–4839;
- 16bH. Hopf, M. S. Sherburn, Angew. Chem. 2012, 124, 2346–2389;
10.1002/ange.201102987 Google ScholarAngew. Chem. Int. Ed. 2012, 51, 2298–2338;
- 16cH. Hopf, Angew. Chem. 1984, 96, 947–958; Angew. Chem. Int. Ed. Engl. 1984, 23, 948–960.
- 17H. Hopf, G. Maas, Angew. Chem. 1992, 104, 953–977; Angew. Chem. Int. Ed. Engl. 1992, 31, 931–954.
- 18Cyclische [3]Dendralene (Trimethylencyclobutane) wurden bereits untersucht, jedoch ist über diese Verbindungklasse wenig bekannt; siehe: J. K. Williams, W. H. Sharkey, J. Am. Chem. Soc. 1959, 81, 4269–4272; L. Trabert, H. Hopf, D. Schomburg, Chem. Ber. 1981, 114, 2405–2414; W. V. Dower, K. P. C. Vollhardt, Angew. Chem. 1982, 94, 712; Angew. Chem. Int. Ed. Engl. 1982, 21, 1545–1555; W. T. Thorstad, N. S. Mills, D. Q. Buckelew, L. S. Govea, J. Org. Chem. 1989, 54, 773–776.
- 19Aus einer CH2Cl2-Lösung auf eine DC-Platte aufgetragen ist diese Fraktion anfänglich orangebraun und geht allmählich, während des Verdampfens des Lösungsmittels, in grün über.
- 20F. Bureš, O. Pytela, M. Kivala, F. Diederich, J. Phys. Org. Chem. 2011, 24, 274–281; B. Strehmel, A. M. Sarker, H. Detert, ChemPhysChem 2003, 4, 249–259.
- 21Für weitere rechteckige [4]Radialene siehe:
- 21aA. E. Learned, A. M. Arif, P. J. Stang, J. Org. Chem. 1988, 53, 3122–3123;
- 21bP. I. Dosa, G. D. Whitener, K. P. C. Vollhardt, A. D. Bond, S. J. Teat, Org. Lett. 2002, 4, 2075–2078.
- 22
- 22aM. Iyoda, H. Otani, M. Oda, Y. Kai, Y. Baba, N. Kasai, J. Am. Chem. Soc. 1986, 108, 5371–5372;
- 22bF. P. van Remoortere, F. P. Boer, J. Am. Chem. Soc. 1970, 92, 3355–3360;
- 22cS. Hashmi, K. Polborn, G. Szeimies, Chem. Ber. 1989, 122, 2399–2401.
- 23D. Bouvy, Z. Janousek, H. G. Viehe, B. Tinant, J.-P. Declercq, Tetrahedron Lett. 1993, 34, 1779–1782.
- 24Die Interpretation dieses Produkts als 16 stützt sich hauptsächlich auf sein Massenspektrum sowie seine zu 15 analoge Bildung und analogen Eigenschaften. Die 1H- und 13C-NMR-Spektren sind wegen stark verbreiterter Signale nicht sehr hilfreich (die Spektren sind in den Hintergrundinformationen zu finden).
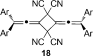
- 25Die Bildung des Kopf-Kopf-Dimers 18 kann nicht ausgeschlossen werden, jedoch wurde bislang kein überzeugender Beweis für diese Bildung gefunden.
- 26Über eine ähnliche Addition von TCNE an ein elektronenreiches [3]Cumulen wurde berichtet: N. Islam, M. Tsukayama, Y. Kawamura, Int. J. Mod. Phys. B 2006, 20, 4619–4624.
- 27R. Pal, R. J. Clark, M. Manoharan, I. V. Alabugin, J. Org. Chem. 2010, 75, 8689–8692.
Citing Literature
This is the
German version
of Angewandte Chemie.
Note for articles published since 1962:
Do not cite this version alone.
Take me to the International Edition version with citable page numbers, DOI, and citation export.
We apologize for the inconvenience.




