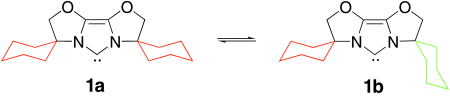
Ein N-heterocyclischer Carbenligand mit flexiblem sterischem Anspruch ermöglicht die Suzuki-Kreuzkupplung sterisch gehinderter Arylchloride bei Raumtemperatur†
Gereon Altenhoff Dipl.-Chem.
Max-Planck-Institut für Kohlenforschung, Kaiser-Wilhelm-Platz 1, 45470 Mülheim an der Ruhr, Deutschland, Fax: (+49) 208-306-2994
Search for more papers by this authorRichard Goddard Dr.
Max-Planck-Institut für Kohlenforschung, Kaiser-Wilhelm-Platz 1, 45470 Mülheim an der Ruhr, Deutschland, Fax: (+49) 208-306-2994
Search for more papers by this authorChristian W. Lehmann Dr.
Max-Planck-Institut für Kohlenforschung, Kaiser-Wilhelm-Platz 1, 45470 Mülheim an der Ruhr, Deutschland, Fax: (+49) 208-306-2994
Search for more papers by this authorFrank Glorius Dr.
Max-Planck-Institut für Kohlenforschung, Kaiser-Wilhelm-Platz 1, 45470 Mülheim an der Ruhr, Deutschland, Fax: (+49) 208-306-2994
Search for more papers by this authorGereon Altenhoff Dipl.-Chem.
Max-Planck-Institut für Kohlenforschung, Kaiser-Wilhelm-Platz 1, 45470 Mülheim an der Ruhr, Deutschland, Fax: (+49) 208-306-2994
Search for more papers by this authorRichard Goddard Dr.
Max-Planck-Institut für Kohlenforschung, Kaiser-Wilhelm-Platz 1, 45470 Mülheim an der Ruhr, Deutschland, Fax: (+49) 208-306-2994
Search for more papers by this authorChristian W. Lehmann Dr.
Max-Planck-Institut für Kohlenforschung, Kaiser-Wilhelm-Platz 1, 45470 Mülheim an der Ruhr, Deutschland, Fax: (+49) 208-306-2994
Search for more papers by this authorFrank Glorius Dr.
Max-Planck-Institut für Kohlenforschung, Kaiser-Wilhelm-Platz 1, 45470 Mülheim an der Ruhr, Deutschland, Fax: (+49) 208-306-2994
Search for more papers by this authorWir danken Prof. A. Fürstner für seine großzügige Unterstützung und dem Fonds der Chemischen Industrie sowie der Deutschen Forschungsgemeinschaft für finanzielle Hilfe.
Graphical Abstract
Gratwanderung gelungen: Sterischer Anspruch eines Liganden fördert bei der Pd-katalysierten Suzuki-Kupplung zwar die reduktive Eliminierung, behindert aber auch die oxidative Addition und Transmetallierung sterisch gehinderter Substrate. Dieses Dilemma lässt sich mit dem Carbenliganden 1 beheben, dessen sterischer Anspruch flexibel ist.
Supporting Information
Supporting information for this article is available on the WWW under http://www.wiley-vch.de/contents/jc_2001/2003/z51325_s.pdf or from the author.
Please note: The publisher is not responsible for the content or functionality of any supporting information supplied by the authors. Any queries (other than missing content) should be directed to the corresponding author for the article.
References
- 1
- 1aN. Miyaura, A. Suzuki, Chem. Rev. 1995, 95, 2457;
- 1bA. Suzuki, J. Organomet. Chem. 1999, 576, 147;
- 1cN. Miyaura, Top. Curr. Chem. 2002, 219, 11;
- 1dS. Kotha, K. Lahiri, D. Kashinath, Tetrahedron 2002, 58, 9633.
- 2Übersichtsartikel: A. F. Littke, G. C. Fu, Angew. Chem. 2002, 114, 4350;
10.1002/1521-3757(20021115)114:22<4350::AID-ANGE4350>3.0.CO;2-0 Google ScholarAngew. Chem. Int. Ed. 2002, 41, 4176.10.1002/1521-3773(20021115)41:22<4176::AID-ANIE4176>3.0.CO;2-U CAS PubMed Web of Science® Google Scholar
- 3Beispielsweise:
- 3aR. B. Bedford, C. S. J. Cazin, S. L. Hazelwood, Angew. Chem. 2002, 114, 4294;
10.1002/1521-3757(20021104)114:21<4294::AID-ANGE4294>3.0.CO;2-G Google ScholarAngew. Chem. Int. Ed. 2002, 41, 4120;10.1002/1521-3773(20021104)41:21<4120::AID-ANIE4120>3.0.CO;2-7 CAS PubMed Web of Science® Google Scholar
- 3bJ. P. Wolfe, R. A. Singer, B. H. Yang, S. L. Buchwald, J. Am. Chem. Soc. 1999, 121, 9550;
- 3cA. F. Littke, C. Dai, G. C. Fu, J. Am. Chem. Soc. 2000, 122, 4020;
- 3dJ. P. Stambuli, R. Kuwano, J. F. Hartwig, Angew. Chem. 2002, 114, 4940;
10.1002/ange.200290035 Google ScholarAngew. Chem. Int. Ed. 2002, 41, 4746;
- 3eA. Zapf, A. Ehrentraut, M. Beller, Angew. Chem. 2000, 112, 4315;
10.1002/1521-3757(20001117)112:22<4315::AID-ANGE4315>3.0.CO;2-L Google ScholarAngew. Chem. Int. Ed. 2000, 39, 4153.10.1002/1521-3773(20001117)39:22<4153::AID-ANIE4153>3.0.CO;2-T CAS PubMed Web of Science® Google Scholar
- 4
- 4aC. W. K. Gstöttmayr, V. P. W. Böhm, E. Herdtweck, M. Grosche, W. A. Herrmann, Angew. Chem. 2002, 114, 1421;
10.1002/1521-3757(20020415)114:8<1421::AID-ANGE1421>3.0.CO;2-E Google ScholarAngew. Chem. Int. Ed. 2002, 41, 1363;10.1002/1521-3773(20020415)41:8<1363::AID-ANIE1363>3.0.CO;2-G CAS PubMed Web of Science® Google Scholar
- 4bW. A. Herrmann, C.-P. Reisinger, M. Spiegler, J. Organomet. Chem. 1998, 557, 93;
- 4cT. Weskamp, V. P. W. Böhm, W. A. Herrmann, J. Organomet. Chem. 1999, 585, 348;
- 4dG. A. Grasa, M. S. Viciu, J. Huang, C. Zhang, M. L. Trudell, S. P. Nolan, Organometallics 2002, 21, 2866;
- 4eC. Zhang, J. Huang, M. L. Trudell, S. P. Nolan, J. Org. Chem. 1999, 64, 3804;
- 4fA. Fürstner, A. Leitner, Synlett 2001, 290.
- 5Exzellente Übersicht über die Verwendung von NHC-Liganden in der Katalyse:
- 5aW. A. Herrmann, Angew. Chem. 2002, 114, 1342; Angew. Chem. Int. Ed. 2002, 41, 1291. Siehe weiterhin:
- 5bA. J. Arduengo III, R. Krafczyk, Chem. Unserer Zeit 1998, 32, 6;
- 5cD. Bourissou, O. Guerret, F. P. Gabbaï, G. Bertrand, Chem. Rev. 2000, 100, 39.
- 6Die Bedeutung von Pd0-Komplexen mit nur einem Liganden als katalytisch aktive Spezies in der Suzuki-Kreuzkupplung wurde postuliert; siehe z. B.:
- 6aLit. [3c];
- 6bLit. [3d];
- 6cQ.-S. Hu, Y. Lu, Z.-Y. Tang, H.-B. Yu, J. Am. Chem. Soc. 2003, 125, 2856.
- 7Synthese von sterisch gehinderten Biarylen durch Suzuki-Kreuzkupplung bei höheren Temperaturen:
- 7aLit. [3b];
- 7bLit. [3c];
- 7cJ. Yin, M. P. Rainka, X.-X. Zhang, S. L. Buchwald, J. Am. Chem. Soc. 2002, 124, 1162.
- 8Mechanistische Diskussion von Pd/NHC-Katalysatorsystemen in der Suzuki-Kreuzkupplung: Lit. [4d].
- 9F. Glorius, G. Altenhoff, R. Goddard, C. Lehmann, Chem. Commun. 2002, 2704.
- 10aKristallstrukturanalyse von 4:[11] [C17H25N2O2]+[CF3O3S]−, aus THF/Hexan, Mr=438.46, Kristalldimensionen: 0.18×0.18×0.18 mm3, monoklin, Raumgruppe P21/n (Nr. 14), a=12.6250(1), b=14.4420(1), c=22.1470(2) Å, β=98.289(1)°, V=3995.88(6) Å3, Z=8, ρber.=1.458 g cm−3, F(000)=1840, 99 914 gemessene und 12 665 unabhängige Reflexe (Rint=0.068), 9933 mit I>2σ(I), θmax=30.96°, Tmin=0.958, Tmax=0.987, 548 Parameter, Imidazolium-H-Atome isotrop verfeinert, ansonsten auf idealen Positionen platziert, ein Anion leicht fehlgeordnet (0.93:0.07), Chebychev-Wichtung, R1=0.0451, wR2=0.1102 (alle Reflexe), Δρmax/min=0.454/−0.443 e Å−3.
- 10bKristallstrukturanalyse von 5⋅THF:[11] [C34H48N4O4Pd]⋅[C4H8O], aus THF/Hexan, Mr=755.27, Kristalldimensionen: 0.24×0.11×0.10 mm3, tetragonal, Raumgruppe I
 (Nr. 82), a=23.7110(2), c=12.6712(1) Å, V=7123.9(1) Å3, Z=8, ρber.=1.408 g cm−3, F(000)=3184, 57 202 gemessene und 11 290 unabhängige Reflexe (Rint=0.053), 9227 mit I>2σ(I), θmax=30.99°, Tmin=0.899, Tmax=0.950; 434 Parameter, absolute Struktur nicht bestimmt (Pd-Atome auf Wyckhoff-Positionen e und f), H-Atome auf idealen Positionen platziert, Chebychev-Wichtung, R1=0.037, wR2=0.085 (alle Reflexe), Δρmax/min=1.820/−0.673 e Å−3.
(Nr. 82), a=23.7110(2), c=12.6712(1) Å, V=7123.9(1) Å3, Z=8, ρber.=1.408 g cm−3, F(000)=3184, 57 202 gemessene und 11 290 unabhängige Reflexe (Rint=0.053), 9227 mit I>2σ(I), θmax=30.99°, Tmin=0.899, Tmax=0.950; 434 Parameter, absolute Struktur nicht bestimmt (Pd-Atome auf Wyckhoff-Positionen e und f), H-Atome auf idealen Positionen platziert, Chebychev-Wichtung, R1=0.037, wR2=0.085 (alle Reflexe), Δρmax/min=1.820/−0.673 e Å−3.
- 11Allgemeines zu den Kristallstrukturanalysen: Nonius-Kappa-CCD-Diffraktometer, λ(MoKα)=0.71073 Å, μ=0.22 mm−1 (4), μ=0.57 mm−1 (5⋅THF), Datensammlung bei T=100 K, Strukturlösung mit Direkten Methoden (SHELXS-97), Verfeinerung nach der Methode der kleinsten Fehlerquadrate gegen F
 (SHELXL-97); beide Programme von G. Sheldrick, Universität Göttingen, 1997. CCDC-204549 (4) und CCDC-204550 (5⋅THF) enthalten die ausführlichen kristallographischen Daten zu dieser Veröffentlichung. Die Daten sind kostenlos über www.ccdc.cam.ac.uk/conts/retrieving.html erhältlich (oder können bei folgender Adresse in Großbritannien angefordert werden: Cambridge Crystallographic Data Centre, 12 Union Road, Cambridge CB2 1EZ; Fax: (+44) 1223-336-033; oder [email protected]).
(SHELXL-97); beide Programme von G. Sheldrick, Universität Göttingen, 1997. CCDC-204549 (4) und CCDC-204550 (5⋅THF) enthalten die ausführlichen kristallographischen Daten zu dieser Veröffentlichung. Die Daten sind kostenlos über www.ccdc.cam.ac.uk/conts/retrieving.html erhältlich (oder können bei folgender Adresse in Großbritannien angefordert werden: Cambridge Crystallographic Data Centre, 12 Union Road, Cambridge CB2 1EZ; Fax: (+44) 1223-336-033; oder [email protected]).
- 12S. Caddick, F. G. N. Cloke, G. K. B. Clentsmith, P. B. Hitchcock, D. McKerrecher, L. R. Titcomb, M. R. V. Williams, J. Organomet. Chem. 2001, 617–618, 635.
- 13Alle neuen Verbindungen wurden vollständig charakterisiert.
- 14Ein positiver Einfluss der Erhöhung des Ligand-zu-Pd-Verhältnisses wurde ebenfalls von Buchwald et al. für Pd/Phosphan-katalysierte Kreuzkupplungen sterisch gehinderter Substrate beobachtet.[3b]
- 15Der CCarben-N-CSubstituent-Winkel beträgt 135° in 5⋅THF, in [Pd(6)2] hingegen 124°. Weiterhin erlaubt die günstige Konformation der spiroanellierten Cyclohexylgruppen dem Komplex 5 eine Anordnung, in welcher die beiden Imidazolylidenliganden zunehmend coplanar sind: In [Pd(6)2] beträgt der Winkel zwischen den Imidazolylidenliganden 84.4(2)°, während er in 5 trotz eines signifikant kleineren Pd-C-Abstandes (2.001(2) gegenüber 2.076(5) Å) 62(1)° (gemittelt) beträgt.[4a]
Citing Literature
This is the
German version
of Angewandte Chemie.
Note for articles published since 1962:
Do not cite this version alone.
Take me to the International Edition version with citable page numbers, DOI, and citation export.
We apologize for the inconvenience.