Eine makrozyklische Hybrid-PET/MRT-Sonde für die quantitative Perfusionsbildgebung in vivo
Abstract
Die Perfusionsdynamik spielt eine entscheidende Rolle bei der Versorgung des Gewebes mit lebenswichtigen Nährstoffen und Sauerstoff und der Abführung von Stoffwechselendprodukten. Bildgebende Verfahren wie die Magnetresonanztomographie (MRT), die Computertomographie (CT) und die Positronen-Emissions-Tomographie (PET) verwenden Kontrastmittel, um Perfusions- und Ausscheidungsmuster sichtbar zu machen. Hybrid-PET/MRT kombiniert die quantitativen Möglichkeiten und Empfindlichkeit der PET mit der hohen funktionellen und anatomischen Detailgenauigkeit der MRT und verspricht eine hohe Präzision bei der molekularen Bildgebung. Die Entwicklung von dualen PET/MRT-Sonden wurde jedoch durch die anspruchsvolle Synthese und Markierung mit radioaktiven Isotopen erschwert. Hier stellen wir eine neuartige PET/MRT-Sonde, [18F][Gd(FL1)], vor, die eine hervorragende Stabilität aufweist, die mit der von makrozyklischen MRT-Kontrastmitteln vergleichbar ist, welche in der klinischen Praxis eingesetzt werden. Das einzigartige molekulare Design von [18F][Gd(FL1)] ermöglicht eine selektive und schnelle Markierung des Gadoliniumchelats im letzten Syntheseschritt. Durch die Nutzung der Stärken von MRT- und PET-Signalen ermöglicht die Sonde eine quantitative in vivo-Darstellung der Perfusions- und Ausscheidungsdynamik durch eine innovative voxelbasierte Analyse. Die diagnostischen Fähigkeiten von [18F][Gd(FL1)] wurden in einer Pilotstudie an gesunden Mäusen nachgewiesen, in der erfolgreich frühe Fälle von einseitiger Nierenfunktionsstörung, einer Erkrankung, die in der Regel schwer zu diagnostizieren ist, nachgewiesen wurden. Diese Studie stellt einen neuen Ansatz für PET/MRT vor und betont ein optimiertes Sondendesign für eine praktische Synthese und eine verbesserte diagnostische Genauigkeit.
Einführung
Eine frühzeitige Erkennung von Krankheiten verbessert die Behandlungsergebnisse und die Prognose für die Patienten erheblich. Pathologische Veränderungen beginnen oft auf molekularer und zellulärer Ebene und verändern die Gewebeumgebung, lange bevor erkennbare Symptome auftreten. Solche Veränderungen können den natürlichen Fluss von Molekülen durch die Blutgefäße und den extrazellulären Raum beeinflussen und dadurch die Gewebedurchblutung und -ausscheidung beeinträchtigen, welche wichtige Biomarker für die Beurteilung von Krebs, Schlaganfall und Nierenerkrankungen darstellen. Medizinische Bildgebungstechnologien bieten die entscheidende Möglichkeit, diese Biomarker für Krankheiten nichtinvasiv zu erkennen, zu lokalisieren und zu visualisieren. Dadurch können möglicherweise auch zusätzliche, unerwartete Befunde entdeckt werden, was wiederum dem Patienten zugutekommt. Die Kombination von Positronen-Emissions-Tomographie (PET) und Magnetresonanztomographie (MRT) in einem Hybridgerät aus PET und MRT stellt einen bedeutenden technologischen Fortschritt in der aktuellen medizinischen Bildgebung dar, da sie die Fähigkeiten zweier führender diagnostischer Technologien vereint. Diese Integration verbindet die quantitative Präzision und hohe Empfindlichkeit der PET-Radionuklid-Detektion mit der unübertroffenen zeitlichen und räumlichen Auflösung der MRT, die eine Differenzierung von Weichteilen ermöglicht.1, 2 Beide Verfahren sind auf extern verabreichte Wirkstoffe angewiesen, um die Genauigkeit der Bildgebung zu verbessern und relevante klinische Parameter zu extrahieren. Bei der PET werden radioaktive Tracer eingesetzt, die bei der Positron-Elektron-Annihilation Gammaphotonen zur Detektion aussenden.3 Ähnlich setzt die MRT häufig Gadolinium-basierte Kontrastmittel (GBCAs) ein, um anatomische Gewebemerkmale zu unterscheiden, insbesondere solche, die durch Zustände verändert werden, die die Durchblutung und Extravasation beeinflussen, wie Schlaganfall oder Tumoren.4 Die für die einzelnen Modalitäten verwendeten Mittel unterscheiden sich sowohl chemisch als auch in der verabreichten Dosis. Während für die hochsensible PET nur Spurenmengen radioaktiver Substanzen erforderlich sind, werden für die kontrastmittelverstärkte MRT in der Regel etwa 1 g Gadolinium für einen Erwachsenen benötigt.4 Dies entspricht einer Differenz von 6 bis 9 Größenordnungen in der molaren Konzentration.
In der aktuellen klinischen Praxis werden PET-Tracer und MRT-Kontrastmittel als separate Klassen von Verbindungen unterschieden. Mit der Einführung der PET/MRT-Technologie wurden jedoch Anstrengungen unternommen, einheitliche Hybrid-PET/MRT-Kontrastmittel zu synthetisieren. Diese Bemühungen konzentrierten sich hauptsächlich auf reaktionsfähige oder zielgerichtete Sonden für spezifische molekulare Marker, wobei die inhärente Komplementarität der beiden Techniken genutzt wurde. So kann beispielsweise das PET-Signal als Indikator dienen, der Bereiche von Interesse für eine hochauflösende MRT-Untersuchung genau lokalisiert. Darüber hinaus ermöglicht die PET die Quantifizierung von Wirkstoffen – ein entscheidender Parameter für reaktionsfähige MRT-Sonden5, 6 – und damit eine Differenzierung zwischen molekularen Reaktionen auf Stimuli und Konzentrationsschwankungen der Sonde, die beide das MRI-Signal beeinflussen. Diese Sonden sind jedoch mit erheblichen Hürden verbunden. Während sich hybride Sonden, auf Basis superparamagnetischen Eisenoxid-Nanopartikeln (SPIOs), einfach herstellen lassen,7 sind diese Sonden nicht reproduzierbar und haben schlechte pharmakokinetische Eigenschaften. Niedermolekulare PET/MRT-Kontrastmittel sind weniger verbreitet, was die Herausforderung unterstreicht, die beiden bildgebenden Verfahren in einem einzigen Präparat zu vereinen. Um dieses Problem zu lösen, wurden verschiedene Strategien zur Kombination von PET-Isotopen und paramagnetischen Metallen untersucht, darunter sowohl pH-abhängige (18F/Gd)8 temperaturabhängige (68Ga/Gd),9 Fibrin-spezifische (64Cu/Gd)10 und Integrin-Targeting (68Ga/Gd)11 molekulare Sonden als auch (52gMn/55Mn)-basierende Sonden.12-14 Obwohl diese Prototypen innovativ sind, beinhalten sie komplexe Synthesemethoden, ein duales Metallchelatmanagement und die Verwendung weniger gängiger Isotope. Darüber hinaus ist die Bildqualität dieser Isotope deutlich schlechter als die von Isotopen mit kürzeren Positronenreichweiten, wie z. B. 18F.
GBCAs verstärken das MRT-Signal, indem sie die T1-Relaxationszeit (Beschleunigung der Relaxationsrate R1=1/T1) der in der Nähe befindlichen Wasserprotonen verkürzen.4 Die Wirksamkeit des Kontrastmittels wird mit seiner r1-Relaxivität beschrieben (r1=R1/c, wobei c die Konzentration in mM ist). Eine wesentliche Einschränkung der MRT besteht darin, dass sie die in vivo-Konzentration des Kontrastmittels nicht genau bestimmen kann. Die Möglichkeit, MRT-Kontrastmittel mithilfe der PET zu quantifizieren, könnte diese seit langem bestehende Einschränkung überwinden. Dies ist besonders für die Nierenbildgebung von Bedeutung, da die Nieren die dynamischsten GBCA-Konzentrationsschwankungen aller Organe aufweisen, sowohl zeitlich als auch räumlich.
Die Standardmethode zur Beurteilung der Nierenfunktion in der klinischen Praxis besteht in der Messung der Serumkreatininkonzentration zur Berechnung der geschätzten glomerulären Filtrationsrate (eGFR).15 Allerdings hat dieser Bluttest erhebliche Einschränkungen, da er nur eine abnorme Funktion erkennen kann, wenn beide Nieren stark beeinträchtigt sind, und keine Einblicke in den Zustand der einzelnen Nieren bietet.16 Im Gegensatz dazu können bildgebende Verfahren die Funktion jeder einzelnen Niere potenziell sehr detailliert darstellen. Aus chemischer Sicht sind GBCAs ideal für die Beurteilung der Nierenfunktion (d. h. Perfusion, Filtration und Ausscheidung), da GBCAs hauptsächlich über die Nieren ausgeschieden werden, vom Glomerulus frei gefiltert werden und weder von den Nephronen ausgeschieden noch resorbiert werden. Jährlich werden Millionen von MRT-Untersuchungen mit Kontrastmittel für verschiedene diagnostische Zwecke durchgeführt.4 Das Potenzial, Nierenerkrankungen frühzeitig zu erkennen, wird jedoch häufig aufgrund der schlechten Quantifizierung von GBCAs in den Nieren während MRT-Scans übersehen.
Während GBCAs wertvolle diagnostische Einblicke bieten, wurden azyklische GBCAs mit der nephrogenen systemischen Fibrose (NSF) in Verbindung gebracht, einer seltenen, aber schweren Erkrankung, die bei Patienten mit eingeschränkter Nierenfunktion auftritt.17 Es gibt auch Bedenken hinsichtlich der langfristigen Speicherung von Gadolinium im Körper.18, 19 Diese Probleme wurden jedoch nicht mit makrozyklischen GBCAs in Verbindung gebracht, die für ihre robuste kinetische Trägheit bekannt sind, die die Freisetzung schädlicher Gd3+-Ionen begrenzt.20, 21 Um alle Hürden bei der Herstellung von Hybrid-PET/MRT-Kontrastmitteln sorgfältig zu berücksichtigen, haben wir ein strukturell unkompliziertes und einfach herzustellendes Kontrastmittel mit Eigenschaften entwickelt, die denen etablierter, klinisch sicherer und zugelassener makrozyklischer GBCAs ähneln. Dieses einzigartige Hybrid-PET/MRT-Kontrastmittel [Gd(FL1)] wurde so konzipiert, dass es eine schnelle und selektive Radiomarkierung mit 18F über eine innovative, Metallchelat-gesteuerte Isotopenaustauschreaktion ermöglicht. [18F][Gd(FL1)] ermöglicht die genaue Überwachung grundlegender biologischer Prozesse über alle Gewebe – Perfusion, Extravasation und Ausscheidungsdynamik. Die Vorteile der Verwendung nicht spezifischer PET/MRT-Kontrastmittel für die Präzisionsbildgebung werden in vivo durch die Erkennung unerwarteter Fälle einseitiger Nierenfunktionsstörungen demonstriert.
Ergebnisse und Diskussion
Design und Synthese von Gd(III)-Chelaten
Ein optimales Design für ein vielseitiges PET/MRT-Kontrastmittel sollte darauf abzielen, die Eigenschaften klinisch zugelassener makrozyklischer MRT-Kontrastmittel, wie hohe kinetische Trägheit, hohe Relaxivität, niedriges Molekulargewicht und schnelle renale Clearance, genau zu replizieren. Ebenso wichtig ist die sorgfältige Auswahl des in das Molekül einzubauenden Positronen-emittierenden Radionuklids für eine optimale PET-Detektion. Unter den brauchbaren Positronen-emittierenden Radionukliden erweist sich 18F als der am besten geeignete Kandidat, da es (i) nur minimale molekulare Veränderungen bewirkt, (ii) eine β+-Zerfallshalbwertszeit von 110 Minuten aufweist, was mit der Pharmakokinetik von Standard-GBCAs übereinstimmt, (iii) eine niedrige Positronenenergie aufweist, die für eine hohe PET-Auflösung optimal ist, und (iv) weltweit in medizinischen Zyklotronen effizient und kostengünstig hergestellt werden kann.22 Schließlich sollte das Radionuklid während des letzten Syntheseschritts in das Chelatormolekül eingebaut werden, um Verluste durch Zerfall zu minimieren. Dies erfordert eine direkte Radiomarkierung eines Gadoliniumchelats, welches sich deutlich von den herkömmlichen organischen Substraten unterscheidet, die normalerweise in der PET-Bildgebung verwendet werden.
Um all diese Anforderungen in einem einzigen Moleküldesign zu erfüllen, stellten wir die Hypothese auf, dass eine Pyridin-Einheit, die für ihre starken Donoreigenschaften bekannt ist, einen der Acetat-Arme in DOTA ersetzen könnte.23 Diese Modifikation würde eine ideale Plattform für eine nachfolgende Derivatisierung bieten, da der Pyridinring für eine nukleophile aromatische Substitution zugänglich ist,24, 25 wodurch die Substitution geeigneter Abgangsgruppen durch Fluoridanionen ermöglicht wird. Obwohl diese Reaktionen für rein organische Substrate beschrieben wurden, war für ihre Anpassung an die erfolgreiche Radiomarkierung von Gadoliniumchelaten eine umfassende Optimierung der strukturellen Gestaltung und der Reaktionsbedingungen erforderlich. Zunächst wurde die Auswahl geeigneter Abgangsgruppen auf Nitro- und Fluoridderivate eingegrenzt. Während über die Substitution der Nitrogruppe durch Fluoridanion berichtet wurde,26 haben wir erstmals die Möglichkeit eines 19F−18F-Isotopenaustauschs in Gadolinium-Chelaten untersucht (Abbildung 1). Zweitens bietet der koordinierte Pyridin-Arm mehrere Positionen für die Platzierung dieser Substituenten, deren Reaktivität sowohl durch Faktoren erster Ordnung (elektronische Aktivierung/Deaktivierung) als auch durch Effekte zweiter Ordnung (Koordinierung/sterische Hinderung) beeinflusst wird. Durch die gründliche Untersuchung aller Positionsisomere stellten wir fest, dass nur die para-Position eine effiziente Radiomarkierung durch eine Kombination aus starker Aktivierung und günstiger sterischer Zugänglichkeit ermöglicht (Tabelle 1, Tabelle S5, Abbildungen S11, S13). Obwohl die ortho-Position stark aktiviert werden sollte, kam es aufgrund der durch die Koordination verursachten sterischen Hinderung nicht zu einer Radiomarkierung (Tabelle S5, Abbildung S16).
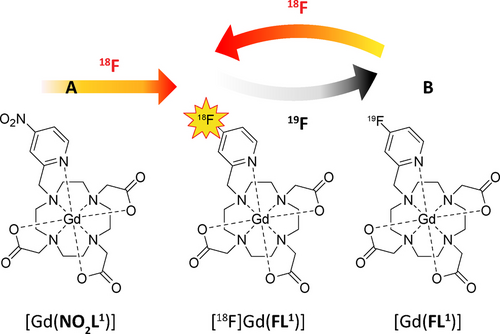
Zwei Wege führen zur hybriden PET/MR-Sonde [18F][Gd(FL1)]. a) Nucleophile Substitution der para-Nitrogruppe durch 18F− am Vorläufer [(Gd(NO2L1)]. b) 18F-für-19F-Isotopenaustausch mit radioaktivem 18F am Vorläufer [Gd(FL1)].
Precursor |
TBAF |
RCY (%)[a] |
Reinheit [b] |
|---|---|---|---|
[Gd(NO2L1)] |
3 Äquiv. |
16.8±2.9 |
76.8±4.3 |
[Gd(FL1)] |
3 Äquiv. |
17.6±1.3 |
86.3±4.3 |
[Gd(FL1)] |
No TBAF |
6.6±0.9 |
90.5±1.8 |
FL1 |
3 Äquiv. |
0 |
75.0±4.2 |
- [a] Die radiochemische Ausbeute wird als Peakfläche des Produkts im Vergleich zur Fläche aller Peaks im Gammadetektor, gemessen durch HPLC (Mittelwert±Standardabweichung; n=3), berechnet. [b] Die Reaktionsreinheit wird als Peakfläche des Produkts im Vergleich zur Fläche aller Peaks bei 254 nm, gemessen durch HPLC (Mittelwert±Standardabweichung; n=3), berechnet.
Die Synthesewege, die zu den Gd(III)-Chelaten der am besten funktionierenden para-Nitro- und para-Fluor-Derivate führen, sind in Schema 1 dargestellt. Die Synthese der anderen getesteten Isomere ist in den Supplemental Information (SI) beschrieben. Für [(Gd(NO2L1)] beginnt die Synthese mit dem im Handel erhältlichen 2-Methyl-4-nitropyridin-1-oxid (1), das durch die Boekelheide-Umlagerung in Trifluoressigsäureanhydrid (TFAA) zum Hydroxomethyl-Derivat 2 derivatisiert wurde.27 Diese Verbindung wurde dann in das Chlormethyl-Derivat 3 in SOCl2 umgewandelt. Anschließend wurde 3 zur Alkylierung von tBu3DO3A verwendet, wodurch der geschützte Chelator 4 entstand. Durch Entschützung mit Trifluoressigsäure (TFA) wurde NO2L1 generiert. Die anschließende Komplexierung von GdCl3 im MOPS-Puffer und die anschließende Reinigung durch RP-HPLC führten zu [Gd(NO2L1)] mit einer Gesamtausbeute von 45 % im Vergleich zu tBu3DO3A (Schema 1a). Die Synthese von [Gd(FL1)] begann mit der Reduktion von 4-Fluorpicolinsäuremethylester (5) mit NaBH4, wobei Alkohol 6 entstand. Dieses wurde dann in das entsprechende Mesylat 7 umgewandelt. Die nachfolgenden Schritte entsprachen denen des Nitroderivats, wobei das Produkt [Gd(FL1)] mit einer Gesamtausbeute von 34 % im Vergleich zu tBu3DO3A erhalten wurde (Schema 1b). Wichtig ist, dass der Chelator FL1 in sauren wässrigen Lösungen nur mäßig stabil ist. Daher verwendeten wir für die nachfolgenden Schritte pH-neutrale Stammlösungen.
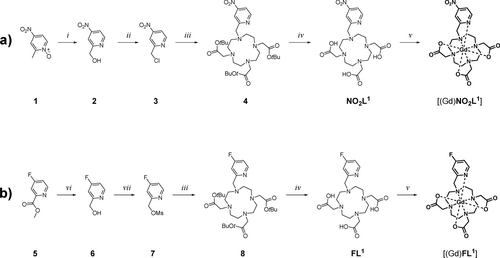
Synthese von Gd(III)-Chelaten, die in dieser Arbeit verwendet wurden. a) Synthese von [(Gd(NO2L1)]. b) Synthese von [Gd(FL1)]. Reaktionsbedingungen: (i) TFAA, DCM, RT; (ii) SOCl2, DMF, DCM, RT (iii) tBu-DO3A*HBr (Hydrobromidsalz von DO3A-tert-butyl ester), K2CO3, MeCN, RT; (iv) TFA (Trifluoressigsäure), RT; (v) GdCl3, aq. MOPS (3-(N-morpholino)propansulfonsäure)/NaOH (pH 7,0), RT; (vi) NaBH4, MeOH, RT; (vii) MsCl, Et3N, DCM, 0 °C bis RT. Die Zwischenprodukte 4 und 8 wurden nicht isoliert.
Radioaktivmarkierung mit 18F
Die Reaktionsbedingungen für die Nitro-Fluor-Substitution wurden zunächst unter Verwendung des nicht radioaktiven Tetrabutylammoniumfluorids (TBAF) getestet, wobei die Bedingungen übernommen wurden, die zuvor für rein organische Pyridinsubstrate verwendet wurden,26 modifiziert, um mit dem Chelat [(Gd(NO2L1)] kompatibel zu sein. Konkret verwendeten wir DMSO als Lösungsmittel, um die vollständige Löslichkeit des Gd(III)-Chelats zu gewährleisten, und zusätzliches TBAF, um die Reaktion vollständig ablaufen zu lassen. Die Tatsache, dass die Umwandlung in [Gd(FL1)] leicht mit HPLC beobachtet werden kann (Abbildung S9), hat den synthetischen Reinigungsprozess erleichtert. Als Nächstes untersuchten und optimierten wir zwei Methoden zur Herstellung von frischem [18F]TBAF, einem Radiomarkierungsreagens, dessen Qualität für eine erfolgreiche Radiomarkierung von entscheidender Bedeutung ist. Beide Methoden beginnen mit [18F]HF, dem Hauptprodukt der Zyklotronproduktion des 18F-Isotops. Bei Methode A wurde die [18F]HF-Lösung auf eine mit NaHCO3 vorbehandelte QMA-SPE-Kartusche (quaternäres Methylammonium) gegeben. Das zuvor erwähnte [18F]TBAF wurde durch Elution des immobilisierten [18F]Fluorids aus der QMA-SPE mit einer Lösung von Tetrabutylammoniumhydrogencarbonat (TBAHCO3), verdünnt mit einem gleichen Volumen Acetonitril, erzeugt. Die Lösung mit dem [18F]TBAF wurde dann unter einem Argonstrom trocken eingedampft. Bei Methode B wurde die QMA-SPE-Kartusche mit KOTf vorbehandelt28 (Kaliumtrifluormethansulfonat), die [18F]HF-Lösung eingefüllt, das Harz mit trockenem Methanol gewaschen und unter einem Argonstrom 3 Minuten lang getrocknet. Die Elution von [18F]TBAF erfolgte mit TBAOTf (Tetrabutylammoniumtrifluormethansulfonat) in trockenem Methanol, gefolgt von 5 Minuten Trocknung bei 100 °C unter einem Argonstrom. Die Reaktionsbedingungen für die Umwandlung von [(Gd(NO2L1)] in [18F][Gd(FL1)] wurden manuell unter Verwendung von Aliquoten von gründlich getrocknetem [18F]TBAF und kleinen Lösungsmittelvolumina getestet. Ein umfangreiches Screening (Tabelle S3) ergab ein Optimum bei 90 °C und einer Reaktionszeit von 5 Minuten mit 3 Äquivalenten [19F]TBAF. Bemerkenswert ist, dass [19F]TBAF den doppelten Zweck erfüllt, die chemische Umwandlung zu verstärken und das nicht radioaktive Produkt zu erzeugen, das für die PET/MRT-Formulierungsanwendungen erforderlich ist – eine hohe spezifische Aktivität ist in diesem Fall nicht erforderlich.
Das [18F]TBAF, das nach Methode B hergestellt wurde, zeigte mit einer radiochemischen Ausbeute (RCY) von 17 % und einer Reinheit von 87 % bessere Ergebnisse und übertraf damit die Ergebnisse von Methode A, die eine RCY von 11 % und eine Reinheit von 74 % ergab (Tabelle S3). Interessanterweise führte die Verwendung von [Gd(FL1)] als Substrat in der Isotopenaustauschreaktion 18F/19F unter identischen Bedingungen zu einer weiteren Verbesserung der Reinheit (Tabelle 1). Über diesen Isotopenaustausch wurde bereits für einfache Fluoropyridinverbindungen berichtet,26, 29, 30 aber nie für Metallchelate. Darüber hinaus ist es erwähnenswert, dass unsere Versuche, den freien Liganden FL1 mit [18F]TBAF zu markieren, erfolglos waren (Abbildung S17, Tabelle S5). Dies könnte auf die Wechselwirkung des [18F]F−Anions mit den protonierten tertiären Aminen des makrozyklischen Liganden zurückzuführen sein, wodurch das Anion für die Reaktion nicht verfügbar ist. Die Daten deuten darauf hin, dass das Vorhandensein des chelatisierten Metallions in [Gd(FL1)] für eine erfolgreiche Radiomarkierung von entscheidender Bedeutung ist (Tabelle 1).
Um die [18F][Gd(FL1)]-Synthese für bildgebende Experimente mit höheren Aktivitäten durchführen zu können, musste ein speziell angefertigtes automatisiertes Synthesemodul (GE) verwendet werden. Ausgehend von 16 GBq [18F]HF lieferte die automatisierte Synthese in 32 Minuten 1340 MBq des Endprodukts (8 % RCY-Zerfall unkorrigiert) mit einer chemischen Reinheit von 97 % und einer radiochemischen Reinheit von 100 % (Abbildung 2). Für in vitro- und in vivo-PET/MRT-Experimente wurde das Produkt mit nicht radioaktivem [Gd(FL1)] kombiniert, um das Verhältnis von Aktivität zu Gadolinium auf ein Niveau einzustellen, das mit beiden Modalitäten kompatibel ist. Die gemeinsamen Anstrengungen bei der rationalen Gestaltung, dem Screening der Vorläufer und der Optimierung der Radiomarkierung führten zu einer skalierbaren Synthese, die eine Voraussetzung für die praktische Anwendbarkeit des hybriden PET/MRT-Agens ist. Insbesondere dieser erste Fall, in dem ein Gadoliniumchelat direkt mit 18F markiert wurde, unterstreicht die aktive Rolle des Chelat-Metalls bei der Ermöglichung der Radiomarkierung und der Steuerung der Regioselektivität.
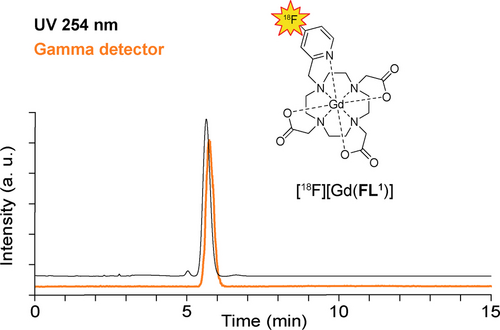
Radioaktive und UV-HPLC-Chromatogramme der [18F][Gd(FL1)]-Probe, die auf dem automatischen Radiosynthesemodul hergestellt wurde. Bei der Gammadetektion (orange) ist nur ein einziger Produktpeak (100 %) sichtbar, während die UV-Detektion bei 254 nm eine Reinheit von >97 % (schwarz) anzeigt.
Physikalisch-chemische In vitro-Messungen Die Relaxivität von GBCAs (r1) hängt von mehreren physikalisch-chemischen Parametern ab.31, 32 Die Anzahl der gebundenen Wasserliganden (Hydratation, q) wurde mit der 17O NMR -Methode zur Induzierung der Verschiebung durch Lanthanide mit Dy(III)-Komplexen bestimmt.33 Dieser Ansatz bestätigte die Koordination eines einzelnen Wassermoleküls in Lösung (Abbildung S1). Der Austauschkoeffizient (kex) des gebundenen Wassers mit der Gesamtlösung wurde durch temperaturabhängige 17O NMR -Relaxometrie-Studien bestimmt (Abbildung S2, Tabelle S2). Es wurde ein Wert von kex=1,7×106 s−1 ermittelt, der etwa 2,4-mal langsamer ist als der von [Gd(DOTA)].34 Diese Beobachtung stimmt mit der etwas geringeren longitudinalen Relaxivität von 3,43 mM−1 s−1 (0,47 T, 37 °C) für [Gd(FL1)] überein. Es sollte jedoch beachtet werden, dass dieser Wert weit innerhalb des typischen Bereichs von 3–4 mM−1 s−1 liegt, der bei klinisch zugelassenen MRT-Kontrastmitteln beobachtet wird (Tabelle 2).35
Komplex |
r1 (mM−1 s−1) |
q |
kex (s−1) |
t1/2 (h) |
|---|---|---|---|---|
[Gd(FL1)] |
3.4±0.1 |
1.0±0.2 |
1.7×106±0.1 |
45 |
[Gd(DOTA)] |
3.9[a] |
1[c] |
4.1×106[b] |
44 |
Ein weiterer entscheidender Faktor für den potenziellen klinischen Einsatz ist die kinetische Trägheit des Metallchelats. Makrozyklische Gd(III)-Chelate, insbesondere solche vom DOTA-Typ, weisen im Vergleich zu ihren azyklischen Gegenstücken eine deutlich höhere Trägheit auf.32, 37, 38 Wir haben eine säureunterstützte Dekomplexierungsmethode in 0,1 M HCl bei 37 °C verwendet, um die kinetische Trägheit von [Gd(FL1)] in Lösung zu überwachen.39 Unter diesen Bedingungen wird das Chelat abgebaut und setzt ein vollständig hydratisiertes Gd(III)-Ion in der Lösung frei, das eine höhere Relaxivität r1 aufweist. Die insgesamt monoexponentielle Zunahme der Relaxationsrate (R1) kann durch die Halbwertszeit (t1/2, Abbildung S3) als Maß für die Abspaltungsrate beschrieben werden. Wir haben festgestellt, dass das azyklische klinische MRT-Kontrastmittel [Gd(DTPA)] sich schnell aufspaltet (t1/2<6 s), während [Gd(FL1)] eine bemerkenswerte kinetische Trägheit mit einer Dissoziationshalbwertszeit von 45 Stunden aufweist, die mit der des klinisch zugelassenen [Gd(DOTA)] vergleichbar ist (Tabelle 2).
In vitro-PET/MRT-Phantom-Bildgebung
Nach der erfolgreichen Radiomarkierung und umfassenden in vitro-Analyse von [Gd(FL1)] haben wir eine Phantom-Bildgebungsstudie für die PET/MRT-Untersuchung durchgeführt. Wir haben eine Formulierung mit [18F][Gd(FL1)] aus der automatisierten Radiosynthese und einer 0,5 mM-Stammlösung von [Gd(FL1)] in PBS hergestellt, um eine Referenzlösung mit bekannter molarer Aktivität und chemischer Konzentration zu erhalten. Diese Mischung wurde in Reagenzgläser aliquotiert, um eine Reihe von Proben mit Konzentrationen zwischen 0,048 und 0,489 mM (quantifiziert durch ICP-OES-Analyse) zu erhalten (Abbildung 3a). Die Quantifizierung von PET/MR-Bildern, die in einem 7T-Präklinischen-Scanner aufgenommen wurden, zeigte eine bemerkenswerte lineare Korrelation zwischen der PET-gemessenen Radioaktivität und dem Signal, das aus T1-gewichteten MR-Bildern abgeleitet wurde (R2=0,99, Abbildung 3b). Diese Korrelation spiegelte sich in der Relaxationsrate wider, die aus den T1-MRT-Karten abgeleitet wurde (R2=0,99, Abbildung 3c). Die Beziehung wurde durch die Quantifizierung der 18F-Aktivität mittels Gammazählung und Gd(III) über ICP-OES weiter validiert (R2=0,99, Abbildung S21). Diese Ergebnisse zeigen das Potenzial von [18F][Gd(FL1)] für die quantitative PET/MRT.
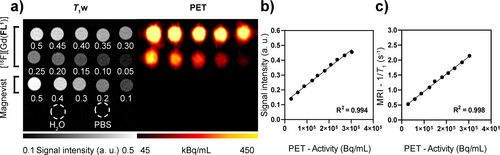
Gleichzeitige PET/MRT-Bildgebung eines Phantoms mit Titrationen von [18F][Gd(FL1)]. Die Konzentration in jedem Röhrchen ist in mM angegeben. Magnevist-Titration, H2O und PBS wurden als Referenz für die MR-Bilder und als Negativkontrollen für die PET-Bilder verwendet. b,c) Korrelationsdiagramme zwischen der mit der PET-Bildgebung gemessenen Radioaktivität und dem T1-gewichteten (T1-w) Signal (b) oder den MRT-Relaxationsraten (c). Die durchgezogenen Linien stellen die lineare Regressionsanalyse dar.
In vivo-PET/MRT-Studien an Mäusen
Die in vivo Leistung von [Gd(FL1)] als hybrides PET/MRT-Kontrastmittel wurde an gesunden C57BL/6-Mäusen (n=6) untersucht. Eine Formulierung von [Gd(FL1)] und seinem radioaktiv markierten Gegenstück [18F][Gd(FL1)] in Kochsalzlösung wurde betäubten Mäusen über eine einzelne Bolusinjektion in die Schwanzvene verabreicht. Die injizierte Dosis betrug 0,09±0,01 mmol/kg Gd, was 0,91±0,07 MBq entspricht. Zwei Kohorten von jeweils drei Mäusen wurden unterschiedlichen Bildgebungsprotokollen unterzogen (Schema S1). In der ersten Gruppe führten wir eine 62-minütige Messung mit gleichzeitiger dynamischer kontrastverstärkter (DCE) MRT und dynamischer PET-Untersuchung durch. Die zweite Gruppe wurde mit 11 aufeinanderfolgenden T1-Karten gemessen, die über 55 Minuten aufgenommen wurden, gefolgt von einer 4,6-minütigen statischen PET-Messung. Nach Abschluss der Bildgebungsverfahren wurden alle Tiere 62 Minuten nach der Injektion eingeschläfert und die Organe für die ex vivo-Analyse entnommen. Die [18F][Gd(FL1)]-Sonde zeigte sowohl in der MRT (Abbildung 4a) als auch in der PET (Abbildung 4b) ein konsistentes pharmakokinetisches Profil, das eine schnelle systemische Verteilung und eine rasche Blutreinigung über die Nieren in die Blase zeigte – ein üblicher Weg für die meisten nicht zielgerichteten Gd-basierten Kontrastmittel. Die Sonde zeigte eine minimale Anreicherung in der Leber und eine minimale Blutretention, was auf eine vernachlässigbare hepatobiliäre Ausscheidung hindeutet (Abbildung 4c).
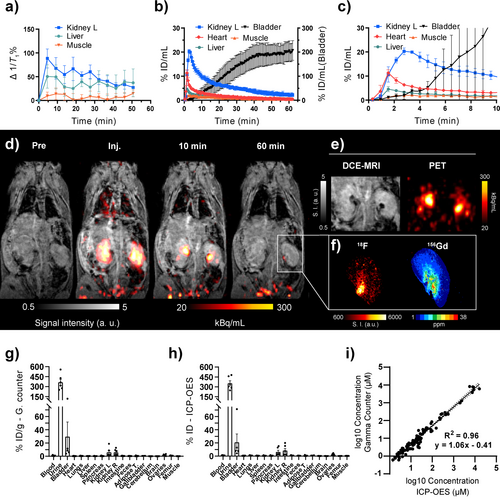
In vivo-Biodistribution von [18F][Gd(FL1)]. a) 1/T1-Änderung im Zeitverlauf nach intravenöser Injektion von [18F][Gd(FL1)], gemessen mit dynamischem T1-Mapping (n=3), wobei die Nieren die höchste T1-Änderung aufweisen. b,c) PET-basierte Pharmakokinetik (n=3), ausgedrückt als %ID/mL, mit geringer Anreicherung in Leber und Muskeln und schneller Anreicherung im Herzen, gefolgt von Anreicherung und Ausscheidung über die Nieren in die Blase während des gesamten PET/MR-Scans (b) oder in den ersten 10 Minuten nach der Injektion (c). d) Repräsentative DCE-MRT- und PET-Überlagerungen vor und nach der Injektion von [18F][Gd(FL1)]. e) Vergleich derselben Nierenbilder in DCE-MRT und PET 10 Minuten nach der Injektion, die die Anreicherung von [18F][Gd(FL1)] im Nierenbecken als hypointensive Flecken im MRT und als hochintensive Flecken im PET darstellen. f) Autoradiographie (links) und LA-ICP-MS (rechts) einer Niere mit gleichzeitiger Darstellung von 18F und Gd. g,h) Ex vivo-Biodistributionsanalyse 62 Minuten nach der Injektion auf der Grundlage von Gammazählung (g) und ICP-OES (h) (n=6); die Aufnahme von [18F][Gd(FL1)] wird als Prozentsatz der injizierten Dosis pro Gramm feuchtem Gewebe ausgedrückt. i) Die lineare Regressionsanalyse zwischen den Gewebekonzentrationen von [18F][Gd(FL1)], die anhand der Gammazähleraktivität berechnet wurden, und der Konzentration, die mit ICP-OES auf einer logarithmischen Skala gemessen wurde, zeigt eine hervorragende Korrelation (R2=0,96). Durchgezogene Linie: lineare Regression; gestrichelte Linien: 95 % Konfidenzintervall. a,b,c,g,h) Die Daten sind als Mittelwert±SEM angegeben.
Die repräsentativen PET/MRT-Bilder (Abbildung 4d) zeigten deutlich die sofortige Kontrastverstärkung von Nierenrinde und -mark zum Zeitpunkt der Injektion, gefolgt von einer schnellen Passage des Kontrastmittels zum Nierenbecken innerhalb von 10 Minuten und seiner fast vollständigen Ausscheidung in die Blase innerhalb von 60 Minuten (Abbildung 4b). PET/MRT zeigte keine Gewebeverstärkung von [18F][Gd(FL1)]. Während die PET- und MRT-Signalverstärkung im Allgemeinen perfekt korrelierte, wurde 10 Minuten nach der Injektion im Nierenbecken gesunder Nieren eine interessante Diskrepanz festgestellt (Abbildung 4e). Hier wies der frisch gebildete Urin eine hohe lokale Konzentration des Kontrastmittels auf, was aufgrund der starken T2- und T2*-Relaxationsmechanismen, die das Signal im T1-gewichteten Kontrastmittel unterdrückten, zu hypointensen Bereichen im MRT führte.40 Dies verdeutlicht die komplexe nichtlineare Beziehung zwischen der GBCA-Konzentration und ihrer Auswirkung auf das MRT-Signal, was eine zuverlässige in vivo Quantifizierung der MRT-basierten GBCA erschwert. Die Hybrid-Methode [18F][Gd(FL1)] ermöglicht jedoch eine unabhängige und quantitative Bewertung der lokalen Konzentration des Kontrastmittels über das PET-Signal. Dies wurde besonders deutlich, als die auf dem MRT beobachteten hypointensen Bereiche perfekt mit den Regionen mit hohem PET-Signal korrelierten (Abbildung 4e).
Nierengewebe von gesunden Mäusen wurde geschnitten und mittels Autoradiographie (für 18F) und Laserablation ICP-MS (für Gd) weiter analysiert. Wie bereits berichtet, liefert die Kombination aus Laserablation-induktiv gekoppeltem Plasma-Massenspektrometer (LA-ICP-MS) und Autoradiographie komplementäre Messungen, die detaillierte Einblicke sowohl in die Metallverteilung als auch in die Radioaktivität ermöglichen.41 Beide Methoden bestätigten die beobachtete in vivo-Verteilung von [Gd(FL1)] und zeigten die niedrigste Konzentration des Kontrastmittels im Kortex und die höchste Konzentration im Becken (Abbildung 4f). Darüber hinaus wurden alle Gewebeproben von eingeschläferten Tieren analysiert, um die Radioaktivität mit einem Gammacounter und den Gadoliniumgehalt mit ICP-OES zu quantifizieren (Abbildung 4g–h). Das Muster der Biodistribution blieb bei beiden Methoden gleich und zeigte die höchste Konzentration von [Gd(FL1)] im Urin und in der Blase, gefolgt von den Nieren. Diese Muster der Biodistribution stimmen mit der Studie von Le Fur et al. überein, in der [86Y][Y(DOTA)] zur Verfolgung der Biodistribution von [Gd(DOTA)] verwendet wurde.42 Alle anderen Gewebe wiesen einen deutlich geringeren [Gd(FL1)]-Gehalt auf. Wichtig ist, dass die Radioaktivität im Oberschenkelknochen gering war (0,86±0,12 % ID/g), was darauf hindeutet, dass keine signifikante Freisetzung des knochensuchenden [18F]F−Anions aus [18F][Gd(FL1)] erfolgt.43 Die durch Gammazählung und ICP-OES ermittelten Gewebekonzentrationen deckten mehrere Größenordnungen ab. Ein direkter Vergleich auf einer logarithmischen Skala ergab eine hervorragende Korrelation (R2=0,96), was die Robustheit und Stabilität des 18F/Gd-Verhältnisses bei verschiedenen Konzentrationen und Gewebetypen unterstreicht (Abbildung 4i). Darüber hinaus führten wir eine LC–MS-Analyse einer Urinprobe durch, die bestätigte, dass der Wirkstoff intakt in die Blase ausgeschieden wurde, was auf ein optimales pharmakokinetisches und pharmakodynamisches Profil in vivo hindeutet (Abbildung S8).
PET/MRT-Renographie
Das Nierensystem verfügt über einen robusten Kompensationsmechanismus, der es einer Niere ermöglicht, die Funktionsstörung der anderen Niere effektiv auszugleichen. Die Früherkennung von Nierenerkrankungen ist jedoch eine Herausforderung. Der Standard-Diagnosetest, bei dem die Serumkreatininkonzentration gemessen wird, zeigt nur ein signifikantes Stadium der Nierenfunktionsstörung an44 und ist nicht empfindlich gegenüber einseitigen oder teilweisen Nierenerkrankungen.45, 40 Bildgebende Verfahren liefern differenziertere Informationen, weisen jedoch spezifische Einschränkungen auf. Die planare SPECT-Renographie wird durch Organüberlappungen beeinträchtigt, während SPECT/CT und PET/CT eine erhebliche Strahlenbelastung mit sich bringen.44 Daher stellt die MRT unter Verwendung von renalen GBCAs trotz ihrer begrenzten Quantifizierbarkeit eine attraktive Alternative dar.40 Obwohl bildgebende Verfahren normalerweise nicht zur Früherkennung eingesetzt werden, ermöglichen sie es Radiologen, unvorhergesehene Erkrankungen zu erkennen, wenn sie aus einem anderen Grund durchgeführt werden. Daher erweist sich die PET/MRT mit [18F][Gd(FL1)] aufgrund ihrer quantitativen Natur als leistungsstarkes und vielseitiges Instrument zur Untersuchung der Nierenfunktion.
Während der in vivo-Studien stellten wir bei zwei Mäusen, M1 und M6, die zwei verschiedenen PET/MRT-Protokollen unterzogen wurden, abnormale Nierenfiltrationsprofile fest (Details in Schema S1). Bei beiden Mäusen wurde eine einseitige Retention von [18F][Gd(FL1)] in der rechten Niere festgestellt. Bei Maus M6 war dies auf dem statischen PET-Bild 55 Minuten nach der Injektion deutlich zu sehen, da es ein starkes und anhaltendes Signal im rechten Nierenbecken zeigte, während in der linken Niere keine Anreicherung der Sonde beobachtet wurde (Abbildung 5a). Das gesamte PET-Signal in der rechten Niere war etwa zehnmal höher als in der linken (Abbildung S24c). Umgekehrt waren die T1-gewichteten MRT-Bilder weniger aussagekräftig, da sie aufgrund der starken T2- und T2*-Effekte hypointense Bereiche in der rechten Niere zeigten (Abbildung 5a, linkes Bild), aber keinen wesentlichen Unterschied zwischen den Nieren in der mittleren Relaxationsrate (Abbildung S24d). Wenn man sich also ausschließlich auf MRT-Daten verlässt, könnte dies dazu führen, dass Hinweise auf eine abnorme Funktion der rechten Niere übersehen werden. Durch die Verwendung von PET als Reporter konnten wir jedoch das Signal quantifizieren und eine detaillierte ex vivo-Analyse von Gewebeschnitten mit Autoradiographie (18F) und Laserablation ICP-MS (Gd) durchführen. Dieser Ansatz bestätigte die heterogene Anreicherung von [18F][Gd(FL1)] in der rechten Niere im Vergleich zur linken (Abbildung 5b–c). Die Histologie zeigte erweiterte Tubuli und luminal proteinhaltiges Material in der rechten Niere, was die pathologische Nierenfunktionsstörung bestätigte (Abbildung 5d).
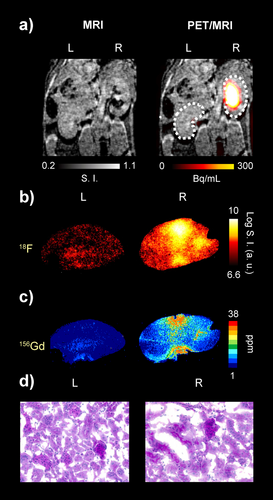
Sequenzielle [18F][Gd(FL1)] PET/MR-Bildgebung von Mäusenieren (Maus M6) mit normaler und beeinträchtigter Nierenausscheidung. a) T1w-MR- und PET/MR-Überlagerung nach Injektion der Hybridsonde, die mit dem sequenziellen PET/MR-Protokollschema (MR: 50 Minuten; PET: 55 Minuten) gemessen wurden. b) Autoradiographie-Bilder der linken (L) und rechten (R) Nierensektion. c) 156Gd-Konzentrationsbilder der linken und rechten Nierensektion, die durch LA-ICP-MS-Bildgebung gewonnen wurden. d) PAS-Färbung der linken und rechten Nierensektion.
Im zweiten Fall (Maus M1) umfasste das Bildgebungsprotokoll eine 62-minütige simultane PET/MRT-Aufnahme (Abbildung 6), die es uns ermöglichte, das dynamische Verhalten der Sonde zu verfolgen und die Nierenfunktion im Detail zu bewerten. Die linke Niere und die Nieren von zwei weiteren Mäusen aus derselben Kohorte (M2, M3) dienten als Referenz für eine normale Nierenfunktion. Wir verwendeten eine innovative voxelbasierte Analyse von koregistrierten Bildern beider Modalitäten, um die Ausspülungsparameter der Sonde zu berechnen (Abbildung 6b–e). Die daraus resultierenden parametrischen Karten, die unabhängig voneinander aus den MRT- und PET-Daten abgeleitet wurden, zeigten heterogene Ausscheidungsmuster in der abnormen rechten Niere, die gut mit den Hotspot-Bereichen mit eingeschränkter Funktion korrelierten (Abbildung 6d–e). Während diese Bereiche im MRT einen Signalverlust aufwiesen, was fälschlicherweise auf eine schnelle Ausspülung der Sonde hindeutete (Abbildung 6b–d), zeigten die Bereiche in der PET-Bildgebung eine erhebliche Anreicherung der Sonde (Abbildung 6c–e). In einer weiteren voxelbasierten Analyse berechneten wir die Fläche unter der Kurve (AUC) und verglichen zwei Regionen von Interesse (ROI) in der beeinträchtigten Niere, eine mit einem stark abnormalen Ausscheidungsmuster und die andere mit einem nahezu normalen Ausscheidungsmuster. Die nahezu normale Region zeichnete sich durch eine enge Verteilung der AUC-Werte aus, während die abnormale ROI sowohl bei den MRT- als auch bei den PET-Daten eine breite Verteilung aufwies (Abbildung 6f–g). Im Vergleich zum abnormalen Fall zeigten alle gesunden Nieren in beiden Modalitäten im Allgemeinen relativ homogene Ausscheidungsmuster (Abbildungen S26–27). Insgesamt bietet die PET/MRT mit dem Hybrid-Kontrastmittel [18F][Gd(FL1)] erhebliche Vorteile für die Beurteilung der Nierenfunktion, wobei beide Modalitäten einen entscheidenden diagnostischen Wert haben. Der PET-Kanal quantifiziert das Mittel unabhängig von der breiten Filtrationsdynamik im Nierengewebe und ermöglicht so die präzise Erkennung abnormaler Ausscheidungsmuster. Andererseits liefert die MRT den anatomischen Kontext und eine detaillierte räumliche Lokalisierung. Wie in Abbildung 6 dargestellt, kann die MRT allein aufgrund der negativen Kontrastverstärkung zu Fehlinterpretationen führen, während die PET allein möglicherweise nicht die Auflösung bietet, um einzelne Hotspots mit beeinträchtigter Gewebefunktion zu erkennen. Unseres Wissens ist dies der erste Bericht, der eine solche PET/MRT-Analyse mit einer hybriden PET/MRT-Sonde durchführt.
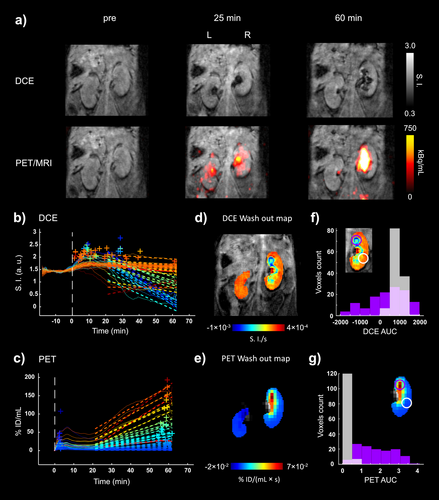
Gleichzeitige dynamische PET/MRT-Bildgebung von C57BL/6-Mäusen mit [18F][Gd(FL1)] zur Darstellung der normalen und beeinträchtigten Nierenfunktion. a) PET-Bilder (Maus M1) überlagert mit T1w-Bildern vor, 25 und 60 Minuten nach Injektion von [18F][Gd(FL1)] zeigen bemerkenswerte Unterschiede im PET- und MRT-Signal zwischen der linken und rechten Niere. Das MRT-Signal zeigt ein besonderes Anreicherungsmuster in der rechten Niere im Vergleich zur linken, mit einer deutlichen Veränderung im Mark, die erst 25 Minuten nach der Injektion im Nierenbecken sichtbar wird. Die Anreicherung (kBq/ml) in der rechten Niere ist deutlich höher als in der linken Niere und steigt mit der Zeit an. b,c) Repräsentative DCE-Signalintensität (SI) und PET-Anreicherung (%ID/ml) im Vergleich zu den Zeitkurven auf Voxelbasis der rechten und linken Nieren. Die gestrichelten Linien beschreiben die lineare Regression, die zur Berechnung der parametrischen Auswaschungskarten verwendet wurde. +, höchste Intensität (DCE) und Aufnahme (PET) für jede Kurve. d,e) DCE- und PET-Ausspülungsparameterkarten, die aus dynamischen Kurven gewonnen wurden. Die MRT zeigt ein homogenes Signal in der linken Niere, während die Ausscheidungsstörung der rechten Niere durch eine abnorme Ringstruktur gekennzeichnet ist. f,g) Histogramme der DCE- und PET-Fläche unter der Kurve (AUC), die in zwei verschiedenen Unterregionen (violette und weiße Kreise) ermittelt wurden, weisen in Bezug auf die Voxelverteilung deutliche Unterschiede auf.
Fazit
In dieser Arbeit stellen wir ein neuartiges hybrides PET/MRT-Kontrastmittel [18F][Gd(FL1)] vor. Dieses Mittel wurde so konzipiert, dass es die günstigen Eigenschaften der klinischen makrozyklischen GBCAs, wie z. B. hohe r1-Relaxivität, ausgezeichnete kinetische Trägheit und schnelle renale Ausscheidung, beibehält und gleichzeitig eine zuverlässige Quantifizierung durch das PET-Signal ermöglicht. Eine schnelle und skalierbare Synthese wird durch einen innovativen 19F-zu-18F-Isotopenaustausch erreicht, der erstmals direkt an einem Gadoliniumchelat durchgeführt wird. Eine Pilotstudie mit PET/MRT an gesunden Mäusen hat gezeigt, dass [18F][Gd(FL1)] unerwartete Fälle von einseitiger Nierenfunktionsstörung erkennen kann, eine Erkrankung, die aufgrund des Kompensationsmechanismus des Nierensystems bekanntermaßen schwer zu erkennen ist. In Kombination mit einer voxelbasierten Bildanalyse liefert die PET/MRT mit [18F][Gd(FL1)] detaillierte anatomische, funktionelle und quantitative Informationen über die Perfusions- und molekulare Ausscheidungsdynamik, die mit MRT oder PET allein nicht erreicht werden können. Dieses Hybridmittel maximiert somit das Synergiepotenzial der PET/MRT-Technologie. Die genaue Kartierung der Perfusions- und Ausscheidungsdynamik ist für die Diagnose von Krankheiten wie Schlaganfall und Krebs von entscheidender Bedeutung. Die hier berichteten Zufallsbefunde von Nierenerkrankungen sind besonders wichtig für die Überwachung von Tumor-zielgerichteten Strahlentherapien, bei denen Nierenschäden eine mögliche Nebenwirkung darstellen. Weitere Studien mit geeigneten, gut etablierten Tiermodellen für Nierenerkrankungen werden das volle Potenzial unseres dualen Ansatzes untersuchen. Darüber hinaus kann PET/MRT mit [18F][Gd(FL1)] eine zuverlässige Grundlage für die Modellierung kompartimentierter mikrovaskulärer Parameter darstellen, insbesondere in Fällen, in denen die Konzentrationsschätzung von GBCAs schwierig ist.46, 47
Zusatzinformationen
Die Autoren haben in den ergänzenden Informationen weitere Quellenangaben aufgeführt.[47–53]
Danksagung
Wir danken dem National Institute for Research of Metabolic and Cardiovascular Diseases (Programm EXCELES, ID Project No. LX22NPO5104) – finanziert von der Europäischen Union – NextGenerationEU; dem Projekt GAUK 1608218 der Karls-Universität; der Deutschen Forschungsgemeinschaft (DFG, German Research Foundation) – 456007791, 516238665 und 390900677. Diese Arbeit wurde durch den Exzellenzcluster iFIT (EXC 2180) „Bildgeführte und funktionell instruierte Tumortherapien“ der Universität Tübingen, die Werner Siemens-Stiftung, die Alexander von Humboldt-Stiftung im Rahmen des Sofja Kovalevskaja-Preises (an AFM) und das DKTK-Innovationsprogramm „HYPERBOLIC“ gefördert. Wir danken Astrid Küppers für ihre Hilfe bei der Erstellung der LA-ICP-MS-Bilder. Wir danken Dr. Julia Mannheim für ihre wertvollen Beiträge zur Interpretation der Bilddaten und Dr. Sabrina Hoffmann für ihre Unterstützung bei der MRT-Akquisition und Datenanalyse. Open Access Veröffentlichung ermöglicht und organisiert durch Projekt DEAL.
Interessenkonflikt
M.P. and J.K. are co-inventors on a pending patent application no. EP22212471 filed in the name of applicant Ustav Organicke Chemie a Biochemie AV CR V.V.I. The application covers some of the compounds and their use discussed in this work.
Open Research
Data Availability Statement
Die Daten, die die Ergebnisse dieser Studie unterstützen, sind in den Hintergrundinformationen zu diesem Artikel verfügbar.




