Dissoziative Elektronenanlagerungsdynamik eines vielversprechenden Krebsmedikaments zeigt sein Potential als Radiosensitizer
Abstract
2-Bromo-1-(3,3-dinitroazetidin-1-yl)ethan-1-on (RRx-001) ist ein Chemotherapeutikum für sauerstoffarme Tumore und zeigte bereits Synergieeffekte in Kombination mit Strahlentherapie. Die Wechselwirkung des Moleküls mit niederenergetischen Sekundärelektronen, die in großer Zahl in der physikalisch-chemischen Phase der Bestrahlung gebildet werden, könnten für diesen Synergieeffekt verantwortlich sein. Die vorliegende Studie konzentriert sich auf die ersten Schritte in der Wechselwirkung von RRx-001 mit niederenergetischen Elektronen, in denen das temporäre negative Ion gebildet wird und rasch fragmentiert. Die Kombination von Resultaten zweier Versuchsaufbauten erlaubt es uns, den Zerfall des RRx-001 Anions auf verschiedenen Zeitskalen zu entflechten. Die alleinige Anwesenheit des eingefangenen Elektrons führt zu einer raschen Abspaltung von NO2 und HNO2, während NO2− und Br− Anionen direkt beziehungsweise über andere Zwischenprodukte gebildet werden. Auf Basis quantenchemischer Rechnungen schlagen wir einen bidirektionalen Wechsel zwischen π*(NO2) und σ*(C−Br) Zuständen vor, welcher die experimentellen Spektren erklärt. Die beobachtete schnelle Dynamik lässt auch Schlussfolgerungen für die Chemie des Anions in der kondensierten Phase zu.
Einleitung
Dabei entspricht (AB)*− dem temporären negativen Ion (TNI), das einem Resonanzzustand entspricht, da die Energie des Elektrons mit der Energie eines TNI Zustands übereinstimmt.4 Dieser anfängliche Übergang zu einem Anion findet auf der Femtosekundenzeitskala statt. Das TNI könnte in A− und B zerfallen, wobei das Erstere ein anionisches Fragment darstellt und B eine neutrale Spezies. Diese Fragmentierung konkurriert mit der spontanen Emission des eingefangenen Elektrons (Autodetachment) und intramolekularer Verteilung der Überschussenergie auf Schwingungsfreiheitsgrade (IVR).5 IVR, falls möglich, kann zur Stabilisierung des TNIs bis zum Mikrosekundenbereich führen. Anionen, die auf einer solch längeren Zeitskala dissoziieren (sogenannte metastabile Anionen) sind besonders interessant für die Massenspektrometrie, da der Zerfallszeitunkt in den Zeitbereich für die Detektion fällt .6, 7 Andererseits bedeutet diese Tatsache, dass Studien über die schnellere Dynamik der TNI Bildung und den Zerfall experimentell herausfordernd sind. Gepulste Radiolyse gepaart mit Übergangsabsorptionsspektroskopie wurde experimentell bereits erfolgreich eingesetzt, um die Bildung von Anionen und deren Zerfall in Lösung auf schnellen Zeitskalen zu untersuchen.8, 9 Experimente in der Gasphase betrachtet, wurde Anregungs-Abfrage-Photolelektronenspektroskopie für die Studien von Anionen verwendet.10 Um den anfänglichen Elektronenanlagerungsprozess abzubilden, wurde Elektronentransfer über Photoanregung von anionischen Jod in einem Cluster ausgenutzt.11 Aus theoretischer Sicht besteht großes Interesse an der Modellierung der Kopplung von Resonanzzuständen in anionischen molekularen Systemen in der Gasphase.12 Solche Kopplungsreaktionen können auch zur effizienten Dissoziation des gebildeten TNIs führen.13, 14
Ein potentieller Kandidat für effiziente DEA ist 2-Bromo-1-(3,3-dinitroazetidin-1-yl)ethan-1-on (C5H6BrN3O5, RRx-001, hier im weiteren Text als RRx bezeichnet). Die molekulare Struktur des Moleküls, das eine acetylbromid-förmige Gruppe und eine geminale Dinitroazetidingruppe, enthält, ist in Abbildung 1 dargestellt. Frühere radio-biologische Studien schlugen vor, dass RRx ein vielversprechendes Krebs-Therapeutikum in isolierter Anwendung und auch ein Radiosensitizer für sauerstoffarme Tumore sein könnte.15, 16 Dieser energetische Stoff mit heterozyklischen Dinitroazetidin entstammt aus der Abwandlung von 1,3,3-Trinitroazetidin, das ursprünglich als Treibstoff in der Weltraumtechnik diente.16 Bis jetzt wurde RRx in klinischen Studien bis zur Phase III getestet und zwar für die Behandlung von verschiedenen soliden Tumoren und als unterstützendes Medikament.17 Neben dem Potential für Radiotheranostik, wo es während der Bestrahlung von Zellmaterial auch niederenergetischen Sekundärelektronen ausgesetzt ist,18 stellt RRx auch aus chemischer Perspektive ein höchst interessantes Molekül dar. Die beiden NO2 Gruppen und das Bromatom (Abbildung 1) konkurrieren aufgrund ihrer hohen Elektronaffinitäten von 2,27 eV19 (NO2) und 3,36 eV20 (Br) um das eingefangene Elektron.
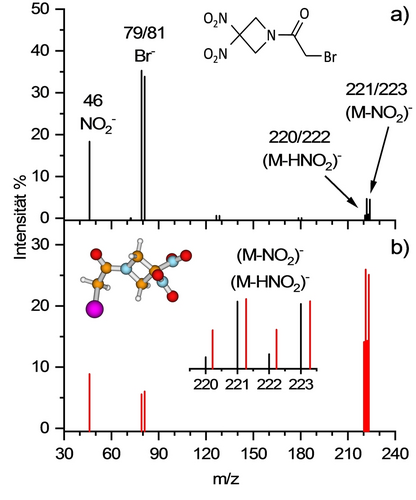
DEA Massenspektren für isoliertes RRx (als M in den beiden Graphen bezeichnet) nach Elektronenanlagerung für a) das Wippi-Experiment, tdet~300 μs und b) CLUB Experiment, tdet ~10 μs. Die relativen Intensitäten wurden mittles Integration der Rohmassenspektren für verschiedene Elektronenenergien von ~0–9 eV bestimmt. Das in b) eingefügte Diagramm zeigt die relative Änderung der Intensitäten von den anionischen Fragmenten (RRx−NO2)− und (RRx−HNO2)−, wobei diese zum denselben Maximum im gezoomten Bereich skaliert wurden. Teilbild a) enthält die Strukturformel des RRx Moleküls und in Teilbild b) ist die Struktur auf dem B3LYP/aug-cc-pVTZ Level gezeigt. Farbcodierung: Wasserstoff – grau, Kohlenstoff – braun, Stickstoff – blau, Sauerstoff – rot, Brom – violett.
In dieser Studie untersuchten wir die Anlagerung eines freien Elektrons an RRx in der Gasphase. Mittels Verwendung von experimenteller Elektronenanlagerungsspektroskopie kombiniert mit Massenspektrometrie und quantenchemischen Berechnungen mit Gaussian21 und Molpro22 Softwarepaketen für Single- und Multi-Referenz Berechnungen, untersuchten wir die Dynamik auf schnellen Zeitskalen. Zusätzlich, erforschten wir die Dissoziationsdynamik von RRx auch auf längeren Zeitskalen bis zu einigen hundert Mikrosekunden und zeigen, dass RRx dabei häufig in reaktive anionische und neutrale Fragmente zerfällt.
Resultate und Diskussion
Das anionische Massenspektrum von RRx, aufgenommen mittels zwei experimentellen Aufbauten mit unterschiedlichen Detektionszeiten, ist in Abbildung 1 gezeigt. Die Spektren zeigen die resultierenden Ionenintensitäten für die gebildeten Anionen als Funktion des Masse-zu-Ladung Verhältnisses m/z. Das Spektrum in Abbildung 1a wurde mit dem „Wippi“-Experiment aufgezeichnet (Quadrupol Massenspektrometer), das eine deutliche längere Detektionszeit von tdet~300 μs im Vergleich zum „CLUB“-Experiment, bei dem ein Flugzeit (TOF) Massenspektrometer verwendet wird. Für das TOF-Setup ist die Detektionszeit ~10 μs. Das dazugehörige TOF Spektrum ist in Abbildung 1b gezeigt. Da die Elektronenanlagerung ein Resonanzprozess ist, wurden die Intensitäten in den gezeigten Plots mittels Integration der Rohspektren bei verschiedenen Elektronenenergien ermittelt. Auch bei Detektionszeiten von einigen Mikrosekunden, kann kein Molekülanion mit den erwarteten Isotopenpeaks bei m/z 267 und 269 detektiert werden. Wenn man allerdings Vergleiche mit dem Spektrum auf längeren Zeitskalen in Abbildung 1a zieht, ist das Verhältnis zwischen leichten und schweren anionischen Fragmenten deutlich verändert: (RRx−NO2)− und (RRx−HNO2)− dominieren das Spektrum 1b, während die Br− und NO2− Intensitäten geringer sind. Die kombinierte Sicht auf die Wippi und CLUB Daten führt zum Schluss, dass die Dissoziationsdynamik auf der frühen Mikrosekunden Zeitskala noch nicht beendet ist. Im Detail, die schwereren (RRx−NO2)− und (RRx−HNO2)− Anionen sind metastabil und zerfallen unter Bildung von Br− und NO2− Fragmenten. Innerhalb dieser zweistufigen Dissoziationsprozesse wird auch sichtbar, dass (RRx−HNO2)− schneller zerfällt als (RRx−NO2)− da die Häufigkeit nach späterer Detektion bei m/z 220 und 222 stärker reduziert ist als bei m/z 221 und 223 (vergleiche eingefügtes Diagramm in Abbildung 1b). Längere Zeit betrachtet wird weiters Br− viel häufiger gebildet als NO2−.
Die beobachteten Dissoziationsprodukte im Massenspektrum können auf Basis der berechneten Energetik charakterisiert werden, siehe das gezeigte Reaktionsschema in Abbildung 2. Falls das Anion dem σ*(C−Br) Reaktionsweg folgt, wird höchstwahrscheinlich Br− über Prädissoziation des Moleküls gebildet. Beim π*(NO2) Reaktionsweg sind mehrere nachfolgenden Reaktionen möglich. Die NO2 Gruppe könnte vom Anion direkt abspalten. Die Reaktionsenergie dafür ist −0,66 eV, und führt zur Bildung des Ions bei m/z 221, welches über die Freisetzung von NO2− in einer fast thermoneutralen Reaktion (0,01 eV) weiter dissoziiert. Ansonsten könnte die NO2 Gruppe sich in der Nähe des (RRx−NO2) Fragments bewegen (Roaming), ein Wasserstoffatom von der CH2 Gruppe annehmen und damit ein neutrales HNO2 Molekül bilden, das anschließend vom Anion exotherm abspaltet (−0,92 eV). Das gebildete Anion bei m/z 220 könnte dissoziieren und damit Br− bilden, was ebenfalls eine fast thermoneutrale Reaktion wäre (0,04 eV). Das einzeln besetzte Molekülorbital (SOMO) im (RRx−HNO2)− Anion bei m/z 220 zeigt die Bildung eines nicht-kovalent gebundenen Typs von anionischem Komplex an, wobei der Abstand C−Br 2,80 Å beträgt, und die Ladung hauptsächlich am Bromatom lokalisiert (−0,59 e). Ein solch exotischer Komplex wurde theoretisch zum ersten Mal für brom-modifizierte anionische Nukleinbasen in der Gasphase und in Lösung vorhergesagt.23 Während für diese Systeme die DEA Reaktion mit der Freisetzung von Br− in Lösung als stark exotherm beschrieben wurde (>2 eV), war die Reaktionsenergie in der Gasphase ca. +0,4 eV. Nachfolgende massenspektrometrische Studien mit 8-Bromoadenin bestätigten die Existenz eines solchen anionischen Komplexes.24 In unserer Studie zeigt sich, dass der nicht-kovalent gebundene Komplex auf massenspektrometrischen Zeitskalen detektiert werden kann, aber er kann auch über Br− Abspaltung mit einer Reaktionenergie nahe 0 eV zerfallen (vergleiche Abbildung 2). Ein ähnlicher Komplex wird auch im Falle der C−Br Prädissoziation mit der Energie von −1,67 eV gebildet. Dabei beträgt die C−Br Bindungslänge 3,02 Å. Erwähnenswert ist, dass frühere Studien die Wichtigkeit von solchen nicht-kovalent gebundenen Komplexen (falls gebildet) für die Dissoziationsdynamik des TNIs in Lösung zeigten.25 Der (RRx−NO2)− Komplex hat kompaktere Struktur mit kovalenten Bindungen zu NO2 und Br. Für diesen Zwischenkomplex ist die Energetik (−0,48 eV) und Ladungslokalisierung bei der NO2 Gruppe entscheidend, dass NO2− Abspaltung als primärer Dissoziationsweg gegeben ist.
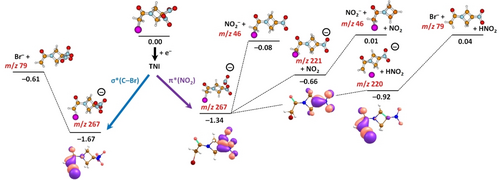
Vorgeschlagene Reaktionswege für Elektronanlagerung an RRx-001 berechnet auf dem CCSD/aug-cc-pVDZ//B3LYP/aug-cc-pVDZ Level. Die Energien sind in eV ausgedrückt und bzgl. des Minimums für das neutrale Molekül angegeben. Einzeln besetzte Orbitale und das höchste besetzte Orbital von (RRx−NO2)− sind gezeigt wie auf dem B3LYP Level berechnet. Vergleiche das Begleitmaterial (Abbildung S1) für höherliegende Dissoziationskanäle und die (RRx)− Struktur ohne Prädissoziation.
Abbildung 2 zeigt, dass die energetisch günstigsten DEA Reaktionswege, die in den Rechnungen berücksichtigt wurden, für alle vier experimentell häufig aufgetretenen, anionischen Fragmente exotherm oder fast exotherm sind. Entlang diesen Reaktionswegen sind auch keine größeren Energiebarrieren vorhanden, welche die Dissoziation durch Elektronen mit einer anfänglichen Energie nahe 0 eV verhindern könnten. Diese Vorhersage auf Basis der Rechnungen ist auch durch die anionischen Massenspektren bei verschiedenen Elektronenenergien bestätigt. Die Spektren sind im Begleitmaterial gezeigt (Abbildung S2). Die Ionenintensitäten im anionischen Massenspektrum nahe 0 eV zeigen deutlich, dass alle diskutierten anionischen Fragmente bei dieser Elektronenergie mit höchster Intensität gebildet werden. Bei einer Elektronenergie nahe 0 eV reicht die im TNI freigewordene Überschussenergie aus, um die Dissoziation zu verursachen. Für einige Reaktionswege liefert auch molekulare Umstrukturierung zusätzliche Energie für ausschlaggebende Bindungsbrüche. In diesem Zusammenhang sollte erwähnt werden, dass beim Wippi-Experiment die Moleküle, welche in einem Molekülstrahlofen in die Gasphase gebracht werden, direkt mit einer Kapillare in die Wechselwirkungszone mit dem Elektronstrahl transferiert werden während im CLUB-Experiment die Moleküle sublimiert werden und anschließend mit Heliumgas in das Vakuum expandiert werden. In diesem Fall können die Moleküle bei der Expansion bzgl. ihrer Translations- und Schwingungsbewegung gekühlt werden. Aufgrund der ursprünglich geringeren Temperatur können die gebildeten Anionen eine längere Lebenszeit besitzen, oder endotherme Dissoziationskanäle könnten geschlossen bleiben. Diese Effekte beinflussen die relativen Intensitäten der Produktanionen in den Massenspektren der Abbildung 1.
Die bis jetzt diskutierten experimentellen und theoretischen Ergebnisse deuten auf den starken Wettbewerb zwischen der elektronaffinen NO2 Gruppe und dem Bromatom hin, die um die negative Überschussladung konkurrieren. Wir untersuchten diesen Wettbewerb während der Bildung und dem Zerfall des TNIs auf sehr frühen Zeitskalen, d. h. Femto- bis Pikosekunden. Vom theoretischen Blick aus gesehen geben semi-quantitative Potentialenergieflächen (PES) Einblick in die Dynamik, siehe Abbildung 3b. RRx besitzt hohe vertikale bzw. adiabatische Elektronenaffinitäten von 0,85 eV bzw. 1,67 eV, (CCSD/aug-cc-pVDZ//B3LYP/aug-cc-pVDZ Level). Die zwei tiefsten elektronischen Zustände sind mit der Lokalisation des Elektrons in π*(NO2) Orbitalen von beiden NO2 Gruppen verknüpft, entweder in symmetrischer oder antisymmetrischer Kombination, wie in Abbildung 3a gezeigt ist. In der Franck–Condon (FC) Region, sind diese Zustände nahezu entartet, wie die Rechnungen auf den TD-CAM-B3LYP/aug-cc-pVTZ Level (Unterschied 0,14 eV) und MRCI(3,5)/6-31g* (0,04 eV) Level zeigen; EOM-CCSD/6-31g* sagt eine größere Lücke von 0,51 eV voraus, die aber vermutlich durch die Methodik der einzelnen Referenz verursacht wird. Auf dem MRCI Level, liegt der dritte elektronische (Valenz−)Zustand ca. 1,4 eV über den π*(NO2) Zuständen, mit dem zusätzlichen Elektron im σ*(C−Br) Orbital. Abhängig vom elektronischen Zustand, der nach der anfänglichen Elektronenanlagerung eingenommen wird, findet Prädissoziation von NO2 oder Br statt. Bei Vergrößerung des C−Br Abstands verringert sich die Energie des σ*(C−Br) Zustands ohne eine Barriere. Wird der elektronische Grundzustand bei einem C−Br Abstand von ca. 2,2 Å am Ende erreicht, ist die Überschussladung des Bromatoms −0,66 e. Für die Dissoziation entlang der C−NO2 Koordinate fanden wir, von der Struktur des neutralen Moleküls ausgehend, auch einen barrierelosen Reaktionsweg bei dem der π*(NO2) Charakter des elektronischen Grundzustandes erhalten blieb. Wenn das Minimum des prädissoziierten Zustandes erreicht ist, beträgt die Ladung bei der locker gebundenen NO2 Gruppe −0,38 e. Beide Reaktionswege resultieren in Übergangsstrukturen mit NO2 oder Br, die jeweils nur locker an ein polarisiertes Fagment gebunden sind, welches weiter zerfällt (siehe Abbildung 2).
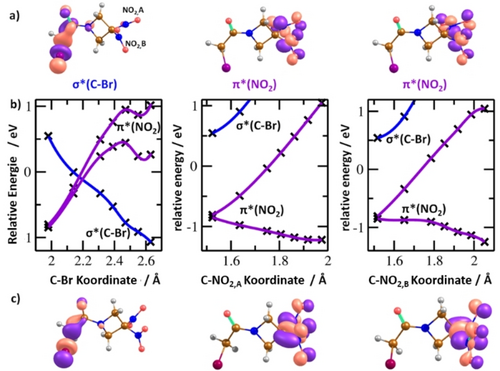
a) Vom ungeraden Elektron besetzte Orbitale für die niedrigsten elektronischen Valenzzustände des RRx Anions, berechnet auf dem TD-CAM-B3LYP/aug-cc-pVTZ Level. Farbcodierung: Wasserstoff – grau, Kohlenstoff – braun, Stickstoff – blau, Sauerstoff – rot, Brom – violett. b) Interpolationskurven für das RRx Anion entlang der C−Br and C−NO2 Koordinate für die drei niedrigsten elektronischen Valenzzustände zwischen der Struktur des neutralen RRx Moleküls und dem Übergangszustand der Prädissoziation (optimiert auf dem B3LYP/aug-cc-pVDZ Level). Die Kreuzsymbole zeigen die auf dem MRCI(3,5)/6-31g* Level berechneten Punkte, die Splines dienen zur verbesserten Visualisierung. Die erwähnten Energiewerte sind relativ zum Grundzustand des neutralen Moleküls und mittels Gleichsetzen von der Energie vom Anion im Minimum des neutrales Moleküls und der negativen vertikalen Elektronenaffinität auf dem CCSD/aug-cc-pVDZ Level (0,85 eV) bestimmt. c) Orbitale vom ungeraden Elektron für die Endpunkte der jeweiligen Interpolationen in b) (berechnet auf dem CAM-B3LYP/aug-cc-pVTZ Level).
Die Interpolationskurven der PES, die in Abbildung 3b gezeigt sind, ergeben auch konische Kreuzungen zwischen π* und σ* Zuständen, die einen Wechsel des Zustands während der raschen Dissoziation erlauben würden. Wie bereits für einfachere Systeme ohne lokale Minima auf der PES gezeigt worden ist, kann die Kopplung eines π* und eines σ* Zustandes zu einer komplexen Dynamik im Übergangsanion führen.14 Wir maßen die Energiescans für die vier Hauptfragmente NO2−, Br−, (RRx−HNO2)− und (RRx−NO2)− mit der Wippi-Apparatur. Die Anionensignale der verschiedenen Fragmente sind in Abbildung 4 präsentiert. Alle anionischen Fragmente zeigen einen Peak nahe 0 eV, der aufgrund der berechneten Energetik der Dissoziationswege (siehe Abbildung 2) erwartbar ist. Das Normieren aller Energiescans bei 0 eV zeigt aber einen wichtigen Unterschied in den Ionensignalen auf: Die NO2− und Br− Signale zeigen eine ausgeprägten Ausläufer vom ersten Peak, der bei den Ionensignalen von (RRx−HNO2)− und (RRx−NO2)− fehlt. Wir fitteten das Ionensignal für diese beiden Anionen mit einer einzelnen, asymmetrischen Peak-Funktion, während der Fit der Energiescans von NO2− und Br− eine zusätzliche zweite Resonanz im Schweif vom ersten Peak identifiziert (alle Fits sind im Begleitmaterial, Abbildung S4, gezeigt). Die zweite Resonanz, die zur Bildung von NO2− führt, fanden wir bei 0,52 eV, im Falle von Br− ist die Resonanzenergie 0,56 eV. Da die Schwellen dieser Resonanzfeatures unterhalb der berechneten Schwellen höher liegender Dissoziationskanäle liegt (≥0,47 eV, siehe Abbildung S1), können die Daten mit dem Reaktionsschema der Abbildung 2 verglichen werden. Wir erklären die Unterschiede zwischen den Ionensignalen von den leichteren und den schwereren anionischen Fragmenten mit den Abläufen während der schnellen TNI Dynamik: Der zweite Peak bei ca. 0,5 eV wird über anfängliche Besetzung des σ*(C−Br) Orbitals gebildet (siehe die Interpolationskurven in Abbildung 3b). Während für die Prädissoziation von Br− das eingefangene Elektron einfach in diesem Orbital verbleibt, ist für die Bildung von NO2− ein Zustandswechsel beim konischen Kreuzungspunkt notwendig. Im Falle von (RRx−HNO2)− und (RRx−NO2)− zeigen die Energiescans, dass beide Anionen über anfängliche Besetzung des π*(NO2) Orbitals gebildet werden, und das σ*(C−Br) Orbital dabei auf der schnellen Zeitskala unbeteiligt bleibt. Es sollte auch erwähnt werden, dass die Resonanz nahe 0,5 eV um einen Faktor 3 breiter ist als der schmale Peak nahe 0 eV. Die Breite der Resonanz kann auch grundlegende Informationen über den beteiligten TNI Zustand liefern. Die längere Lebenszeit von π* Resonanzen im Vergleich zu σ* Resonanzen ist mit einer schmäleren Breite verknüpft.26 Demzufolge lässt sich der Peak nahe 0 eV der Besetzung eines π* Zustandes zuordnen, da er praktisch die Auflösung des Elektronenstrahls abbildet. In der geringen Breite und hohen Intensität des 0 eV Peaks lässt sich ein s-Wellen-Anlagerungsprozess erkennen, bei dem das Elektron mit einem Wirkungsquerschnitt innerhalb des E−0,5 Limits eingefangen wird (E ist die anfängliche Energie des Elektrons). Die Anzahl der nahe 0,5 eV gebildeten temporären negativen Ionen wird auch durch die Möglichkeit der spontanen Elektronenemission bis nahe des Kreuzungspunkts bei ca. 2,2 Å (C−Br Abstand betrachtet) verringert. Diese Effekte erklären den signifikanten Intensitätsunterschied der beiden in den Energiespektren beobachteten Resonanzen.
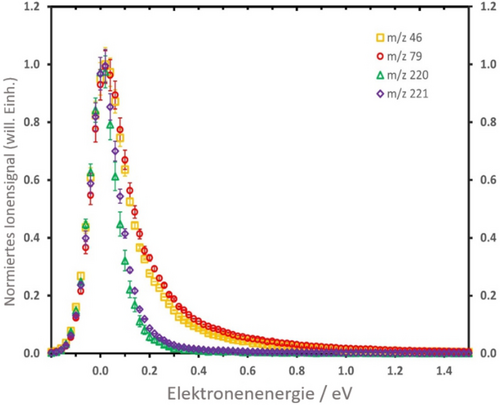
Anionensignale für die anionischen Fragmente NO2− (m/z 46), Br− (m/z 79), (RRx−HNO2)− (m/z 220) und (RRx−NO2)− (m/z 221), welche bei Elektronenanlagerung an RRx gebildet werden können. Die Ionensignale der verschiedenen Anionen (in willkürlichen Einheiten) sind bei der 0 eV Resonanz normiert. Die statistischen Fehlerbereiche für jeden Datenpunkt entsprechen dem Standardfehler des Mittelwerts verschiedener Einzelmessungen (siehe Begleitmaterial für nähere Details). Die Symbole der Datenpunkte sind wie folgt: m/z 46 (gelbe Quadrate), m/z 79 (rote Kreise), m/z 220 (grüne Dreiecke), und m/z 221 (indigofarbene Diamanten).
Schlussfolgerung
Unsere Elektronanlagerungsresultate für RRx zeigen, dass das Molekül höchst empfänglich für niederenergetische Elektronen ist. Das Br− Anion stellt erst einige hundert Mikrosekunden nach der TNI Bildung das häufigste anionische Fragment dar. Dieses Ergebnis widerlegt die Hypothese, dass ein einfacher Dissoziationsprozess über den repulsiven σ*(C−Br) Zustand passiert, da die Dissoziation unerwartet lange für eine exotherme Reaktion dauert. Stattdessen deuten die Berechnungen auf die Bildung eines nicht-kovalenten Typs von anionischen Komplex Br−–(RRx−HNO2)⋅ hin, der im Massenspektrum auf früheren Zeitskalen auftritt. Der analoge Mechanismus lässt sich dem Reaktionspfad für die Bildung von NO2− zuordnen, der auf späteren Zeitskalen einen unabhängigen, konkurrierenden Reaktionsweg zur Br− Freisetzung darstellt. Dieser Reaktionsweg wird auf schnellen Zeitskalen über einen Kreuzungspunkt der π*(NO2) und σ*(C−Br) Zustände erreicht. In früheren theoretischen Arbeiten wurde die σ* Prädissoziation einer π* Resonanz als effizienter DEA Mechanismus für verschiedene Moleküle vorgeschlagen.26-28 Beispielsweise wurde die Bildung eines Einzelstrangbruches in (getrockneter) DNA mit der anfänglichen Bildung einer π* Resonanz der Nukleinbase erklärt, da ein Elektronentransfer vom π* Orbital in das repulsive C−O σ* Orbital der Phosphatgruppe möglich ist.29, 30 Experimentelle Daten geben auch generell der π*→σ* Kopplung hohe Relevanz, da die nicht-dissoziativen π* Resonanzen durch längere Lebenszeit in Bezug zur spontanen Elektronenemission gekennzeichnet sind.26 Für anionisches RRx erlaubt der konische Schnittpunkt, der sich energetisch unter dem Autodetachmentkontinuum befindet, experimentell auch die umgekehrte σ*→π* Kopplung zu beobachten. Deren Erscheinung tritt in Form der Resonanz bei ~0,5 eV im NO2− Anionensignal auf. Wir merken an dieser Stelle an, dass der involvierte π* Zustand dissoziativen Charakter hat, im Gegensatz zu nicht-dissoziativen π* Resonanzen, die für andere anionische Systeme auftraten.26-28
Radiobiologische Experimente zeigten, dass RRx eine hohe biologische Aktivität in Zellen entwickelt. Unsere Experimente in der Gasphase erlauben die Erforschung von Zwischenreaktionen der Strahlenschädigung und die Unterscheidung von direkten und indirekten Prozessen.31 Eine mögliche Hypothese wäre, dass RRx in bestrahlten Zellen auch als möglicher Radiosensitizer durch niederenergetische Elektronen aktiviert werden könnte. Eine frühere Studie über Elektronenanlagerung mit dem Radiosensitizer Nimorazol zeigte eine solche Möglichkeit der Aktivierung.32 Unsere Resultate für RRx würden auf die effiziente Freisetzung von Nitrit, Stickstoffdioxid, und salpetrige Säure hindeuten, welche eine Reihe von Elektronentransfer-, Additions-, und Subtraktionsreaktionen eingehen,33 die hauptsächlich zu einen gefäßerweiternden Effekt34 oder zur Erhöhung des oxidativen Stresses über die vermehrte Bildung von OH-Radikalen führen.35 Dies würde einen neuen Mechanismus für die Sauerstoffanreicherung von sauerstoffarmen Tumorzellen darstellen; zusätzlich zur vorgeschlagenen Reduktion von Nitrit im Serum zu Stickstoffmonoxid durch RRx.36 Reoxygenierung von hypoxischen Krebszellen würde zu einer geringeren Lebensdauer dieser Zellen bei Bestrahlung führen.37 Allerdings sollte erwähnt werden, dass die Dissoziationsprozesse auf einer Zeitskala von Mikrosekunden in einer molekularen Umgebung bspw. durch schnelle intermolekulare Energieverteilung38 oder stabilisierenden Protonentransfer verhindert werden könnten.30 In diesem Fall relaxiert das anionische System bevor Dissoziation stattfindet. Eine Ausnahme betrifft schnelle Prozesse, wie frühere Studien von angeregten Nukleosidanionen in Lösung zeigten.9 Dies legt den Schluss nahe, dass die hier anfänglich besetzten Zustände in der Lösung dieselben sein werden und unsere Studie daher – unabhängig von der molekularen Umgebung – grundlegende Einsicht in die ersten Schritte des potentiellen Radiosensitizers unter Bestrahlung geben kann. Wir möchten zum Abschluss auch noch die Wichtigkeit von Studien über die Dynamik der Bildung und den Zerfall von negativen Ionen für andere Klassen von Molekülen hervorstreichen. Ein Beispiel ist die Gruppe von Photokatalysatoren, die für (mittels Photoreduktion) herbeigeführte organische Reaktionen und Polymerisationen Anwendung finden.39
Begleitmaterial
Das Begleitmaterial enthält eine Zusammenfassung der experimentellen und theoretischen Methoden, die Begleitabbildungen S1–S4, die Begleittabelle S1, die kartesischen Koordinaten der gerechneten Strukturen und die Rohdaten. Wir verwendeten zusätzliche Zitierungen im Begleitmaterial.40
Danksagung
Die im Artikel präsentierte Forschung wurde zum Teil vom österreichischen Wissenschaftsfonds FWF [Projekt-DOIs 10.55776/P30332 and 10.55776/I5390] gefördert. Für Open-Access Zwecke, haben die Autoren eine öffentliche CC BY Copyright-Lizenz für die angenommene Version beantragt. Die quantenchemischen Rechnungen unserer Studie wurden mit der HPC Infrastruktur LEO der Universität Innsbruck durchgeführt. Ein Teil der Autoren dankt auch dem Ministerium für Bildung, Jugend und Sport der tschechischen Republik, Projekt CZ.02.01.01/00/22_008/0004649 QUEENTECH, mitfinanziert von der Europäischen Union. B.S. dankt der tschechischen Förderagentur für Wissenschaft, Projekt Nr. 21-26601X. F.I. wurde von der COST Action CA20129 – Multiscale Irradiation and Chemistry Driven Processes and Related Technologies (MultIChem) unterstützt.
Interessenkonflikt
Die Autoren erklären, dass keine Interessenkonflikte vorliegen.
Open Research
Data Availability Statement
Die Daten, die die Ergebnisse dieser Studie unterstützen, sind in den Hintergrundinformationen zu diesem Artikel verfügbar.




