Nichtkovalente Organokatalyse mit Halogen-, Chalkogen-, Pniktogen- und Tetrelbrücken: neuere Entwicklungen
Abstract
Die Anwendung nichtkovalenter Wechselwirkungen, welche auf elektrophilen Halogen-, Chalkogen-, Pniktogen- oder Tetrelzentren beruhen, hat in der Organokatalyse deutlich an Aufmerksamkeit gewonnen. Wir geben hier einen Überblick über die wichtigsten Entwicklungen der letzten Jahre, mit einem Fokus auf experimentellen Studien und auf Katalysatoren, die über nicht-transiente derartige Welchselwirkungen agieren.
1 Einleitung
Nichtkovalente Wechselwirkungen (NCIs) sind die entscheidenden Komponenten in der Supramolekularen Chemie und in ihren Anwendungen, beispielsweise in der molekularen Erkennung und der Organokatalyse.1 Neben Wasserstoffbrücken (HB) sind in den letzten 20 Jahren auch andere Varianten mit unterschiedlichen Elementen als elektrophilen Zentren in den Blickpunkt gerückt, wobei Halogenbrücken (XB) die bekanntesten Beispiele darstellen (Abbildung 1).2 Ihre vielseitigen Anwendungen im Crystal Engineering,3 in der Polymerchemie,4 der Arzneimittelentwicklung5 und der Organokatalyse6, 7 wurden bereits in einigen Übersichtsartikeln behandelt.8 Inspiriert durch diese Erfolgsgeschichte hat sich die Aufmerksamkeit auch auf verwandte NCIs gerichtet, und besonders das Interesse an Chalkogenbrücken (ChB) ist im letzten Jahrzehnt erheblich gewachsen; erste Anwendungen in der Organokatalyse sind ebenfalls erschienen.9 Im Vergleich dazu sind Pniktogenbrücken (PnB)10, 11 wesentlich weniger untersucht,12 und zu Tetrelbrücken liegen aktuell nur wenige Studien vor.13
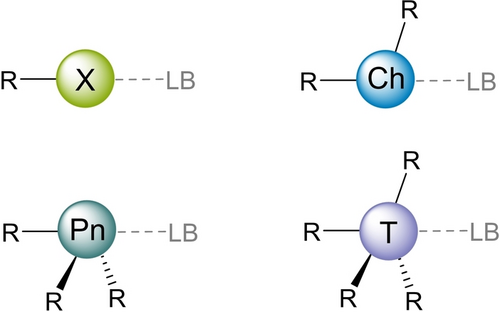
Nichtkovalente Wechselwirkungen von Halogen- (X=F, Cl, Br, I), Chalkogen- (Ch=O, S, Se, T), Pniktogen- (Pn=N, P, As, Sb, Bi) und Tetrelzentren (T=C, Si, Ge, Sn, Pb) mit Lewisbasen (LB). Die hier dargestellten üblichen Valenzen können in “hypervalenten” Verbindungen überschritten werden.
Ein entscheidender elektronischer Beitrag zu all diesen Wechselwirkungen ist die elektrostatische Anziehung, welche auf Bereichen positiven elektrostatischen Potentials in Verlängerung der R−Z-Bindungsachen (Z=Substituent: Halogen X, Chalkogen Ch, Pniktogen Pn, Tetrel T) basiert, den sogenannten „σ-Löchern“.14
Da die Elektrostatik alle Eigenschaften der hier besprochenen NCIs zu erklären scheint, werden diese manchmal „σ-Löcherbindungen“ genannt. Wir werden das nicht tun, da ein zweiter wichtiger Beitrag vorliegt, nämlich n→σ* Orbitalwechselwirkungen (oder Mulliken‘scher15 “Ladungstransfer”) (Abbildung 2). Diese sind am relevantesten für starke Addukte und für Fälle wie “anti-elektrostatische” XBs zwischen zwei Anionen.16
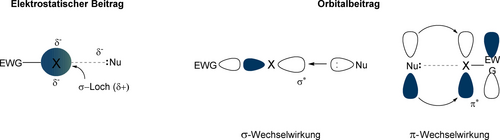
Electrostatischer und Orbitalbeitrag zu Halogenbrücken (EWG=elektronenziehende Gruppe; Nu=Nucleophil; X=Halogen).
Die Orbitalabstoßungen zwischen den einsamen Elektronenpaaren der Lewisbase (LB) und des Atoms Z sind auch der Grund für die hohe Direktionalität der NCIs (mit R−Z⋅⋅⋅LB≈180°). Mit zunehmender Anzahl an Substituenten an den Atomen X, Ch, Pn und T ist grundsätzlich auch eine zunehmende Anzahl elektrophiler Achsen vorhanden, und es hängt vom jeweiligen Substituenten R (Abbildung 1) ab, welche davon Lewis-azide werden. Ein weiterer möglicher Beitrag zu Halogenbrücken wurde von Berlinguette und Mitarbeitern herausgestellt: in halogenierten Triphenylammoniumradikalsalzen wechselwirkt die Lewisbase mit dem π*-Orbital des XB-Donors (d. h. der halogenierten Lewissäure) (Abbildung 2).17 Dieser Effekt – der mit Metall-Ligand-Bindungen verglichen worden ist – wird besonders für XB-Donoren mit tiefliegenden π*-Orbitalen wichtig sein.
Dieser Minireview soll einen Überblick über die neuesten Entwicklungen bei allen vier NCIs (XB, ChB, PnB und TB) in der nichtkovalenten Organokatalyse seit etwa 2019 geben. Für frühere Arbeiten zur XB- und ChB-Organokatalyse verweisen wir auf vorherige Übersichtsarbeiten.7, 18, 19 Einzelne Aspekte wurden anderswo ausführlicher diskutiert, während wir hier einen kompakten (und notwendigerweise subjektiven) Überblick geben wollen. Die folgenden Aspekte werden (mit wenigen Ausnahmen) nicht besprochen: a) rein theoretische Arbeiten; b) Anionenerkennung mit XB,20 ChB21 oder PnB;22 c) Katalysen, deren Aktivierungsmodi nicht auf Lewisazidität beruhen;23 d) Katalysen mit elementarem Iod;24 und e) Katalysen durch vorübergehende (transiente) NCIs, in denen die R−Z-Bindung des NCI-Donors während der Reaktion gespalten wird, z. B. in photochemischen Prozessen.25 Es gibt in der Tat viele schöne Beispiele für solche transienten XB26 oder ChB27 in der Organokatalyse, aber aus Gründen der Klarheit und Kürze werden wir uns hier auf „stabile“ Katalysatoren beschränken.
2 Halogenbrückendonoren
2.1 Halogen(I)brückendonoren
Die Organokatalyse mit XB ist zweifellos von allen vier NCIs die etablierteste. Elementares Iod war in Reaktionen spätestens seit 1915 eingesetzt worden,28 der zugrundeliegende Mechanismus blieb aber weitestgehend unklar, und es konnte erst viel später gezeigt werden, dass XB in einigen solcher Fälle relevant sind.29 Zum Einsatz von Organohalogenaktivatoren und -katalysatoren wurden 2008/2011 erste Pionierarbeiten vorgestellt,30 und seitdem hat dieser Bereich eine stetige Erweiterung in Richtung neuer Katalysatorstrukturen und Reaktionen erfahren. In diesem Abschnitt werden wir uns auf Verbindungen beschränken, in denen das Halogen, weit überwiegend Iod, nur einen Substituenten trägt. Traditionell wurde Iod in solchen Verbindungen die Oxidationsstufe −I zugewiesen, da aber die Substituenten in XB-Donoren üblicherweise elektronenziehend sind, betrachten wir es lieber als Iod(+I). Die meisten bisher in der Organokatalyse eingesetzten XB-Donoren können in zwei Kategorien aufgeteilt werden: neutrale Verbindungen (wie polyfluorierte Polyphenyle, Heteroaromaten sowie Alkinderivate) oder kationische Heteroaromaten, welche zwar wegen der Ladungsunterstützung meistens stärkere XBs ausbilden, allerdings auch unter der Koordiation von Anionen leiden können.18 In den letzten Jahren wurden in beiden Kategorien neue Strukturmotive eingeführt.
Beispielsweise präsentierte Shibata die auf polarisierten Csp3−I-Bindungen beruhenden XB-Donoren 1 und 2 (Abbildung 3a) und setzte sie auch erfolgreich in einer Mukaiyama-Aldolreaktion sowie in Chinolinreduktionen ein.31 Eine chirale BINOL-basierte Variante32 führte nicht zu asymmetrischer Induktion. Berryman verwendete “HB-verstärkte XB“ (HBeXB) als einen neuen Ansatz, um die stärkeren Halopyridinium-basierten Organokatalysatoren 3 (Abbildung 3b) zu erhalten: ein interner HB-Donor versteift die Struktur und führt außerdem über eine weitere Polarisierung des Iods zu einer höheren Lewisazidität. Dieser Effekt wurde über die Messung von Bindungsstärken33 und in Testreaktionen34 quantifiziert.
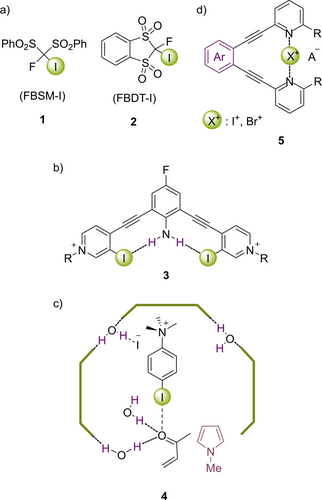
a) C(sp3)-basierter XB-Organokatalysator b) Iodpyridinium-Organokatalysator mit HBeXB c) Resorcinarenkapsel mit XB-Katalysator d) Katalysator auf Basis eines Haleniumions.
Ein alternativer Ansatz zur Steigerung der katalytischen Aktivität liegt in der Beeinflussung der Umgebung. La Manna et al. verwendeten eine Resorcinarenkapsel als nanometergroßen abgeschlossenen Raum und platzierten ein geladenes Iodphenyl in diesem Hohlraum (Abbildung 3c).35 Während dieser Katalysator in Lösung inaktiv war, aktivierte er eine Michael-Reaktion in der Kapsel 4. Computerchemische Studien ergaben Beiträge von HB und (überwiegend) XB. Eine ungewöhnliche Umgebung wurde außerdem durch das Anheften zweizähniger XB-Donoren an ein Polymergerüst etabliert.36 Die Wiederverwendbarkeit eines solchen Katalysators konnte über mehrere Zyklen hinweg gezeigt werden, allerdings verbleiben noch viele Herausforderungen bei der Darstellung immobilisierter Systeme.
Einer der stärkstmöglichen XB-Donoren ist das Haleniumion, I+. Seine Addukte mit zwei Donorgruppen, oft Pyridinen, sind in der Supramolekularen Chemie breit eingesetzt worden.37 Momiyama berichtete über die Katalyse einer Mukaiyama-Mannich-Reaktion mit solchen NXN-Systemen 5 (Abbildung 3d).38 Die Anionenbindungskatalyse verläuft wahrscheinlich über mehrere Gleichgewichte unter dem Austausch von Pyridin(en) gegen Chlorid(e), und damit liegt hier ein Grenzfall zwischen transienter und nicht-transienter XB-Katalyse vor.
Die Erweiterung der XB-Katalyse auf neue Reaktionen wird oft durch quantenchemische Rechnungen unterstützt, wir können hier aber nur zwei Beiträge kurz andeuten. Fernández und Bickelhaupt postulierten, dass Dihalogene Michael-Reaktionen über eine Reduzierung der Pauli-Abstoßung zwischen den Reaktionspartnern katalysieren.39 Solche Michael-Reaktionen wurden auch von Legault analysiert, der herausfand, dass im Gegensatz zu einer klassischen Koordination an die Carbonylgruppe auch die direkte Aktivierung des π-Systems der dominierende Katalysemodus sein kann. Dies stimmt mit früheren Berichten zur Katalyse mittels C−I⋅⋅⋅π XBs40 überein; es wird zudem starke Auswirkungen auf die zukünftige Entwicklung von Katalysatoren haben.
Zwei neue Arten an Reaktionen wurden kürzlich in die XB-Katalyse eingeführt: herausfordernde Glykosylierungen41 und die Kombination von XB mit Metallkatalyse. Eine einfache Glykosylierung war bereits zuvor publiziert worden,42 Loh zeigte aber auf überzeugende Weise, dass XB auch für komplexere Substrate angewendet werden können: in einer ringspannungsgetriebenen Glykosylierung wurden verschiedene Glykosidinhibitoren für den Hedgehog-Signalweg erhalten,43 und später konnte auch eine 2-Deoxoglykosylierung etabliert werden (Abbildung 1a).44 In beiden Fällen übertraf die XB-Katalyse deutlich die HB-Katalyse mit einem Thioharnstoff. Für das zweitgenannte Beispiel schlug Loh ein kompliziertes Reaktionsnetzwerk vor, welches mehrere verschiedene Aktivierungsmodi des XB-Katalysators in verschiedenen Abschnitten der Reaktion aufwies. Zunächst wird das katalytische Intermediat 6 a durch Koordination des XB-Donors an den Alkohol erzeugt, was zu dessen Azidifizierung und einem geschwindigkeitsbestimmenden Protonentransfer (unter quantenmechanischem Tunneln) führt, wodurch das genannte Ionenpaar gebildet wird (Schema 1b). Anschließend protoniert das katalytische Intermediat das Glykal unter Ausbildung des Produkts, welches ebenfalls an den XB-Donor binden kann (siehe Komplex 6 b in Schema 1b). Dies führt zu einer Aktivierung des Glykosids und einem dynamischen Austausch des neu-eingeführten Substituenten in einem zweiten Katalysezyklus, welcher einen Teil des Katalysators aus dem Hauptzyklus herausziehen kann. Dieses Beispiel verkörpert den wohl am präzisesten analysierten komplexen XB-Mechanismus und illustriert gleichzeitig sehr anschaulich die variablen Rollen, die NCI-Donoren selbst in einer scheinbar einfachen Reaktion spielen können.
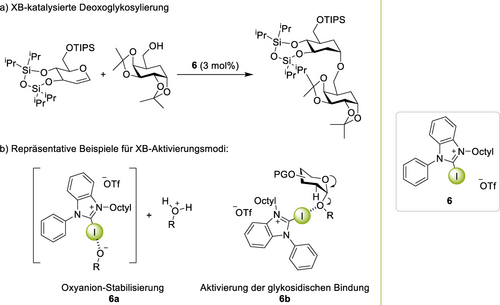
a) XB-katalysierte 2-Deoxoglykosylierung b) XB-induzierte Aktivierung: 6 a und 6 b.
Die Kombination von Halogenbrücken mit Metallkomplexen war zuvor von Vidal-Ferran45 in Form eines XB-induzierten Ligandenaufbaus in einer Rh(I)-katalysierten Hydroborierung gezeigt worden (Schema 2a). Während sogar das nichtfluorierte Iodbenzol in situ zum Aufbau des Metallkomplexes mit dem Diphosphinligand (7) führte, zeigte vor allem die fluorierte Variante eine beeindruckende Leistung bei der katalytischen Hydroborierung endständiger Alkine. Bemerkenswerterweise bewirkte dieser Katalysator eine hohe Selektivität für das verzweigte Produkt. In einer nachfolgenden Arbeit wurde auch die entscheidende Rolle des Gegenions in solchen Prozessen untermauert.46 In Au(I)-katalysierten Cyclisierungsreaktionen konnte die Au−Cl−Bindung des Katalysators Ph3PAuCl durch Iod(I)- (8) und Iod(III)-basierte XB-Donoren aktiviert werden (Schema 2b),47 wodurch die üblicherweise eingesetzten Silbersalze ersetzt werden konnten. Der vorgeschlagene Aktivierungsmodus wurde später computerchemisch bekräftigt;48 er wurde zudem auf Cyclisierungen mit Au(III) erweitert.49
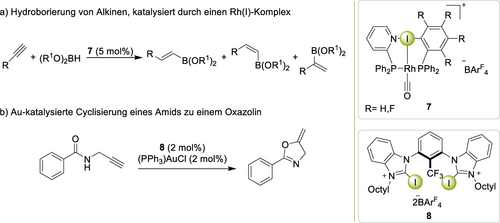
Katalyse einer Hydroborierungs- sowie einer Cyclisierungsreaktion durch XB mit Metallkomplexen.
Ein offensichtliches Zeil für weitere XB-Organokatalysen sind enantioselektive Reaktionen. Zwei konzeptionell verschiedene Ansätze könnten eingesetzt werden, um eine Enantioinduktion zu erzielen: a) die Kombination eines achiralen XB-ausbildenden Kations mit chiralen Anionen und b) der Einsatz chiraler XB-Donoren. Die erstgenannte Option ist eine Variante der asymmetrischen Gegenanion-vermittelten Katalyse (ACDC).50 Über erste derartige Bemühungen wurde von mehreren Gruppen berichtet (Schema 3): eine elektrophile aromatische Substitutionsreaktion von Cheung und Yeung,51 eine Dreikomponenten-Mannich-Reaktion von Han und Liu,52 sowie eine Michael-Addition von Scheidt.53 In allen drei Studien wurden von BINOL-Phosphat abgeleitete Anionen eingesetzt, aber in allen drei Fällen konnten nur geringe Enantiomerenüberschüsse (ee) erzielt werden.
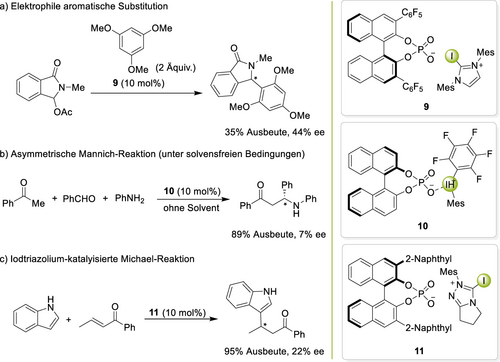
Asymmetrische Gegenanionen-vermittelte Katalyse mit kationischen Halogenbrückendonoren.
Chirale XB-Organokatalysatoren wurden bereits von 2012 an vorgestellt.54 Obwohl mit bifunktionellen Katalysatoren eine hohe Enantioselektivität erreicht werden konnte,55 ist die Relevanz von XB in diesen Systemen unklar und es ist wahrscheinlich, dass XB nicht die hauptsächlich wirksame Komponente sind.18, 56 Im Jahr 2020 stellte unsere Gruppe einen zweizähnigen Bis(iodimidazolium)katalysator 12 mit chiralen Seitenarmen vor (Schema 4a).57 In einer Mukaiyama-Aldolreaktion wurde ein moderater ee von 33 % erhalten, welcher nichtsdestotrotz die erste Enantioinduktion durch „reine“ XB darstellt (da der nicht-halogenierte Katalysator inaktiv war). Kurz darauf berichteten Taylor und Garcia-Mancheño über einen ähnlichen ee (30 %) in einer Anionenbindungsreaktion (Schema 4b).58 Der pseudo-helikale XB-Katalysator 13 wies vier Iodtriazoleinheiten auf und führte zu der inversen Stereoselektivität seines nichtiodierten Gegenstücks, wodurch die entscheidende Rolle der XB bestätigt wurde. Durch weitere Optimierung, vor allem die Einfügung eines halogenbrücken-bildenden Substituenten in das Substrat, konnte ein verbesserter ee von 90 % erreicht werden (Schema 4c).59 Obwohl diese bemerkenswerte Stereoselektivität einen wichtigen Schritt zum weiteren Einsatz von XB in komplexen Reaktionen darstellt, so verbleiben dennoch einige Herausforderungen: können ähnliche Enantioselektivitäten auch mit zweizähnigen XB-Donoren erreicht werden, in Reaktionen mit Substraten ohne Halogenbrückeneinheit, und in Umsetzungen, die nicht auf Anionenbindung basieren?
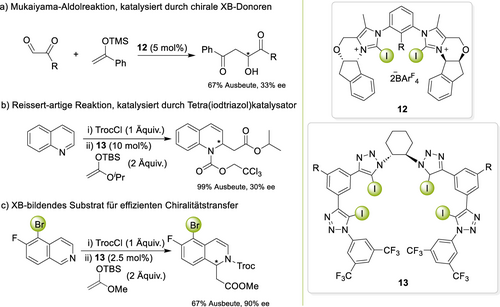
Durch chirale XB-Donoren katalysierte asymmetrische Organokatalysen.
2.2 Halogen(III)brückendonoren
Acyclische Diaryliodoniumsalze (DAI) 14 wurden erstmals 2015 von Han und Liu als Katalysatoren eingesetzt, aber der Mechanismus wurde nicht aufgeklärt.52 Cyclische fünfgliedrige Diaryliodoniumverbindungen 15 – Iodoliumsalze – wurden von unserer Gruppe 2018 in die nichtkovalente Organokatalyse eingeführt (Schema 5a, n=0), und XB wurden als entscheidender Aktivierungsmodus identifiziert.
a) Bindungsmodi acyclischer und cyclischer DAI; b) Einsatz von 14 als Lewissäure-Katalysator in einer Polymerisation.
Acyclische DAI-Salze waren zuvor seit einiger Zeit in lichtgesteuerten kationischen Polymerisationen eingesetzt worden,60 allerdings üblicherweise als Photoinitiatoren, welche sich bei Bestrahlung zersetzen. Kürzlich berichtete Aoshima auch von deren Einsatz als nichtkovalente Katalysatoren in solchen Reaktionen (Schema 5b).61
Messungen von Mayer und Legault zeigen, dass Iodoliumverbindungen ungefähr zwei Größenordnungen stärker Lewis-azide sind als die entsprechenden acyclischen Varianten.62 Außerdem sind sie stabiler und ihr starres Grundgerüst erlaubt die präzise Positionierung der Substituenten im Raum.63 In Reaktionen und Titration hat unsere Gruppe beobachtet, dass sechsgliedrige Diaryliodoniumkationen deutlich weniger Lewis-azide sind als Iodoliumspezies.64 Folglich wurden letztere in zunehmender Weise in der Organokatalyse eingesetzt, in einer breiten Palette an Reaktionen. Dies bezieht sich auch auf die in Abschnitt 2.1 diskutierten Au(I)-katalysierten Cyclisierungen.47, 49 In diesem Fall schnitten präorganisierte Iod(I)-basierte XB-Donoren besser ab als Iodolia (d. h. Iodoliumverbindungen), letztere sind aber deutlich einfacher herzustellen.
Weitere Beispiele umfassen eine Knorr-artige Cyclisierung65 und die [4+2]-Cycloaddition von 2-Alkenylindolen,66 welche durch C−X⋅⋅⋅π⋅⋅⋅XB aktiviert wurden (Schema 6a,b). In einer derartigen Kreuz-[4+2]-Cycloaddition von 2-Vinylindolen mit 2-Alkenylindolen wurden die entsprechenden Tetrahydrocarbazole in hohen Ausbeuten und Diastereoselektivitäten erhalten. In der gleichen Studie verwirklichte Arai ebenso die effiziente DAI-katalysierte Povarov-Reaktion von 2-Vinylindolen mit N-p-Methoxyphenyliminen. Zusätzliche Belege für die vielfältigen Möglichkeiten der DAI-Organokatalyse beruhen auf der Nazarov-Cyclisierung von präaktivierten Divinylketonen durch Murphy (Schema 6c)67 und auf einem Bericht von Sekar,68 der verschiedene organische Umsetzungen enthielt (Schema 6d,e).
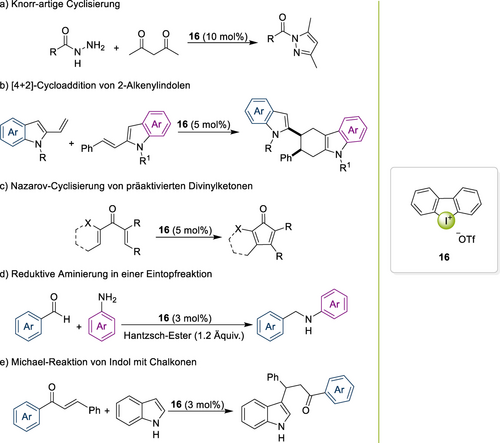
Verschiedene organische Umsetzungen, welche vom zyklischen DAI-Salz 16 katalysiert wurden.
Die bereits eindrucksvolle Leistung einzähniger Iod(III)-Derivate konnte in zweizähnigen Varianten noch einmal deutlich gesteigert werden. Das erste solche Beispiel war das Thiophen-verknüpfte Bis(iodolium)barfat 17, welches die Aktivität des zuvor stärksten Iod(I)-basierten Katalysators 8 in mehreren Testreaktionen übertraf (Schema 7a,b),69 beispielsweise in einer Nitro-Michael-Reaktion. Die Aktivität des Katalysators erreichte dabei fast diejenige der starken Lewis-Säure BF3, und eine computerchemische Studie zeigte, dass die perfluorierte Version 18 sie sogar übertreffen könnte (Schema 7c).70
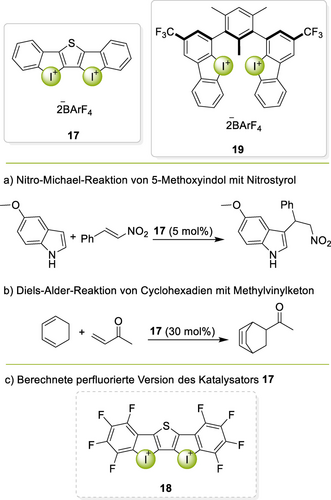
Starre und flexible zweizähnige Iodoliumkatalysatoren 17 and 19 samt den entsprechenden Testreaktionen (a und b) sowie der perfluorierte Katalysator 18.
Der planare XB-Donor 17 weist einen hohen Grad an Präorganisation auf, welche zwar die Bindungsstärke zu geeigneten Substraten erhöht, aber möglicherweise auch die Anpassung an weniger gut passende Substrate verhindert. Daher wurde der flexiblere zweizähnige XB-Donor 19 entwickelt (Schema 7).71 Bisher jedoch war dieser „klammer-artige“ Katalysator deutlich weniger aktiv als das starre System 17.
Im Gegensatz zu Iodoniumsalzen war die Forschung zu Bromoniumreagenzien bisher relativ begrenzt.72 Diese sind weniger stabil gegenüber Nukleophilen73 und computerchemische Analysen zeigen eine verringerte Lewis-Azidität im Vergleich mit Iodolia.74 Nichtsdestotrotz wurden die neuartigen cyclischen Diarylbromoniumsalze 20 von Yoshida synthetisiert und erstmals erfolgreich als XB-Katalysatoren in einer Michael-Reaktion eingesetzt (Schema 8).75 Die Autoren zeigten zudem auf überzeugende Art und Weise, dass mögliche Verunreinigungen wie elementares Brom nicht katalytisch aktiv sind.
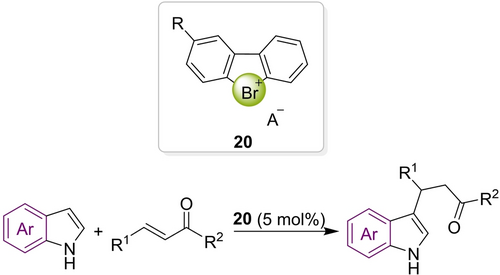
Michael-Additionsreaktion mit einem Bromoniumkatalysator.
Währenddessen wurde von Nachtsheim und Mitarbeitern eine neue Klasse an XB-Donoren entwickelt: N-heterozyklische Iod(az)oliumsalze (NHIS) 21 (Abbildung 4a).76 Insbesondere der XB-Donor 22 zeigte eine herausragende Aktivität in verschiedenen Testreaktionen, welche diejenigen des zweizähnigen XB-Donors 17 und der Lewissäure BF3 übertraf (Abbildung 4a). Kürzlich verwendeten sie diesen Katalysator auch in einer Friedel–Crafts-Reaktion in Wasser, und selbst mit lediglich 0.5 mol-% des Katalysators 22 konnten zufriedenstellende Ausbeuten des Produkts erhalten werden (Abbildung 4b).77 Zusätzlich wurde die relative Lewisazidität von über 100 NHIS-Varianten computerchemisch auf der Grundlage der Gutmann-Beckett-Methode ermittelt, was die weitere Entwicklung dieser Katalysatoren leiten wird.78 NHIS-Verbindungen wie 22 gehören aktuell zu den stärksten verfügbaren XB-Organokatalysatoren, und es wird schwer werden, ihre Azidität weiter zu erhöhen ohne dabei die Katalysatorstabilität weiter zu verringern.
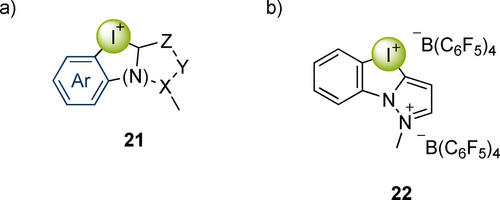
a) N-heterozyklische Iod(az)oliumsalze (NHIS) b) NHIS als Organokatalysatoren für Friedel–Crafts-Reaktionen in Wasser.
λ3-Iodane wie z. B. Tognis Reagenz79 sind gebräuchliche Transferreagenzien, und es ist denkbar, dass in diesen Prozessen auch transiente XB auftreten. Gulder schlug 2020 vor, dass derartige XB mit dem Stickoffzentrum des Substrates die oxidative α-Funktionalisierung von Ketonen steuern.80
Ähnlich wie bei den Halogen(I)-basierten Organokatalysatoren sind auch bei den Halogen(III)-basierten Systemen in letzter Zeit chirale Varianten erschienen. Die erste erfolgreiche enantioselektive Anwendung wurde von Yoshida und Mitarbeitern publiziert.81 Ihr Katalysator 23 besteht aus einer Bromoniumeinheit, die an ein axial-chirales BINOL-Derivat gebunden ist, welches wiederum mit einer Amidgruppe weiter funktionalisiert ist (Schema 9a). In einer vinylogen Mannich-Reaktion konnten hohe Ausbeuten und beeindruckende Enantioselektivitäten (bis zu 96 % ee) erreicht werden. Interessanterweise wurde eine merkliche Aktivierung auch mit der Referenzverbindungen ohne Bromoniumeinheit erhalten (41 % Ausbeute anstelle von 91 %), während das entsprechende Iodoniumanalogon (welches Lewis-azider sein sollte) ebenfalls zu einer deutlich reduzierten Ausbeute führte. Dies deutet auf einen bifunktionellen Aktivierungsmodus hin, in welchem die Amidgruppe ebenfalls an das Substrat bindet. Die Autoren bauten diese elegante Pionierarbeit anschließend weiter aus und setzen das Iodoniumanalogon 24 in einer N,S-Acetalbildung ein (Schema 9b), welche erneut in hoher Enantioselektivität (bis zu 97 % ee) erreicht werden konnte.82 Vor Kurzem zeigten sie, dass ein Derivat des Bromoniumkatalysators 23 mit einer N-Nitrosamingruppe die Mannich-Reaktion von (Isatin-abgeleiteten) Ketiminen mit Malonestern in hoher Enantioselektivität (80 % ee) katalysiert.83 Diese Machbarkeitsstudien illustrieren sehr deutlich das Potential der potenten „hypervalenten“ XB-Donoren für weitere asymmetrische Induktionen.
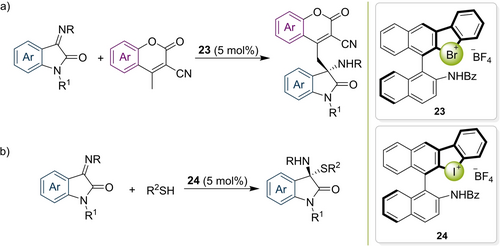
Anwendungen von: a) chiralen Bromoniumsalzen in der asymmetrischen Synthese von N,S-Acetalen b) chiralen Iodoliumsalzen in einer vinylogen Mannich-Reaktion.
3 Chalkogenbrückendonoren
3.1 Chalkogen(II)brückendonoren
Intramolekulare ChB waren bereits Mitte der 1990er von Tomoda und Wirth eingesetzt worden, um chirale Selenylierungsreagenzien zu versteifen.84 Später führten interne S⋅⋅⋅O ChB zwischen nucleophilen Thioharnstoff-artigen Organokatalysatoren und Carbonsäurederivaten zu einer ähnlichen Steigerung der Stereoselektivität.85 Die erste intermolekulare ChB-Organokatalyse mit einem Dithienothiophen wurde 2017 von Matile publiziert.9 Später im selben Jahr stellte unsere Gruppe die erste Selen-basierte ChB-Organokatalyse vor.86
In den letzten Jahren gab es in der ChB-Organokatalyse verschiedene Entwicklungen, die oft den früheren Pfad der XB widerspiegelten. Dies bezieht sich auch auf intramolekulare ChBs in der nucleophilen Organokatalyse, dieses Thema wird hier aber nicht weiter besprochen.
Ein chiraler Se-basierter ChB-Katalysator 25, welcher auf einer atropisomeren 4,4‘-Bipyridineinheit basiert, wurde 2019 von Peluso und Mamane entwickelt (Schema 10).87 Bei einer Chinolinreduktion übertraf Katalysator 25 den analogen iodierten XB-Donor deutlich. Während der Aktivierungsmodus eindeutig dem Selenzentrum zugeordnet werden konnte, wurde keine asymmetrische Induktion beobachtet.
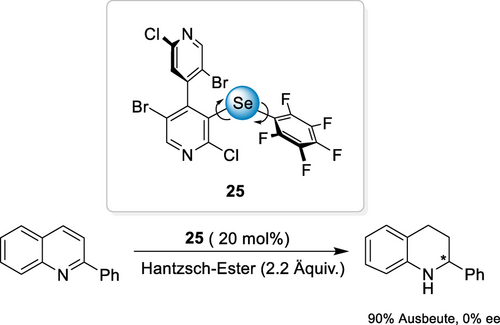
Reduktion von 2-Phenylchinolin, katalysiert durch einen chiralen ChB-Donor.
Im gleichen Jahr etablierte Wang eine sehr interessante neue Art von ChB-Organokatalysator, nämlich ein- und zweizähnige Phosphoniumselenide wie Verbindung 26, welche dann zur Aktivierung von Carbonylverbindungen eingesetzt wurden (Schema 11a).88 In einer mehrstufigen Reaktion zwischen Indolen und β-Ketoaldehyden wurde eine Reihe von Katalysatorstrukturen getestet, und Se⋅⋅⋅O ChB wurden als Hauptmodus der Katalyse ermittelt. Als Nächstes wurden die von Binaphthyl abgeleiteten zweizähnigen Phosphoniumselenide 30 sehr erfolgreich mit nur 15 ppm Katalysatorbeladung in der Cyanosilylierung von Ketonen verwendet.89 In einer anschließend veröffentlichten Rauhut-Currier-artigen Reaktion schlugen die Autoren eine doppelte ChB-Katalyse vor, in welcher der ChB-Donor 27 gleichzeitig mit beiden Substraten, Enon und Alkohol, wechselwirkt.90 Diese Studie offenbart sehr anschaulich die Fähigkeiten der nichtkovalenten Organokatalyse, da diese Reaktionen üblicherweise von starken Lewisbasen wie z. B. Trialkylphosphinen katalysiert werden. Die Vielseitigkeit dieser ChB-Katalysatoren wurde von Wand dann durch eine eindrucksvolle Reihe weiterer Beispiele aufgezeigt,91 z. B. bei der doppelten Aktivierung von zwei Carbonylgruppen in einer Cloke-Wilson-Umlagerung92 oder in Reaktionen von Sulfonyl-geschützten Aziridinen (Schema 11b).93 Letztere Arbeit postulierte einen kooperativen ChB-Bindungsmodus unter Beteiligung einer Se⋅⋅⋅O- sowie einer Se⋅⋅⋅N-Wechselwirkung, um die Sulfonyl-geschützten Aziridine zu aktivieren. Dies erforderte die Verwendung eines sorgfältig ausgewählten Linkers mit dem richtigen Abstand und der richtigen Versteifung (Abbildung 5).
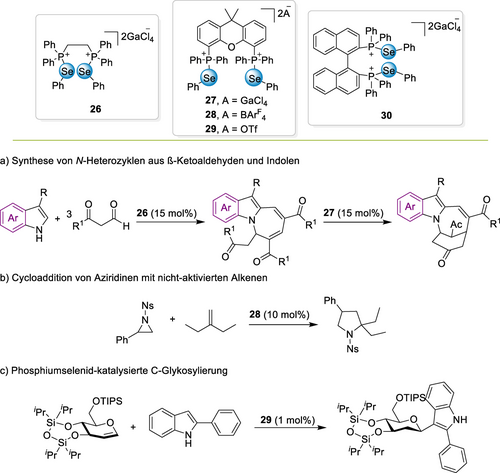
Phosphoniumchalkogenide als ChB-Donoren für die Aktivierung verschiedener Heterocyclen (Ns=p-Nitrobenzolsulfonyl).
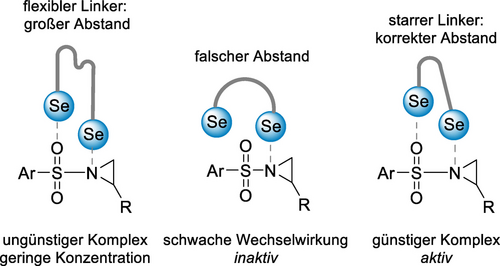
Kooperative Se⋅⋅⋅O- und Se⋅⋅⋅N-Wechselwirkungen zwischen Ch-Donoren und dem Aziridin.
Aufbauend auf ihren früheren Arbeiten mit XB-Donoren verwendeten Loh und Mitarbeiter auch Phosphoniumselenide wie z. B. 29 in mehreren Glykosylierungsreaktionen. In einer spannungsabbauenden Septanosylierung führte ein Netzwerk aus nichtkovalenten Wechselwirkungen (mit einer zweizähnigen/verzweigten ChB und einer zusätzlichen HB) zur Bildung des Produkts in hoher Ausbeute und Stereoselektivität.94 Interessanterweise waren mehrere Iod(I)- und Iod(III)-basierte XB-Donoren inaktiv. In jüngster Zeit wurde diese Strategie auf die C- sowie die N-Glykosylierung von Indolen ausgeweitet, und es wurde vorgeschlagen, dass die Aktivierung über eine doppelte ChB ergänzt um π-Wechselwirkungen verläuft (Schema 11c).95
Mehrere Studien befassten sich auch mit der Aktivierung von Vinylindolen (Schema 12a),96 Alkenen (Schema 12b)97 und Alkinen98 über Se⋅⋅⋅π ChBs (siehe z. B. 31 a), sowie mit der doppelten Aktivierung von vinylischen/benzylischen Ethern99 (welche ebenfalls solche Kontakte beinhaltet). In Verbindung mit den oben erwähnten Erfolgen bei der XB-induzierten π-Aktivierung scheint es daher, dass ungesättigte Systeme besonders gut für die nichtkovalente Organokatalyse geeignet sind.
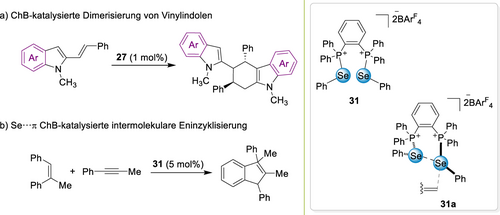
Aktivierung von π-Systemen durch Chalkogenbrücken; rechts: Katalysator (31) sowie vorgeschlagener Wechselwirkungsmodus (31 a).
Obwohl Te-Zentren die Lewis-azidesten (stabilen) Chalkogene sind, hat die manchmal begrenzte Stabilität Te-basierter ChB-Donoren möglicherweise den Einsatz von Organotellurspezies in der Organokatalyse etwas gebremst.100 Im Jahr 2019 stellte unsere Gruppe den zweizähnigen ChB-Donor 32 vor und belegte dessen überlegene Lewis-Azidität mittels einer Nitro-Michael-Reaktion (Schema 13).101 Die jeweiligen S- und Se-Analoga sowie der entsprechende XB-Donor waren alle inaktiv. Eine computerchemische Studie von Kozuch bestätigte das Vorliegen einer Zweipunkt-Chalkogenbrücke im Übergangszustand.102 Eine aus zwei Wassermolekülen bestehende molekulare Brücke ist entscheidend für den Protonentransfer, und der Te-basierte Donor übertrifft den (stärker Lewis-aziden) XB-Donor aufgrund von Solvenseffekten. Der Katalysator 32 übertraf später den XB-Donor auch in einer Michael-Reaktion.103 In einer Povarov-[4+2]-Cycloadditionsreaktion führte eine Variante von 32 mit chiralen Alkylgruppen an den Triazoliumeinheiten nicht zu einer messbaren Enantioselektivität.104
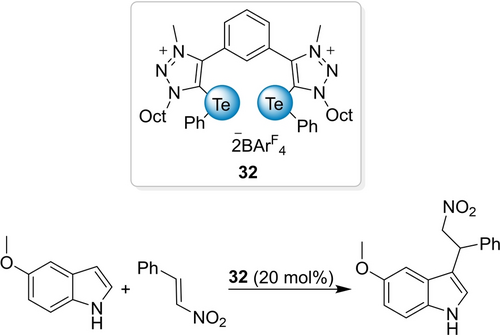
Nitro-Michael-Reaktion zwischen trans- -Nitrostyrol und Indolen.
Tellurtriazoliumeinheiten wurden auch von Zhang in einer Pionierarbeit zu einem licht-schaltbaren ChB-Organokatalysator 33 eingesetzt (Schema 14).105 Das Azobenzolgerüst des Donors erlaubte das Umschalten zwischen (E)- und zweizähnigem (Z)-Isomer, wobei letzteres stärkere Anionenbindung und eine bessere Leistung in einer SN1-artigen Testreaktion zeigte.
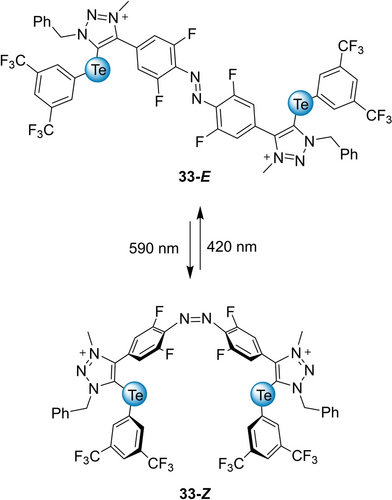
Photoschaltbares Tellur-Triazole/Triazolium-basiertes ChB-System.
Offenkunding hat die ChB-Organokatalyse in wenigen Jahren sehr deutliche Fortschritte gemacht. Nun, da sowohl XB- als auch ChB-Katalyse eine gewisse Reife erreicht haben, eröffnen sich faszinierende Optionen für die Kombination der beiden NCIs. Auf diese Art können zwei NCI-Donorzentren, jedes mit seinen eigenen Merkmalen wie Größe oder Weichheit, gemeinsam an eines oder getrennt an zwei Lewis-basische Zentren eines Substrats binden. Die sich dadurch bietende Möglichkeit, wechselwirkende Atome aufeinander abzustimmen, war zuvor nicht verfügbar. Der gemischte XB/ChB-Donor 34 ist das erste Beispiel eines solchen NCI-Donors (Schema 15).106 Seine Leistung in einer allerersten Diels–Alder-Testreaktion war erwartungsgemäß zwischen derjenigen der reinen XB- und ChB-Varianten.
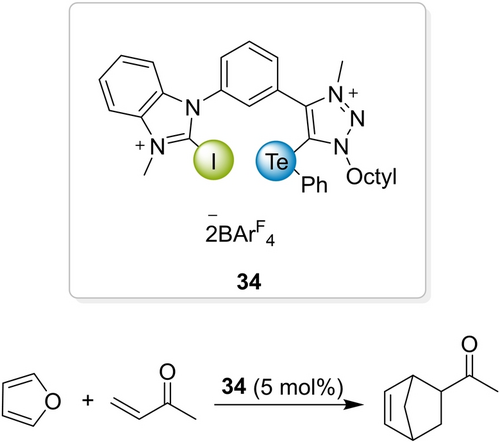
Gemischt XB/ChB-katalysierte Diels–Alder-Reaktion.
3.2 Chalkogen(IV)brückendonoren
Ähnlichen wie bei den XB wurde auch die ChB-Organokatalyse zu höheren Oxidationsstufen hin erweitert.19, 107 Der Einsatz des Selenoniumsalzes 35 als Lösungsmittel in einer Thioacetalisierung im Jahr 2008 durch Lenardão (Scheme 16)108 stellt möglicherweise das erste Beispiel einer NCI-Aktivierung durch solche Verbindungen dar, der exakte Mechanismus wurde allerdings nicht aufgeklärt. Die einzähnigen Selenonium-Organokatalysatoren 36 wurden 2018 von Ke und Yeung in mehreren Reaktionen erstmals eingesetzt, unter anderem zur Bromierung von Aromaten (Schema 17) and Alkenen sowie in einer Mukaiyama-Aldolreaktion.109 Die Selenoniumspezies erzielten hohe Ausbeuten mit 5 % oder weniger Katalysatorbeladung, während die entsprechenden Sulfoniumsalze wenig Aktivität zeigten. Drei Jahre später wurden zweizähnige Varianten dieser Katalysatoren auch in (Aza−)Diels–Alder-Reaktionen und Bromierungen eingesetzt. Die zweizähnige Koordination wurde durch DFT-Rechnungen110 und durch Vergleichsexperimente mit weniger aktiven einzähnigen Analoga bestätigt.

Ein Selenoniumsalz als Lösungsmittel in einer Thioacetalbildung.

Selenonium-katalysierte Bromierung von Anisol.
Pale und Mamane setzen 2021 einzähnige Telluroniumsalze in Bromierungen und in einer Diels–Alder-Reaktion ein (Schema 18a)111 und untersuchten deren Lewis-Azidität in Lösung. Der ChB-Donor 37 zeigte eine starke Leistung selbst bei 1 mol % Katalysatorbeladung. Das noch Lewis-azidere Derivat 38 wurde anschließend auch in einer Povarov-[4+2]-Cycloaddition verwendet (Schema 18b).112
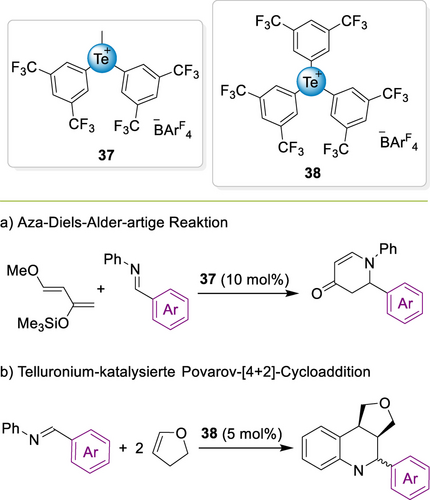
a) Telluronium-katalysierte Aza-Diels–Alder-Reaktion b) Telluronium-catalysierte Povarov-Reaktion.
Parallel hierzu bauten Gabbaï und Mitarbeiter auf ihrer Expertise in der Anionenbindung113 auf und synthetisierten die 1,2-bis(tellur)-substituierten Benzolderivate 39, in denen ein Te(II)-Zentrum das andere Te(IV)-Zentrum stabilisiert.
Offenbar in Unkenntnis der Untersuchungen von Pale und Mamane stellten sie auch die oben erwähnten Salze 37 dar. Beide zeigten hohe Aktivität in einer Wasserstofftransfer-Testreaktion (Schema 19a), und durch einen Vergleich mit den fast inaktiven nicht-methylierten Te(II)-Varianten konnte die entscheidende Rolle der Te(IV)-Zentren bestätigt werden.114 Da mit den ditellurierten Benzolen eine Dialkylierung nicht möglich war, wandten sich die Autoren einem breiteren Grundkörper zu und gelangten so schließlich zum ersten bidentaten Telluronium-ChB-Donor 40 (Schema 19b).115 Dessen Lewis-Azidität wurde mittels Chloridabtraktion aus Tritylchlorid und in Cycloisomerisierungsreaktionen mit Au−Cl- und Pt−Cl-Bindungsaktivierung analysiert.

a) Wasserstofftransfer-Testreaktion; b) Telluronium-katalysierte Cycloisomerisierung.
Schließlich sollte noch erwähnt werden, dass ein- und zweizähnige Selenonium- sowie monodentate Telluroniumspezies auch in Polymerisationsreaktionen verwendet wurden.116
4 Pniktogen- und Tetrelbrückendonoren
4.1 Pniktogenbrückendonoren
Der Begriff “PnB-Katalyse”117 wurde 2018 von Matile geprägt, im Rahmen einer systematischen Untersuchung von Lewis-Säuren der Hauptgruppenelemente mit (Pentafluor)phenylsubstituenten (Abbildung 6a).118 Die Sb-Variante 42 übertraf ChB- und XB-Donoren in einer Halogenidabstraktionsreaktion, selbst als eines der drei Pentafluorphenyle durch einen Phenylrest ersetzt wurde. Generell bietet das Vorhandensein von drei Substituenten bei Pn(III)-basierten PnB-Donoren beträchtlich mehr Manipulationsmöglichkeiten, besonders im Vergleich mit X(I)-basierten XB-Donoren.
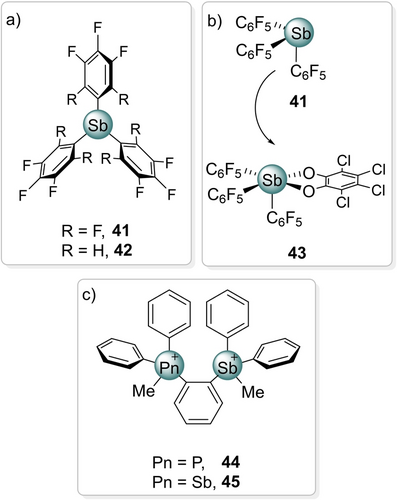
a) Matiles und b) Gabbaïs Katalysatoren c) Bidentater PnB-Donor.
Parallel hierzu hatte die Gruppe von Gabbaï die Lewis-Azidität von Organopniktogenverbindungen untersucht,119 und im Jahr 2018 berichteten sie über den Einsatz von Sb(V)-Derivaten wie 43 als Katalysatoren (Abbildung 6b). Dabei konnten sie auch zeigen, dass diese Katalysatoren die Sb(III)-basierten in Hinblick auf ihre Wirksamkeit klar übertrafen (ähnlich wie in den Fällen I(I)/I(III) und Te(II)/Te(IV)). Später erweiterte die Gruppe diese Untersuchungen auf Tetraarylstiboniumsalze120 und das zweizähnige Phosphonium/Stibonium 44 sowie den Bis(stibonium)-PnB-Donor 45 (Abbildung 6c).121 Da das Bis(stibonium) deutlich besser abschnitt als das einzähnige Analogon, wurde ein kooperativer Bindungs-/Aktivierungsmodus postuliert.
Eine interessante Adaption dieses Prinzips an Cycloisomerisierungsreaktionen ist die intramolekulare Au−Cl-Bindungsaktivierung in einem Komplex 46 von Gold mit einem bifunktionellen Phosphin/Stiboran-Liganden (Schema 20).122 Die Bedeutung der präorganisierten koplanaren Orientierung wurde durch die Inaktivität einer rotationsmäßig flexibleren Alternativstruktur bestätigt.
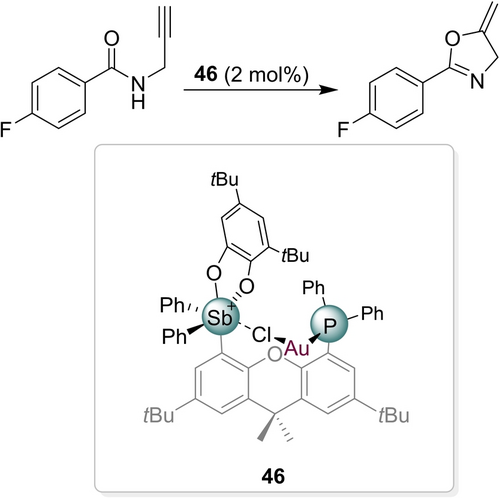
Intramolekulare Au−Cl-Bindungsaktivierung und deren Anwendung in einer Cycloisomerisierungsreaktion.
Da Sb(III)- und Sb(V)-Halogenide wohlbekannte Lewissäuren sind stellt sich natürlich die Frage, ob und wie sich die „nicht-kovalente“ PnB-Katalyse mit Organoantimonverbindungen von der klassischen „kovalenten“ Katalyse unterscheidet. Die Struktur der jeweiligen Addukte mit Lewisbasen mag ein Anhaltspunkt sein, da die kovalente Bindung an Sb(III)-Halogenide zu einer tetragonalen Struktur führen sollte, während Pniktogenbrücken in der Verlängerung der R−Sb-Bindung ausgebildet werden sollten (was zu einer anderen Geometrie führt). Spiegelt sich dies aber auch in der Katalyse wider?
Ein faszinierendes Instrument zur Erforschung dieser Fragestellung wurde von Matile vorgestellt: Epoxid-öffnende Polyethercyclisierungsreaktionen (Schema 21a).10, 123 In Vergleichsexperimenten folgen Cyclisierungen mittels klassischer Lewissäuren wie SbCl3 meist den Baldwin-Regeln, wohingegen Pniktogenbrückendonoren wie 47 überwiegend zu anti-Baldwin-Produkten führen. Obwohl das Ausmaß der anti-Baldwin-Reaktivität auch vom Fluorierungsgrad abhängt, deutet dies doch auf Selektivitätsunterschiede zwischen den beiden Arten von Katalysatoren hin. In späteren Studien wurde der Mechanismus weiter aufgeklärt124 und die Katalyse wurde auch mit einem Ionentransport durch Lipid-Doppelschichtmembranen kombiniert.11 Bei der Katalyse in solch einem hydrophoben Nanoraum wurde eine Steigerung der relativen Reaktionsgeschwindigkeit um sechs Größenordnungen beobachtet.

a) Epoxidöffnende Polyethercyclisierungsreaktionen; b) Kationische Polymerisierung.
Ähnlich zu XB und ChB wurden Sb(III)- und Sb(V)-basierte PnB-Donoren wie 41 und Tetraphenylstiboniumsalze von der Gruppe um Takagi auch bereits in kationischen Polymerisationsreaktionen eingesetzt (Schema 21b).125 Genau wie in Matiles Studie von 2018 schnitt auch hier Sb(C6F5)3 deutlich besser ab als der ChB-Donor Te(C6F5)2 und der XB-Donor IC6F5.
Über einen wichtigen Durchbruch wurde im Jahr 2021 von Tan berichtet: asymmetrische PnB-Katalyse (Schema 22).126 Ein chirales Ionenpaar (mit einem achiralen Tetraphenylstiboniumkation als PnB-Donor und einem chiralen Antimonat-Gegenion 48) agierte in einer ACDC-analogen Art und erreichte 99 % Ausbeute und 94 % ee in einer Transferhydrogenierung.
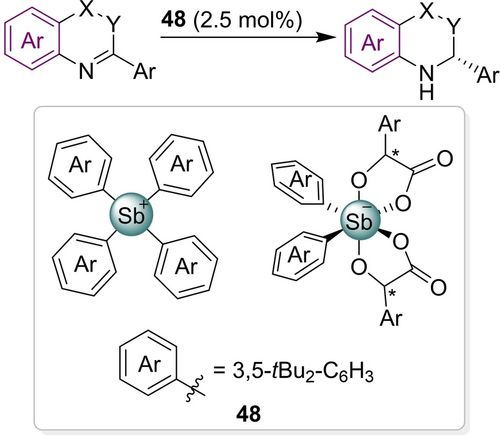
Transferhydrogenierung mit einem asymmetrischen PnB-Katalysator.
Die “PnB-Katalyse” bezog sich bisher fast ausschließlich auf elektrophile Sb-Zentren. Lewissaure Nitreniumverbindungen sind bekannt127 und wurden auch bereits in der Katalyse eingesetzt,128 und das Gleiche gilt für Phospheniumverbindungen.129 In beiden Fällen würde die Wirkungsweise wohl eher als „klassische“ kovalente Lewissäurekatalyse angesehen werden. Phosphor(V)verbindungen sind ebenfalls als Lewissäuren wohlbekannt,130 und es liegen umfangreiche Arbeiten über Phosphoniumsalze in der Organokatalyse vor.131 Während sich einige dieser Studien auf Phasentransferkatalysen beziehen, konzentrieren sich andere auf deren Lewisazidität, mit einer Pionierarbeit von Mukaiyama132 und einem wichtigen aktuelleren Beitrag von Stephan über Organofluorphosphoniumsalze wie 49 (Schema 23).133 Eine ganze Reihe von Reaktionen wurden von solchen Verbindungen katalysiert (siehe z. B. Schema 23 a–d), aber keine wurde bisher scheinbar als „PnB-Katalyse“ bezeichnet. Teilweise liegt dies sicherlich auch am erst vergleichsweise kürzlichen Aufkommen des Begriffes selbst. Angesichts der vielen Ähnlichkeiten mit Sb(V)-, Te(IV)- und I(III)-basierter Katalyse und mangels einer klaren Unterscheidung zwischen kovalenter und nichtkovalenter Aktivierung, sollten solche P(V)-Katalysen ebenfalls als PnB-Katalysen angesehen werden. Die Machbarkeit der phosphor-basierten PnB-Katalyse wurde im Übrigen auch bereits durch die Theorie bestätigt.134
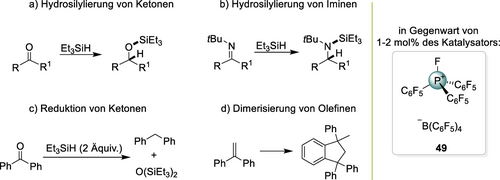
Ausgewählte Beispiele für Reaktionen, die vom Organofluorphosphoniumsalz 49 katalysiert werden.
4.2 Tetrelbrückendonoren
TB135-Donoren auf Basis von Sn und Ge wurden neben PnB-Donoren bereits bei den Polyethercyclisierungen von Matile eingesetzt,10, 123 und sie hatten dort eine deutlich geringere Aktivität gezeigt. Der größere sterische Anspruch aufgrund der vier Substituenten mag hier seinen Tribut fordern. Katalysen auf Basis der schwereren Elemente sowie mit Silylium-136 oder Carbenium-137 Spezies werden wahrscheinlich wieder als primär kovalent erachtet. Neutrale Silicium-Lewissäuren sind strukturell mit neutralem P(V) verwandt und könnten als TB-Donoren betrachtet werden, mit geeigneten Substituenten können sie aber auch Lewis-Superazidität erreichen.138 Wiederum ist die Klassifizierung komplex und diese Thematik soll hier nicht weiter diskutiert werden. Stattdessen konzentrieren wir uns auf die eine Wechselwirkung, die klar nichtkovalent ist: Kohlenstoffbrücken.139 Aufgrund der Häufigkeit und der Bedeutung von Kohlenstoff in der Organischen Chemie wurde vorgeschlagen, die Bezeichnung “Kohlenstoffbrücken” als unabhängigen Begriff neben dem Namen „Tetrelbrücken“ einzuführen (als komplementäres Gegenstück zu Wasserstoffbrücken).140
Obwohl diese Argumentation stichhaltig ist, werden wir diese NCI hier doch als Variante des allgemeinen Begriffs (TB) aufführen, um mit der Namensgebung der anderen Wechselwirkungen kongruent zu bleiben.
Wang hat zwei Pionierarbeiten zum Einsatz von Kohlenstoffbrücken in der Organokatalyse beigetragen. Im Jahr 2021 zeigte er, dass der sorgfältig optimierte TB-Donor 50 (Schema 24a) eine Michael-Addition förderte,141 während Derivate ohne Estergruppen inaktiv waren. Die breite Anwendbarkeit des Organokatalysators 50 wurde anschließend in verschiedenen Benchmarkreaktionen gezeigt, inklusive einer schwierigen Terpencyclisierung. Co-Kristalle mit Lewisbasen und Titrationen unterstützten einen auf TB/Kohlenstoffbrücken beruhenden Aktivierungsmodus. Später wurden strukturell ähnliche TB-Donoren wie 51 in Cycloisomerisierungsreaktionen zur Aktivierung einer Au−Cl-Bindung eingesetzt, ähnlich wie dies bereits oben besprochen worden war (Schema 24b).142 In mehreren Reaktionen wurde im Vergleich zu Aktivatoren wie AgOTf eine stark erhöhte Selektivität zugunsten des Hauptprodukts beobachtet. Da weitere Berichte fehlen, steckt die Organokatalyse mit Kohlenstoffbrücken derzeit eindeutig noch in den Kinderschuhen.
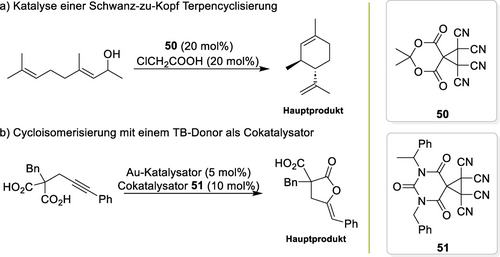
Anwendungen der TB-/Kohlenstoffbrückendonoren 50 und 51.
5 Zusammenfassung
Die Zeiten, als HB das Gebiet der nichtkovalenten Organokatalyse dominiert haben, sind inzwischen seit einiger Zeit vorbei. Nach einem langsamen Beginn in den frühen 2010ern mit den ersten Anwendungen von XB in Lösung143 sind neue NCIs nun zu Routinewerkzeugen für die Konstruktion nichtkovalenter Katalysatoren geworden. Im Gegensatz zu HB bieten die meisten Wechselwirkungen zwei Oxidationsstufen des donierenden Elements an, sowie mehrere Substituenten, was viel Raum für strukturelle Variationen lässt. Das ist ein klarer Vorteil gegenüber den allgegenwärtig eingesetzten HB, und erste Fälle illustrieren, dass es vorteilhaft sein kann, sich vom am häufigsten verwendeten (d. h. dem am stärksten polarisierbaren) Element der jeweiligen Gruppe zu entfernen (siehe z. B. Schema 9). Außerdem deutet die zunehmende Zahl an Berichten zur π-Aktivierung durch alle hier vorgestellten NCIs an, dass diese in der Tat als „weichere“ nichtkovalente Wechselwirkungen (im Vergleich zu den vergleichsweise „harten“ HB) angesehen werden können. Dies sollte die Erschließung weiterer Klassen an Substraten für die nichtkovalente Organokatalyse erlauben.
Die XB- und ChB-Organokatalyse hat klar den Bereich der Machbarkeitsstudien verlassen, und zunehmend komplexere NCI-Donoren und Anwendungen werden vorgestellt. PnB holen schnell auf, während TB immer noch in einer frühen Phase sind, und es ist unklar, ob sie eine Art Kuriosität bleiben werden. Das allerdings wurde vor 15 Jahren auch über die XB-Organokatalyse gesagt … ;-)
In dem Maße, wie sich die Anwendungen weiter in Richtung PnB und TB verschieben, beginnen auch die Grenzen zwischen nichtkovalenter Katalyse und „kovalenter“ Lewissäurenkatalyse zunehmend zu verwischen. Wann ist es gerechtfertigt, einen Katalysemodus als PnB oder TB zu bezeichnen? Natürlich wird zwischen den beiden Extremen nie eine klar definierte Grenze existieren – die nichtkovalente Bindungsstärke hängt dazu zu sehr von den Wechselwirkungspartner und der spezifischen Umgebung ab. Es gibt eine breite Palette an Fällen zwischen kovalenter und nicht-kovalenter Bindung, beispielsweise kurze/starke HB oder N−I−N-artige XB.144 Ein präziser Grenzwert (z. B. im Hinblick auf Bindungsstärken) würde wahrscheinlich einige solcher Wechselwirkungen ausschließen, obwohl viele sie gegenwärtig als Teil der allgemeinen Klasse von NCIs ansehen. In Ermangelung einer klaren Unterscheidung schlagen wir stattdessen für Grenzfälle vor: a) bei Metallen, die auch als „klassische“ Lewissäuren bekannt sind, besonders sorgfältig zu sein; b) das Vorhandensein eines Merkmals oder eines Verhaltens, das mit anderen NCIs in einem Zusammenhang steht, als Kriterium zu verwenden (z. B. Reversibilität bei der Adduktbildung oder ähnliche strukturelle Motive); und c) im Zweifelsfall großzügig zu sein.
Warum ist die Namensgebung überhaupt relevant? Jeder, der schon einmal versucht hat, frühe Beispiele von XB und ChB zu finden, bevor der jeweilige Begriff geprägt worden ist, kann den Wert einer einheitlichen Nomenklatur bezeugen. Ein gemeinsamer Name kann auch zu Inspirationen aus anderen Fällen führen, die auf den ersten Blick nicht verwandt erscheinen. Abgesehen von der Frage der Namensgebung: ist die PnB- und TB-Katalyse einzigartige oder stellt sie eine schwache Variante der klassischen Lewissäurekatalyse dar? Werden wir eine zunehmende Zahl an einzigartigen Selektivitäten mit NCI-Organokatalysatoren erleben? Das wird nur die Zeit zeigen, aber für alle vier Wechselwirkungen gibt es mit Sicherheit noch eine Fülle an Möglichkeiten.
Danksagung
Die Autoren danken allen gegenwärtigen und früheren Mitarbeitern für ihre Beiträge zu diesem Forschungsbereich. Unsere Forschung wird von der Deutschen Forschungsgemeinschaft (DFG) im Rahmen der deutschen Exzellenzstrategie (EXC 2033 – 390677874 – RESOLV) gefördert. Wir danken ebenso Prof. Máté Erdélyi (Universität von Uppsala) für aufschlussreiche Diskussionen. Open Access Veröffentlichung ermöglicht und organisiert durch Projekt DEAL.
Interessenkonflikt
Die Autoren erklären, dass keine Interessenkonflikte vorliegen.
Open Research
Data Availability Statement
Die Bereitstellung von Daten entfällt, da für diese wissenschaftlichen Publikation keine neuen Daten erzeugt oder analysiert wurden.
Biographical Information
Dragana Jovanovic erwarb ihren B.Sc.– und M.Sc.-Abschluss in Chemie an der Universität von Belgrad - Fakultät für Chemie. Seit 2022 promoviert sie in der Gruppe von Prof. Huber an der Ruhr-Universität Bochum. Der Schwerpunkt ihrer Arbeit liegt auf der Synthese von Iod(III)-basierten Halogenbrückendonoren und deren Anwendung in der Organokatalyse.
Biographical Information
Meghana Poliyodath Mohanan schloss ihr Studium der Chemie am Indian Institute of Science Education and Research (IISER), Berhampur, im Jahr 2022 ab. Zurzeit promoviert sie unter der Leitung von Prof. Huber. Ihre aktuelle Forschung konzentriert sich auf die Synthese und Anwendung von Iod(I)-basierten Halogenbrückendonoren.
Biographical Information
Stefan M. Huber promovierte im Jahr 2007 bei Prof. Robert Weiss. Nach Postdoc-Aufenthalten an der University of Minnesota und der Universität Genf begann er 2009 seine eigenständige Karriere an der TU München. Seit 2014 ist er Professor für Organische Chemie an der Ruhr-Universität Bochum. Seine Gruppe untersucht Halogen- und Chalkogenbrücken in Lösung.







