Eine Alkin-verbrückte kovalent organische Gerüstverbindung mit interaktiven Bindungstaschen für das Einfangen von Brom
Abstract
Die hohe Korrosivität und Reaktivität von Brom, welches aus verschiedenen Quellen freigesetzt wird, stellt eine ernsthafte Gefahr für die Umwelt dar. Darüber hinaus erfordert seine Koexistenz mit Iod und die daraus resultierende Gleichgewichtsverbindung Iodmonobromid (IBr) die selektive Abtrennung von Brom aus Halogengemischen. Die Elektrophilie von Halogenen gegenüber π-elektronenreichen Strukturen ermöglichte uns die strategische Entwicklung einer kovalent organischen Gerüstverbindung für die Halogenaufnahme, die eine definierte Porenumgebung mit lokalisierten Sorptionsstellen aufweist. Die um ~41 % höhere Aufnahmekapazität von Brom (4,6 g g−1) gegenüber Iod zeigt das Potenzial für die selektive Aufnahme. Die spektroskopischen Ergebnisse, welche die bevorzugten Wechselwirkungsstellen aufzeigen, werden durch theoretische Untersuchungen gestützt. Die Alkin-Brücke ist eine Kernfunktionalität, die die Selektivität bei der Aufnahme durch synergistische Physisorption fördert, was durch die höhere Orbitalüberlappung von Brom aufgrund seiner geringeren atomaren Größe, sowie durch reversible chemische Wechselwirkungen begründet ist. Das sogenannte „slip stacking“ in der Struktur hat dieses Phänomen weiter gefördert, indem Cluster molekularer Interaktionsstellen mit zwischen den Schichten eingelagertem Brom geschaffen wurden. Die Einführung ungesättigter Einheiten, d. h. Dreifachbindungen, und die komplementäre Porengeometrie bieten eine vielversprechende Designstrategie für die Konstruktion poröser Materialien für die Halogenaufnahme.
Einleitung
Halogene haben eine schädigende Auswirkung auf die Umwelt und verursachen durch die Oxidation organischer und anorganischer Verbindungen in der Troposphäre einen Abbau der Ozonschicht.1 In den Polarregionen ist die Bildung reaktiver molekularer Halogene ein weit verbreitetes Phänomen.2 Diese Halogene reagieren insbesondere mit Ozon durch eine heterogene Reaktionssequenz, welche als sogenannte „Halogenexplosion“ bekannt ist.3 Dies steht vor allem im Zusammenhang mit der Freisetzung von Schadstoffen aus verschiedenen industriellen Quellen, die erhebliche Mengen an Brom und Iod enthalten (Halone).4 Brom kann in der Troposphäre photokatalytisch gespalten werden und bildet freie BrO-Radikale, die bereits bei ppb-Konzentrationen das gesamte lokale Ozon abbauen können.5 Darüber hinaus ist Brom im Gegensatz zu Iod toxisch, welches in Spuren für die menschliche Gesundheit nützlich ist und für das ordnungsgemäße Funktionieren der Schilddrüse benötigt wird.6 Die Toxizität, Korrosivität, Reaktivität und Flüchtigkeit von Brom stellen eine beträchtliche Herausforderung dar. Die Quelle dieser reaktiven Bromspezies ist in erster Linie auf marine Aerosole7 aus Meersalz und Meeresorganismen zurückzuführen. Bromhaltige Salze werden auch bei der Kohleverbrennung eingesetzt,8 um giftige Quecksilberdampfemissionen durch Umwandlung in leicht entfernbares Quecksilberbromid zu verringern. Brom wird auch in Flammschutzmitteln, in der Landwirtschaft, in der Produktion von Feinchemikalien und in pharmazeutischen Betrieben verwendet.9 Die negativen Auswirkungen auf das Ökosystem und der steigende Brombedarf der Industrie erfordern Maßnahmen. Daher ist die Entwicklung geeigneter Materialien für die Abscheidung, die Lagerung und den Transport solcher flüchtiger Bromverbindungen von größter Bedeutung. Systeme, die auf adsorptiver Aufnahme beruhen, haben einen Vorteil gegenüber den traditionellen, langwierigen industriellen Verfahren der Wasserdampfdestillation,10 da sie weniger Energie verbrauchen und auch wesentlich einfacher zu handhaben sind. Die Fortschritte bei der Entwicklung poröser Materialien für die wirksame Aufnahme von Halogenen haben uns mehrere Prinzipien für die Gestaltung der Materialien und die zugrunde liegenden Mechanismen aufgezeigt, obgleich sich die meisten der umfangreichen Studien hauptsächlich mit Iod befassen11, 12, 13-15
Die Entwicklung von Materialien für die Aufnahme von Brom wird hauptsächlich durch die Oxidationsfähigkeit von Brom begrenzt, die wesentlich höher ist als die von Iod. Das Vorhandensein selektiver Bindungsstellen und eines stark konjugierten Systems, das die Bildung von Ladungstransferkomplexen ermöglicht,16, 17 ist entscheidend für eine hohe Aufnahmekapazität, wie es bereits für Materialien zur Iod-Aufnahme festgestellt wurde. Aufgrund der hohen Reaktivität und des ätzenden Charakters von Brom ist die Affinität selektiver Bindungsstellen zu Brom stark erhöht, was zu struktureller Zersetzung oder chemischen Reaktionen führen kann.18 Abgesehen davon hängt die Diffusion von Brom zu den Wechselwirkungsstellen von der Porenstruktur und der Porosität des porösen Materials ab. In jüngster Zeit wurden organische Käfige für die Bromabscheidung verwendet, die jedoch im Allgemeinen löslich sind, was das Recycling eines Großteils des Materials zur Wiederverwendung bei der Abscheidung aus der Lösung erschwert.16, 19 Im Fall poröser aromatischer Gerüstverbindungen (porous aromatic frameworks, PAFs),20 einer Klasse amorpher modularer Materialien mit intrinsischer Porosität, ist der Diffusionsweg im Vergleich zu retikulären Materialien nicht sehr ausgeprägt, was diffusionsgetriebene Trennungen erschwert.21 Metallorganische Gerüstverbindungen (metal–organic frameworks, MOFs), eine Klasse einstellbarer poröser Materialien, die aus organischen Linkermolekülen aufgebaut sind, welche durch koordinative Bindungen mit Metallclustern verbunden sind, wurden für die Aufnahme von Brom untersucht. Jedoch erschwert die geringe Stabilität dieser Materialien gegenüber korrosiven Gasen ihre Anwendung.17 Im Vergleich dazu sind geschichtete kovalent organische 2D-Gerüstverbindungen (covalent organic frameworks, COFs),22 eine Klasse kristalliner 2D-Polymere, die durch kovalente Bindungen miteinander verbunden sind, stabiler,23 können harschen Bedingungen widerstehen,24 sind strukturell einstellbar und verfügen über 1D-Kanäle, die die Diffusion des Broms zu den Adsorptionsstellen leiten.
Um die Auswirkungen der strukturellen Merkmale zu untersuchen, die die Aufnahme von Brom beeinflussen, haben wir in diesem Beitrag ein Alkin-verbrücktes, Iminverknüpftes 2D-geschichtetes COF untersucht, das sogenannte TAEDP-TA-OMe (mit TAEDP=4,4′,4′′,4′′′-(Pyren-1,3,6,8-tetrayltetrakis(ethin-2,1-diyl))tetraanilin und TA-OMe=2,5-Dimethoxyterephthalaldehyd). Da frühere Studien bereits über die Adsorption von Iod an (lokal elektronenreichen) N-Stellen berichten,25 bestand die primäre Strategie darin, ausreichend elektronenreiche Stellen für die effiziente Aufnahme bereitzustellen, die dem Material durch die π-Konjugation in der Struktur, die Iminbindungen und die C−C-Dreifachbindungen verliehen werden.26 Außerdem ist der Alkin-Teil sehr stabil,27 was die Effizienz in der folgenden Anwendung fördert. Da Brom häufig mit Iod gemischt wird oder sogar eine interhalogene Verbindung IBr bildet,28 haben wir auch die Selektivität für die Bromaufnahme aus gemischten Lösungen untersucht. Besonderes Augenmerk haben wir auf das Verständnis des Bromaufnahmemechanismus gelegt, der mit verschiedenen spektroskopischen und rechnerischen Methoden im Detail untersucht wurde.
Synthese und Charakterisierung
Die Pyren-Einheit wurde, als hochgradig elektronenreiche und planar aromatische Einheit,29 als zentrales Strukturmerkmal in unserem COF verwendet. Rationale Designstrategien wurden angewandt, um ein COF mit zusätzlichen Alkinbindungen30 namens TAEDP-TA-OMe durch Solvothermalsynthese herzustellen (siehe Tabelle S1 in den unterstützenden Informationen), was ein kastanienbraunes Pulver ergab. Die Kristallinität des Materials wurde durch Pulverröntgendiffraktometrie (PXRD) verifiziert und durch Modelle und Simulationen wurde ein Strukturmodell für das 2D-geschichtete COF abgeleitet (Abbildung 1e, S1). Das Modell zeigt eine leichte Verschiebung von 4,65 Å (AA′) (Abbildung 1c, S2) zwischen benachbarten Schichten, die auch in früheren Studien für vergleichbare Materialien beobachtet wurde.31, 32 Im Gegensatz dazu passt ein verdecktes Strukturmodell mit AA-Stapelung benachbarter Schichten (Abbildung S3) jedoch nicht gut zu dem experimentell erhaltenen Röntgen-Pulverdiffraktogramm (Abbildung 1e). Darüber hinaus werden in HRTEM (Hochauflösende Transmissions-elektronenmikroskopie) Aufnahmen (Abbildung 1g, S4) Gitterlinien mit einem Abstand von 1,88 nm beobachtet, die zu dem entsprechenden Beugungspeak bei 2θ=9,3° passen und mit dem AA′-verschobenen Modell übereinstimmen (Abbildung 1e). Das Fehlen eines Reflexes bei diesem Winkel für die simulierte AA-Struktur bestätigt die vorgeschlagene Modellstruktur weiter. Das experimentelle PXRD-Muster zeigt einen intensiven ersten Reflex bei 2θ=3,68° (100), gefolgt von Reflexen geringer Intensität bei 6,32°, 7,45°, 10,16° und der bei ~24,74° (001) beobachteten Schichtstapelung (Abbildung 1e). Darüber hinaus stimmt die deutlich geringere Gesamtmenge des bei 77 K in der TAEDP-TA-OMe-Struktur adsorbierten N2 im Vergleich zu ähnlichen COF-Strukturen33 mit dem vorgeschlagenen Strukturmodell überein.
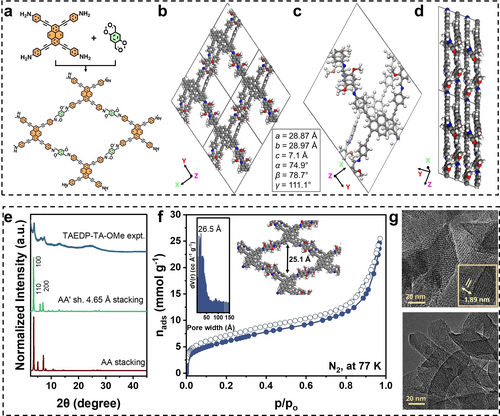
(a) Chemische Struktur des synthetisierten TAEDP-TA-OMe COF. (b) Darstellung der geometrisch optimierten Modellstruktur des COFs entlang der z-Achse. (c) Vorgeschlagene Einheitszelle nach einer Verschiebung von 4,65 Å zwischen benachbarten Schichten,32, 34 zur besseren Veranschaulichung wurde die untere Schicht hellgrau eingefärbt. (d) Ansicht der Struktur entlang der x-Achse, die die Verschiebung zwischen den beiden benachbarten Schichten zeigt. C, H, O und N sind jeweils in Grau, Weiß, Rot und Blau dargestellt. (e) Vergleich des experimentellen Pulverröntgendiffraktogramms mit den Diffraktogrammen, die anhand der vorgeschlagenen Strukturmodelle simuliert wurden, was die Übereinstimmung mit der verschobenen AA′-Stapelstruktur bestätigt. (f) Bei 77 K gemessene N2-Physisorptionsisotherme (die ausgefüllten und leeren Symbole stellen den Ad- bzw. Desorptionszweig dar. Die Linien, die die Messpunkte verbinden, haben keine physikalische Bedeutung und sind aus Gründen der Klarheit hinzugefügt wurden), Einschub: Porengrößenverteilung des COFs, extrahiert mit der NLDFT-Methode. (g) HRTEM-Bilder, die die Gittersäume der kristallinen COF hervorheben.
Die Bildung des COFs wurde auch durch Fourier-transformierte Infrarotspektroskopie (FTIR) und kreuzpolarisiertes „magic angle spinning“ 13C NMR (CP-MAS 13C NMR) nachgewiesen, die die Bildung der Iminbindung (Abbildung S5a, S6b) und den Verbrauch der Ausgangsstoffe durch das Fehlen von Signalen, die den Amin- und Aldehydgruppen zugeordnet werden können, zeigen. Nach Aktivierung des COFs durch Soxhlet-Extraktion und Trocknung bei 60 °C zeigt das Material eine für mesoporöse Strukturen charakteristische N2-Physisorptionsisotherme (bei 77 K) mit einer Brunauer–Emmett–Teller-Oberfläche (BET) von 498 m2 g−1 (Abbildung 1f, Abbildung S7a). Die Feldemissions-Rasterelektronenmikroskopie (FESEM) und die HRTEM-Mikroskopie (Abbildung 1g, S8, S9) zeigen das Vorhandensein von Kristalliten mit definierten Formen und Gitterlinien.
Die thermogravimetrische Analyse deutet darauf hin, dass die TAEDP-TA-OMe-COF in einer Argon-Atmosphäre Temperaturen von etwa 357 °C standhalten können (Abbildung S5b).
Selektivität bezüglich der Aufnahme von Brom
TAEDP-TA-OMe weist π-konjugierte Struktureinheiten mit ausreichend elektronenreichen Zentren auf, die potenziell Bindungsstellen für Halogene bieten. Aufgrund dieser interessanten Strukturmerkmale wurde die Bromaufnahme im COF durch statische Messungen mit Bromdampf (Abbildung S10a) (Dampfdruck von Brom=0,285 bar) bei 298 K und Umgebungsdruck untersucht. Es zeigt eine signifikante Aufnahme von 4,6 g g−1 (Abbildung 2a) nach Erreichen des Gleichgewichts nach ~4 Stunden Exposition. Dies ist fast 1,5-Mal höher als die theoretische Aufnahme aufgrund der Porosität (Dichte des Broms (3,1 g cm−3)×Porenvolumen (0,93 cm3 g−1)=2,88 g g−1). Das Material konnte leicht zurückgewonnen werden, indem es Hitze und Vakuum ausgesetzt wurde (Abbildung S19, weitere experimentelle Details in den unterstützenden Informationen). Nach der Rückgewinnung wurde es weiteren fünf Zyklen der Brom-Ad- und Desorption unterzogen (Abbildung S20), wobei ~89 % der ursprünglichen Kapazität erhalten blieben. Zum Vergleich wurde durch iodometrische Titration des aus dem COF zurückgewonnenen Broms eine Aufnahme von 3,8 g−1 ermittelt (Abbildung S10b). Um die Aufnahme von Brom aus Lösungen zu untersuchen, wurde eine 2 mM-Bromlösung in Cyclohexan hergestellt, danach wurde das COF in diese Lösung gegeben (mit einer Konzentration von 1 mg COF pro 3 mL Lösung, siehe unterstützende Informationen für weitere Details) und die Absorption wurde über die Zeit durch UV/Vis-Spektroskopie überwacht. Innerhalb von 90 Minuten dieses Experiments werden ~60 % des Broms aus der Lösung abgeschieden, was zu einer Konzentration von ~0,05 mM führt, was einer 3,6-fachen Abnahme der Absorptionswerte am Ende des Experiments entspricht (Abbildung 2b).
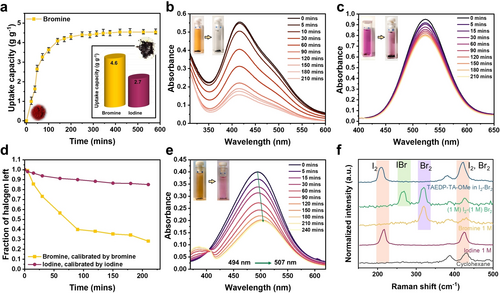
(a) Statische Aufnahme von Brom durch TAEDP-TA-OMe COF zusammen mit dem Farbwechsel von kastanienbraun zu schwarz nach der Aufnahme, die Fehlerbalken geben die Abweichungen von drei parallelen Messungen an, Inset: Vergleich der statischen Aufnahmekapazitäten von Iod und Brom. (b) Zeitabhängige UV/Vis-Messung, die die Aufnahme von Brom aus einer 2 mM-Lösung in Cyclohexan durch das COF zeigt, was zu einer Entfärbung der Lösung nach dem Experiment führt. (c) Zeitabhängige UV/Vis-Messung, die die Aufnahme von Iod aus einer 2 mM-Lösung in Cyclohexan zeigt und die teilweise Entfernung von Iod aus der Lösung belegt. (d) Vergleich des Anteils der in der Lösung verbliebenen Halogene nach den Experimenten zur Aufnahme von Iod und Brom in Lösung. Die Linien, die die Messpunkte verbinden, stellen nur eine visuelle Hilfe dar und haben keine physikalische Bedeutung h. (e) Die zeitabhängige UV/Vis-Messung, die die Aufnahme von I2 und Br2 aus einer gemischten Lösung zeigt, zeigt einen Farbwechsel von Orange zu Rosa zusammen mit der Verschiebung des λmax. (f) Raman-Spektren der Lösungen, gemessen bei 514 nm, zeigen die Entfernung der Halogene aus der Lösung nach den Aufnahme Experimenten.
Die Iodaufnahme aus den statischen Messungen zeigt eine deutlich geringere Aufnahme von 2,7 g g−1 (Abbildung 2a, S13) bei Sättigung, verglichen mit 4,6 g g−1 für Brom. Dies deutet darauf hin, dass mit diesem Gerüst eine Trennung von Iod und Brom möglich ist. Daher wurde die Abtrennung von Iod (2 mM) in Lösung analog zur Abtrennung von Brom durchgeführt (Abbildung 2c). Es wurde festgestellt, dass die Iodkonzentration in der Lösung nach 3,5 Stunden 1,73 mM beträgt, was auf eine geringere Kinetik der Iodaufnahme aus der Lösung sowie auf eine geringere Affinität des Materials gegenüber Iod hindeutet. Dies könnte auf die vergleichsweise geringe Porosität (und das Porenvolumen)13 des Materials zurückzuführen sein. Das kinetische Modell pseudo-zweiter Ordnung passt sowohl für die Iod- als auch für die Bromaufnahme gut, da der Korrelationskoeffizient höher ist als bei dem Modell pseudo-erster Ordnung (Abbildung S14 und S15). Das EDX-Mapping der Probe nach den Aufnahme Experimenten zeigt auch qualitativ eine höhere Menge an Brom im Vergleich zu Iod und weist eine gleichmäßige Verteilung der Halogene in den Proben auf (Abbildung S16, S17).
Wenn wir die in der Lösung verbliebene Menge an Iod und Brom vergleichen (Abbildung 2d), stellen wir fest, dass die Iodaufnahme aus der Lösung nach ca. 50 Minuten fast stagniert und 85 % Iod in der Lösung verbleiben, während am Ende des Experiments nur noch 25 % Brom vorhanden sind. Daher haben wir Selektivitätstests in der Flüssigphase durchgeführt, indem wir ein Äquivolumen-Gemisch aus den 2 mM Br2 und 2 mM I2 Lösungen herstellten, COF zu diesem Gemisch hinzufügten und anschließend die Veränderung der UV/Vis-Spektren über die Zeit beobachteten. Dabei zeigt sich die höchste Absorption bei einem λmax von 494 nm, was zunächst dem Gemisch aus Br2 und I2 entspricht (Abbildung 2e). Dieser Wert verschiebt sich bis zum Ende des Experiments auf 507 nm, was ungefähr dem λmax von Iod entspricht. Dies deutet darauf hin, dass das Brom bevorzugt aufgenommen wurde und die verbleibende Lösung hauptsächlich Iod enthält. Da in Iod- und Brommischungen auch eine Interhalogenverbindung (IBr) gebildet wird, ist es von entscheidender Bedeutung, die Möglichkeit der Koexistenz von Br2, I2 und IBr35, 36 in der Lösung und die Fähigkeit des Materials, IBr einzufangen, zu analysieren. Um dies zu beurteilen, wurden Raman-Spektren für die einzelnen Iod- und Bromlösungen sowie für das äquimolare Iod-Brom-Gemisch und das Iod-Brom-Gemisch nach Einwirkung des COFs aufgenommen (Abbildung 2f). Nach der Äquilibrierung des TAEDP-TA-OMe COF in der äquimolaren Iod-Brom-Lösung beobachten wir, dass die I2-Signale bei 216 cm−1 und 426 cm−1 erhalten bleiben (Abbildung 2f, oberste Kurve, blau), während die Br2- (320 cm−1) und IBr-Signale (268 cm−1) fehlen.36 Dies ist ein bemerkenswerter Nachweis für die Fähigkeit des Materials, selektiv Brom aus einer gemischten Lösung von Iod und Brom einzufangen.
Um den Mechanismus der selektiven Bindung zu veranschaulichen und die Wechselwirkungsstellen von Brom und Iod innerhalb des COF-Skeletts zu klären, wurden verschiedene spektroskopische Techniken verwendet. Die Raman-Spektroskopie zeigt das Verschwinden der Schwingung der C−C-Dreifachbindung bei 2191 cm−1 ausschließlich nach der Aufnahme von Brom (Abbildung 3d), was auf eine starke Beteiligung der Alkinbrücke bei der Aufnahme von Brom hindeutet, im Gegensatz zu Iod, wo dieses Signal intakt bleibt. Dies wird auch durch die Fourier-Transform-Infrarot-Spektroskopie (FTIR) bestätigt, die die starke Wechselwirkung des Halogens mit der Alkinbindung zeigt, da mit der Bromaufnahme das Verschwinden der −C≡C−Schwingung bei 2179 cm−1 einhergeht.
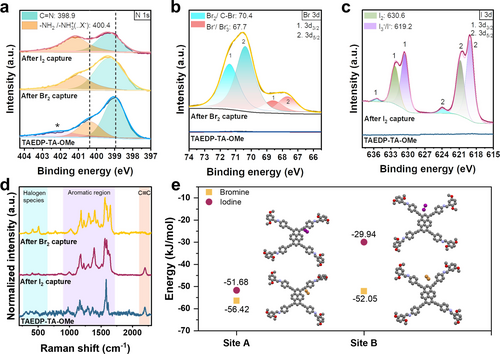
(a) Vergleich der XPS-Spektren der N 1s-Region für das COF vor und nach der Halogaufnahme. Das * steht für die Anwesenheit der quaternisierten NH3+-Spezies. Hinweis: Die in der Abbildung angegebenen Bindungsenergien für die einzelnen Funktionen entsprechen der Position des Peaks im unveränderten COF. (b) Vergleich der XPS-Spektren des Br 3d-Bereichs für das COF vor und nach der Bromaufnahme. (c) Vergleich der XPS-Spektren des I 3d-Bereichs für das COF vor und nach der Iodaufnahme. (d) Vergleich der bei 640 nm gemessenen Raman-Spektren, die die strukturellen Veränderungen im COF nach Halogenaufnahmeexperimenten zeigen. (e) Energieminimierte Positionen von Brom und Iod in der TAEDP-TA-OMe-Struktur an den beiden Stellen nahe den Alkinbindungen, die eine bevorzugte Wechselwirkungsenergie mit Brom zeigen.
Dies kann auf die höhere Orbitalüberlappung des Broms mit der Dreifachbindung aufgrund der geringeren Atomgröße im Vergleich zum Iod zurückgeführt werden. Parallel dazu ist eine gleichzeitige Zunahme der Intensität in den Raman-Spektren bei 1644 cm−1 und 410 cm−1 zu beobachten, die der −C=C-Schwingung bzw. der −C−Br-Schwingung entsprechen. Dies deutet auf die Umwandlung der Dreifachbindung in eine Doppelbindung mit Bromsubstituenten hin, die nach der Rückgewinnung des Materials abgeschwächt wird, was auf eine reversible Chemisorption schließen lässt (Abbildung S23). Aus den FTIR-Spektren geht auch eine Blauverschiebung der Imin-Streckschwingungen von 1617 cm−1 zu 1629 cm−1 hervor, was auf eine weitere mögliche Wechselwirkungsstelle für die Halogene hinweist (Abbildung S29b).15, 37 Zum Vergleich haben wir die Aufnahmeexperimente auch mit einem COF mit ähnlichem Grundgerüst ohne Dreifachbindung, nämlich TAP-TA-OMe, durchgeführt (Abbildung S33). Die Aufnahmekapazität für Brom und Iod unter statischen Bedingungen beträgt 3,4 g g−1 bzw. 3,0 g g−1. Dieser geringe Unterschied in der Aufnahme ist auch bei den Aufnahmeexperimenten in der Lösungsphase zu beobachten, was auf eine fehlende Aufnahmeselektivität schließen lässt (Abbildung S34) und die Rolle der Dreifachbindung bestätigt.
Um die Bindungsstellen und den Zustand des eingefangenen Broms besser zu verstehen, wurden Röntgenphotoelektronen-spektroskopie (XPS) Messungen durchgeführt. Die XPS-Spektren deuten auf eine aktive Beteiligung der Iminbindung an der Bindung beider Halogene hin. Dies wird durch das Vorhandensein eines asymmetrischen Peaks in der N 1s-Region für das unbehandelte COF deutlich, dessen Intensität in den halogenbehandelten COFs zunimmt. Das Signal kann dekonvolutiert und der Iminbindung (−C=N−) bei 398,9 eV und nicht umgesetzten oder an der Oberfläche befindlichen Aminen bei 400,4 eV zugeordnet werden, die bei der XPS-Messung aufgrund ihrer Oberflächenempfindlichkeit überrepräsentiert sein könnten. Beide Signale verschieben sich nach den Halogenaufnahmeexperimenten zu höheren Bindungsenergien von 399,3 eV und ~401,3 eV, was die Wechselwirkung der Halogene mit der Iminbindung bestätigt (Abbildung 3a). Die Verschiebung des Aminsignals kann auf die Coulomb-Wechselwirkung zurückgeführt werden, die mit der Quaternisierung des Amins zu -NH3+ (begleitet von der Bildung von X−: Br−/I−)38 oder der Bildung von Ladungstransferkomplexen einhergeht.14 Aus den Berechnungen der Dichtefunktionaltheorie (DFT) zur Bestimmung der bevorzugten Adsorptionsstellen von Brom und Iod geht außerdem hervor, dass die stärkste Wechselwirkung von Brom und Iod an der Iminbindung (Stelle C) stattfindet, die die niedrigsten Adsorptionsenergien von −76,42 kJ/mol bzw. −67,11 kJ/mol aufweist (Abbildung S25). Die O 1s- und C 1s-Spektren aus den XPS-Messungen zeigen beide Verschiebungen der Hauptsignale nach der Bromaufnahme, was auf eine Wechselwirkung des adsorbierten Broms mit der Kernstruktur des COF hindeutet (Abbildung S22). Dies könnte auf die Bindungstasche zurückzuführen sein, die durch die -C−O-Bindung von einer Schicht zum C≡C− in der benachbarten Schicht aufgrund der Verschiebung zwischen den Schichten (Abbildung 1c) in der vorgeschlagenen Struktur entsteht. Dies ist auch an dem Verlust der Kristallinität nach den Aufnahmeexperimenten zu erkennen, der durch die Einlagerung der Halogene zwischen den Schichten verursacht werden könnte, was zu einem Verlust der Stapelung führt,39 die durch die anschließende Entfernung der Halogene teilweise wiederhergestellt wird (Abbildung S29a). Die Wechselwirkungsstelle der Halogene an der Alkinbrücke hat zwei mögliche Orientierungen, wie aus den DFT-Berechnungen hervorgeht (Abbildung S25), deren Energie höher ist als die der Iminstelle. Die berechneten Wechselwirkungsenergien an den Dreifachbindungen zeigen eine signifikante Wechselwirkung von Brom im Vergleich zu Iod (Abbildung 3e). Das σ*-Orbital der Halogene kann mit den π-Elektronen des Alkins in Wechselwirkung treten, was auch aus der vorhergesagten kolinearen Ausrichtung der Halogene am Standort A hervorgeht, wo der Abstand der Wechselwirkung von Brom (2,84 Å) geringer ist als der von Iod (3,04 Å), was auf eine stärkere Wechselwirkung mit Brom hindeutet (Abbildungen S26 und S27). Die chemisorptive Wechselwirkung wurde auch durch DFT-Berechnungen aufgeklärt, die die Möglichkeit einer selektiven elektrophilen Substitution von Brom in den trans-Positionen der Alkinbrücke mit einer Adsorptionsenergie von −168,63 kJ/mol zeigt (Abbildung S28). Dies untermauert die Wechselwirkungsstellen im COF und folglich auch die Verbesserung der Bromadsorption.
Aus den XPS-Spektren geht hervor, dass sich das eingefangene Brom einerseits im Br3−/Br−-Zustand befindet, wie aus dem Br 3d-Spektrum bei 67,7 eV hervorgeht. Der zweite Peak bei 70,4 eV kann dem als Br2 adsorbierten Brom sowie etwas chemisorbiertem −C−Br zugeordnet werden (Abbildung 3b). Dies ist auch aus den Raman-Spektren ersichtlich, da Polybromide bei 192 cm−1 sowie ein Signal bei 410 cm−1 sichtbar sind, das der C−Br-Bindung zugeordnet werden kann (Abbildung S21a). Die Raman-Spektren des COFs nach Entfernung des Broms (Abbildung S23) zeigen die reversible Rückkehr der Schwingung für die −C−C-Dreifachbindungen bei 2200 cm−1. Bei der Iodaufnahme sehen wir das Vorhandensein von physisorbiertem I2, Iodiden oder Polyiodiden40 (Abbildung 3c, S21b). Diese Ergebnisse deuten darauf hin, dass die Bromaufnahme auf eine Kombination mehrerer Effekte zurückzuführen ist, hauptsächlich auf die in der Struktur vorhandenen interaktiven Stellen, die die Chemi- und Physisorption fördern, in Verbindung mit der Porosität.
Nach den Aufnahmeexperimenten können die Materialien zurückgewonnen werden (Abbildung S18, S19), und die Röntgenpulverdiffraktogramme zeigen, dass die Kristallinität teilweise wiederhergestellt werden kann (Abbildung S29a). Die Positionen der Schwingungsbanden haben sich nach den FTIR-Experimenten, wie bereits erwähnt, deutlich verschoben und sind nach der Wiederherstellung wieder in ihre ursprüngliche Position zurückgekehrt. Darüber hinaus wurden die Proben auf die Physisorption von N2 bei 77 K untersucht, was eine qualitative Wiederherstellung des maximalen Gasaufnahmevolumens nach der Probenrückgewinnung zeigt (Abbildung S29c). Die Untersuchungen zur Bewertung der morphologischen Veränderungen nach der Regenerierung (d. h. REM) der Probe zeigen eine praktisch unveränderte Schichtmorphologie (Abbildung S32). Die CP-MAS 13C NMR -Untersuchung zeigt eine Verbreiterung der Peaks, die auf die Amorphisierung der Probe nach der Aufnahme zurückzuführen ist, obwohl die Hauptmerkmale der Probe nach der Regenerierung intakt bleiben. (Abbildung S31).
Fazit
In dieser Studie haben wir erfolgreich das Design eines COF für die Aufnahme von Brom demonstriert und den Beitrag der in das poröse Material integrierten strukturellen Merkmale entschlüsselt. So wurde der Einbau selektiver Bindungsstellen, die die heterogene Porenoberfläche des COFs ergänzen, umfassend untersucht und hierin nachgewiesen, wodurch eine Möglichkeit geschaffen wurde, auch zwei in Lösung befindliche Halogene (Br2 und I2) zu trennen. Bei der Betrachtung der strukturellen Merkmale haben wir festgestellt, dass Brom durch Adsorption an Alkinbrücken eingefangen wird, abseits der elektronenreichen Iminbrücken und des Pyrenkerns des COFs, wie aus den spektroskopischen Untersuchungen hervorgeht. Diese Beteiligung der Dreifachbindung kann als kombinierter Physisorptions- und reversibler Chemisorptions-prozess eingestuft werden, was zu einer außergewöhnlichen Methode für die reversible Bindung von Br2 führt. Die Reaktivität von Brom wurde somit zu unseren Gunsten ausgenutzt, was die Selektivität in diesem Prozess bestimmt. Dies bietet anderen Wissenschaftlern einen einzigartigen Leitfaden für die gezielte Entwicklung von Materialien zur Abscheidung von umweltschädlichen Halogenen. Zukünftige Studien werden sich darauf konzentrieren, den Chemisorptionsprozess noch genauer zu verstehen.
Danksagung
Die Autoren bedanken sich für die Unterstützung durch den von der Deutschen Forschungsgemeinschaft (DFG) geförderten Sonderforschungsbereich “Chemie synthetischer 2D-Materialien” – SFB-1415-417590517. A.S. dankt dem Fonds der Chemischen Industrie für ein Liebig-Stipendium. S.H. dankt dem DFG-Schwerpunktprogramm “Polymerbatterien” (SPP 2248). A.D. dankt Dr. Arpan Hazra für seine Hilfestellung bei der Strukturmodellierung. Die Autoren bedanken sich für die Nutzung der TEM-Einrichtungen am Dresden Centre for Nanoanalysis (DCN) der Technischen Universität Dresden. Die Berechnungen wurden mit Hilfe der Ressourcen von PALMA@WWU durchgeführt. Open Access Veröffentlichung ermöglicht und organisiert durch Projekt DEAL.
Interessenkonflikt
Die Autoren erklären, dass keine Interessenkonflikte vorliegen.
Open Research
Data Availability Statement
Die Daten, die die Ergebnisse dieser Studie unterstützen, sind in den Hintergrundinformationen zu diesem Artikel verfügbar.




