Bestimmung der Produktivität der direkten Umwandlung von Methan in Methanol mittels Kupfer ausgetauschtem Zeolith Omega (MAZ) mittels dem Sauerstoff Looping Verfahren
Abstract
Die Methan in Methanol (MtM) Umwandlung über den Sauerstoff-Looping-Ansatz unter Verwendung von kupferausgetauschten Zeolithen wurde in den letzten zehn Jahren eingehend untersucht. Während sich ein Großteil der Forschung auf die Maximierung von Ausbeute und Selektivität konzentrierte, wurde der Produktivität weniger Aufmerksamkeit geschenkt - einer Kennzahl, die für die Bewertung des industriellen Potenzials viel aussagekräftiger ist. Anhand von kupferausgetauschtem Zeolith Omega (Cu-Omega), einem Material mit hoher Aktivität und Selektivität für die MtM-Umwandlung über den isothermen Sauerstoff-Looping-Ansatz, zeigen wir, dass dieses Material ein noch nicht dagewesenes Potenzial für die industrielle Anwendung aufweist. Dabei stellen wir auch eine neuartige Methodik vor, welche Operando XAS und Massenspektrometrie für das Screening von Materialien für die MtM-Umwandlung im Sauerstoff-Looping-Verfahren kombiniert.
Einleitung
Methanol ist ein effektiver flüssiger Energieträger1 und ein vielseitiger Rohstoff für die Herstellung von Kohlenwasserstoffen.2 Verfahren zur Umwandlung von Methanol in Kraftstoffe, wie das MTG-Verfahren (Methanol zu Benzin),3 sowie in höherwertige Produkte über das MTO-Verfahren (Methanol zu Olefinen)4 gibt es seit Jahrzehnten. Die am weitesten verbreitete Methode zur Methanol Synthese aus Erdgas erfolgt über einen zweistufigen Prozess, in welchem in der ersten Stufe Synthesegas (ein Gemisch aus Wasserstoff und Kohlenmonoxid) über eine Kohlenstoffquelle in einem katalytischen Reforming-Prozess erzeugt wird.5 In der zweiten Stufe wird Synthesegas katalytisch in Methanol umgewandelt.6 Die Herstellung von Synthesegas ist ein sehr energieintensiver Prozess, bei welchem mehr als 25 % des Einsatzmaterials verwendet werden müssen, um die erforderlichen Reaktionstemperaturen von 800–1000 °C zu erreichen.7 Darüber hinaus muss das Synthesegas gereinigt werden, um Katalysatorgifte zu entfernen.8 Aufgrund dieser Faktoren ist die Herstellung von Synthesegas nur in großem Maßstab wirtschaftlich.9-11 Dieses Verfahren ist daher an abgelegenen und dezentralen Standorten, wie z. B. an Schieferölförderstätten mit geringer Kapazität, wo Methan als Hauptbestandteil von Erdgas als Begleitgas entsteht, nicht wirtschaftlich.12 Da es keine Verfahren in kleinem bis mittlerem Maßstab zur Valorisierung von Methan gibt und es sich um ein Treibhausgas handelt, dessen Treibhauspotenzial (GWP) über eine Zeitskala von 100 Jahren 28 bis 34 Mal höher ist als das von Kohlendioxid,13 wird Methan abgefackelt, damit es nicht in die Atmosphäre emittiert wird. In Ermangelung eines wirtschaftlich rentablen Verfahrens zur Methanverwertung in kleinem bis mittlerem Maßstab müssen daher jährlich rund 140 Mrd. m3 Erdgas abgefackelt werden, was zur Emission von 300 Millionen Tonnen Kohlendioxid führt.14 Dies entspricht 100 Millionen Megatonnen Methan,15 genug um zwei Drittel des jährlichen Strombedarfs der Europäischen Union zu erzeugen.16 Hinzu kommt, dass eine kürzlich durchgeführte Untersuchung zur Effizienz des Abfackelns ergeben hat, dass nur etwa 90 % des Methans umgewandelt werden.17 Dies ist sowohl auf ineffiziente Verbrennung, wie auch auf nicht gezündete Fackeln zurückzuführen. Sowohl die Umweltauswirkungen als auch die wirtschaftlichen Verluste, die sich aus dem massiven, zuweilen ineffizienten Abfackeln von Erdgas ergeben, machen die Suche nach einem skalenflexiblen, Synthesegas freien Verfahren zur direkten Umwandlung von Methan in Methanol (MtM) äußerst attraktiv.
Methan ist der stabilste Kohlenwasserstoff18 und oxidiert leichter unter den für seine Aktivierung erforderlichen Bedingungen aufgrund einer schwächeren C−H-Bindung (~370 kJ mol−1), im Vergleich zur C−H-Bindung von Methan (~440 kJ mol−1).19, 20 Dies bringt die direkte partielle Oxidation von Methan zu Methanol an eine sehr ungünstige Selektivitätsgrenze.21-23 Um eine industrielle Umsetzung zu ermöglichen, muss ein potenzielles Verfahren zunächst zwei Ziele erfüllen: i) die leichte Aktivierung von Methan mit Sauerstoff, da dieser das einzige wirtschaftlich und kommerziell nutzbare Oxidationsmittel ist,24 und ii) den Schutz des Produkts Methanol vor anschließender Oxidation.11, 25
Strategien zum Schutz von Methanol vor Oxidation sind in den letzten Jahrzehnten Gegenstand intensiver Forschung gewesen. Die Ansätze können in drei Kategorien eingeteilt werden: i) physikalischer Schutz, ii) chemischer Schutz und iii) physikalisch-chemischer Schutz.
Das Konzept des physikalischen Schutzes schließt den Kontakt zwischen dem Oxidationsmittel und dem/den gewünschten Produkt(en) aus.11 Es gibt nur wenige Ansätze für die Umwandlung von Methan mit rein physikalischem Schutzkonzept. Eine einfache aber wirksame physikalische Schutzstrategie wurde von Ohkubo und Hirose26 beschrieben, welche ein Zweiphasen-Flüssigkeitssystem aus Perfluorhexan und Wasser verwendet. Da Methanol unlöslich und Sauerstoff in Perfluorhexan löslich ist und in Wasser umgekehrt, wird die Oxidation von Methanol vermieden. Es wird eine 99 % Umwandlung bezüglich Ameisensäure und Methanol erreicht.
Der chemische Schutz ist ein zweistufiges Konzept. Im ersten Schritt wird durch Oxidation von Methan eine oxidationsbeständige Methanol Vorstufe hergestellt,11 welche in Abwesenheit des Oxidationsmittels in Methanol umgewandelt werden kann.11 Die Strategie des chemischen Schutzes wurde in einer Vielzahl von Ansätzen untersucht, die sowohl homogen als auch heterogen katalysierte Systeme umfassen. Ein Beispiel ist der homogene Flüssigphasen-Niedrigtemperatur-Ansatz, von dem die Periana-Systeme wohl die bekanntesten sind:27 Im ersten Schritt werden HgII-, PtII- oder PdII-Salze zur Oxidation von Methan mit konzentrierter Schwefelsäure verwendet, um oxidationsbeständiges Methylbisulfat zu erzeugen.23, 27 Im zweiten Schritt wird dieser Methanol-Vorläufer hydrolysiert, um das gewünschte Methanol zu erhalten.23 Ein solches Verfahren ist mit zahlreichen Herausforderungen verbunden, vor allem mit der notwendigen Abtrennung des Methylbisulfats von der konzentrierten Säure.28 Daher ist ein Übergang der Forschung zu heterogen katalysierten Systemen notwendig, um die Fallstricke zu vermeiden, die solche homogenen Systeme aufweisen. Einer der ersten Ansätze wurde von Palkovits et al. vorgestellt, bei dem Methan mit Hilfe von Platin, welches an ein festes kovalentes Gerüst auf Triazinbasis (CTF) koordiniert ist, in Oleum in die Vorstufe Methylbisulfat umgewandelt wird.28 Bei einem neueren von Blankenship et al. entwickelten Ansatz, werden Kobaltkatalysatoren auf Siliziumdioxidträgern verwendet, um die Umwandlung von Methan heterogen zu katalysieren, wobei eine anschließende Veresterung mit Trifluoressigsäure (TFA) in Perfluoralkanen erfolgt, um das Produkt vor weiterer Oxidation zu schützen.29
Der physikalisch-chemische Schutz stellt eine Kombination der beiden vorgenannten Schutzstrategien dar.11 Ein solches ist das Sauerstoff-Looping-Konzept, welches eine einfache und kostengünstige physikalisch-chemische Methanol Schutzstrategie darstellt. Bei diesem Konzept wird die Oxidation von Methanol durch das Oxidationsmittel vermieden, da Methanol und das Oxidationsmittel im Reaktorsystem nie in Kontakt kommen. Die Reaktion wird in drei verschiedene Phasen unterteilt: i) die (Re−)Aktivierung des Feststoffs unter Sauerstoff; ii) die Reaktion mit dem Substrat Methan und die Stabilisierung des resultierenden Methylderivat-Zwischenprodukts; und iii) die Desorption des gewünschten Produkts unter Wasserdampf.
Eine Art von Material, welche für dieses chemische Looping Verfahren ausgiebig untersucht wurde, sind metallhaltige Zeolithe, die insbesondere Eisen-31 und Kupferspezien32, 33 als aktive Zentren enthalten. Die erste erfolgreiche MtM-Umwandlung unter Verwendung von metallausgetauschten Zeolithen wurde 1995 unter Verwendung des eisenausgetauschten Zeoliths ZSM-5 und N2O als Oxidationsmittel durchgeführt.31 Weitere Arbeiten haben gezeigt, dass Sauerstoff als Oxidationsmittel bei der Verwendung von Zeolithen benützt werden kann, was aufgrund der höheren Kosten, welche mit anderen Oxidationsmitteln verbunden sind, die einzige kosteneffiziente Option ist.24 Viele verschiedene metallausgetauschte Zeolithe mit unterschiedlichen Eigenschaften wurden für die Methanol Umwandlungsreaktion untersucht und weisen unterschiedlich großes Potenzial auf.9, 33-40
Damit ein MtM-Prozess im Falle eines Gas-Feststoff-Verfahrens industriell rentabel ist, sollten vier Ziele erfüllt werden:25 i) Selektivität für Methanol: >70 %; ii) Methanol Konzentration im Produktstrom: >3 Gew. %; iii) Materialverbrauch: >1 TonneProdukt kgMaterial−1; und iv) Methanol Produktivität: 100 kgProdukt m−3 h−1. Bei einer Schüttdichte von 1000 kg m3 entspricht dies 0.1 kgMethanol kgMaterial−1 h−1, oder ~3000 μmol gMaterial−1 h−1.11
Keines der untersuchten Zeolith Systeme, die das einzige industriell rentable Oxidationsmittel Sauerstoff verwenden, hat die erforderlichen Produktivitätswerte auch nur annähernd erreicht. Soweit die Autoren wissen, haben jedoch drei Systeme alle anderen übertroffen. Dinh et al. verwendeten ein Tandemsystem aus kupferausgetauschtem Zeolith SSZ-13 (CHA) und protoniertem ZSM-5 (MFI) in einem kontinuierlichen Durchflusssystem, bei dem alle Reaktanten gleichzeitig zugeführt werden.41 Methan wird über kupferausgetauschtes SSZ-13 in Methanol umgewandelt. In einer Folgereaktion wird das oxidationsanfällige Methanol Molekül in ZSM-5 durch gleichzeitige Zufuhr von Benzol in Toluol umgewandelt, wodurch eine Oxidation zu unerwünschten Produkten vermieden wird. Es wurden Produktivitätswerte von ~162 μmolProdukt gKatalysator−1 h−1 bei einer Selektivität von 59 % gegenüber Toluol und Xylol und 0.66 % Methanumwandlung erreicht.41 Sushkevich et al. untersuchten kupferausgetauschtes Faujasit (FAU) über den Sauerstoff-Looping-Prozess und erzielten ~360 μmol gZeolith−1 in einem Zeitrahmen von 3 Stunden,9 was ~120 μmol gZeolith−1 h−1 entspricht. Unserem Wissen nach wurden die höchsten Produktivitätswerte in der Arbeit von Hirayama et al. erzielt, die ein kontinuierliches Durchflusssystem auf der Basis von kupferausgetauschtem Zeolith SSZ-13 verwendeten. Der sehr beeindruckende Wert von 678 μmol gKatalysator−1 h−1 wurde erreicht, allerdings bei einer Selektivität von ~45 % für Methanol und einer Methanumwandlung von 0.06 %.42 Während diese drei Systeme im Vergleich zu vielen anderen sehr beeindruckend sind, sind sie dennoch weit vom erforderlichen Wert von ~3000 μmol gMaterial−1 h−1 entfernt.11
Ein Zeolith, der kürzlich gezeigt hat, dass er ein erhebliches Potenzial für ein Gas-Feststoff-Prozessdesign aufweist, ist Cu-Omega.37, 43, 44 Cu-Omega wandelt Methan in Methanol mit Ausbeuten von bis zu 200 μmol gZeolith−1 und einer Selektivität von bis zu 97 % um, wenn man das Nebenprodukt Dimethylether mit einbezieht.43, 45-47 Außerdem übertrifft die Kupfereffizienz des aktiven Kupfers jene vieler anderer untersuchter kupferausgetauschter Zeolithe. Eine weitere nützliche Eigenschaft von Cu-Omega ist, dass der Sauerstoff-Looping-Prozess isotherm bei Temperaturen bis zu 473 K durchgeführt werden kann.43 Der isotherme Looping-Modus ist im Vergleich zum Hochtemperatur-Aktivierungsverfahren zu bevorzugen, da die Aufheiz- und Abkühlungsschritte des Hochtemperatur-Aktivierungsverfahren den Zeitaufwand für einen vollständigen Loop erhöhen und den Gesamtenergieaufwand für den Prozess steigern. Der isotherme Sauerstoff-Looping-Prozess umfasst sowohl “aktive” als auch “parasitäre” Schritte, wie in Schema 1a dargestellt.
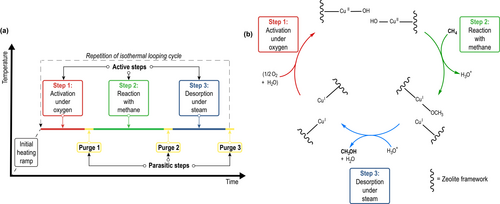
a) Schematische Darstellung des isothermen Sauerstoff-Looping-Prozesses, bestehend aus “aktiven” und “parasitären” Schritten (b) Die Reaktionsfolge der Methan-to-Methanol Umwandlung in kupferausgetauschtem Zeolith Omega.
Wie in Schema 1a zu sehen ist, sind die aktiven Schritte i) Schritt 1: Aktivierung unter Sauerstoff; ii) Schritt 2: Reaktion mit Methan; und iii) Schritt 3: Desorption unter Wasserdampf. Spülung 1 ist ein notwendiger Spülschritt, um die Bildung von entflammbaren oder explosiven Gasatmosphären zu vermeiden, während Spülung 2 und Spülung 3 eingeführt werden, um die Beobachtung der chemischen Prozesse zu erleichtern.
Frühere Untersuchungen von Newton et al. haben gezeigt, dass ein Zwei-Elektronen-Mechanismus auf der Grundlage von CuII/CuI-Redox-Paaren die Grundlage für die MtM-Umsetzung in Cu-Omega ist, wobei das Verhältnis von Kupferatomen zu Methanol nahe bei 2 : 1 liegt und damit aufzeigt, dass Cu-Omega Methanol mit hohen Selektivitäten produziert.48 Die leichte Abweichung dieses Verhältnisses von 2 : 1 deutet darauf hin, dass auch andere Produkte entstehen können.
Knorpp et al. untersuchten die Struktur der aktiven Zentren mittels anomaler Röntgen Pulver Diffraktion und stellten fest, dass es sich dabei um ein Kupfer Monomer Paar handelt, das sich in den achtgliedrigen Ringen von Cu-Omega befindet.46 Aufgrund der Topologie von Zeolith-Omega bleibt der monomere Charakter der aktiven Zentren erhalten, während gleichzeitig eine Wechselwirkung zwischen den beiden Monomeren möglich ist. Daher ergibt sich die in Schema 1b dargestellte Reaktionsfolge.
Schritt 1 (Schema 1b) zeigt die (Re−)Aktivierung der aktiven Zentren unter Sauerstoff, wobei die beiden CuI-Zentren zu zwei proximalen CuII-Monomeren oxidiert werden. Schritt 2 (Schema 1b) zeigt die Reaktion zwischen den proximalen Monomeren und Methan, welche eine Reduktion des CuII zu zwei CuI-Zentren bewirkt, von denen eines an das Methoxy-Zwischenprodukt gebunden ist. Schritt 3 (Schema 1b) zeigt die Desorption des Produkts Methanol unter Wasserdampf, wobei es durch einen Protonentransfer desorbiert wird. Da die anaerobe Oxidation der aktiven Kupferzentren mit Wasserdampf ein langsamer Prozess ist, wird der größte Teil des Kupfers oxidiert, sobald es in Schritt 1 einer Sauerstoffatmosphäre ausgesetzt wird.49
 (1)
(1)Während Methanol einen Transfer von zwei Elektronen benötigt, sind für Dimethylether insgesamt vier Elektronen erforderlich, wobei die Reaktion über Brønsted-Säure-Zentren im Zeolith-Gerüst abläuft.35 Eine weitere Oxidation zu unerwünschten Produkten erfordert weitere Elektronen, wobei Kohlenmonoxid sechs und Kohlendioxid acht Elektronen zur Bildung benötigt.37
Wie sich gezeigt hat, erfüllt Cu-Omega die für eine industrielle Umsetzung erforderliche Selektivität von über 70 %.43, 45, 47, 48 Die erwähnten Anforderungen in Bezug auf Produktivität, Materialverbrauch und Produktkonzentration im Strom erfordern weiterer Untersuchung. Das Hauptziel der in dieser Arbeit vorgestellten Untersuchungen ist die Bestimmung des Produktivitätspotenzials von Cu-Omega im isothermen Sauerstoff-Looping-Modus. Produktivität ist definiert als die Ausbeute an Produkten, die während des Desorptionsschritts desorbiert werden, geteilt durch die Gesamtzykluszeit, wobei sich die Gesamtzykluszeit aus den Zeitrahmen aller aktiven Schritte zusammensetzt (Schema 1a). Die Ausbeute wird auf der Grundlage von Methanol Äquivalenten berechnet. Das einzige beobachtete Hauptnebenprodukt ist Dimethylether, wobei ein Molekül Dimethylether als zwei potenzielle Moleküle Methanol berechnet wird (Gl. 1). Da die parasitären Spülschritte (Schema 1a) keine Auswirkungen auf den eigentlichen chemischen Prozess der Reaktion haben, werden sie bei den Produktivitätsberechnungen nicht berücksichtigt. Die erforderlichen Schrittzeiten werden durch die Kinetik der einzelnen aktiven Schritte bestimmt (Schema 1a). Mit Hilfe einer systematischen und quantitativen Methodik kann die Kinetik der CuII-Bildung unter Sauerstoff und der CuI-Bildung unter Methan bestimmt werden. Daher wird in dieser Arbeit auch eine fortgeschrittene Methode für das Screening von Materialien für die MtM-Umwandlung im Sauerstoff-Looping-Modus durch die Kombination von Operando XAS und Massenspektrometrie vorgestellt. Die ermittelten Produktivitätswerte können dann mit den Werten verglichen werden, die zum Erreichen der industriellen Machbarkeit erforderlich sind, wie in der Literatur beschrieben.11, 25
Durch die Beantwortung dieser Frage für eine Reihe von Reaktionsbedingungen zeigen wir, dass Cu-Omega potenzielle Produktivitätsniveaus erreichen kann, die zwar noch nicht das Niveau für industrielle Anwendbarkeit erreichen, jedoch einen bedeutenden Fortschritt darstellen. Daher verdient dieses Verfahren unter Verwendung von Cu-Omega weitere Untersuchung.
Ergebnisse und Diskussion
Kinetik der Kupferspezies während Schritt 1: Aktivierung unter Sauerstoff
Abbildung 1(a–c) zeigt die Veränderung der Kupferspezies, wie sie sich aus der LCA-Analyse der zeitaufgelösten Cu−K-Edge-XANES während Schritt 1 (Schema 1) als Funktion der Zeit bei verschiedenen Temperaturen (200–300 °C) ergibt. Der Sauerstoffdruck wird konstant auf 1 bar gehalten, wobei t=0 s die Umschaltung auf Sauerstoff darstellt. Bevor die Probe dem Sauerstoff ausgesetzt wurde, wurden Schritt 3 und Spülung 3 durchgeführt, wobei CuI zurückbleibt (Schema 1).
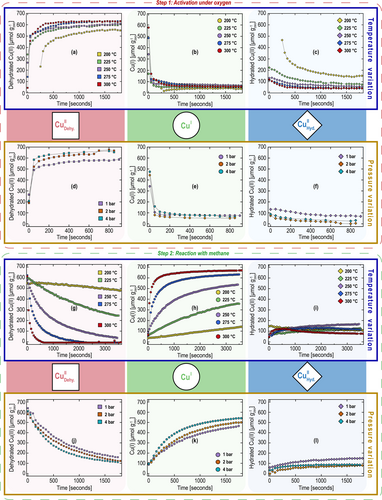
Veränderungen von (a) dehydratisiertem CuII (b) CuI und (c) hydratisiertem CuII bei einem Sauerstoffdruck von 1 bar und unterschiedlichen Temperaturen sowie von (d) dehydratisiertem CuII (e) CuI und (f) hydratisiertem CuII bei 250 °C und unterschiedlichen Sauerstoffdrucken während Schritt 1: Aktivierung unter Sauerstoff. Bei t=0 s erfolgt ein Wechsel von Argon (Spülung 3, Schema 1) zu Sauerstoff. Vor Schritt 1 wird Methanol desorbiert (Schritt 3, Schema 1) unter Verwendung von 40 mbar Wasserdampf (Argon-Gleichgewicht, um alle Schritte des Loops isobar durchzuführen). Veränderungen von (g) dehydratisiertem CuII (h) CuI und (i) hydratisiertem CuII bei einem Methandruck von 1 bar und unterschiedlichen Temperaturen sowie (j) dehydratisiertem CuII (k) CuI und (l) hydratisiertem CuII bei 250 °C bei unterschiedlichen Drucken von Methan bei 250 °C während Schritt 2: Reaktion mit Methan (Schema 1). Bei t=0 s erfolgt ein Wechsel von Argon (Spülung 1, Schema 1a) zu Methan. Vor Schritt 2 wird Schritt 1 (Schema 1) durchgeführt. Alle Stufen des Sauerstoff-Looping-Zyklus werden unter isothermen und isobaren Bedingungen durchgeführt. Der Offset bei 200 °C (a–c) ist darauf zurückzuführen, dass eine Heizrampe verwendet wird, um vom RTP auf die Temperatur von 200 °C zu gelangen. Der erste Punkt wird aufgezeichnet, wenn die Temperatur der Probe 200 °C erreicht hat.
Es wird eine schnelle Umwandlung der CuI-Spezies in dehydriertes CuII (Abbildung 1a & Abbildung 1b) beobachtet, wie in Schritt 1 (Schema 1b) dargestellt. Ein langsamerer Übergang von hydratisiertem CuII in dehydratisiertes CuII kann auch beobachtet werden (Abbildung 1a und Abbildung 1c), wobei höhere Temperaturen zu einem schnelleren Übergang führen. Für die gewählten Zeiträume erhöht ein Anstieg der Temperatur von 200 °C auf 300 °C die Menge des während der aeroben Aktivierung gebildeten dehydrierten CuII Spezies um mehr als 20 %. Alle Spezies erreichen in den gewählten Zeiträumen ein Plateau, wobei die endgültige Menge an dehydratisiertem und hydratisiertem CuII temperaturabhängig ist. Im Gegensatz dazu scheint die finale Menge von CuI relativ temperaturunabhängig zu sein.
Abbildung 1(d–f) zeigt die Veränderung der Kupfer Speziation während Schritt 1 (Schema 1) als Funktion der Zeit bei verschiedenen Drucken (1 bis 4 bar). Die Temperatur wurde konstant bei 250 °C gehalten, wobei t=0 s den Übergang zu Sauerstoff darstellt.
Wie bereits in Abbildung 1a zu sehen ist, verläuft die aerobe Oxidation bei 250 °C und unterschiedlichen Sauerstoffdrucken zunächst sehr schnell (Abbildung 1d). Ein erster schneller Übergang von CuI (Abbildung 1e) in dehydriertes CuII (Abbildung 1d) ist zu beobachten, wie in Schritt 1 (Schema 1b) dargestellt. Ein deutlich langsamerer Übergang von hydratisiertem CuII (Abbildung 1f) in dehydratisiertes CuII (Abbildung 1d), wobei die Endwerte von dehydratisiertem CuII von 1 auf 2 bar um etwa 100 μmol gZeolith−1 ansteigen, ist ebenfalls zu beobachten. Dies entspricht einem Anstieg der endgültigen Menge dehydrierter CuII-Spezies um ca. 20 %, was zeigt, dass steigende Sauerstoffdrucke eine positive Auswirkung auf Schritt 1 haben (Schema 1). Die Untersuchung der Wendepunkte für die Bildung von dehydriertem CuII (Abbildung 1d) zeigt, dass diese druckabhängig sind und bei höheren Sauerstoffdrucken zunehmen. Hinter dem Wendepunkt nimmt die endgültige Menge an dehydratisiertem CuII nicht mehr signifikant zu. Die endgültigen Mengen an dehydriertem CuII, die bei 2 und 4 bar erreicht werden, sind jedoch sehr ähnlich.
Kinetik der Kupferspezies während Schritt 2: Reaktion mit Methan
Abbildung 1(g–i) zeigt die Veränderung der Kupferspezies während Schritt 2 (Schema 1) als Funktion der Zeit bei verschiedenen Temperaturen (200–300 °C). Der Methandruck wurde konstant auf 1 bar gehalten, wobei t=0 s den Übergang zu einem Methanfluss darstellt. Bevor die Probe dem Methan ausgesetzt wurde, wurden Schritt 1 und Spülung 1 durchgeführt, wobei überwiegend dehydriertes CuII zurückblieb (Schema 1).
Das dehydrierte CuII (Abbildung 1g) wird unter Methan zu CuI (Abbildung 1h) reduziert, wie in Schritt 2 dargestellt (Schema 1b). Die Geschwindigkeit der CuI-Bildung nimmt mit steigender Temperatur deutlich zu. Die relative Auswirkung der Temperaturerhöhung auf die CuI-Bildung unter Methan (Abbildung 1h) ist im Vergleich zur dehydrierten CuII-Bildung unter Sauerstoff (Abbildung 1a) signifikanter. Bei einer Erhöhung der Temperatur von 200 °C auf 300 °C ist ein Anstieg der CuI-Spezies von etwa 100 μmol gZeolith−1 auf 650 μmol gZeolith−1 zu beobachten. Dies entspricht etwa 90 % des gesamten Kupfers in der Probe. Bei 275 °C und 300 °C verschwindet die dehydrierte CuII-Spezies bei ~2000 s bzw. 500 s vollständig, während die Menge an CuI bei den jeweiligen Temperaturen über diese Zeitspannen hinaus ansteigt. Im Anschluss daran wird eine anfängliche Bildung der hydratisierten CuII-Spezies beobachtet (Abbildung 1i), die langsam in CuI übergeht.
Abbildung 1(j–l) zeigt die Veränderung der Kupfer Speziation während Schritt 2 (Schema 1) als Funktion der Zeit bei verschiedenen Drucken (1 bis 4 bar). Die Temperatur wurde bei 250 °C gehalten, wobei t=0 s den Übergang zu einem Methanfluss darstellt.
Auch hier ist eine Reduktion des dehydrierten CuII (Abbildung 1j) zu CuI (Abbildung 1k) zu beobachten, wie in Schritt 2 (Schema 1b) abgebildet. Ein Anstieg der Methankonzentration korreliert mit einem Anstieg der Gesamtmenge der gebildeten CuI-Spezies sowie der anfänglichen Geschwindigkeit der CuI-Bildung (Abbildung 1k). Die anfängliche Verlustrate von dehydriertem CuII erhöht sich mit steigendem Methandruck (Abbildung 1j). Eine weitere interessante Beobachtung ist die Bildung der hydratisierten CuII-Spezies (Abbildung 1l), die bei niedrigerem Methandruck stärker ausgeprägt ist. Wasser ist ein Nebenprodukt von Schritt 2 (Schema 1b), wobei ein höherer Methandruck anscheinend dazu beiträgt, Wasser von aktiven Zentren zu desorbieren.
Kinetik der Methanol Desorption während Schritt 3: Desorption unter Wasserdampf
Mit Hilfe der Massenspektrometrie lassen sich die desorbierten Produkte während Schritt 3 (Schema 1) quantifizieren, sowie die Kinetik ihrer Desorption untersuchen. Dies ist in Abbildung 2 zu sehen, in welcher die Methanol Ausbeute als Funktion der Zeit bei unterschiedlichen Temperaturen (200–300 °C) dargestellt ist.

Methanol Ausbeute bei unterschiedlichen Temperaturen während Schritt 3: Desorption unter Wasserdampf (Schema 1). Bei t=0 s wird ein Wechsel von Argon (Spülung 2, Schema 1a) auf 40 mbar Wasserdampf mit einem Argon Ausgleich auf 1 bar ausgeführt. Vor Schritt 3 wurden Schritt 1: Aktivierung unter Sauerstoff und Schritt 2: Reaktion mit Methan (Schema 1) sowie die weiteren parasitären Argon Spülungen (Spülung 1 und Spülung 2) durchgeführt. Alle Stufen des Sauerstoff-Looping-Zyklus werden unter isothermen Bedingungen durchgeführt. Die dargestellte Methanol ausbeute ist die durchschnittliche Ausbeute über vier aufeinanderfolgende Zyklen.
Abbildung 2 zeigt, dass eine Erhöhung der Temperatur mehrere Vorteile hat. Zum einen ist das Einsetzen der Methanol Desorption temperaturabhängig, wobei höhere Temperaturen ein früheres Einsetzen der Produktdesorption bewirken (Abbildung 2). Bei Temperaturen über 275 °C desorbiert das meiste Methanol sehr schnell. Nach etwa 400 s ist der größte Teil des Methanols bereits desorbiert. Um das gesamte Methanol zu desorbieren, muss ein erheblicher Zeitaufwand in Kauf genommen werden. Das Nebenprodukt Dimethylether desorbiert schneller, wobei die Gesamtmenge an Dimethylether nach ~400 s desorbiert ist (Abbildung S7). Die Desorptionsgeschwindigkeit erhöht sich auch bei höheren Temperaturen, wodurch sich die für einen Zyklus erforderliche Zeit weiter verringert.
Die Zeiten für die Desorption nehmen zu, wenn der Gesamtdruck erhöht wird während der Partialdruck des Wasserdampfes gleich gehalten wird (Tabelle S3). Dies ist darauf zurückzuführen, dass der höhere Partialdruck von Argon die Zeit für die Produktrückgewinnung verlängert.
Neben Methanol und Dimethylether wurden in Schritt 3 (Schema 1) keine weiteren Produkte mittels Massenspektrometrie beobachtet. Durch den quantitativen Querverweis zwischen den Cu−K-Edge-XANES und den quantifizierten Produkten können wir die potenzielle Menge aller weiteren möglicherweise zu bildenden Produkte bestimmen, indem wir die Menge der für die Bildung solcher Produkte benötigten Elektronen dazu in Beziehung setzen. Wie in Abbildung S11 dargestellt, sind alle anderen Produkte, die sich über die aktiven Kupferzentren bei Temperaturen mit signifikanter Produktausbeute bilden können, vernachlässigbar.
Ermittelte Ausbeute
In Abbildung 3 sind die unter den untersuchten Bedingungen erzielten Ausbeuten dargestellt. Die Temperatur wirkt sich positiv auf die Gesamtausbeute aus (Abbildung 3a), wobei die höchste Ausbeute bei 275 °C mit ~277 μmol gZeolith−1 erreicht wird. Eine Erhöhung der Temperatur auf 300 °C bewirkt einen leichten Rückgang der Ausbeute auf ~264 μmol gZeolith−1. Die unter diesen Bedingungen erzielte Selektivität beträgt ~97 % bei 275 °C und ~87 % bei 300 °C (Abbildung S10). Daher ist der Rückgang der Ausbeute vermutlich auf eine Überoxidation zurückzuführen, die bei 300 °C stärker ausgeprägt ist.
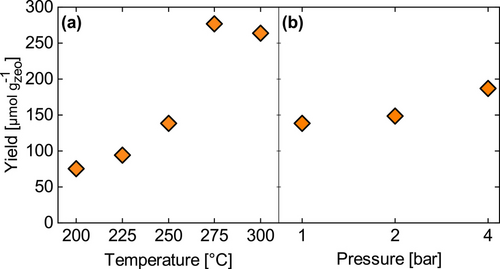
(a) Ausbeute dargestellt in Abhängigkeit von der Temperatur bei einem Gesamtdruck von 1 bar aller Gas Atmosphären und (b) Ausbeute in Abhängigkeit vom Druck bei 250 °C. Die für die Berechnung verwendete Ausbeute bezieht sich auf das gesamte Methanol und alle Methanol Äquivalente. Der Durchschnitt wurde über vier aufeinander folgende Zyklen ermittelt.
Abbildung 3b zeigt, dass sich eine Erhöhung der jeweiligen Drucke von Sauerstoff (Schritt 1, Schema 1) und Methan (Schritt 2, Schema 1) bei 250 °C positiv auf die Gesamtausbeute auswirkt, wobei die höchsten Werte bei 4 bar mit ~187 μmol gZeolith−1 im Vergleich zu ~138 μmol gZeolith−1 bei 1 bar erreicht werden.
Ermittelte potenzielle Produktivität
Abbildung 4a und Abbildung 4b zeigen die verschiedenen erreichbaren potenziellen Produktivitäten, die sich aus diesen Messungen ableiten lassen. Das Zeitelement der berechneten Produktivität ist die Summe der erforderlichen Zeitrahmen von Schritt 1, Schritt 2 und Schritt 3 (Schema 1) unter den angegebenen Reaktionsbedingungen. Eine ausführliche Erläuterung der Berechnung ist im experimentellen Teil zu finden.
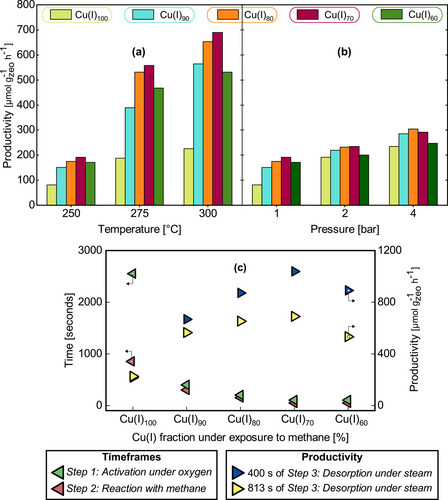
Potenzielle Produktivität auf Methanol Äquivalentbasis in Abhängigkeit von (a) Temperatur bei 1 bar und (b) Druck bei 250 °C. Dargestellt sind die erreichbaren Produktivitäten bei verschiedenen Anteilen des gesamten CuI, das während Schritt 2: Reaktion mit Methan (Schema 1) gebildet wird, wie in Abbildung 1h und Abbildung 1k dargestellt. (c) Erforderliche Zeitrahmen für Schritt 1: Aktivierung unter Sauerstoff, Schritt 2 und Produktivität bei verschiedenen CuI-Fraktionen (Schema 1) bei 300 °C und 1 bar. Diese Produktivitätswerte werden unter Verwendung der vollen Desorptionszeit von 813 Sekunden sowie einer verkürzten Desorptionszeit von 400 Sekunden während Schritt 3: Desorption unter Wasserdampf (Schema 1) und der damit einhergehenden reduzierten Methanol Ausbeute berechnet. Die Produktivität wird für einen ganzen Sauerstoffkreislauf berechnet. Die für die Berechnung verwendete Ausbeute umfasst das gesamte Methanol und die Methanol Äquivalente. Der für Schritt 1 angegebene Zeitrahmen ist die Zeit, die erforderlich ist, um den gleichen Anteil an dehydriertem CuII zu erhalten, wie er für CuI in Schritt 2 verwendet wird (Schema 1). Eine genauere Erläuterung der Berechnungen findet sich im experimentellen Teil.
Bei CuI100 während Schritt 2 (Schema 1) beträgt die höchste erzielte Produktivität ~234 μmol gZeolith−1 h−1. Diese wird bei 250 °C mit einem Sauerstoff- und Methandruck von 4 bar und einem Wasserdampfpartialdruck von 40 mbar erreicht (4 bar Gesamtdruck, Argon Ausgleich). Dies stimmt nicht mit den Bedingungen überein, bei denen die höchsten Ausbeuten erzielt wurden (Abbildung 3). Dass der höchste Produktivitätswert unter Bedingungen erreicht wird, bei denen die höchste Ausbeute nicht erzielt wurde, ist auf die verkürzten Zeitspannen zurückzuführen, die für Schritt 1 und Schritt 2 erforderlich sind (Abbildung 1).
Da die anfänglichen Raten der Bildung der gewünschten Kupferspezies viel höher sind als die Gesamtraten, wurden für die Berechnung der Produktivität verschiedene Teilmengen der in Schritt 2 (Schema 1) gebildeten Gesamtmenge an CuI verwendet. Der höchste Produktivitätswert von ~690 μmol gZeolith−1 h−1 wurde für CuI70 während Schritt 2 (Schema 1) berechnet. Dieser Produktivitätswert wurde bei 300 °C, einem Sauerstoff- und Methandruck von 1 bar und einem Wasserdampfpartialdruck von 40 mbar (Argon Ausgleich zu 1 bar) ermittelt. Dieser Wert entspricht fast einem Viertel des in der Literatur angegebenen Wertes für die industrielle Anwendbarkeit von 3000 μmol gZeolith−1 h−1.11 Eine weitere Verringerung des Anteils des in Schritt 2 (Schema 1) gebildeten CuI auf CuI60 führt zu einer Verringerung der Produktivität.
Wie in Abbildung 2 dargestellt, verläuft die Desorption von Methanol in Schritt 3 (Schema 1) nichtlinear, und zwar mit anfangs hohen Desorptionsraten. Durch die Desorption des gesamten potenziellen Methanols erhöht sich die für einen vollständigen Loop benötigte Zeit erheblich. Dimethylether wird dagegen schnell desorbiert, und zwar unter allen untersuchten Bedingungen bei etwa 400 s (Abbildung S7). Um den Nutzen einer Verringerung des Zeitrahmens während Schritt 3 zu verdeutlichen, wurde ein cut-off Punkt bei 400 s bei 300 °C und 1 bar untersucht. Bei 400 s sind ~82 % des gesamten Methanols und 100 % des gesamten Dimethylethers desorbiert. Dies entspricht ca. 86 % der Produkte auf der Basis von Methanol Äquivalenten. Die Produktivität bei 300 °C und 1 bar unter Verwendung der gesamten Desorptionszeit zur Desorption des gesamten Methanols sowie die ermittelte Produktivität bei einer Desorptionszeit von 400 s sind in Abbildung 4c dargestellt.
Eine Verringerung der Desorptionszeit von ~800 s auf 400 s erhöht die Produktivität erheblich. Bei CuI70 springt die Produktivität von ~690 μmol gZeolith−1 h−1 auf ~1040 μmol gZeolith−1 h−1. Dies ist mehr als ein Drittel der Produktivität von 3000 μmol gZeolith−1 h−1, die für die industrielle Anwendung erforderlich ist[11]. Die erhebliche Produktivitätssteigerung ist hauptsächlich auf die verkürzten Zeiträume der Bildung von dehydriertem CuII während Schritt 1 (Abbildung 1a) und der Bildung von CuI während Schritt 2 (Abbildung 1h) zurückzuführen, wie in Abbildung 4c zu sehen ist. Der größte Vorteil ist die Verringerung der für Schritt 2 (Schema 1) erforderlichen Zeit, wobei die Verringerung der Menge von CuI100 auf CuI70 die erforderliche Reaktionszeit von 2550 s auf 100 s bei 300 °C reduziert. Für Schritt 1 (Schema 1) verringert sich die erforderliche Zeit von 850 s auf 50 s. Die weitere Verringerung der Fraktion von CuI, die während Schritt 2 (Schema 1) gebildet wird, über CuI70 hinaus ändert die erforderliche Zeit nicht weiter. Es ist jedoch zu beachten, dass die Zeit für einen XAS-Scan 50 s beträgt. Die ermittelten Zeitrahmen, Ausbeuten und Produktivitäten bei verschiedenen CuI-Fraktionen bei 300 °C unter Verwendung der verschiedenen Desorptionszeitrahmen für Schritt 3 (Schema 1) sind in den Hintergrundinformationen (Tabellen S1–S2) aufgeführt.
Zusammenfassung
Diese Arbeit hat gezeigt, welch großes Potenzial Cu-Omega für den MtM-Sauerstoff-Looping-Prozess hat. Dabei wurde eine neuartige Methodik zur Bestimmung der Kinetik der einzelnen aufeinanderfolgenden Schritte des Sauerstoff-Looping-Prozesses demonstriert. Diese Methode wird das Screening anderer Materialien für den MtM-Sauerstoff-Looping-Prozess erheblich erleichtern und den Vergleich verschiedene zeolithischer Materialien für diese Reaktion vereinfachen.
Die Ergebnisse zeigen die günstigen Auswirkungen einer Erhöhung des Drucks und der Temperatur auf die Verkürzung der erforderlichen Zeiten für die Oxidation zu CuII während der aeroben Aktivierung (Schritt 1: Aktivierung unter Sauerstoff, Abbildung 1 und Schema 1) und die anschließende Reduktion zu CuI durch Methan (Schritt 2: Reaktion mit Methan, Abbildung 1 und Schema 1). Höhere Temperaturen wirkten sich günstig auf die Ausbeuten aus, wobei die Ausbeuten bei 275 °C (~277 μmol gZeolith−1 h−1) und 300 °C (~264 μmol gZeolith−1 h−1), beide bei 1 bar, frühere Ausbeuten übertrafen, die in der Literatur für Cu-Omega berichtet wurden.43, 45, 47 Höhere Drucke von Sauerstoff und Methan bei 250 °C erhöhten ebenfalls die Ausbeute im Vergleich zu der bei 1 bar ermittelten Ausbeute. Der höhere Partialdruck von Argon während der Produktdesorption verlängerte jedoch die für die Produktrückgewinnung erforderliche Zeit. Die Verringerung der Zeitrahmen aller aktiven Schritte (Abbildung 4c) des Sauerstoff-Looping-Zyklus führt zwar zu einer Verringerung der potenziellen Ausbeute, kommt aber der potenziellen Produktivität sehr zugute, wobei der höchste beobachtete Wert ~1040 μmol gZeolith−1 h−1beträgt, ein Drittel des in der Literatur genannten, industriell attraktiven Zielwerts von 3000 μmol gZeolith−1 h−1.11
Obwohl die derzeitigen Produktivitätswerte noch nicht den für eine industrielle Anwendung erforderlichen Wert erreichen, sind die Fortschritte bemerkenswert, und es gibt zahlreiche Möglichkeiten, diesen Wert weiter zu steigern. Weitere Produktivitätssteigerungen sind absehbar, wenn Schritt 3: Desorption unter Wasserdampf bei niedrigeren Drucken als in Schritt 1 und Schritt 2 durchgeführt wird (Schema 1). Zusätzliche Untersuchungen zur Verkürzung der einzelnen Schritte des Sauerstoff-Looping-Prozesses können ebenfalls zu weiteren Produktivitätssteigerungen führen, auch wenn die damit verbundenen Kosten die potenzielle Ausbeute verringern. Weitere Vorteile können durch die Verbesserung bestimmter Eigenschaften von Cu-Omega erzielt werden. Es muss untersucht werden, ob das Si/Al Verhältnis des Ausgangszeoliths verringert werden kann und ob dies zu einer Verringerung der Stabilität führt. Es ist bekannt, dass natürlicher Mazzite bei einem Si/Al-Verhältnis von 2,650 vorkommt, so dass das Erreichen dieser Werte machbar erscheint. Eine Erhöhung der Menge an Kupferspezies pro Gramm Material kann ebenfalls geprüft werden. Das Cu/Al Verhältnis des verwendeten Cu-Omegas beträgt ~0.25. Da in Zeolith Omega ein Aluminiumatom erforderlich ist, um eine aktive Kupferstelle zu stabilisieren46 (Schema 1b), ist ein Cu/Al-Verhältnis von ~1 konzeptionell möglich. Dadurch würde sich die potenzielle Ausbeute und damit die Produktivität um den Faktor vier erhöhen. Kombiniert man die potenziellen Maxima des Cu/Al- und des Si/Al-Verhältnisses, könnte eine maximale Produktivitätssteigerung um einen Faktor von ~6.6 erreicht werden. Wie jedoch für verschiedene Zeolith Typen gezeigt wurde, können unterschiedliche Si/Al-Verhältnisse und die entsprechenden Cu-Beladungen die Bildung verschiedener aktiver Zentren mit unterschiedlichem Aktivitätsgrad für die MtM-Reaktion verursachen. Es muss untersucht werden, wie sich eine Änderung dieser Parameter auf Cu-Omega auswirkt. Andere zeolithische Materialien, die mit einem niedrigen Si/Al-Verhältnis synthetisiert werden können, um höhere Kupfergehalte zu erreichen, sind ebenfalls potenzielle Kandidaten.
Die meisten der häufig untersuchten Zeolith Typen können die oben genannten Anforderungen nicht erfüllen oder erfüllen sie nicht, was zu pessimistischen Prognosen über die industrielle Anwendbarkeit geführt hat.11 Der Schwerpunkt liegt oft auf der Optimierung der Ausbeute, die zwar wesentlich ist, aber nur einen der wichtigsten Aspekte darstellt, die berücksichtigt werden müssen. Diese Arbeit hat gezeigt, dass eine geringfügige Verringerung der Gesamtausbeute zu einer erheblichen Steigerung der Produktivität des Prozesses führen kann. Es sollte mehr Wert darauf gelegt werden, jede Phase des chemischen Kreislaufs zu untersuchen und zu verstehen, anstatt sich nur auf die Maximierung der Produktausbeute in der Desorptionsphase zu konzentrieren. Durch eine Kombination aus Prozess- und Materialverbesserung könnte das Ziel einer Produktivität von 3000 μmol gZeolith−1 h−1mit dem Sauerstoff-Looping-Verfahren erreicht werden.
Danksagung
Wir bedanken uns bei der ESRF und den Swiss-Norwegian Beamlines (SNBL) für den Zugang zu den Einrichtungen und die in die Experimente investierte Zeit. Wir sind auch sehr dankbar für die technische Unterstützung durch Joel Jenni und Fredy Mettler von der ETH. Wir danken auch der Technischen Universität München (TUM), insbesondere Professor Andreas Jentys, sowie der ETH Zürich, die es JW ermöglicht haben, seine Masterarbeit an der ETH Zürich zu schreiben. Wir danken auch Dr. Zoran Jovanovic und Jonas Meidinger (MSc) für aufschlussreiche Diskussionen und das Lesen dieses Manuskripts. Open Access funding provided by Eidgenössische Technische Hochschule Zürich.
Interessenkonflikt
Die Autoren erklären, dass keine Interessenkonflikte vorliegen.
Open Research
Data Availability Statement
Die Daten, die die Ergebnisse dieser Studie unterstützen, sind auf begründete Anfrage beim Autor erhältlich.




