Eine Familie von Heterobimetallischen Würfeln zeigt Spin-Crossover-Verhalten nahe Raumtemperatur
Abstract
Durch die Verwendung von 4-(4′-Pyridyl)anilin als einfachen organischen Baustein in Kombination mit drei verschiedenen Aldehydkomponenten und Metall(II)salzen wurden drei verschiedene Fe8Pt6-Würfel und ihre entsprechenden Zn8Pt6-Analoga mit Hilfe des Subkomponenten Selbstorganisationsansatzes hergestellt. Während die Verwendung von Zink(II)-Salzen zu diamagnetischen Käfigen führte, ergaben Eisen(II)-Salze metallosupramolekulare Käfige, die in Lösung Spin-Crossover-Verhalten zeigen. Die Spin-Übergangstemperatur T1/2 hängt von der verwendeten Aldehydkomponente ab, wodurch sich ein Baukasten für die gezielte Synthese von Spin-Crossover-Verbindungen mit maßgeschneiderten Übergangseigenschaften ergibt. Der Einbau von 4-Thiazolcarbaldehyd oder N-Methyl-2-Imidazolcarbaldehyd führte zu Käfigen, die bei Raumtemperatur einen Spin-Crossover durchlaufen, während der mit 1H-4-Imidazolcarbaldehyd erhaltene Käfig einen Spin-Übergang bei niedrigen Temperaturen zeigt. Drei der neuen Aggregate wurden durch Synchrotron-Röntgenbeugung strukturell charakterisiert und alle Strukturen wurden mittels Massenspektrometrie, NMR und UV/Vis-Spektroskopie untersucht.
Einleitung
Die metallosupramolekulare Chemie1 ist ein sich rasch entwickelndes Gebiet, das zahlreiche Koordinationskäfige mit unterschiedlichen Geometrien und Architekturen hervorgebracht hat.2 Da noch größere strukturelle Vielfalt und Komplexität mit monometallischen Ansätzen jedoch immer schwieriger zu erreichen sind,3 wurden neue Strategien entwickelt, die auf die Konstruktion heterobimetallischer Komplexe abzielen. Dazu gehört beispielsweise die Umsetzung neuer Konzepte wie die Komplex-als-Ligand-Strategie,4 die zu immer mehr Studien über heterobimetallische Käfige mit unterschiedlichen Formen und Geometrien geführt hat.4, 5 Auf der Suche nach neuen funktionellen Materialien bieten solche heterobimetallischen Aggregate zudem spannende Möglichkeiten, die Eigenschaften zweier verschiedener Metallzentren in einer diskreten Struktur zu kombinieren und so möglicherweise ihre elektrochemischen,6 photophysikalischen7 oder magnetischen Eigenschaften zu erweitern.8
Eine prominente magnetische Eigenschaft, die das Interesse vieler Forscher geweckt hat, ist das Phänomen des Spin-Crossover,9 bei dem ein System durch äußere Reize wie Temperatur,10 Licht11 oder Druck zwischen unterscheidbaren Zuständen mit hohem und niedrigem Spin umschaltet.12 Insbesondere Systeme auf Basis von Eisen(II)salzen wurden intensiv auf ihre Spin-Crossover-Eigenschaften hin untersucht,10, 11, 12, 13 da Eisen(II) zwischen einem paramagnetischen (high-spin) und einem diamagnetischen (low-spin) Zustand umschaltet. Dies bietet die Möglichkeit, beide Zustände leicht anhand ihres Magnetismus und oft auch ihrer optischen Eigenschaften zu unterscheiden. Aufgrund dieses Verhaltens sind Spin-Crossover-Systeme interessante Materialien für verschiedene Anwendungen, bei denen es auf molekulares Schalten ankommt.14 Dabei schränken niedrige Übergangs-temperaturen die Anwendbarkeit von Spin-Crossover-Systemen allerdings häufig ein, weshalb die Suche nach Systemen, die einen Spinübergang in der Nähe der Raumtemperatur durchlaufen, ein wünschenswertes Ziel ist. Bei der Entwicklung neuer Spin-Crossover-Materialien hat die supramolekulare Chemie zunehmend an Bedeutung gewonnen, da supramolekulare Architekturen die Möglichkeit bieten, mehrere Spin-Crossover-Zentren in mehrkernigen Komplexen wie quadratischen und gitterförmigen Aggregaten,15 Helicaten,16 oder supramolekularen Tetraedern mechanisch zu verbinden.10a, 17 Bislang sind in der Literatur jedoch nur sehr wenige Beispiele für Spin-Crossover-Käfige mit einer höheren Anzahl an Metallzentren als vier bekannt.10d, 18 Dies könnte darauf zurückzuführen sein, dass klassische kovalente Synthesestrategien zur Herstellung entsprechender Liganden für die Bildung solcher Strukturen oft sehr aufwendig sind und daher die Möglichkeit einschränken, den Einfluss verschiedener Liganden auf die Spin-Crossover-Zentren zu untersuchen. All dies macht die Suche nach Systemen, die einen Spin-Übergang nahe der Raumtemperatur zeigen, zu einem anspruchsvollen Unterfangen.
Im Jahr 2012 stellten Nitschke et al. einen beeindruckenden heterobimetallischen kubischen Käfig mit der Gesamtformel [Fe8(PtL4)6]28+ vor. Dieser Käfig enthielt acht Eisen(II)-Zentren, die durch Pyridylimin-Bindungsstellen mit Eisenzentren im diamagnetischen low-spin-Zustand koordiniert waren. Die Eisenkationen an den Ecken des Würfels wurden durch vierwertige [PtL4]-Bausteine verbrückt, die jeweils die Fläche des Würfels bilden. Die Synthese dieses Käfigs war relativ einfach, indem der Platin(II)-Vorläuferbaustein mit 2-Formylpyridin als Azin-Komponente und einem Eisen(II)-Salz kombiniert wurde.5b
Mit dieser Arbeit erweitern wir das von Nitschke etablierte Konzept, um diesen Ansatz für die Synthese von schaltbaren Spin-Crossover-Käfigen zu nutzen. Aus der Literatur ist bekannt, dass der Austausch von Azin-Bausteinen im letzten Teilschritt der Selbstorganisation durch geeignete Azol-Bausteine eine effektive Möglichkeit darstellt, die Ligandenfeldstärke zu verringern. Eine solche Verringerung der Ligandenfeldstärke kann letztlich zur Stabilisierung des paramagnetischen high-spin-Zustandes in Eisen(II)-Kationen führen und bei geschickter Feinabstimmung sogar einen Spin-Crossover-Prozess ermöglichen.10d, 10e, 16, 17a-18, 19
Hier stellen wir drei neue metallosupramolekulare Spin-Crossover-Käfige vor, von denen zwei einen Spin-Übergang in der Nähe von Raumtemperatur und einer einen Übergang bei niedrigen Temperaturen zeigen. Alle drei Liganden sind direkt miteinander verwandt und können leicht aus demselben Ausgangsmaterial durch eine einfache Subkomponenten-Selbstorganisationsstrategie gewonnen werden.20 Zusätzlich berichten wir auch von den diamagnetischen Zink(II)-Analoga aller Spin-Crossover-Würfel, die insbesondere mittels NMR-spektroskopischer Methoden eingehend untersucht werden konnten.
Ergebnisse und Diskussion
Synthese und strukturelle Charakterisierung
Der Subkomponenten-Selbstorganisationsansatz ist mittlerweile ein gut etabliertes und leistungsfähiges Werkzeug, das nicht nur die Synthese von Liganden (und Käfigen) vereinfacht, sondern auch ein schnelles Screening von einer Vielzahl von Ligandenstrukturen auf modulare Weise erlaubt.20 Da sich dieser Ansatz bereits für die Assemblierung heterobimetallischer Strukturen als nützlich erwiesen hat,4d-4h haben wir uns für den zuvor von Nitschke5b als Tetrafluoroboratsalz eingeführten, robusten D4-symmetrischen Metalloliganden [Pt] entschieden, um die angestrebten heterobimetallischen Strukturen herzustellen. Dieser Vorläufer lässt sich leicht durch die Verbindung von vier Äquivalenten 4-(4′-Pyridyl)anilin, das nach einem aus der Literatur bekannten Verfahren synthetisiert wurde,21 mit einem Äquivalent Bis(acetonitril)platin(II)chlorid in Gegenwart von zwei Äquivalenten Silber(I)tetrafluoroborat5b synthetisieren. Da die Pt−N-Bindung bemerkenswert stark ist,22 erwies sich der Metalloligand [Pt] unter normalen Umgebungsbedingungen über mehrere Wochen als stabil. Sechs Äquivalente [Pt] ergaben so zusammen mit 24 Äquivalenten der Aldehydkomponenten 1H-4-Imidazolcarbaldehyd 1, N-Methyl-2-imidazolcarbaldehyd 2 oder 4-Thiazolcarbaldehyd 3 und 8 Äquivalenten Eisen(II)tetrafluoroborat-Hexahydrat bzw. Zink(II)-tetrafluoroborat sechs verschiedene vierzehnkernige heterobimetallische Würfel [M8(PtL4)6](BF4)28 (M=Fe oder Zn, L=1-(1H-Imidazol-4-yl)-N-(4-(pyridin-4-yl)phenyl)methanimin, 1-(1-Methyl-1H-imidazol-2-yl)-N-(4-(pyridin-4-yl)phenyl)methanimin) oder N-(4-(Pyridin-4-yl)phenyl)-1-(thiazol-4-yl)methanimin) [Fe1–3] bzw. [Zn1–3] (Schema 1).
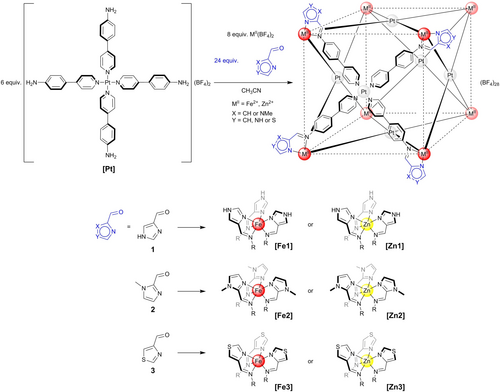
Synthesestrategie für die Herstellung der heterobimetallischen Würfel [Fe1]–[Fe3] und [Zn1]–[Zn3] aus dem Platin(II)-Vorläufer [Pt].
Die reversible Bildung der Iminbindungen in situ und der eher labile Charakter der Eisen(II)-Stickstoff- und Zink(II)-Stickstoff-Bindungen sorgten in allen Fällen für eine schnelle Käfigbildung innerhalb von 12 Stunden bei 65 °C und erlaubten die Isolierung der anvisierten kubischen Käfige in 87–95 % Ausbeute (siehe Hintergrundinformationen). Die auf Zink(II) basierenden Käfige [Zn1–3] sind vollständig diamagnetisch und ermöglichten daher umfassende NMR-spektroskopische Untersuchungen (siehe Hintergrundinformationen). Die 1H- und 13C-NMR-Spektren aller Käfige zeigten jeweils einen definierten Satz von Signalen, der auf das Vorhandensein von O-symmetrischen Komplexen in Lösung hinweist. 1H-2D-DOSY NMR-Spektren bestätigten die Bildung diskreter Strukturen mit solvodynamischen Radien von 1,58-1,60 nm (Abbildung 1). Zudem zeigten die 1H-NMR-Spektren der Würfel [Zn1–3] auch, dass selbst nach wiederholter Kristallisation und Extraktion der Komplexe geringe Mengen der entsprechenden Aldehyde in den Proben vorhanden waren. Außerdem fanden wir in den ESI-MS-Spektren über mehrere Wochen hinweg eine zunehmende Menge der freien Aldehyde und der entsprechenden Säuren, was darauf schließen lässt, dass die Käfige [Zn1–3] in Lösung sehr langsam zerfallen. Die Identität der Zink(II)-Würfel konnte allerdings trotzdem durch Elektrospray-Ionisations-Massenspektrometrie (ESI-MS) und UV/Vis-Spektroskopie zweifelsfrei bestätigt werden (siehe Hintergrundinformationen).
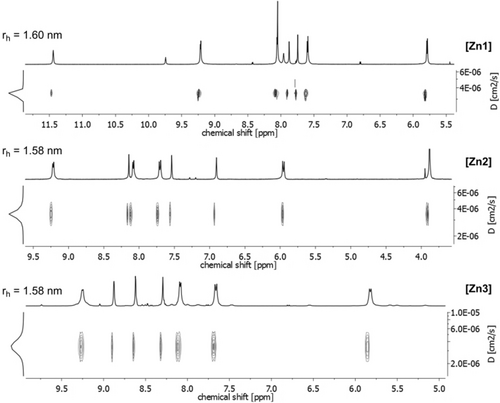
1H-2D-DOSY-Spektren (700 MHz, Acetonitril-d3, 298 K) von [Zn1] (rh=1,60 nm, oberes Spektrum); [Zn2] (rh=1,58 nm, Spektrum in der Mitte) und [Zn3] (rh=1,58 nm, unteres Spektrum).
Die Käfige, die Eisen(II)ionen enthalten, konnten ebenfalls durch 1H-NMR23 und UV/Vis-Spektroskopie und ESI-MS identifiziert werden. In Übereinstimmung mit den entsprechenden Zinkanaloga wurde auch in den 1H-NMR-Spektren der Eisenkäfige [Fe1–3] nur einen Satz von Signalen beobachtet, was wiederum auf symmetrische O-Aggregate in Lösung hindeutet.
Drei der vorgestellten Käfige konnten wir zusätzlich in ihrem kristallinen Zustand charakterisieren.24 [Fe2] und [Fe3] wurden nach anfänglicher Fällung durch langsame Diffusion von Diethyletherdampf in Acetonitrillösungen der Käfige, durch Extraktion des so erhaltenen Niederschlags mit Acetonitril und anschließende langsame Diffusion von tert-Butylmethylether in die Acetonitrillösungen kristallisiert (Einzelheiten siehe Hintergrundinformationen). Dieses Verfahren führte zu roten blockförmigen Kristallen aus [Fe2] und dunkelroten plättchenförmigen aus [Fe3], deren Einkristallstrukturen durch die Kombination aus kryogener Kristallhandhabung und Synchrotronstrahlung25 bestimmt werden konnten (Abbildung 2).
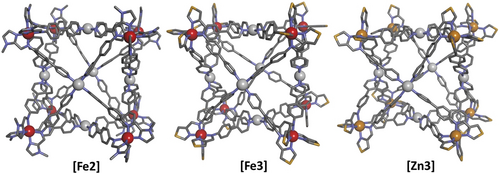
Festkörperstrukturen von [Fe2] (links), [Fe3] (Mitte) und [Zn3] (rechts), wie sie durch Einkristall-Röntgenbeugung mit Synchrotronstrahlung bestimmt werden konnten. Wasserstoffatome, Gegenionen und Solvatmoleküle sind aus Gründen der Übersichtlichkeit nicht dargestellt. Farbcode: grau – Kohlenstoff, rot – Eisen, weiß – Platin, orange – Zink, blau – Stickstoff, gelb – Schwefel.
In beiden Aggregaten besetzen die Platin(II)-Kationen die Zentren der Oberflächen der kubischen Assemblate, die jeweils von vier 4-Pyridyl-Donoren quadratisch-planar koordiniert werden. [Fe2] kristallisiert in der tetragonalen Raumgruppe P4/n mit einem Viertel des Würfels in der asymmetrischen Einheit, wobei beide homochiralen Enantiomere (all-Λ und all-Δ) in der Einheitszelle gefunden wurden. Die Eisen(II)-Kationen werden von drei N-Methyl-2-imidazolylimin-Einheiten in einer Koordinationssphäre koordiniert, die am besten als oktaedrisch beschrieben werden kann. Die Fe−N-Bindungslängen bei 80 K liegen zwischen 1,85(3) und 2,20(3) Å. Die als Abstand zwischen zwei Eisenatomen gemessene Raumdiagonale beträgt 2,88 nm und der Pt-Pt-Abstand zweier gegenüberliegender Platin(II)-Kationen 1,60 nm. Wahrscheinlich ist der große Hohlraum mit ungeordneten Lösungsmittelmolekülen und Gegenanionen gefüllt.
[Fe3] kristallisiert in der triklinen Raumgruppe P , mit zwei Würfeln in der asymmetrischen Einheit. Die Analyse wurde dadurch erschwert, dass einer der beiden Würfel fehlgeordnet ist und in zwei diskreten Positionen modelliert werden musste. Auch hier sind beide homochiralen Enantiomere in der Einheitszelle vorhanden. Die Eisen(II)-Kationen in [Fe3] werden durch drei 4-Thiazolylimin-Chelatliganden in ähnlicher Weise koordiniert wie bei [Fe2] und die Fe−N-Bindungslängen bei 80 K liegen zwischen 1,89(2) und 2,06(2) Å. Insgesamt wird eine sehr ähnliche Dimension dieses Käfigs beobachtet, wie sie bereits für [Fe2] gefunden wurde (Fe-Fe[Fe3]=2,85 nm; Pt-Pt[Fe3]=1,65 nm).
, mit zwei Würfeln in der asymmetrischen Einheit. Die Analyse wurde dadurch erschwert, dass einer der beiden Würfel fehlgeordnet ist und in zwei diskreten Positionen modelliert werden musste. Auch hier sind beide homochiralen Enantiomere in der Einheitszelle vorhanden. Die Eisen(II)-Kationen in [Fe3] werden durch drei 4-Thiazolylimin-Chelatliganden in ähnlicher Weise koordiniert wie bei [Fe2] und die Fe−N-Bindungslängen bei 80 K liegen zwischen 1,89(2) und 2,06(2) Å. Insgesamt wird eine sehr ähnliche Dimension dieses Käfigs beobachtet, wie sie bereits für [Fe2] gefunden wurde (Fe-Fe[Fe3]=2,85 nm; Pt-Pt[Fe3]=1,65 nm).
Ein Zyklus aus langsamer Diffusion von tert-Butylmethylether in eine Acetonitrillösung von [Zn3] und anschließender Extraktion mit Acetonitril ergab transparente gelbe plättchenförmig Kristalle, die sich für eine Bestimmung der Einkristallstruktur mittels Synchrotronstrahlung eigneten (Abbildung 2).
[Zn3] kristallisiert ebenfalls in der triklinen Raumgruppe P allerdings mit einem vollen Würfel in der asymmetrischen Einheit und einer racemischen Mischung der homochiralen Aggregate. Wie schon bei [Fe2] und [Fe3] besetzen die Platin(II)ionen die C4-Symmetrieachse eines insgesamt (annähernd) O-symmetrischen kubischen Käfigs, während die Zink(II)-Kationen die C3-symmetrischen Ecken bilden. Jedes Zinkkation wird von drei 4-Thiazolylimin-Donoren koordiniert, wobei die Zn-N-Abstände zwischen 2,12(3)–2,26(2) Å liegen. Auch für die raumdiagonalen Zn-Zn-Abstände und den Abstand zwischen zwei gegenüberliegenden Pt-Zentren wurden ähnliche Dimensionen gefunden (Zn-Zn[Zn3]=2,88 nm; Pt-Pt[Zn3]=1,66 nm), die zudem auch in sehr guter Übereinstimmung mit den aus den DOSY-NMR-Experimenten abgeleiteten Abständen sind.
allerdings mit einem vollen Würfel in der asymmetrischen Einheit und einer racemischen Mischung der homochiralen Aggregate. Wie schon bei [Fe2] und [Fe3] besetzen die Platin(II)ionen die C4-Symmetrieachse eines insgesamt (annähernd) O-symmetrischen kubischen Käfigs, während die Zink(II)-Kationen die C3-symmetrischen Ecken bilden. Jedes Zinkkation wird von drei 4-Thiazolylimin-Donoren koordiniert, wobei die Zn-N-Abstände zwischen 2,12(3)–2,26(2) Å liegen. Auch für die raumdiagonalen Zn-Zn-Abstände und den Abstand zwischen zwei gegenüberliegenden Pt-Zentren wurden ähnliche Dimensionen gefunden (Zn-Zn[Zn3]=2,88 nm; Pt-Pt[Zn3]=1,66 nm), die zudem auch in sehr guter Übereinstimmung mit den aus den DOSY-NMR-Experimenten abgeleiteten Abständen sind.
Magnetische Eigenschaften der Käfige [Fe1], [Fe2] und [Fe3]
NMR-spektroskopische Untersuchungen der Eisen(II)-haltigen heterobimetallischen Käfige [Fe1–3] ergaben 1H-NMR-Signale, die nicht den rein diamagnetischen Verbindungen zugeordnet werden konnten. Während [Fe1] verbreiterte Signale im Bereich von −9 bis +156 ppm zeigte, was auf paramagnetische Eisen(II)-Komplexe im high-spin-Zustand schließen lässt,26 zeigten die Käfige [Fe2] und [Fe3] Signale, die auf das Vorhandensein von Eisen(II)-Ionen im high- und low-spin-Zustand bei Raumtemperatur schließen lassen. Die 1H-NMR-Signale von [Fe2] waren dabei mit chemischen Verschiebungen von bis zu 88 ppm deutlich weiter tieffeld-verschoben, als die Signale von [Fe3] bei Raumtemperatur, die eine weniger stark ausgeprägte Tieffeld-Verschiebung von bis zu 45 ppm aufwiesen. Die so beobachteten chemischen Verschiebungen deuten darauf hin, dass der Anteil der Eisen(II)-Kationen im high-spin-Zustand bei Raumtemperatur in der Reihenfolge [Fe1] > [Fe2] > [Fe3] in Übereinstimmung mit den beobachteten Tieffeld-Verschie-bungen abnimmt. Zur weiteren Untersuchung der magnetischen Eigenschaften dieser Käfige in Acetonitrillösungen, insbesondere ihrer Spin-Crossover-Eigenschaften, führten wir temperaturabhängige NMR-Experimente nach der Evans-Methode27 durch und verwendeten zusätzlich auch noch das ideal solution Modell28, 29, 10d, 17a zur Auswertung unserer Ergebnisse (Abbildung 3, Hintergrundinformationen).30
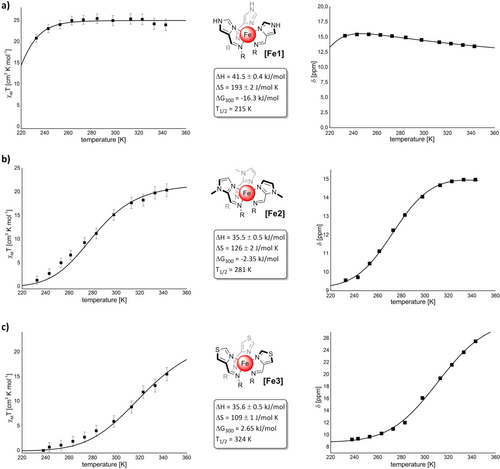
Berechnete molare magnetische Suszeptibilitäten multipliziert mit der Temperatur χMT auf der Grundlage des ideal solution Modells (linke Spalte, Quadrate sind die mit der Evans-Methode erhaltenen Werte mit berechneten Fehlerbalken und die Linien sind die nichtlinearen Regressionen nach dem ideal solution Modell.) für a) [Fe1], b) [Fe2] und c) [Fe3] und die entsprechenden temperaturabhängigen 1H-NMR-Verschiebungen ausgewählter Protonen in Acetonitril-d3 (schwarze Quadrate, die Linien entsprechen den nichtlinearen Regressionen nach dem ideal solution Modell in der rechten Spalte). Die Kästen fassen die thermodynamischen Daten auf der Grundlage des ideal solution Modells zusammen. Dabei gilt es zu beachten, dass für die Analyse des Verhaltens von [Fe3] ein 1H-NMR-Signal mit einer ausgeprägteren Tieffeld-Verschiebung gewählt wurde als bei [Fe1] und [Fe2]. Dies geschah um die Präzision der Analyse zu verbessern, indem wir Signale auswählten, die leicht zu verfolgen und genau zu lokalisieren waren. Generell, zeigen die NMR-Spektren jedoch, dass die Tieffeld-Verschiebung bei [Fe3] weniger stark ausgeprägt ist, als bei den anderen Eisenkäfigen.
Der 4-Imidazolylimin-Käfig [Fe1] erwies sich bei Raum-temperatur als rein paramagnetisch31 und zeigte eine mit der Temperatur multiplizierte molare magnetische Suszeptibilität von χMT298 K=24,9 cm3 K mol−1 (ideal solution Modell) bzw. χMT298 K=24,9±1,2 cm3 K mol−1 (Evans-Methode).32 Der high-spin-Zustand erwies sich bis zu einer Temperatur von etwa 245 K als stabil. Bei einer weiteren Absenkung der Temperatur beobachteten wir den Beginn eines Spin-Crossover-Prozesses, und bei 233 K wurden magnetische Suszeptibilitäten von χMT233 K=20,8 cm3 K mol−1 (ideal solution Modell) und χMT233 K=20,8±0,9 cm3 K mol−1 (Evans-Methode) ermittelt, was bedeutet, dass sich noch etwa 85 % der Eisen(II)-Zentren im paramagnetischen high-spin-Zustand befinden. Aufgrund der durch den Gefrierpunkt von Acetonitril gegebenen Beschränkung konnten wir den Spin-Übergang nicht bei noch niedrigeren Temperaturen verfolgen, aber eine nichtlineare Regression auf der Grundlage des ideal solution Modells (Hintergrundinformationen) sagt voraus, dass die Spin-Übergangstemperatur von [Fe1] bei T1/2=215 K liegen sollte (Abbildung 3 a).
Das bei Raumtemperatur aufgenommene 1H-NMR-Spektrum des N-Methyl-2-imidazolylimin-Käfigs [Fe2] deutete bereits darauf hin, dass bei dieser Temperatur sowohl Eisen(II)-Zentren im high- als auch im low-spin Zustand vorhanden sind. Diese Beobachtung wurde durch unsere Experimente bestätigt, die eine magnetische Suszeptibilität bei Raumtemperatur von χMT298 K=15,3 cm3 K mol−1 (ideal solution Modell) und χMT298 K=15,1±1,2 cm3 K mol−1 (Evans-Methode) ergaben. Dieser Wert entspricht einem Anteil von 63 % der Eisen(II)-Zentren im paramagnetischen high-spin-Zustand. In Übereinstimmung mit diesem Ergebnis liegt die Spin-Übergangstemperatur dieses Käfigs mit T1/2=281 K etwas unterhalb der Raumtemperatur (Abbildung 3 b).
Innerhalb der durch das Lösungsmittel gesetzten Temperaturgrenzen konnten wir weder einen rein paramagnetischen noch einen rein diamagnetischen Zustand des Komplexes beobachten. Bei 343 K beträgt die magnetische Suszeptibilität χMT343 K=20,5 cm3 K mol−1 (ideal solution Modell) und χMT343 K=20,3±1,3 cm3 K mol−1 (Evans-Methode) (entspricht etwa 84 % high-spin-Eisen(II)-Zentren), und bei 233 K beträgt sie χMT233 K=0,8 cm3 K mol−1 (ideal solution Modell). Bei 233 K ist die Situation so, dass fast nur noch vollständig diamagnetische low-spin-Komplexe vorhanden sind, so dass die Anwendung der Evans-Methode zu Messfehlern führen kann (Diskussion in Hintergrundinformationen).
Der 4-Thiazolylimin-Käfig [Fe3] zeigte eine am wenigsten ausgeprägte Tieffeld-Verschiebung der 1H-NMR-Signale bei Raumtemperatur, was darauf hindeutet, dass die untersuchten Komplexe bei dieser Temperatur den höchsten Anteil an low-spin-Eisen(II)-Zentren aufweisen. Tatsächlich betrug die magnetische Suszeptibilität bei Raumtemperatur nur χMT298 K=5,6 cm3 K mol−1 (ideal solution Modell) und χMT298 K=5,9±1,1 cm3 K mol−1 (Evans-Methode), was auf einen Anteil von 77 % der Eisen(II)-Zentren im diamagnetischen low-spin-Zustand schließen lässt. Bei 233 K konnte daher gar keine magnetische Suszeptibilität mehr mit der Evans-Methode gemessen werden, während das ideal solution Modell den sehr kleinen Wert χMT233 K=0,1 cm3 K mol−1 ergab.
Bei hohen Temperaturen hingegen wird der Anteil der high-spin-Zentren deutlich größer, und bei 343 K erhielten wir Werte von χMT343 K=15,9 cm3 K mol−1 (ideal solution Modell) und χMT343 K=15,5±1,3 cm3 K mol−1 (Evans-Methode), was deutlich macht, dass [Fe3] mit T1/2=324 K, also etwas oberhalb der Raumtemperatur, die höchste Spinübergangstemperatur der untersuchten Käfige aufweist (Abbildung 3 c).
Das ideal solution Modell liefert nicht nur magnetische Suszeptibilitäten, sondern kann auch verwendet werden, um thermodynamische Daten aus temperaturabhängigen 1H-NMR-Experimenten zu erhalten (Abbildung 3, Details in den Hintergrundinformationen). Da das Spin-Crossover-Phänomen ein hauptsächlich entropisch getriebener Prozess ist,9d nehmen die berechneten Übergangsentropien ΔS mit sinkenden Übergangstemperaturen zu. Mit anderen Worten: Die Übergangsentropie des Systems ist hoch, wenn die Stabilisierung des paramagnetischen high-spin-Zustands hoch ist. Dementsprechend beobachteten wir ΔS([Fe1]) > ΔS([Fe2]) > ΔS([Fe3]). Darüber hinaus deuten die berechneten Übergangsenthalpien ΔH und Übergangsentropien ΔS darauf hin, dass ΔG300 für [Fe1] und [Fe2] negativ ist, was bedeutet, dass der high-spin-Zustand bei 300 K tatsächlich der bevorzugte Zustand ist, während ΔG300 für [Fe3] positiv ist und somit darauf hinweist, dass der high-spin-Zustand für diesen Käfig bei 300 K weniger begünstigt ist als der low-spin-Zustand. Diese Ergebnisse stehen im Einklang mit den ermittelten Übergangstemperaturen, die für [Fe1] und [Fe2] unter 300 K, für [Fe3] jedoch über 300 K liegen. Dieses Resultat stimmt somit auch mit den Ergebnissen anderer Studien überein, die den Einfluss verschiedener Azol-Bausteine auf das Spin-Crossover-Verhalten von Eisen(II)-Kationen untersuchten. Dabei wiesen Thiazole regelmäßig das stärkste Ligandenfeld unter den Azolen auf und führten folglich zu den höchsten Spin-Übergangstemperaturen.10e, 16b, 16c, 19
Zusammenfassung
In dieser Studie haben wir die modulare Synthese von sechs heterobimetallischen kubischen Käfigen vorgestellt, die alle von demselben D4-symmetrischen Platin(II)-Metalloliganden [Pt] ausgehen. Die eigentlichen chelatbildenden Liganden ließen sich dann leicht durch einen Subkomponenten-Selbstorganisationsansatz erhalten, der eine einfache Synthese von drei direkt verwandten Liganden ermöglichte, indem 1H-4-Imidazolcarbaldehyd 1, N-Methyl-2-imidazolcarbaldehyd 2 oder 4-Thiazolcarbaldehyd 3 als Subkomponenten verwendet wurden. Die Verwendung von Zink(II)-Salzen ergab die diamagnetischen Käfige [Zn1–3], an denen wir umfassende NMR-spektroskopische Untersuchungen vornehmen konnten. Die Verwendung von Eisen(II)-Salzen führte dagegen zu den Käfigen [Fe1–3], die in Lösung Spin-Crossover-Eigenschaften zeigten. Drei dieser großen vierzehnkernigen Käfige konnten wir auch in ihrem festen Zustand charakterisieren.
Das magnetische Verhalten der Eisen(II)-haltigen Spin-Crossover-Käfige haben wir in Acetonitrillösungen weiter untersucht und dazu sowohl die Evans-Methode als auch das ideal solution Modell verwendet. Während [Fe1] eine Spin-Übergangstemperatur bei einer vergleichsweise niedrigen Temperatur (T1/2([Fe1])=215 K) zeigte, wiesen die Käfige [Fe2] und [Fe3] Übergangstemperaturen um Raumtemperatur auf (T1/2([Fe2])=281 K; T1/2([Fe3])=324 K), was für potenzielle Anwendungen um Raumtemperatur herum viel vorteilhafter ist. Die metallosupramolekulare Chemie, insbesondere der Ansatz der Subkomponenten-Selbstorganisation, erwies sich so als einfach anwendbare Strategie zur Einstellung der Komplexeigenschaften durch den simplen Austausch von einzelnen Bausteinen des Liganden. Die Käfige [Fe1–3] erweitern somit gleichzeitig die Zahl der bekannten oktanuklearen Eisen(II)-Spin-Crossover-Käfige, die in der Literatur bislang nur selten zu finden sind.10d, 13a Damit konnten die Käfige auch das enorme Potenzial solcher vielkerniger Eisen(II)-Käfige als molekulare Schalter aufzeigen, die sehr leicht durch die Einbeziehung von Platin(II) als zweite Art von Metallkation erhalten werden können, wodurch der schnelle Zusammenbau aus kleinen und einfachen Bausteinen gewährleistet wird. Die großen Hohlräume der vorgestellten Verbindungen könnten zudem auch noch die Aufnahme von Gästen ermöglichen, was eine zusätzliche Möglichkeit zur Manipulation des Spin-Crossover-Prozesses eröffnen sollte und in künftigen Arbeiten untersucht werden soll.
Acknowledgements
M.H. dankt der Jürgen-Manchot-Stiftung für ein Promotionsstipendium. N.S. bedankt sich bei der Evonic Foundation für ein Promotionsstipendium. Wir danken der DFG, SFB 813 “Chemie an Spinzentren” für die finanzielle Unterstützung. S.H. dankt dem JSPS Program for Advancing Strategic International Networks to Accelerate the Circulation on Talented Researchers. G.H.C., J.T. und J.J.H. danken dem Europäischen Forschungsrat (ERC Consolidator grant 683083, RAMSES) für die Unterstützung dieser Studie. Die Beugungsdaten von [Fe2], [Fe3] und [Zn3] wurden am PETRA III bei DESY, einem Mitglied der Helmholtz-Gemeinschaft (HGF), gemessen. Die Autoren danken Eva Crosas und Olga Lorbeer für die Unterstützung bei der Nutzung der Synchrotron-Beamline P11 (I-20180412). Open Access Veröffentlichung ermöglicht und organisiert durch Projekt DEAL.
Conflict of interest
Die Autoren erklären, dass keine Interessenkonflikte vorliegen.




