Tetrapyrrolische Pigmente aus dem Häm- und Chlorophyllabbau interagieren mit Aktin
Abstract
Chlorophyll und Häm sind sogenannte “Pigmente des Lebens”, tetrapyrrolische Strukturen, ohne die das Leben auf der Erde nicht möglich wäre. Ihre Abbauprodukte, die Phyllobiline bzw. die Biline, teilen nicht nur strukturelle Merkmale, sondern auch eine ähnliche Geschichte: Lange Zeit wurden sie nur als Abfallprodukte von Entgiftungsprozessen angesehen; inzwischen konnten für beide Klassen wichtige Bioaktivitäten nachgewiesen werden. Für die Phyllobiline gibt es jedoch nur wenige Erkenntnisse über physiologische Rollen. Hier stellen wir mit Aktin, dem Hauptbestandteil des Zytoskeletts, die erste entdeckte Zielstruktur von Phyllobilinen und eine neue Zielstruktur von Bilinen vor. Wir zeigen die Hemmung der Aktindynamik in vitro und Auswirkungen auf Aktin und Aktin-abhängige Prozesse in Krebszellen. Eine direkte Interaktion mit G-Aktin wird durch in silico-Studien dargelegt und durch Affinitätschromatographie bestätigt. Unsere Ergebnisse eröffnen ein neues Kapitel über Bioaktivitäten von Tetrapyrrolen – insbesondere der Phyllobiline – und bilden die Grundlage für weitreichende Anwendungen in der Pflanzenwissenschaft, Ökologie und Physiologie.
Einleitung
Tetrapyrrolische Pigmente gehören zu den wichtigsten Naturstoffen auf der Erde. Einige dieser Pigmente sind Teil essentieller Prozesse in lebenden Organismen, wodurch sie den Namen “Pigmente des Lebens” erhielten.1 Unter diesen spielen das grüne Pigment Chlorophyll (Chl) und das rote Blutpigment Häm entscheidende Rollen bei mehreren biologischen Prozessen.2 Beide Substanzen sind im ungebundenen Zustand giftig und müssen abgebaut werden.3 Die dabei entstehenden Abbauprodukte sind die Biline aus dem Abbau von Häm und die Phyllobiline, die während des Chl-Katabolismus entstehen.
Biline sind vor allem als Stoffwechselprodukte des Hämabbaus in Säugetieren bekannt, kommen aber auch in niederen Wirbeltieren, Pflanzen, Algen und Bakterien vor. Während des Hämabbaus katalysiert die Häm-Oxygenase die oxygenolytische Öffnung des Makrozyklus an einer der vier Methinbrücken, wodurch das lineare Tetrapyrrol Biliverdin (BV) entsteht (Schema 1). In der Leber von Säugetieren wird BV durch die Biliverdin-Reduktase A zu Bilirubin (BR) reduziert. Ursprünglich nahm man an, dass Biline Abfallprodukte eines katabolischen Prozesses sind, jedoch konnte mittlerweile umfangreiche Literatur relevante Bioaktivitäten für BR und BV aufzeigen, z. B. ihr Potential als starke endogene Antioxidantien.4 Darüber hinaus haben Studien protektive Eigenschaften gegen eine Vielzahl von Krankheiten wie Herzschädigungen, gastrointestinale Entzündungen oder neurodegenerative Erkrankungen nachgewiesen.5
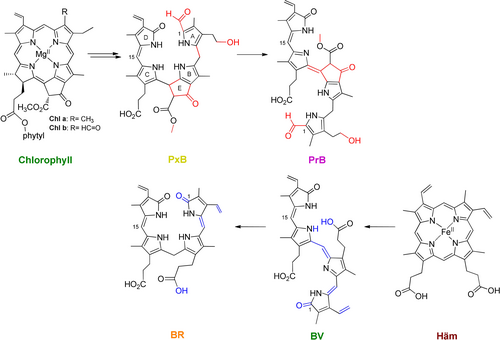
Strukturelle Übersicht zum Vergleich der durch den Hämabbau entstehenden Biline, Bilirubin (BR) und Biliverdin (BV), und der späteren Schritte des Chl-Katabolismus, durch den die farbigen Phyllobiline, das Phylloxanthobilin (PxB, das am häufigsten identifizierte Modifikationsmotiv ist dargestellt11) und das Phylloroseobilin (PrB), entstehen. Strukturelle Unterschiede zwischen Metaboliten des Häm- und Chl-Katabolismus sind farblich hervorgehoben.
Phyllobiline (PBs) sind die Abbauprodukte des grünen Pflanzenpigments Chl und werden in seneszenten Blättern im Herbst sowie in reifendem Obst und Gemüse gebildet.6 Zunächst wurde vermutet, dass PBs – ähnlich wie die Biline – “nur” Produkte eines Entgiftungsprozesses sind. Es stellte sich heraus, dass der entsprechende Abbauprozess viel komplexer ist als der Abbau des strukturell vergleichbaren Häms, aber ebenfalls eine enzymatische Öffnung des Makrozyklus beinhaltet. Im Falle des Chl-Abbaus wird dieser durch die Phäophorbid a-Oxygenase katalysiert.7 In einem streng kontrollierten Prozess werden farblose Chl-Abbauprodukte, die Phylloleucobiline (PleBs), gebildet und reichern sich in den Vakuolen der Pflanzenzelle an.6, 8 In den Jahren 2008 und 2011 konnten Oxidationsprodukte eines PleB, so genannte Phyllochromobiline, identifiziert werden: ein gelbes Phylloxanthobilin (PxB) und ein rosafarbenes Phylloroseobilin (PrB). Im Gegensatz zur enzymatischen Reduktion von BV ist der Mechanismus der Bildung von dem PxB und dem PrB in Pflanzen noch nicht geklärt. Neuere Studien deuten jedoch auf eine enzymatische “oxidative Aktivität” hin, die PleBs effektiv in PxBs umwandelt.10
Die in der späten Phase des Chl-Abbaus gebildeten PBs, PxB und PrB, weisen eine bemerkenswerte strukturelle Ähnlichkeit mit BR und BV auf.6 Dabei ähnelt das PxB dem finalen Häm-Abbauprodukt BR durch die Doppelbindung an C15, während das PrB, das Oxidationsprodukt des PxB, durch ein erweitertes konjugiertes π-System das Analogon des BV darstellt. Strukturelle Unterschiede äußern sich durch die 1-Formyl-Gruppe an Ring A und dem zusätzlichen Ring E der PBs (Schema 1).
PBs erwiesen sich als Stoffe mit sehr interessanten chemischen Eigenschaften und es wurden bereits mögliche bioaktive Eigenschaften vermutet.6, 12 Erste Hinweise erbrachten Müller et al. im Jahr 2007 durch den Nachweis einer starken antioxidativen Aktivität eines PleB in Schalen von Äpfeln und Birnen.13 In der Zwischenzeit konnten auch für PxBs antioxidative Eigenschaften und entzündungshemmende Aktivitäten nachgewiesen werden.14 Darüber hinaus wurde gezeigt, dass PxBs von Zellen aufgenommen werden und vielversprechende Aktivitäten gegen Krebszellen aufweisen.11, 15 Im Vergleich zu den Bilinen sind die Untersuchungen zur physiologischen Rolle der PBs jedoch noch weniger weit fortgeschritten.
Biline und PBs sind ubiquitäre tetrapyrrolische Strukturen und neueste Studien verdeutlichen die Notwendigkeit, potentielle Zielstrukturen dieser Substanzen aufzudecken.16 Generell ist die Identifizierung direkt interagierender Proteine entscheidend für die Aufklärung von detaillierten Mechanismen und Wirkungsweisen von Naturstoffen. Derzeit sind für beide Klassen von Tetrapyrrolen nur wenige relevante Zielstrukturen bekannt; für die PBs wurde bisher noch keine menschliche Zielstruktur identifiziert.
In einem funktionellen Screening auf mögliche Effekte von PBs auf Krebszellen beobachteten wir eine Hemmung der Zellmigration durch die Phyllochromobiline PxB und PrB. Die Untersuchung der aus dem Hämabbau stammenden Gegenspielern BR und BV ergab ebenfalls eine Auswirkung auf die Zellmotilität. Da das Zytoskelettprotein Aktin eine Schlüsselfunktion in zellulären Prozessen wie der Zellmotilität, der Stabilisierung der äußeren Zellform, der Zellteilung und dem intrazellulären Transport spielt,17 führten wir bildgebende Experimente mittels Aktin-Färbung durch, die phänotypische Veränderungen des Aktin-Zytoskeletts nach Behandlung mit den Tetrapyrrolen aufzeigten. Zelluläre Prozesse, an denen das Aktin-Zytoskelett beteiligt ist, hängen weitgehend von der Dynamik der Aktinfilamente ab, die durch Polymerisation und Depolymerisation charakterisiert ist.
Wir zeigen hier, dass das PxB und das PrB sowie die Biline BR und BV hemmende Wirkungen auf die Aktindynamik und Aktin-abhängige Funktionen in Zellen aufweisen. Darüber hinaus decken in silico-Docking-Studien für alle vier Verbindungen das Potenzial für eine direkte Bindung an G-Aktin auf, welche durch Affinitätschromatographie und biophysikalische Methoden bestätigt wurde.
Ergebnisse und Diskussion
In der vorliegenden Studie haben wir zwei PBs getestet, ein PxB und ein PrB (Schema 1), die durch Partialsynthese hergestellt wurden, wie in den Hintergrundinformationen beschrieben.9b, 18 Die Identitäten der Substanzen wurden durch HPLC, UV/Vis, HR-MS und 1H-NMR bestätigt (Abbildung S1 in den Hintergrundinformationen). Unser Ziel war es, diese beiden PBs mit den strukturellen Gegenspielern aus dem Hämabbau, BR und BV, zu vergleichen, die im Handel erhältlich sind. Wir untersuchten den Einfluss der Tetrapyrrole auf die Zellmigration mithilfe eines Scratch-Wundheilungstests in zwei verschiedenen menschlichen Krebszelllinien, T24- und HeLa-Zellen. Der Wundheilungstest zeigte, dass alle getesteten Tetrapyrrole die Zellmigration in unterschiedlichem Maße beeinflussen, jedoch ohne die Viabilität der Zellen in den für den Zellmigrationstest verwendeten Konzentrationen zu beeinträchtigen (Abbildung 1, Abbildung S2, S3). Das PrB schien dabei die wirksamste Substanz zu sein, da die Zellmigration selbst in niedrigen nanomolaren Dosen signifikant gehemmt wurde. BR und BV beeinflussten die Zellmigration nur in hohen mikromolaren Dosen: beide zeigten einen signifikanten Effekt bei 100 μM in T24-Zellen.
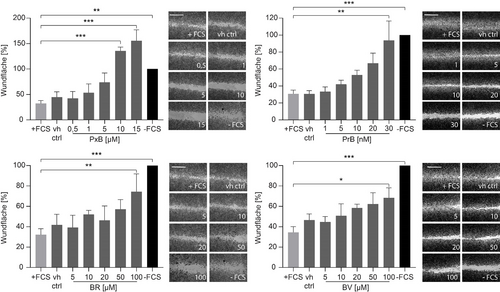
Einfluss von PBs und Bilinen auf die Zellmigration. T24-Zellen, die mit PxB, PrB, BR, BV und der Vehikelkontrolle (vh ctrl) behandelt wurden, wurden mit einem Scratch-Wundheilungstest analysiert. Die Behandlung mit Zellmedium mit fötalem Kälberserum (FCS) diente als Negativkontrolle und Medium ohne FCS als Positivkontrolle. Die Balkendiagramme zeigen die relative Wundheilungsfläche normalisiert auf die Kontrolle ohne FCS als Mittelwert±Standardfehler des arithmetischen Mittels aus drei unabhängigen Experimenten, durchgeführt jeweils in Triplikaten (einfache Varianzanalyse gefolgt von Dunnett-Test, *P<0.05, **P<0.01, ***P<0.001). Abgebildet sind repräsentative Bilder des Wundheilungstests, die 16–24 Stunden nach der Erzeugung der Wundfläche aufgenommen wurden. Maßstab: 1 mm.
Das Aktin-Zytoskelett spielt bei vielen zellulären Prozessen, einschließlich der Zellmigration, eine wichtige Rolle.19 Daher untersuchten wir die Effekte der vier migrationshemmenden Substanzen auf das Aktin-Zytoskelett in Zellen. T24- und HeLa-Zellen wurden über einen Zeitraum von vier Stunden mit PxB, PrB, BR und BV behandelt, bevor die Zellen fixiert und F-Aktin mit einem Phalloidin-Rhodamin-Farbstoff gefärbt wurde. In den Zellen, die mit niedrigen mikromolaren Konzentrationen PxB und niedrigen nanomolaren Konzentrationen PrB behandelt wurden, zeigte sich eine starke Agglomeration des Aktins in der Nähe des Zellkerns, und im Vergleich zur Kontrolle waren die Aktinfilamente deutlich desorganisierter (Abbildung 2). Im Gegensatz dazu wies die Behandlung von Zellen mit BV und BR in Konzentrationen bis zu 100 μM keinen Einfluss auf die Organisation der Aktinfilamente auf (Abbildung S4).
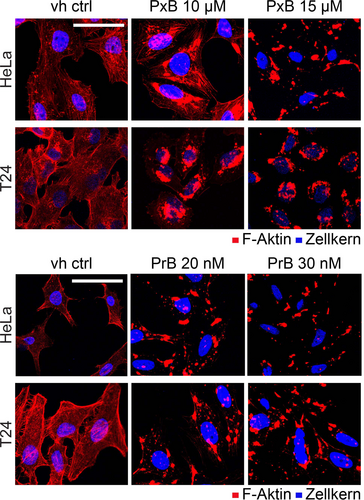
Effekte von PBs und Bilinen auf die F-Aktin-Morphologie. Bilder von HeLa- und T24-Zellen, die vier Stunden lang mit dem PxB und PrB behandelt und durch Immunfluoreszenz gefärbt wurden. Die Zellkerne wurden mit Hoechst (blau) und F-Aktin mit Rhodamin-Phalloidin (rot) gefärbt. Maßstab: 50 μm. Abgebildet sind repräsentative Bilder aus drei unabhängigen Experimenten.
Nachdem wir festgestellt hatten, dass die getesteten Verbindungen eine Wirkung auf Aktin und Aktin-abhängige Prozesse in Zellen haben, wurde ihr Einfluss auf den Auf- und Abbau von Aktin mittels verschiedener In-vitro-Versuche untersucht. Unter Verwendung von Pyren-markiertem Aktin analysierten wir die Polymerisations- und Depolymerisationsprozesse. Dabei wurde die Veränderung der Pyren-Fluoreszenzintensitäten nach Zugabe von PxB, PrB, BR und BV über die Zeit gemessen. Alle vier Substanzen zeigten eine Hemmung der Aktinpolymerisation im Vergleich zur Kontrolle. Als Reaktion auf die Zugabe von PBs und Bilinen wurde ein verlangsamter Polymerisationsprozess und ein niedrigeres Plateau der Fluoreszenzintensität beobachtet (Abbildung 3 A). Auch hier zeigten die PBs Effekte in niedrigeren Konzentrationen als die Biline, wobei das PrB die Polymerisation in vitro bereits im niedrigen mikromolaren Bereich beeinflusste. Außerdem untersuchten wir den Einfluss der Tetrapyrrole auf die Depolymerisation von F-Aktin. Alle vier Tetrapyrrole zeigten eine beschleunigte Depolymerisationsrate verglichen mit der Kontrolle. Im Vergleich mit dem Aktin-Depolymerisierer Latrunculin B (LatB),20 welcher in einer Konzentration von 10 μM gemessen wurde, zeigten das PrB (gemessen bei 50 μM), und das PxB und BV (gemessen bei 100 μM) allesamt eine erhöhte Depolymerisationsrate. BR zeigte nur einen geringen Effekt auf die Depolymerisationsrate in einer hohen Konzentration von 1000 μM (Abbildung 3 B).
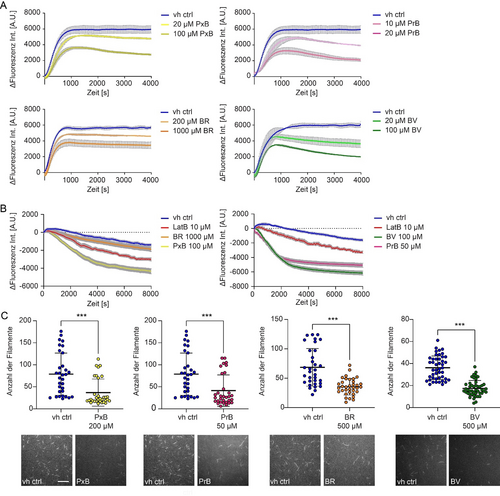
Hemmung der In-vitro-Aktindynamik durch PBs und Biline. A) Polymerisation von Pyren-markiertem G-Aktin, inkubiert mit PxB, PrB, BR, BV und der Vehikelkontrolle (vh ctrl). Die Daten zeigen den Mittelwert±Standardfehler des arithmetischen Mittels aus drei unabhängigen Experimenten, durchgeführt jeweils in Duplikaten (Standardfehler ist in grau dargestellt). B) Nachdem das Pyren-markierte Aktin für eine Stunde lang polymerisiert wurde, wurde die Depolymerisation nach Zugabe von PBs, Bilinen, LatB und einer Vehikelkontrolle (vh ctrl) analysiert. Die Daten zeigen Mittelwerte±Standardfehler des arithmetischen Mittels aus drei unabhängigen Experimenten, durchgeführt jeweils in Triplikaten (Standardfehler ist in grau dargestellt). C) Hemmung der Aktinnukleation. TIRF-Mikroskopie-Untersuchungen von Atto488-markiertem G-Aktin, das mit PxB, PrB, BR, BV und einer Vehikelkontrolle (vh ctrl) inkubiert wurde. Das Streudiagramm stellt die Anzahl der in jedem Bild vorhandenen Aktinnuklei dar (berechnet aus der Anzahl der Filamente). Für das PrB und das PxB sind dieselben Kontrollen dargestellt, da die Experimente gleichzeitig durchgeführt wurden. Durchschnitt der Aktinnuklei±Standardfehler des arithmetischen Mittels (zweiseitiger, ungepaarter Student's t-Test, *** P<0.001). Abgebildet sind repräsentative Bilder mit der jeweiligen Kontrollmessung. Maßstab: 15 μm.
Mithilfe von TIRF-Mikroskopie testeten wir zusätzlich die Auswirkungen der linearen Tetrapyrrole auf die Aktinnukleation, den initialen Schritt des Aktinpolymerisationsprozesses.21 Es stellte sich heraus, dass die Nukleation sowohl durch PBs als auch durch Biline signifikant gehemmt wird (Abbildung 3 C).
Um zu untersuchen, ob die beobachteten Effekte durch eine direkte Interaktion mit G-Aktin verursacht werden, führten wir eine Affinitätschromatographie mit G-Aktin durch, das auf Sepharose-Beads immobilisiert ist. Die Menge der Tetrapyrrole, die an die G-Aktin-Beads bindet, wurde durch analytische HPLC ermittelt und mit Agarose-Beads verglichen. Diese dienten als Negativkontrolle, um eine unspezifische Bindung an Beads auszuschließen. Die Analyse ergab, dass von den G-Aktin-Beads im Vergleich zu den Agarose-Beads eine signifikant höhere Menge aller Substanzen eluiert wurde (Abbildung 4 A).
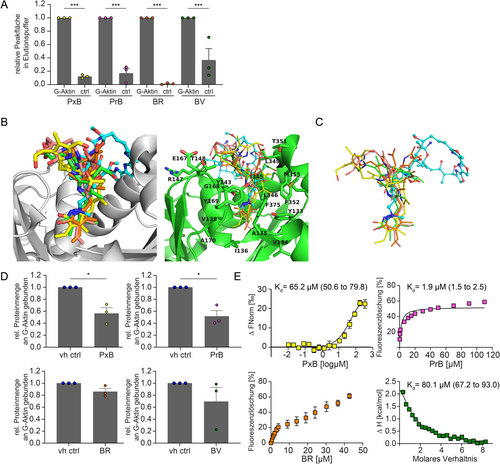
Charakterisierung der In-vitro-Bindung von PBs und Bilinen an G-Aktin. A) Ein G-Aktin-Bindungstest wurde mit G-Aktin-gekoppelten Sepharose-Beads durchgeführt. G-Aktin- oder Agarose-Beads (ctrl) wurden für einen Zeitraum von einer Stunde mit den Substanzen in einer Konzentration von 50 μM inkubiert, bevor die Mischung zentrifugiert und gewaschen wurde. Die gebundenen Substanzen wurden von den Beads eluiert und das Eluat wurde durch analytische HPLC untersucht. Die Ergebnisse stellen die relative Peakfläche als Mittelwert±Standardfehler des arithmetischen Mittels von drei unabhängigen Experimenten dar (einfache Varianzanalyse gefolgt von Dunnett-Test, *** P<0.001). B) Kalkulierter Bindungsmodus von PBs und Bilinen (Kohlenstoffatome für PxB in gelb; PrB in rosa; BV in grün; BR in orange) im Docking-Modell mit Aktin (dargestellt in grau oder grün) (PDB-Code: 4K41). Die an der Bindung beteiligten Aktinreste sind markiert und als Stäbe dargestellt. KabC ist mit einem Kugel-Stab-Modell (cyan) dargestellt. C) Überlagerung der gedockten Konformeren vom PxB in gelb, PrB in rosa, BV in grün, BR in orange und KabC in cyan (PDB-Code: 4K41), die zeigen, dass die Pyrrolin-2-on-Einheit (Ring D) die gleichen Bereiche wie das N-Vinylformamid von KabC besetzt. D) Kompetitiver G-Aktin-Bindungstest der Substanzen in Kombination mit dem Aktin-bindenden Protein Profilin. G-Aktin-Beads wurden vor der Zugabe von Profilin (0.67 μM) eine Stunde lang mit PBs oder Bilinen in einer Konzentration von 50 μM inkubiert. Die Beads wurden zentrifugiert und die solubilisierte Pelletfraktion wurde durch SDS-PAGE analysiert. Die Menge an Profilin wurde quantifiziert und auf die Vehikelkontrolle (vh ctrl) normiert. Die Daten stellen Mittelwerte±Standardfehler des arithmetischen Mittels von drei unabhängigen Experimenten dar (zweiseitiger, ungepaarter Student's t-Test mit Welch-Korrektur, * P<0.05). E) Bestimmung der Kd-Werte mittels MST für das PxB (Proteinkonzentration=71.4 nM), Fluoreszenzlöschung für das PrB und BR (Proteinkonzentration=200 nM) und ITC für BV (Proteinkonzentration=50 μM). Ein Kd-Wert für BR wurde nicht berechnet, da das Bindungsmodell nur unzureichend angepasst werden konnte. Die Ergebnisse für das PxB, PrB und BR stellen Mittelwerte±Standardfehler des arithmetischen Mittels von drei unabhängigen Experimenten dar. Die Kd-Werte sind als Mittelwerte (68 % Konfidenzintervall) angegeben.
Als Nächstes analysierten wir im Rahmen von in silico-Bindungsstudien die potenzielle Interaktion der Tetrapyrrole mit G-Aktin. Im Docking-Modell, in dem die vier Moleküle auf eine potentielle Bindung an der Bindungsstelle von Kabiramide C (KabC), einem bekannten Aktinbinder,22 getestet wurden, wurden für jedes Molekül mehrere unterschiedliche Bindungsorientierungen nachgewiesen. Interessanterweise gab es unter den verschiedenen Konformationen, die für jeden Liganden erzeugt wurden, einen gemeinsamen Bindungsmodus für alle vier Verbindungen, bei dem ein Pyrrolin-2-on-Ring in eine hydrophobe Tasche in G-Aktin platziert wurde (Abbildung 4 B, C). Diese Tasche ist mit den Resten Y133, I136, V139, Y169 und F375 ausgekleidet (Abbildung S5). Bei der Polymerisation von G-Aktin wird diese Bindungsstelle normalerweise von der D-Schleife des nächsten Aktinmonomers im Aktinfilament besetzt und wird im Allgemeinen von Naturstoffen wie Makroliden angegriffen, die die Depolymerisation von Aktin fördern.23 Die N-Vinylformamid-Gruppe der wichtigen Seitenkette des KabC-Moleküls interagiert ebenfalls mit derselben hydrophoben Tasche, und durch das Fehlen spezifischer Wasserstoffbrückenbindungen oder polarer Wechselwirkungen wird eine Platzierung sowohl der 17-Methyl-18-vinyl-17-pyrrolin-19-on-Einheit (Ring D) als auch der 2-Methyl-3-vinyl-2-pyrrolin-1-on-Gruppe (Ring A) (BR und BV) in derselben Tasche ermöglicht (Nummerierung der Tetrapyrrolstruktur siehe Schema 1). Aufgrund mehrerer polarer Atome in den Molekülen sollten bei der weiteren Präzisierung der Docking-Modelle sowohl intramolekulare als auch Lösungsmittel-Wechselwirkungen berücksichtigt werden.
Die kalkulierte Bindungsstelle wurde mithilfe eines kompetitiven Pull Down-Experiments unter Verwendung von G-Aktin-Beads und dem Aktin-bindenden Protein Profilin, das ebenfalls mit dieser Bindungsstelle vieler Aktin-bindender Proteine und kleiner Moleküle wie KabC interagiert, bestätigt.24 Die Menge des an G-Aktin gebundenen Profilins wurde mit und ohne Vorbehandlung mit den vier Substanzen quantifiziert und zeigte eine signifikant verringerte Bindung von Profilin nach Inkubation mit dem PxB und PrB im Vergleich zur Kontrolle. Dies deutet darauf hin, dass die PBs vermutlich dieselbe Bindungstasche von G-Aktin besetzen und daher die Bindung von Profilin verhindern. Im Gegensatz dazu führte die Inkubation mit Bilinen zu einer geringfügigen Inhibition der Profilinbindung (Abbildung 4 D, Abbildung S6).
Die vier getesteten Tetrapyrrole sind zwar strukturell ähnlich, unterscheiden sich jedoch stark in ihren physikalisch-chemischen Eigenschaften wie Löslichkeit, Polarität und Fluoreszenzverhalten. Zur Charakterisierung der Bindungsaffinitäten der einzelnen Verbindungen zu G-Aktin und zur Bestimmung der Dissoziationskonstanten (Kd) wurden verschiedene biophysikalische Methoden verwendet, darunter Fluoreszenzlöschung, „microscale“ Thermophorese (MST) und isotherme Titrationskalorimetrie (ITC) (Abbildung 4 E, Abbildung S7–10).
Die Interaktion des PxB mit G-Aktin wurde mithilfe von MST getestet. Dabei wurde die thermophoretische Bewegung von Atto647-markiertem G-Aktin mit steigenden Konzentrationen von PxB erfasst und ergab einen Kd von 65.2 μM (50.6 bis 79.8). Die Bindungsstärke des PrB wurde durch Fluoreszenz-Titrationsspektroskopie und Messung der Fluoreszenzlöschung von Atto647-markiertem G-Aktin nach Zugabe des PrB bestimmt. Es wurde ein Kd von 1.9 μM (1.5 bis 2.5) ermittelt. Eine Fluoreszenzlöschung von Atto647-markiertem G-Aktin konnte auch während der Titration mit BR beobachtet werden. Jedoch wurde aufgrund der geringen Löslichkeit von BR keine Sättigung der Fluoreszenzlöschung erreicht. Daher konnte kein Kd-Wert bestimmt werden, er lässt sich aber im mikromolaren Bereich vermuten. Für BV wurde mittels ITC ein Kd-Wert von 80.1 μM (67.2 bis 93.0) ermittelt. Zusammenfassend lässt sich feststellen, dass das PxB, PrB und BV alle eine Bindungsaffinität zu G-Aktin im niedrigen mikromolaren Bereich aufwiesen. Dies stimmt mit den Beobachtungen aus den biologischen Untersuchungen überein, in denen das PrB als die Substanz mit der stärksten Wechselwirkung mit G-Aktin nachgewiesen wurde.
Es hat sich herausgestellt, dass BR in physiologischen Konzentrationen eine wichtige zytoprotektive Rolle spielt. Es ist jedoch auch bekannt, dass erhöhte Konzentrationen von Albumin-gebundenem oder unkonjugiertem BR eine Hyperbilirubinämie verursachen. Mehrere Faktoren wie Konzentrationen, Konjugationsstatus oder Redoxzustand und Wirkort in den Zellen scheinen dabei eine wichtige Rolle zu spielen.25 Daher gilt es noch zu untersuchen, ob die hier beschriebenen Effekte der Biline auf die Aktindynamik und Aktinfunktionen in den gemessenen Konzentrationsbereichen von physiologischer Bedeutung sind. Für die PBs, die Aktin und davon abhängige Funktionen in niedrigeren Konzentrationen beeinflussen, liefern wir jedoch die Grundlage um weitere Effekte auf zelluläre Funktionen und die zugrundeliegenden Wirkungsmechanismen detaillierter aufzuklären. Dies ist von besonderer Bedeutung für das PrB, die potenteste Struktur, für die bisher noch keine Bioaktivität erforscht wurde. Frühere Studien haben bereits bewiesen, dass das PxB eine vielversprechende Substanz gegen Krebszellen ist, die das Wachstum von Krebszellen hemmt und Apoptose auslöst.11 Darüber hinaus wurde gezeigt, dass ein G2/M-Zellzyklus-Arrest in Konzentrationen unter 20 μM induziert wird. Da das Aktin-Zytoskelett eine wichtige Rolle bei der Zellteilung spielt, werden künftige Studien die Rolle der Aktinbindung und der Agglomeration von Aktinfilamenten beim Fortschreiten des Zellzyklus untersuchen. Für die PBs ist die Identifizierung von Aktin als Zielstruktur ein wichtiger Schritt zum Verständnis ihrer Bioaktivität. Die in unserer Studie für das PrB beobachtete starke Hemmung der Krebszellmigration in nanomolaren Konzentrationen könnte jedoch auf mehr als die Hemmung der Aktinpolymerisation zurückzuführen sein, da die Affinität von dem PrB zu Aktin im niedrigen mikromolaren Bereich ermittelt wurde. Daher ist es möglich, dass das PrB auch weitere zelluläre Zielstrukturen angreift.
Zusammenfassung
Viele Argumente sprechen gegen die Auffassung, dass der Abbau der “Pigmente des Lebens” lediglich ein Entgiftungsprozess ist. Die Frage nach der Rolle der Abbauprodukte bleibt jedoch nach wie vor rätselhaft. Viele Organismen wie Bakterien, Pflanzen oder Tiere produzieren Naturstoffe mit Aktin-bindenden Eigenschaften26 und eine gestiegene Anzahl an Forschungsarbeiten deutet darauf hin, dass diese Verbindungen möglicherweise eine Rolle als Abwehrstoffe spielen.27 Interessanterweise wurde erst vor kurzem ein Zusammenhang zwischen dem Auftreten von PBs und Pflanzenabwehrmechanismen gegen Pathogenbefall erkannt.28
PBs und Biline sind eine Klasse ubiquitär vorkommender Naturstoffe. Für beide wurde bereits gezeigt, dass sie eine Vielzahl physiologisch relevanter Eigenschaften besitzen. Indem wir in dieser Studie Aktin als menschliche Zielstruktur für PBs und Biline einführen, gehen wir einen Schritt weiter, um die Hintergründe des Abbaus von zwei der wichtigsten Pigmente auf der Erde zu entschlüsseln. Schätzungsweise werden auf der Erde jedes Jahr 109 Tonnen Chl abgebaut29 – das Verständnis für die Auswirkungen der daher weitverbreiteten Metaboliten, die während dieses Prozesses gebildet werden, der PBs, öffnet die Tür für zukünftige Studien über die physiologischen Rollen dieser ubiquitären Klasse von Tetrapyrrolen.
Acknowledgements
Wir danken Kerstin Schmid und Rita Socher für die technische Unterstützung, und Dr. Lars Allmendinger für die NMR Messungen. Wir danken Prof. Dr. Michaela Smolle von der Biophysics-Core-Facility am Biomedizinischen Zentrum der LMU München und Dr. Sophie Brameyer von der Bioanalytics-Core-Facility am LMU Biozentrum für die Unterstützung bei den ITC- und MST-Experimenten. Wir bedanken uns für die Förderung dieser Arbeit durch die Deutsche Forschungsgemeinschaft (DFG) (Prof. Dr. Stefan Zahler und Prof. Dr. Don C. Lamb Projekt-ID 201269156 – SFB 1032 Projekt B03 und B08, und Dr. Simone Moser Projekt-ID 448289381). Open Access Veröffentlichung ermöglicht und organisiert durch Projekt DEAL.
Conflict of interest
Die Autoren erklären, dass keine Interessenkonflikte vorliegen.




