Das riechende Prinzip des Vetiveröls, aufgeklärt durch chemische Synthese
Abstract
Vetiveröl wird im Multitonnen-Maßstab aus den Wurzeln des Vetivergrases gewonnen und ist einer der begehrtesten Duftbausteine der modernen Parfümerie. Das exquisite ätherische Öl, das sich in über einem Drittel aller Parfüms findet, ist eine komplexe Mischung aus Hunderten von unterschiedlichen Verbindungen, wobei das riechende Prinzip, das für den charakteristischen sanften und süßen, transparenten, holzig-ambrierten Geruchscharakter verantwortlich ist, bis heute Rätsel aufgibt. Durch eine elfstufige chemische Synthese mit einer neuartigen asymmetrischen organokatalytischen Mukaiyama-Michael-Addition im Zentrum beweisen wir hier, dass (+)-2-epi-Ziza-6(13)en-3-on das riechende Prinzip des Vetiveröls ist. Seine olfaktorische Charakterisierung ergab einen außergewöhnlich tiefen Schwellenwert von 29 Pikogramm pro Liter Luft, der für die sinnliche Aura und die quasi-pheromonartige Anziehung, die es auf Parfümeure wie Verbraucher gleichermaßen ausübt, verantwortlich ist.
Von Ernest Beaux' “Chanel N°5” (1921) und Jean-Paul Guerlains “Vetiver de Guerlain” (1959) bis zur extremen Dosis von 90 % im rebellischen “Turtle Vetiver” (LesNez, 2019) von Isabelle Doyen ist Vetiveröl in der modernen Parfümerie allgegenwärtig.1, 2 Kein anderer Riechstoff kommt häufiger im Namen eines Parfüms vor: fragrantica.com listet zurzeit 2267 maskuline, 1976 feminine und 2302 Unisex-Parfüms, die um dieses im wahrsten Sinne des Wortes essentielle Öl konzipiert wurden. In der parfümistischen Komposition ist Vetiver ein echtes Chamäleon und kann etwa verwendet werden, um ein klassisches Kölnisch Wasser maskuliner auszugestalten oder um üppige feminine Blumendüfte mit einem Hauch von Erdigkeit zu kontrastieren.3 Diese Vielseitigkeit ist auf eine charakteristische sanfte und süße holzig-ambrierte Transparenz zurückzuführen, die eine auraartige Wirkung entfaltet, wie sie generell von Duftstoffen mit extrem niedrigem Schwellenwert ausgeht, wie etwa Paradison [(+)-(1R,2S,Z)-Methyldihydrojasmonat]4 oder Rotundon.5 Vetiveröl wird in einer Ausbeute von 0.2–0.3 % durch Wasserdampfdestillation der getrockneten Wurzeln des büschelartigen mehrjährigen Grases Chrysopogon zizanioides (L.) Roberty gewonnen. Trotz eines Preises von 350–500 $/kg wird sein weltweiter Verbrauch auf 300–400 t/Jahr geschätzt, wovon etwa 60 % aus der Gemeinde Les Cayes in Haiti stammen.6 Als eines der komplexesten ätherischen Öle enthält es viele hundert Sesquiterpenderivate von hoher struktureller Diversität, von denen eine Vielzahl bis heute nicht einmal identifiziert ist. Diese Komplexität hat die Analyse von Vetiveröl trotz der bedeutenden Fortschritte der modernen Analytik zu einer enormen Herausforderung gemacht. In seiner Duftpalette steht dem Parfümeur auch heute keine überzeugende Rekonstruktion dieses Schlüsselbausteins zur Verfügung, und kein Riechstoff kann alleine den typischen Vetiver-Geruchseindruck vermitteln.5 Im Geruchsprofil von Vetiver verbindet sich eine frische, hesperidisch-zitrische Pampelmuse im Kopf mit einer ausgesprochen dunklen sanften und süßen, transparenten, holzig-ambrierten Basisnote zu einem universellen Duftskelett, einem Parfüm in einem Parfüm, das zu einer nahezu unbegrenzten Menge an Interpretationen einlädt. Während der zitrusartige Aspekt nach Pampelmusen gut verstanden ist und von α-Vetivon (1), β-Vetivon (2) und Nootkaton (3) herrührt, sind erdige Aspekte auf (−)-Geosmin (4) zurückzuführen, unterstützt von nor-Acorenon, und der cremige Sandelholz-Charakter resultiert hauptsächlich vom (E)-Isovalencenol (5; Abbildung 1). Der typische transparente, holzig-ambrierte Geruchsaspekt von Vetiver ist jedoch noch immer nicht verstanden, und das riechende Prinzip von Vetiver stellt nach wie vor ein großes Rätsel dar. Khusimon (6), das zu etwa 2 % im ätherischen Öl vorkommt und von Maurer 1980 für das Geruchsprinzip von Vertier gehalten wurde, ist die einzige Verbindung, bei der sich die Literatur über diesen begehrten Duftcharakter einig ist.7 Eine erschöpfende Analyse von Weyerstahl et al. aus dem Jahr 2000 schien dies prinzipiell zu bestätigen, da alle anderen Vertier-Verbindungen wie Eremophiladienal (7), 1,7-Cyclogerma-1(10)-4-dienal (8) sowie Ziza-6(13)-enon (9) und 2-epi-Ziza-6(13)-enon (10) von ihnen als khusimonähnlich, aber deutlich schwächer beschrieben wurden (Abbildung 1).8 Mit einem relativ hohen Schwellenwert von 4.7 ng L−1 Luft konnte Khusimon (6) jedoch nicht das riechende Prinzip des Vetiveröls sein.
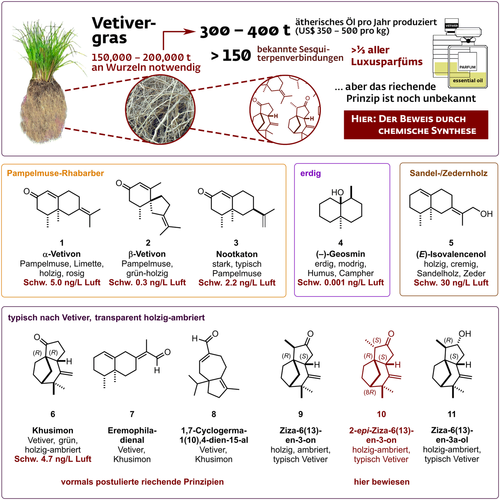
Die wichtigen Komponenten, die zum olfaktorischen Profil von Vetiveröl beitragen. α-Vetivon (1), β-Vetivon (2) und Nootkaton (3) sind für die Pampelmuse-Rhabarber-Kopfnote verantwortlich, während (−)-Geosmin (4) erdige Aspekte beisteuert und (E)-Isovalencenol den cremigen, zedern- und sandelholzartigen Hintergrund bildet. Die mysteriöse, so begehrte transparente holzig-ambrierte Note blieb jedoch bislang noch ein Geheimnis. Als dafür verantwortliche Substanzen wurden unbestätigt Eremophiladienal (7) und 1,7-Cyclogerma-1(10),4-dien-15-al (8), Khusimon (6), Ziza-6(13)-en-3-ol (11), Ziza-6(13)-enon (9) und 2-epi-Ziza-6(13)-enon (10) vermutet.
Zu diesem Schluss kamen auch Belhassen et al. in einer neueren Studie, obwohl auch für sie Khusimon (6) tatsächlich das typische holzig-ambrierte Vetiver-Geruchsprofil besitzt.9 Nach Einsatz von GC×GC/MS und GC–Olfaktometrie hielten sie aber Ziza-6(13)en-3-on (9) und 2-epi-Ziza-6(13)en-3-one (10) für die potenziell wichtigsten Geruchsvektoren, da sie deutlich höhere Aromaverdünnungsfaktoren als Khusimon (6) aufwiesen. Daneben schrieben sie auch Ziza-6(13)-en-3-ol (11),10 dem entsprechenden (R,R)-konfigurierten Alkohol von 9, eine typische Vetivernote zu, fanden ihn aber schwächer. Anders als etwa bei Patchouli (Clearwood) oder Sandelholzöl (Dreamwood)5 gibt es für Vetiveröl noch keinen biotechnologischen Zugang, und dies setzt zunächst auch Kenntnisse über das riechende Prinzip voraus. Außerdem gab es auch Spekulationen, dass Wurzelbakterien an der Biogenese der Komponenten beteiligt sein könnten.11 Unabhängig von den Arbeiten von Belhassen et al. wurde in der Riechstoffindustrie daher ohnehin intensiv nach dem riechenden Prinzip des Vetiveröls geforscht. Eine Destillation von haitianischem Vetiveröl über eine 50-cm-Sulzer-Kolonne in halbtechnischem Maßstab (800 g, Abbildung 2) mit Fraktionierung im Spaltrohr, gefolgt von der Abtrennung der Aldehyde und Ketone aus der am intensivsten riechenden Fraktion mit dem Girard-P-Reagenz, ließ nach anschließender Flash-Chromatographie in der Tat das Keton 10 als wahrscheinlichsten Kandidaten für den Hauptgeruchsträger des Vetiveröls erscheinen. Wegen der enormen Komplexität des ätherischen Öls (Abbildung 2), von dem bisher lediglich 155 Komponenten identifiziert wurden,8, 6a konnten Verfälschungen durch hochintensive Spurenbestandteile jedoch nicht ausgeschlossen werden. Darüber hinaus rochen einige leichter synthetisch zugängliche Partialstrukturen nicht nach Vertier,12 was erneut Zweifel daran aufkommen ließ, dass die Verbindungen 9–11 wirklich die entscheidenden Geruchsträger sind. Da extrem intensiv riechende Nebenbestandteile nie wirklich ausgeschlossen werden können und auch von modernen analytischen Instrumenten nicht immer detektierbar sind (Abbildung 2), sind die reinen Verbindungen unabdingbar, um eine definitive Aussage über ihre olfaktorische Bedeutung im ätherischen Öl treffen zu können. Was die GC–Olfaktometrie betrifft, so ist auch jeder Versuch, den Hauptgeruchsträger durch präparative GC physikalisch aus der komplexen Matrix zu isolieren, extrem anfällig für Verunreinigungen.
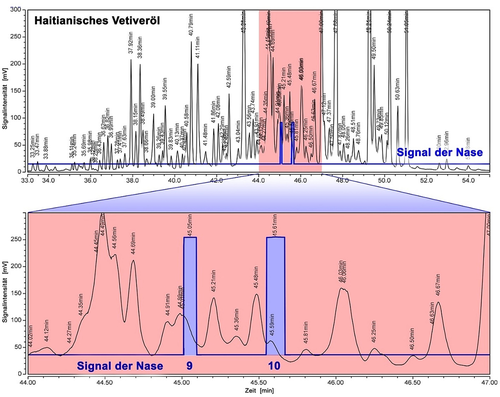
GC–Olfaktometrie von Haitianischem Vetiveröl. Das GC-Übersichtsspektrum (FID, oberer Abschnitt) veranschaulicht die enorme Komplexität des natürlichen ätherischen Öls, überladen mit Hunderten einzelner Peaks. Die blauen Signale zeigen an, wann in dem Spektrum der typische transparente Vetivercharakter wahrnehmbar ist. Wie später durch Koinjektion gezeigt werden konnte, entsprechen diese Peaks tatsächlich dem Ziza-6(13)-enon (9) und dem 2-epi-Ziza-6(13)-enon (10).
In Anbetracht dieser Überlegungen wurde immer deutlicher, dass nur eine stereoselektive Totalsynthese Klarheit schaffen konnte. Wir begannen daher mit der Ausarbeitung einer enantio- und diastereoselektiven Synthesestrategie zum 2-epi-Ziza-6(13)en-3-on (10). Dabei lag der Schwerpunkt auf dem Auffinden eines Weges, der frühzeitig die korrekte (R)-Konfiguration an C-8 festlegt, die allen Zizaenon-Naturstoffen gemein ist. Hinsichtlich der übrigen stereogenen Zentren sollte der Syntheseweg hingegen flexibel sein, um so prinzipiell auch die olfaktorische Auswertung der übrigen Zizaenon-Diastereomere zu ermöglichen.
Wie in Abbildung 3 dargestellt, planten wir für den Schlüsselschritt bei der Konstruktion des einzigartigen Kohlenstoffgerüsts des 2-epi-Ziza-6(13)en-3-ons (10) eine intramolekulare Pauson-Khand-Cyclisierung von 1-Ethyliden-3-(2-methyl-3-methylenpent-4-in-2-yl)cyclopentan (20), die direkt zum tricyclischen Ziza-6(13)-en-3-on 21 führen sollte. Zur Realisierung dieses Syntheseplans schien eine enantioselektive Mukaiyama-Michael-Reaktion von 2-Cyclopentenon (12) mit dem leicht zugänglichen und kommerziell erhältlichen Silylketenacetal (SKA) von Methylisobutyrat ein idealer Ausgangspunkt zu sein, um das enantiomerenreine Cyclopentan 1513 herzustellen, welches wiederum ein geeigneter Vorläufer des Pauson-Khand-Substrats 20 darstellen sollte. Trotz intensiver Suche nach asymmetrischen, katalytischen Additionsreaktionen vom Mukaiyama-Michael-Typ waren Beispiele mit 2-Cyclopentenon als Elektrophil überraschenderweise jedoch extrem selten, und die entsprechende Substratkombination ist sogar vollkommen neuartig.14
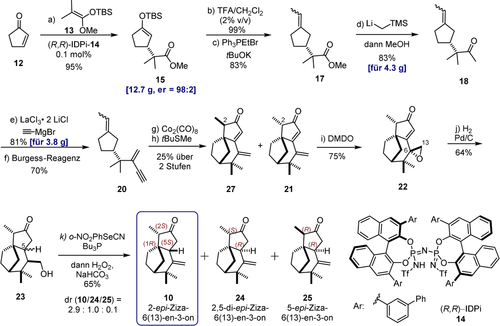
Enantioselektive Totatalsynthese des 2-epi-Ziza-6(13)-en-3-ons (10). Reagentien und Reaktionsbedingungen wie folgt: a) Cyclopentenon (12, 1 Äquiv.), SKA (13, 1.05 Äquiv.), Katalysator 14 (0.1 mol % Beladung), −78 °C, Toluol, 95 %, er 98:2. b) 15 (1 Äquiv.), TFA (1.05 Äquiv.), DCM, 23 °C, 10 min, 99 %. c) Ethyltriphenylphosphoniumbromid (1.2 Äquiv.), Kalium-tert-butoxid (1.2 Äquiv.), THF, −60 °C, 1 h, dann desilyliertes Keton (1 Äquiv.), −60→23 °C, 83 %, E/Z=1:1.7. d) 17 (1.0 Äquiv.), (Trimethylsilyl)methyllithium (2.5 Äquiv.), Pentan, 0 °C, dann MeOH, 2 h, 83 %. e) LaCl3⋅2 LiCl (1.06 Äquiv.), THF, 0 °C, dann Ethinylmagnesiumchlorid (1.7 Äquiv.), 81 %. f) Burgess-Reagenz (2.3 Äquiv.), Hexan/Toluol (9:1), 60 °C, 19 h, 70 %. g) Dicobaltoctacarbonyl (1.3 Äquiv.), Diethylether, 23 °C. h) tert-Butyl(methyl)sulfan (3.5 Äquiv., bezogen auf 20), Benzol, 90 °C, 19 h, 25 % über 2 Stufen, die Diastereomere (dr 1.7:1 an C-2) wurden durch präparative HPLC getrennt. i) DMDO (Überschuss), DCM, 0 °C, 75 %, mit einem dr 9:1 an C-6 zugunsten von 22. j) Palladium auf Aktivkohle (3 Äquiv.), H2, Ethylacetat, 23 °C, 64 %, dr 2:1 an C-5. k) 23 (1 Äquiv.), 1-Nitro-2-selenocyanatobenzol (1.28 Äquiv.), Tributylphosphin (2.5 Äquiv.), THF, 23 °C, 1 h, NaHCO3 (30 Äquiv.), H2O2 (30 % aq, 30 Äquiv.), 23 °C, 4 h, 65 %, dr(10/24/25)=2.9:1:0.1, die Diastereoisomere wurden durch präparative HPLC getrennt. SKA: Silylketenacetal; TFA: Trifluoressigsäure; DCM: Dichlormethan; THF: Tetrahydrofuran; Burgess-Reagenz: Methyl-N-(triethylammoniumsulfonyl)carbamat; DMDO: Dimethyldioxiran; die Enantiomerenverhältnisse (er, enantiomeric ratios) wurden durch HPLC an chiraler stationärer Phase bestimmt; die Diastereomerenverhältnisse (dr, diastereomeric ratios) wurden durch NMR oder GC bestimmt.
Basierend auf dem Konzept der asymmetrischen gegenaniongerichteten Silylium-Lewis-Säure-Katalyse (Si-ACDC), das zuvor in unserem Labor entwickelt wurde,15 vermuteten wir, dass unsere Imidodiphosphorimidat (IDPi)-Katalysatorklasse die gewünschte Umwandlung ermöglichen könnte.16 Nach einigen Versuchs- und Entwicklungsarbeiten, die separat veröffentlicht werden, konnten wir tatsächlich eine Methode finden, die einen Zugang zum entsprechend substituierten Cyclopentenon 15 eröffnet. Durch Reaktion von 2-Cyclopentenon mit dem Silylketenacetal 13 in Anwesenheit von 0.1 Mol-% des IDPi-Katalysators 14 wurde der gewünschte (R)-konfigurierte Silylenolether 15 tatsächlich in 95 % Ausbeute im Multigramm-Maßstab mit einem ausgezeichneten Enantiomerenverhältnis von 98:2 erhalten. Durch Protodesilylierung mit Trifluoressigsäure und Wittig-Reaktion mit Ethyltriphenylphosphoniumbromid wurde 15 dann in 83 % Ausbeute mit einem E/Z-Verhältnis von 1:1.7 in das Olefin 17 überführt.17 Dieser Methylester wurde dann durch Reaktion mit Trimethylsilylmethyllithium und nachfolgende Protodesilylierung im Multigramm-Maßstab in 83 % Ausbeute in das entsprechende Methylketon 18 überführt.18 Die anschließende Addition von Ethinylmagnesiumbromid unter den von Knochel et al. beschriebenen Bedingungen,19 um der sterischen Hinderung und Reaktivitätsproblemen Rechnung zu tragen, führte dann in einer Ausbeute von 81 % zu dem entsprechenden isolierten Alkohol.19 Dessen Dehydratisierung erwies sich aber erheblich schwieriger als erwartet und ließ sich in unseren Händen nur mit dem milden und effizienten Burgess-Reagenz20 erreichen, das das gewünschte Produkt 20, das Substrat der zentralen Pauson-Khand-Reaktion, in 70 % Ausbeute lieferte. Wie erwartet stellte die sterisch höchst anspruchsvolle intramolekulare Pauson-Khand-[2+2+1]-Cycloaddition den kritischen Engpass unseres Syntheseplans dar. Mehrere der standardmäßig etablierten Pauson-Khand-Protokolle lieferten nicht einmal Spuren des gewünschten Produkts 21.21 Nach Prüfung alternativer Optionen wurde schließlich ein schrittweises Vorgehen gewählt, bei der zunächst ein 18-Elektronen-Dicobaltatetrahedran-Komplex durch Reaktion des Alkins 20 mit Dicobaltoctacarbonyl hergestellt und isoliert wurde. Die anschließende Cyclisierung in Gegenwart von tert-Butyl(methyl)sulfid als Promotor in Benzol unter Rückfluss ergab das gewünschte Produkt 21 zusammen mit dem nicht abtrennbaren C-2-Epimer 27 (siehe Hintergrundinformationen) in einer Ausbeute von 25 %. Trotz größter Anstrengungen blieb die Gesamtausbeute dieser Umwandlung zwar unbefriedigend, dennoch lieferte diese Pauson-Khand-Cyclisierung das komplette Kohlenstoffgerüst des Naturstoffs und induzierte alle drei Ringe sowie das kritische quartäre stereogene Zentrum in der korrekten Konfiguration.
Mit dem Enon 21 in den Händen fühlten wir uns nun in einer ausgezeichneten Position, um die letzte Herausforderung unseres Syntheseplans anzugehen, die in der selektiven Reduktion der Cyclopentenon-Doppelbindung bestand. Auch wenn diese Umwandlung auf den ersten Blick trivial erscheinen mag, erwies sie sich doch als der schwierigste Schritt der gesamten Synthesesequenz. Unter den unterschiedlichsten Reduktionsbedingungen (z. B. Strykers Reagenz,22 SmI2,23 Hantzsch-Ester,24 Wilkinsons Reagenz,25 siehe Hintergrundinformationen) wurden statt des gewünschten 1,4-Reduktionsprodukts lediglich Produkte aus der unerwünschten 1,6-Reduktion der exocyclischen Doppelbindung erhalten. Daher musste ein indirekter Weg eingeschlagen werden. Durch Epoxidierung der viel reaktiveren exocyclischen Doppelbindung mit frisch hergestelltem Dimethyldioxiran (DMDO) wurde zunächst das Epoxid 22 in 75 % Ausbeute (dr 9:1 an C-6) synthetisiert.26 Die Konstitution und Konfiguration dieser Zwischenstufe wurde durch Röntgenkristallographie bestätigt. Die anschließende Hydrierung der Enon-Doppelbindung in Gegenwart von Pd/C verlief problemlos, zusammen mit der hydrierenden Ringöffnung des Epoxids zum Alkohol 23 in 64 % Ausbeute (dr 2:1 bei C-5). Wir führten die nur mäßige diastereofaciale Differenzierung dieser konjugierten Reduktion auf den vernachlässigbaren sterischen Einfluss der äquatorialen Methylengruppe des Epoxids an C-13 zurück. Die anschließende Dehydratisierung des primären Alkohols 23 wurde durch eine Grieco-Eliminierung realisiert,27 was in einer Gesamtausbeute von 65 % zu drei Diastereomeren in einem Diastereomerenverhältnis von 2.9:1:0.1 zugunsten des Zielmoleküls 10 führte. Die Spuren des Produkts 25 resultieren vermutlich aus der Isomerisierung des Nebenisomers 24 unter den gewählten Eliminierungsbedingungen.
Die olfaktorischen Eigenschaften und Schwellenwerte28 der vier (1R)-konfigurierten Ziza-6(13)-en-3-on-Stereoisomere sind in Abbildung 4 zusammengestellt. Während schon das Ziza-6(13)-en-3-on (9) einen klaren, frischen, transparenten, holzig-ambrierten Vetivercharakter mit einem Schwellenwert von 0.13 ng L−1 Luft besitzt, weist das 2-epi-Ziza-6(13)-en-3-on (10) einen deutlich ausgeprägteren und typischeren Vetivercharakter mit einer akzentuiert trockenen und transparent holzig-ambrierten Note auf. Dieser Geruchscharakter erinnert stark an den populären Duftbaustein Iso E Super, der ebenfalls eine transparente, holzig-ambrierte Note besitzt, die von der Nebenkomponente Arboron (26)29 herrührt, das eine quasi-pheromonähnliche Anziehungskraft besitzen soll.30 Diese Geruchsassoziation lässt sich durch eine Überlagerungsanalyse (75 % sterisch, 25 % elektronisch, Discovery Studio31) erklären, eine Methode, die auch beim Auffinden der kleinsten gemeinsamen dreidimensionalen Substruktur einer Gruppe von Molekülen verwendet wird, die bei der Entdeckung von Medikamenten oder Riechstoffen an denselben Rezeptor binden.32 Wie in der Überlagerungsanalyse in Abbildung 4 gezeigt, überlagert 2-epi-Ziza-6(13)-en-3-on (10) mit Arboron (26, Überlagerungsähnlichkeit/26=0.87) überraschend gut, was auf eine strukturelle Verwandschaft der riechenden Prinzipien von Vetiveröl und Iso E Super hindeutet. Wie auch aus Abbildung 4 ersichtlich, überlagert die geruchlose Antipode ent-10 weit weniger gut, insbesondere was die für den Geruch entscheidende hydrophobe gem-Dimethylgruppe von 26 anbetrifft.
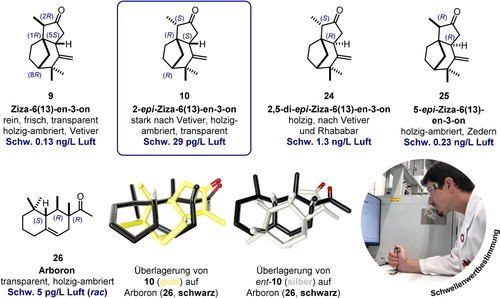
Olfaktorische Eigenschaften der (1R)-konfigurierten Ziza-6(13)-en-3-on-Stereoisomere 9, 10, 24 und 25; alle enantiomeren Antipoden ent-9, ent-10, ent-24 und ent-25 sind geruchlos. Ebenfalls abgebildet ist Arboron (26), das Geruchsprinzip des kommerziellen Duftbausteins Iso E Super, eine Überlagerung (75 % elektronisch, 25 % sterisch) von 2-epi-Ziza-6(13)-en-3-on (10) auf 26, die das transparente holzig-ambrierte Geruchsprofil von 10 im Vergleich zum geruchlosen Enantiomer ent-10 erklärt, sowie die Schwellenwertbestimmung durch GC–Olfaktometrie.
Im Vergleich mit dem natürlich vorkommenden Ziza-6(13)-en-3-on (9) und dem 2-epi-Ziza-6(13)-en-3-on (10) besitzen auch die synthetischen Diastereomere 2,5-di-epi-Ziza-6(13)-en-3-on (24) und 5-epi-Ziza-6(13)-en-3-on (25) einen holzig-ambrierten Geruchseindruck. Allerdings ist weder 24, mit seinen deutlich ausgeprägten hesperidischen Rhabarberfacetten und einem Schwellenwert von 1.3 ng L−1, noch 25, mit einem stärkeren Zedernholzcharakter und einem Schwellenwert von 0.23 ng L−1 Luft, stärker oder charakteristischer als der natürliche Vetiver-Geruchsvektor 10; zudem sind diese auch nicht im Vetiveröl nachweisbar.
Es lässt sich zusammenfassend feststellen, dass die beschriebene enantioselektive Totalsynthese des 2-epi-Ziza-6(13)-en-3-ons (10) eine erfolgreiche Abkehr von der klassischen Auftrennungs-Strategie zur Aufklärung eines Geruchsprinzips darstellt. Die elfstufige Synthese legt den Grundstein für einen neuen und flexiblen enantioselektiven Zugang zu den Zizaen-Körpern. Die Auswertung der Schwellenwerte beweist deutlich, dass das enantiomerenreine Keton 10 die Schlüsselkomponente für die typische transparente, holzig-ambrierte Vetivernote ist. Der Schwellenwert von 10 ist über 150-mal niedriger als der von Khusimon (6), das bislang in der Literatur als das riechende Prinzip von Vetiver angesehen wurde. Außerdem kann die gute stereochemische Überlagerung von 2-epi-Ziza-6(13)-en-3-on (10) auf Arboron (26) die fast magische Anziehungskraft erklären, die Vetiveröl auf Menschen ausübt, und wieso diese überraschenderweise der unwiderstehlichen Attraktivität von Iso E Super gleicht – eine Wirkung, die physiologisch noch gar nicht verstanden ist, aber jetzt auf molekularer Ebene fassbar wird.
Acknowledgements
Wir danken Robin Clery (Givaudan) für seine analytischen Untersuchungen zum Vetiveröl, die unabhängig von Belhassen et al. das 2-epi-Ziza-6(13)en-3-on (10) als Geruchsprinzip nahelegten, sowie Dominique Lelievre (Givaudan) für die olfaktorische Beurteilung der Verbindungen. Darüber hinaus sind wir den Technikern der NMR-, GC- und HPLC-Gruppen des MPI für Kohlenforschung für ihren exzellenten Service zu Dank verpflichtet. Finanzierung: Die großzügige Unterstützung durch die Max-Planck-Gesellschaft, durch die Deutsche Forschungsgemeinschaft (Leibniz-Preis an B.L.) und den European Research Council (Advanced Grant “C-H Acids for Organic Synthesis, CHAOS”) wird dankbar gewürdigt. Open Access Veröffentlichung ermöglicht und organisiert durch Projekt DEAL.
Conflict of interest
Die Autoren erklären die folgenden konkurrierenden finanziellen Interessen: Ein Patent, WO2017037141 (A1), das die Klasse der IDPi-Katalysatoren und ihre Anwendung in der asymmetrischen Synthese abdeckt, ist vom MPI für Kohlenforschung angemeldet worden. S.J., S.D. und P.K. sind Angestellte der Givaudan S.A., eines kommerziellen Anbieters von Parfüms und Riechstoffen.




