Isolierung und strukturelle Charakterisierung der achtfach protonierten Octacyanometallate [M(CNH)8]4+ (M=MoIV,WIV) aus Supersäuren
Professor Konrad Seppelt zum 75. Geburtstag gewidmet
Abstract
Die Octacyanometallate K4[Mo(CN)8] und K4[W(CN)8] werden in der supersauren Mischung von wasserfreiem Fluorwasserstoff und Antimonpentafluorid vollständig protoniert. Die dabei entstandenen Komplexe [Mo(CNH)8]4+[SbF6]−4 und [W(CNH)8]4+[SbF6]−4 sind die ersten Beispiele für achtfach koordinierte homoleptische Komplexe mit Isoblausäure-Liganden (CNH). Diese Verbindungen wurden kristallographisch untersucht und zeigen Netzwerke aus Wasserstoffbrückenbindungen mit kurzen N⋅⋅⋅H⋅⋅⋅F-Kontakten. Tieftemperatur-NMR-Messungen in HF bestätigen einen schnellen Protonenaustausch sogar bei −40 °C. Durch die Protonierung steigt die Wellenzahl der ν(C≡N)-Schwingung um etwa 50 cm−1, was im Einklang mit DFT-Rechnungen steht.
Die Empfindlichkeit von metallgebundenen Cyaniden gegenüber Säuren ist wohlbekannt und häufig Gegenstand von Sicherheitswarnhinweisen, da hier die sehr giftige und flüchtige Blausäure entstehen kann. Im Allgemeinen führt die Protonierung eines metallgebundenen Cyanids (M−C≡N) am terminalen Stickstoffatom zu dem entsprechenden Metall-Isoblausäure-Komplex (M−C≡N−H)+.1, 2 Im Gegensatz dazu sind nur wenige Komplexe mit Blausäure-Liganden (M−N≡C−H)+ bekannt.3-9 Auch wenn Isoblausäure ein guter Ligand für Übergangsmetalle ist, so kann er trotzdem von donierenden Lösungsmitteln (z. B. Wasser) oder von nukleophilen Gegenionen ersetzt werden.10 Dadurch kann die freigewordene Isoblausäure CNH zu der thermodynamisch stabileren Blausäure HCN tautomerisieren.
Die Supersäuren HF/AsF5 oder HF/SbF5 wurden vor kurzem benutzt, um organische Nitrile11, 12 und sogar HCN13 zu protonieren, sowie zur Darstellung hochelektrophiler organischer Kationen.14, 15 Auch wenn es denkbar ist, dass die Benutzung von Supersäuren zur sofortigen Zersetzung von Polycyanometallaten führen sollte, haben diese Systeme den Vorteil, dass selbst die gebildeten Gegenionen AsF6− oder SbF6− nur schwache Nukleophile und somit viel schwächere Liganden sind als der CNH-Ligand, der durch die Protonierung gebildet wurde.
Auch wenn die ersten Berichte von Octacyanometallaten [M(CN)8]4− (M=MoIV,WIV) bis an den Beginn des 20. Jahrhunderts zurückgehen,16-19 haben sie in den letzten Jahrzehnten viel Aufmerksamkeit von Koordinations- und Magnetochemikern erfahren. Seit den frühen 2000er Jahren wurde über eine Vielzahl Octacyanometallat-basierter supramolekularer Netzwerke sowie mehrkerniger Komplexe und Cluster-Verbindungen berichtet.20-24 Die leichte Oxidierbarkeit von [M(CN)8]4− (M=Mo,W) zu [M(CN)8]3− und die Verfügbarkeit eines angeregten Triplett-Zustands von [M(CN)8]4− (M=Mo,W) durch Bestrahlung machen Octacyanometallate der Oxidationsstufe +IV zu geeigneten Bausteinen für photomagnetische Materialien,25-28 während die paramagnetischen Komplexe der Oxidationsstufe +V, also [M(CN)8]3− (M=Mo,W), vielversprechende Bestandteile für molekulare Magnete sind.29
Während die Umsetzung von Octacyanometallaten mit Chlorwasserstoff zu Addukten von den neutralen Säuren H4[M(CN)8]⋅6 H2O (M=Mo,W),30 H4[W(CN)8]⋅4 HCl⋅12 H2O31 und H4[Mo(CN)8]⋅2 O(C2H5)2⋅CH3OH⋅2 H2O führt,32 wird eine vollständige (achtfache) Protonierung durch die Reaktion von K4[M(CN)8]⋅2 H2O (M=Mo,W) in wasserfreiem Fluorwasserstoff mit einem großen Überschuss Antimonpentafluorid SbF5 erreicht (Schema 1). Auch wenn die vollständig protonierten Verbindungen [M(CNH)8][SbF6]4 (M=Mo,W) bei Raumtemperatur nur sehr schwer löslich in wasserfreiem Fluorwasserstoff sind, kann ihre Löslichkeit durch die Verwendung von kleinen Mengen Schwefeldioxid SO2 als sekundärem Lösungsmittel leicht erhöht werden. Beim langsamen Abkühlen der Lösung auf −75 °C bilden sich stark feuchtigkeitsempfindliche gelbe Kristalle neben dem farblos-kristallinen Nebenprodukt KSbF6.
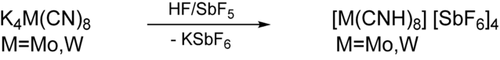
Darstellung von [M(CNH)8]4+[SbF6]−4 (M=Mo,W).
[Mo(CNH)8]4+[SbF6]−4⋅2 HF und [W(CNH)8]4+[SbF6]−4⋅2 HF kristallisieren beide in der monoklinen Raumgruppe P21/n und sind isomorph. Das zentrale Metallion ist von acht (kristallographisch unterschiedlichen) protonierten Cyanid-/ Isoblausäure-Liganden (M−CNH) umgeben, was zu einer leicht verzerrten quadratisch-antiprismatischen Koordinationsgeometrie führt. Die Frage, ob die Liganden an das Metall über den Kohlenstoff (M−C≡NH) oder über den Stickstoff (M−N≡CH) koordinieren, konnte klar durch den Vergleich der R-Werte und Auslenkungsparameter von beiden Strukturlösungen aufgeklärt werden (siehe Hintergrundinformationen). Durch die insgesamt hohe kristallographische Datenqualität konnten die Positionen aller Wasserstoffatome anhand der Restelektronendichte ermittelt werden.
Die M−C−N−H Bindungen sind nahezu linear angeordnet (Winkel zwischen 172–179°; Abbildung 1). Dabei bilden die terminalen Wasserstoffatome der Isoblausäure-Liganden starke Wasserstoffbrückenbindungen zu den Fluor-Atomen der SbF6− Ionen und den cokristallisierten HF-Molekülen aus. In der Molybdänverbindung reichen die MCNH⋅⋅⋅F-Abstände von 1.718(3) bis 1.994(4) Å. Somit sind auch die N−(H)⋅⋅⋅F-Abstände relativ kurz (2.584(2)–2.709(2) Å) und in einer ähnlichen Größenordnung wie bei protonierten Nitrilen mit Hexafluorometallat-Gegenionen (2.5–2.8 Å).11-13
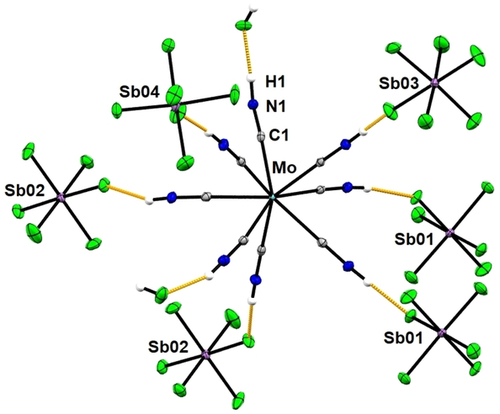
Ausgewählte kurze H⋅⋅⋅F-Kontakte <2 Å (in orange) in der Kristallstruktur von [Mo(CNH)8]4+[SbF6]−4⋅2 HF. Ellipsoide aller nicht-Wasserstoffatome mit 50 % Wahrscheinlichkeit dargestellt; C: grau, N: blau, H: weiß, Mo: türkis, F: grün, Sb: violett.
Die Mo-C-Bindungslängen in [Mo(CNH)8]4+[SbF6]−4⋅2 HF (2.140(2)–2.168(2) Å) sind sehr ähnlich zu den Mo-C-Bindungslängen in K4[Mo(CN)8]⋅2 H2O (2.163(5) Å).33 Jedoch ändert sich die C-N-Bindungslänge deutlich. In der vollständig protonierten Verbindung sind die C-N-Bindungslängen 1.128(3)–1.136(3) Å lang und damit kürzer als im Kaliumsalz (1.152(6) Å). Während die C-N-Bindungslängen der protonierten Verbindung eher den protonierten Nitrilen ähneln,11 sind die des Kaliumsalzes ähnlicher zu freier Blausäure HCN (1.157(1) Å).34 Die Bindungslängen der Verbindung [W(CNH)8]4+ [SbF6]−4⋅2 HF sind sehr ähnlich zur analogen Mo-Verbindung (siehe Tabelle 1). Diese Ergebnisse werden auch von DFT-Rechnungen (M06-L/def2-TZVP) für [M(CNH)8]4+ und [M(CNH)8]4+⋅8 HF (M=Mo,W) unterstützt. Die Fluorwasserstoff-Einheiten wurden gewählt, um den Einfluss der Wasserstoffbrückenbindungen im Kristall zu simulieren. Interessanterweise zeigt der Vergleich, dass die C-N-Bindungslängen komplett unbeeinflusst bleiben, während die M-C-Bindungslängen in den HF-Solvaten leicht verkürzt sind. Jedoch muss erwähnt werden, dass die berechneten M-C-Bindungslängen deutlich länger sind als die experimentell ermittelten.
Verbindung |
M−C (exp). |
C−N (exp.) |
M−C (ber.) |
C−N (ber.) |
|---|---|---|---|---|
[Mo(CNH)8]4+ |
2.140(2)– 2.168(2) |
1.128(3)– 1.136(3) |
2.203 |
1.146 |
[W(CNH)8]4+ |
2.142(2)– 2.169(2) |
1.127(3)– 1.137(3) |
2.211 |
1.147 |
Zusätzlich dazu zeigte sich, dass die Berechnungen der Schwingungsfrequenzen deutlich problematischer sind. Denn der Vergleich der berechneten Schwingungsfrequenzen von [M(CNH)8]4+, [M(NCH)8]4+, [M(CNH)8]4+⋅8 HF und [M(NCH)8]4+⋅8 HF (M=Mo,W) mit den experimentellen Schwingungsspektren der Reaktionsprodukte war unschlüssig. Höchstwahrscheinlich liegt das an den hohen Ionenladungen und den starken Wasserstoffbrückenbindungen, welche nur ungenügend simuliert werden konnten.
Die IR-Schwingungsspektren von [M(CNH)8]4+[SbF6]−4⋅2 HF (M=Mo,W; Abbildung 2) zeigen beide eine breite Bande bei über 3000 cm−1, diese kann der N-H Streckschwingung zugeordnet werden. Zusätzlich dazu kann eine schwache Bande bei 1615 cm−1 als N-H-Deformationsschwingung klassifiziert werden, da beide Banden bei den Deuterierungsexperimenten mit DF/SbF5 stark verschoben wurden. Während der Faktor der Isotopenverschiebung der Beugeschwingungen δ(NH)/δ(ND) bei 1.37 liegt (nahe am theoretischen Wert von 1.41), ist der entsprechende Faktor der Streckschwingungen ν(NH)/ν(ND) mit ≈1.2 deutlich geringer (Tabelle 2). Von ähnlichen Beobachtungen wurde schon zuvor berichtet.35 Dieser Effekt wird durch starke Wasserstoffbrücken hervorgerufen, welche einen größeren Einfluss auf die Streckschwingungen als auf die Beugeschwingungen haben.
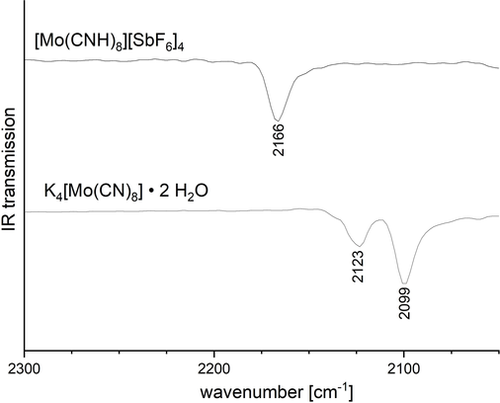
Ausschnitt aus den IR-Spektren; Verschiebung der CN-Streckschwingung durch Protonierung.
|
[Mo(CNH)8]4+ |
[Mo(CND)8]4+ |
[W(CNH)8]4+ |
[W(CND)8]4+ |
|---|---|---|---|---|
ν(NH)/ ν(ND) |
3082 (b) |
2529 (b) |
3030 (b) |
2525 (b) |
ν(CN) |
2166 (m) |
1960 (b) |
2145 (m) |
1970 (b) |
δ(NH)/ δ(ND) |
1615 (m) |
1182 (m) |
1620 (m) |
1180 (m) |
Die IR- und Raman-Schwingungsspektren von [M(CNH)8]4+[SbF6]−4⋅2 HF (M=Mo,W) zeigen beide eine Erhöhung der CN-Streckschwingung von circa 50 cm−1 im Vergleich zu K4[M(CN)8]⋅2 H2O. Eine ähnliche Blauverschiebung wurde bereits bei den IR-Spektren der neutralen Säuren beobachtet.36-40 Die Bindungsstärkung durch Protonierung kann durch die verstärkte Polarisation der Kohlenstoff-Stickstoff-Bindung erklärt werden. Diese Beobachtung ist kohärent mit der beobachteten Verkürzung der C-N-Bindung in der Kristallstruktur.
Trotz der schlechten Löslichkeit von [M(CNH)8]4+[SbF6]−4 (M=Mo,W) in wasserfreiem HF, selbst bei Raumtemperatur, war es möglich, NMR-Spektren von den Produkten in einer Mischung von HF und SO2 bei −40 °C zu messen (Tabelle 3). Das 14N-NMR Spektrum einer Lösung von [Mo(CNH)8]4+ [SbF6]−4 zeigt einen breiten, unaufgelösten Peak bei δ=−182 ppm, was eine deutliche Verschiebung zu K4[Mo(CN)8] in Wasser ist (δ=−95 ppm). Eine ähnliche Verschiebung wurde bei der Protonierung von Acetonitril beobachtet (δ(CH3CN=−134 ppm); δ(CH3CNH+)=−241 ppm).11 Auch das 13C NMR Spektrum zeigt lediglich ein Signal bei δ=121 ppm, was eine Hochfeldverschiebung im Vergleich zu der wässrigen Lösung von K4[Mo(CN)8] (δ=149 ppm) bedeutet.
|
13C |
14N |
|
|---|---|---|---|
K4Mo(CN)8 in D2O |
+149 |
−95 |
|
K4W(CN)8 in D2O |
+143 |
−98 |
|
[Mo(CNH)8]4+ [SbF6]−4 in HF |
+121 |
−182 |
|
[W(CNH)8]4+ [SbF6]−4 in HF |
+115 |
−179 |
Leider war es nicht möglich, ein Signal im 1H-NMR-Spektrum dem CNH-Liganden zuzuordnen, da ein schneller Protonenaustausch zwischen der CNH-Gruppe und dem supersauren Lösungsmittel zu erwarten ist. Von einem ähnlichen Problem wurde bei der Protonierung von H4Fe(CN)6 mit HF/BF3 berichtet, wo es selbst beim Schmelzpunkt des Lösungsmittels (−84 °C) nicht möglich war, den schnellen Austausch auszufrieren.41 Auch wenn über das Produkt [Fe(CNH)6][BF4]2 berichtet wurde, dass es über Monate in wasserfreiem Fluorwasserstoff stabil ist, zerfällt es im Vakuum unter Abspaltung von HF und BF3 zu H4Fe(CN)6. An dieser Stelle sollte erwähnt werden, dass unter deutlich basischeren Bedingungen, also in der Anwesenheit von Ethanol, ein sogenannter supramolekularer Komplex mit der Formel [Fe{CNH−O(H)Et}6]Cl2 kristallographisch charakterisiert wurde.42
Zusammenfassend berichten wir von der ersten erfolgreichen Isolierung eines homoleptischen Metallkomplexes mit acht Isoblausäure-Liganden mittels Protonierung von K4M(CN)8 (M=Mo,W) durch die Supersäure HF/SbF5. Weil Isocyanide (CNR) gute σ-Donor-, aber schwache π-Akzeptor-Liganden sind,43 können sie effektiv die hohen Ladungen der Mo4+- und W4+-Kationen stabilisieren. Die daraus resultierenden quadratisch-antiprismatischen Komplexe [M(CNH)8]4+ (M=MoIV,WIV) sind diamagnetisch und erfüllen die 18-Elektronen-Regel. Während die M−C Bindungslängen fast gleich bleiben, bewirkt die Protonierung eine leichte Verkürzung der C≡N-Bindungslänge, was durch die Erhöhung der Wellenzahl der Streckschwingung ν(CN) um 50 cm−1 bestätigt wird. Zusätzlich dazu zeigt die Molekülstruktur im Festkörper Netzwerke von starken H⋅⋅⋅F-Wasserstoffbrückenbindungen. Diese Ergebnisse zeigen, dass Polycyanometallate deutlich stabiler gegenüber Protolyse sind als zuvor angenommen (zumindest in der Abwesenheit von Nukleophilen). Dies eröffnet ganz neue Wege zu Wasserstoff-verbrückten Netzwerken mit unterschiedlichsten Anwendungsmöglichkeiten.44
Acknowledgements
Gefördert durch die Deutsche Forschungsgemeinschaft (DFG) – Projektnummer 387284271 – SFB 1349. Rechenzeit wurde vom HPC-Service der ZEDAT, FU Berlin bereitgestellt.
Conflict of interest
Die Autoren erklären, dass keine Interessenkonflikte vorliegen.




