Hydrothermale Synthese von konjugierten Polymeren am Beispiel von Pyrronpolymeren und Polybenzimidazolen
Abstract
Verschiedene Polyimide und Polyamide wurden in letzter Zeit durch hydrothermale Synthese in nichts als H2O unter Hochdruck- und Hochtemperaturbedingungen hergestellt. Keines dieser Polymere weist jedoch ein konjugiertes Polymerrückgrat auf. Hiermit berichten wir über eine Erweiterung des synthetischen Anwendungsbereichs dieser einfachen und von Natur aus umweltfreundlichen Polymerisationstechnik auf die Herstellung von konjugierten Polymeren. Ausgewählte Vertreter von zwei verschiedenen Polymerklassen, Pyrronpolymere und Polybenzimidazole, wurden hydrothermal synthetisiert. Neben einer mechanistischen Diskussion der Polymerbildung wird auch eine elektrochemische Charakterisierung des vielversprechendsten Produktes präsentiert.
Einleitung
Hydrothermale (HT) Reaktionen werden seit Jahrzehnten in der präparativen anorganischen Chemie durchgeführt, um eine Vielzahl unterschiedlicher Materialien zu erzeugen, die von synthetischen Edelsteinen bis hin zu Quarzkristallen und Zeolithen reichen.1-3 Erst in den letzten Jahren wurden HT-Methoden auch erfolgreich zur Herstellung einer Reihe von anspruchsvollen organischen Hochleistungspolymeren eingesetzt. Bisher wurden jedoch nur zwei Klassen von makromolekularen Verbindungen erfolgreich hydrothermal gewonnen, nämlich verschiedene Polyimide (polyimides, PIs) und Polyamide (polyamides, PAs).4-8 Die HT-Herstellung dieser Polymere zeichnet sich durch experimentelle Einfachheit sowie inhärente Umweltfreundlichkeit und geringe Kosten aus, da weder ausgeprägte synthetische Fähigkeiten noch toxische Lösungsmittel oder schädliche Katalysatoren benötigt werden. Bei der hydrothermalen Polymerisation (hydrothermal polymerization, HTP) ist H2O nicht nur das einzig verwendete Lösungsmittel und der einzige Katalysator, sondern auch das einzig entstehende Reaktionsnebenprodukt (PIs und PAs sind Kondensationspolymere). Dadurch kann die Handhabung und Entsorgung von gefährlichen Stoffen auf ein Minimum reduziert werden.
Es gibt nun eindeutige Hinweise dafür, dass neben den außergewöhnlichen Eigenschaften von hochtemperiertem Wasser (high-temperature water, HTW) zusätzlich noch eine beträchtliche energetische Triebkraft – z. B. erzeugt durch die Ausbildung starker Bindungen (d. h. Bindungen mit hoher Dissoziationsenergie), Zyklisierungsreaktionen, Konjugation und/oder Kristallisation – für den Ablauf einer Polymerisation unter HT-Bedingungen vorteilhaft ist. Wenn man beispielsweise eine geeignete aromatische Anhydridgruppe (oder die entsprechende Dicarbonsäure) wie in Naphthalinbisanhydrid (NBA) mit einem primären Amin (z. B. Anilin) umsetzt, wird über eine Zyklokondensation ein zyklisches Imid gebildet (Schema 1 A, oben).9 Im Allgemeinen wurden HT-Imidbildungen bereits ausführlich untersucht: Sowohl kleine Moleküle9 als auch eine Vielzahl verschiedener PIs4-6, 8, 10 konnten auf effiziente Weise synthetisiert werden. In dem gerade vorgestellten Beispiel sind die gebildeten Imidgruppen zyklisch und sechsgliedrig. Außerdem sind die C=O-Gruppen des Imids und sein N-Atom linear konjugiert. Die gesamte Imidgruppe ist jedoch mit der Naphthalineinheit nur kreuzkonjugiert. Es ist allgemein bekannt, dass die elektronische Kommunikation zwischen kreuzkonjugierten Systemen im Vergleich zu linear konjugierten Systemen deutlich schwächer ist.11 Darüber hinaus führt die Kreuzkonjugation auch zu einer drastisch reduzierten Leitfähigkeit und wirkt sich daher negativ auf die Ladungstransporteigenschaften aus.12 Wenn jedoch anstelle einer aromatischen Monoamingruppe (zur Bildung eines Imids) eine aromatische o-Diaminkomponente mit einer aromatischen Anhydridkomponente umgesetzt wird (wie in NBA; Schema 1 A, unten), kann es zu einer Doppelzyklisierung kommen. Infolgedessen entsteht eine Imidazolgruppe gebunden an eine zyklische Amidfunktion, was verglichen mit einem Imid eine noch stärker Verknüfungsfunktion ist.13 Zusätzlich kann durch die Verknüpfung der Edukte über eine Doppelzyklisierung eine lineare Konjugation zwischen den Ausgangskomponenten erreicht werden. Allerdings gibt es bisher keinen Bericht über eine solche HT-Doppelzyklisierung zur Erzeugung eines Polymers. Es gibt lediglich einen Beitrag bezüglich der Synthese eines kleinen Moleküls mittels HT-Doppelzyklisierung: Die Reaktion von o-Phenylendiamin (o-PDA) mit NBA führt zu einem Isomerengemisch des Carbonylfarbstoffs Perinon (Schema 1 A, unten).13 Aufgrund seiner hocharomatischen und konjugierten Struktur ist Perinon vollständig planar. Planarität, Aromatizität und Konjugation verleihen generell Eigenschaften wie extreme thermische und chemische Stabilität und wären natürlich auch hochinteressant um in einem organischen Polymer implementiert zu werden. Durch die Anwendung dieser perinonartigen Verknüpfungschemie und die Reaktion von geeigneten aromatischen Bis(o-diamin)en mit aromatischen Dianhydriden (oder ihren Tetracarbonsäuren) können prinzipiell sogenannte Pyrronpolymere (pyrron polymers, PPs; Schema 1 B,C) erhalten werden. Diese Materialien wurden bereits in den 1960er Jahren intensiv aufgrund ihrer hohen T- und Strahlungsbeständigkeit untersucht, weshalb sie als vielversprechende Materialien für den Luft- und Raumfahrtsektor angesehen wurde.14, 15 In jüngerer Zeit haben PPs aufgrund ihrer konjugierten Natur Aufmerksamkeit im Bereich von Elektronik- und Optikanwendungen erregt (insbesondere aufgrund nichtlinearer optischer Eigenschaften).16-19 Wenn man außerdem bedenkt, dass PIs und chinondekorierte Polymere bereits als wässrige Batterieelektroden in neutralen und sauren Elektrolyten untersucht wurden,20-22 so sind wir davon ausgegangen, dass auch PPs in wässrigen Elektrolyten nützliche elektrochemische Eigenschaften aufweisen könnten. Genau wie HTP machen sich auch wässrige Batterien die umweltfreundliche Natur von H2O zunutze.23
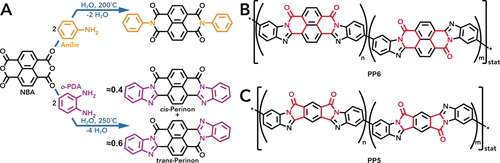
HT-Zyklokondensationen: A) Reaktion von Anilin und NBA unter Bildung eines Naphthalinbisimids (oben) und Reaktion von o-PDA und NBA unter Bildung einer Mischung aus cis- und trans-Perinon (unten). B) PP6: Zwischen den beiden Comonomeren besteht eine sechsgliedrige zyklische Amidbindung (rot). C) PP5: Die Comonomere sind über ein fünfgliedriges zyklisches Amid (rot) miteinander verbunden. Sowohl PP5 als auch PP6 zeigen zwei mögliche Konfigurationen von r.u.s (cis und trans).
Inspiriert durch unsere jüngsten Berichte bezüglich der HTP verschiedener PIs sowie zur HT-Synthese von Perinon haben wir uns nun zum Ziel gesetzt, sowohl die Anzahl der hydrothermal herstellbaren Polymere zu erweitern als auch Polymere mit einem konjugierten Rückgrat durch HTP herzustellen. Wir betrachten dies als einen äußerst wichtigen Schritt, um HTP auf eine neue Ebene der breiteren Anwendbarkeit zu heben. Die beiden prominentesten Vertreter von PPs sind in Schema 1 B und 1 C dargestellt. Zu beachten ist, dass die Art des verwendeten Dianhydrids die Größe der zyklischen Amideinheit bestimmt, die die beiden Comonomere verbindet. Während NBA zu einer sechsgliedrigen Amideinheit führt, liefert Pyromellitsäuredianhydrid (PMDA) eine fünfgliedrige zyklische Amideinheit. Die entsprechenden PPs vom Semiladder-Typ werden im Folgenden als PP6 (auch bekannt als BBB) bzw. PP5 bezeichnet. Im Allgemeinen wird eine zufällige Verteilung von cis- und trans-Konfigurationen von Repetiereinheiten (repeating units, r.u.s) entlang der Polymerkette erwartet. Die beiden üblichen synthetischen Verfahren zur Herstellung von PPs sind: (i) Kontrolliertes und schrittweises Erhitzen der reinen Comonomere in Polyphosphorsäure, wodurch PP-Partikel entstehen,14, 15 die durch Hochtemperaturformgebung verarbeitet werden können;24 (ii) Rühren der reinen Comonomere bei Raumtemperatur (room temperature, rt) in einem aprotischen, polaren Lösungsmittel wie N,N-Dimethylformamid (DMF), um eine verarbeitbare Poly(amidaminosäure)-Lösung zu erhalten, die beispielsweise zu Filme und Fasern verarbeitet werden kann, bevor ein abschließender thermischer Härtungsschritt bei T≥300 °C das gewünschte PP-Produkt liefert.25, 26 Es ist klar, dass diese beiden letztgenannten Verfahren langwierig und keineswegs umweltfreundlich sind. Daher zielten wir hiermit auf eine einfache, grüne Synthesestrategie zur Herstellung von PPs ab, die nichts als “heißes Wasser” benötigt.
Resultate und Diskussion
HTP zur Herstellung von PP6
Zur Untersuchung der generellen Durchführbarkeit der hydrothermalen Synthese von PPs versuchten wir, die ursprünglich verwendeten Comonomere möglichst ähnlich zu den Ausgangsstoffen von Perinon zu halten, und wandten dabei auch die für die HT-Perinonbildung als optimal befundenen Reaktionsbedingungen an.13 Folglich wurden NBA und 3,3′-Diaminobenzidin (DAB) als Edukte eingesetzt, um die PP6-Synthese unter HT-Bedingungen zu versuchen. Da sich im Falle von PIs die Verwendung von Monomersalzen (monomer salts, MSs) als Vorstufen für die HTP als sehr vorteilhaft gegenüber der Arbeit mit reinen Comonomeren erwiesen hat,4-6 beabsichtigten wir, auch für PP6 ein MS aus DAB und Naphthalintetracarbonsäure (NTCA; durch die Hydrolyse von NBA) herzustellen (Schema 2). MSs liefern oft von sich aus eine äquimolare Comonomerstöchiometrie, was für die Gewinnung hochmolekularer Produkte durch eine Polykondensation von entscheidender Bedeutung ist (Carother'sches Gesetz). Darüber hinaus weisen MSs im Vergleich zu reinen Aminen – zumindest teilweise – protonierte NH2-Gruppen auf, die stabiler gegenüber Oxidation sind und daher ohne besondere Vorkehrungen deutlich länger lagerfähig sind. Zusätzlich ist zu erwarten, dass MSs im Vergleich zu reinen Comonomeren aufgrund ihrer ionischen Natur, der Vororganisation in einem Salzkristall und der dadurch bedingten räumlichen Nähe von reaktiven Gruppen, bereits im festen Zustand, eine veränderte Reaktivität und Löslichkeit aufweisen.27 Das für die HTP zu PP6 geeignete MS (abgekürzt MS6) wurde durch Präzipitation in H2O hergestellt (Hintergrundinformationen, SI). MS6 wurde dabei als violetter Feststoff erhalten. Die Analyse mittels abgeschwächter Totalreflexions-Fourier-Transformations-Infrarot (attenuated total reflectance Fourier transform infrared, ATR-FTIR)-Spektroskopie und 1H-NMR-Spektroskopie bestätigte seine erfolgreiche Bildung. Die ATR-FTIR-Spektren von MS6 und seinen Ausgangsverbindungen NBA und DAB unterscheiden sich deutlich voneinander (Abbildung 1 A). Die für die Edukte charakteristischen Banden (hervorgehoben durch farbige Boxen; νC=O(NBA)≈1770 cm−1, νN-H(DAB)≈3450–3200 cm−1)28, 29 fehlen im Spektrum von MS6. Stattdessen werden mehrere Banden beobachtet, die auf die Bildung von MS6 hindeuten (hervorgehoben durch Pfeile; νN-H(NH2)≈3375 cm−1, ≈3220 cm−1; νN-H(NH3+)≈2885 cm−1, ≈2585 cm−1; νC=O(COOH)≈1710 cm−1; νC=O(COO−)≈1525 cm−1). Abbildung 1 B zeigt das 1H-NMR-Spektrum von MS6: Das Singulett (Ha) bei 8.00 ppm entspricht den Naphthalinprotonen, während das Singulett (Hb) bei 6.65 ppm und das Multiplett (Hc) bei 6.52 ppm von den Biphenylprotonen stammen. Das Integralverhältnis Ha:Hb:Hc=4:2:4 bestätigt eine 1:1 DAB:NTCA-Zusammensetzung.
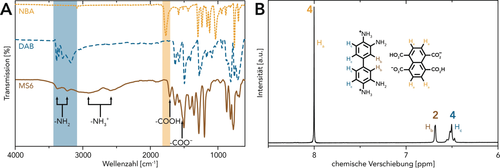
Charakterisierung von MS6: A) ATR-FTIR-Spektren von MS6 und seinen Ausgangsverbindungen DAB und NBA: charakteristische Banden der Ausgangsverbindungen sind durch farbige Boxen hervorgehoben; Banden, die für MS6 indikativ sind, sind durch Pfeile gekennzeichnet. B) 1H-NMR-Spektrum von MS6 gemessen in [D6]DMSO: ein Integralverhältnis Ha:Hb:Hc=4:2:4 bestätigt ein molares Verhältnis von NTCA:DAB von 1:1.
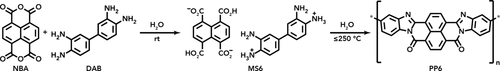
HTP zu PP6: Zuerst hydrolysiert NBA zu NTCA, welche dann mit DAB zu MS6 reagiert (Position der Ladungen in der Darstellung von MS6 ist willkürlich). Danach, wenn MS6 HT-Bedingungen ausgesetzt wird, findet die Doppelzyklisierung zu PP6 problemlos statt.
Anschließend wurde ausgehend von MS6 eine durch Mikrowellen (microwaves, MWs) unterstützte HTP zu PP6 durchgeführt. Dazu wurde eine wässrige Dispersion von MS6 (c=0.01 mol L−1) in einen Glasliner eingebracht, der in einen PTFE-ausgekleideten gerührten MW-Autoklaven überführt und durch MW-Bestrahlung innerhalb einer Heizzeit (tH) von 10 min auf die gewünschte Reaktionstemperatur (TR) von 250 °C erhitzt wurde. Die TR wurde über eine Reaktionszeit (tR) von 15 min konstant gehalten. Nach der Abkühlung auf rt enthielt der Glasliner zwei unterschiedliche Schichten: ein festes, schwarzes Sediment am Boden und einen durchscheinenden, farblosen, klaren Flüssigkeitsüberstand. Die schwarze Farbe des Feststoffs war bereits ein Hinweis auf die Bildung von PP6. ATR-FTIR-Spektroskopie des Feststoffs (Abbildung 2 A) bestätigte eine erfolgreiche Doppelzyklisierung durch das Vorhandensein mehrerer charakteristischer PP6-Banden,15, 30 die denen von Perinon ähnlich sind:13 νC=O(PP6)≈1700 cm−1; νC=C/C=N(PP6)≈1620 cm−1 (kombinierte Bande); ν(Benzimidazol)≈1450 cm−1 (in-plane Schwingung); νC-N(PP6)≈1310 cm−1. Jedoch deuten die intensiven bei ≈1780 cm−1 und ≈1740 cm−1 auftretenden Banden (Abbildung 2 A, braune Box) auf das Vorhandensein von Anhydridendgruppen hin.31, 32 Zweifellos bedeuten freie Anhydridgruppen, dass auch nicht umgesetzte NH2-Gruppen im erhaltenen Polymer vorhanden sein müssen. Es wird jedoch erwartet, dass die Banden der N-H-Streckschwingung inhärent schwächer sind als die Banden der Anhydridendgruppen. Die Bildung intermolekularer H-Brückenbindungen zu den im Produkt enthaltenen C=O-Gruppen führt zu einer signifikanten Bandenverbreiterung und senkt zusätzlich die mittlere Absorptionsfrequenz.33 Daher werden hier und im Folgenden nur die indikativen und gut ausgeprägten C=O-Banden der Anhydridfunktion verwendet, um den Erfolg eines HTP-Experiments abzuschätzen. Aufgrund der Intensität dieser C=O-Banden vermuteten wir, dass das in diesem ersten Testexperiment erzeugte PP6 ein relativ niedriges Molekulargewicht hat. In weiterer Folge wurden verschiedene Versuche (SI) unternommen, um Produkte mit höherem Molekulargewicht zu erhalten: weder die Senkung der c, die Änderung des pH-Wertes, die Erhöhung der tR, die Verlängerung der tH, noch die Zugabe einer nicht-nukleophilen Base (die nachweislich die HT-Bildung von Imiden fördert)9 führten zu einer Abnahme der Intensitäten der Anhydridendgruppenbanden in den entsprechenden ATR-FTIR-Spektren. Alle diese HTP-Experimente wurden mittels des konventionellen, gerührten, MW-unterstützten Reaktionssetups bei TR=250 °C durchgeführt (was die maximale kontinuierliche Betriebstemperatur dieses Setups ist). Die Untersuchung von TRs≥250 °C schien jedoch eine weitere vielversprechende Strategie zu sein, um Produkte mit höherem Molekulargewicht zu erhalten. Bei Erhöhung der T nimmt die statische Dielektrizitätskonstante von H2O kontinuierlich ab,34 was eine deutlich verbesserte Löslichkeit verschiedener organischer Verbindungen, die unter Umgebungsbedingungen in H2O praktisch unlöslich sind (insbesondere von Aromaten), zur Folge hat.35-37 Darüber hinaus wird auch die klassische PP-Synthese bei TRs≥300 °C durchgeführt.26 Um höhere TRs verwenden zu können, mussten wir unseren Versuchsaufbau auf einen ungerührten Hochtemperaturhochdruckautoklaven (high-temperature high-pressure autoclave, HPA; für Details siehe SI) umstellen. Das Verfahren zur Probenvorbereitung blieb dasselbe wie bei den MW-unterstützten Experimenten, wobei vor dem Erhitzen 10 bar Argon-Vordruck angewendet wurden.71

Charakterisierung von PP6: A) ATR-FTIR-Spektren von PP6 (MW, c=0.01 mol L−1, TR=250 °C, tH=10 min, tR=15 min) und seiner Vorstufe MS6: charakteristische PP6-Banden sind durch Pfeile hervorgehoben; Banden der Anhydridendgruppen sind durch eine braune Box gekennzeichnet. B) ATR-FTIR-Spektren von PP6 (HPA, c=0.01 mol L−1, tR=2 h), die bei verschiedenen TRs hergestellt wurden: mit zunehmender TR verschwinden die Banden der Anhydridendgruppen (braune Box) allmählich. C) TGA-Kurve (N2, 10 °C min−1) einer vollständig kondensierten PP6-Probe (HPA, c=0.01 mol L−1, TR=350 ° C, tR=2 h): ein anfänglicher Massenverlust ist auf physisorbiertes H2O zurückzuführen; die Polymerabbautemperaturen T95 % und T90 % sind angegeben. D) PXRD-Muster von PP6 (HPA, c=0.01 mol L−1, TR=350 °C, tR=2 h): zwei breite Merkmale treten auf: M1 (Länge der r.u.) und M2 (Abstand zwischen den Ketten).
Im Folgenden wurden HTPs von MS6 zu PP6 bei verschiedenen TRs (250 °C, 275 °C, 300 °C, 325 °C, 350 °C) und tRs (15 min, 2 h, 12 h) durchgeführt. Erste Experimente bei TR=250 °C zeigten sofort, dass im Vergleich zum MW-unterstützten, gerührten Setup im HPA die Abwesenheit von Rühren längere tRs notwendig macht, um die gleichen Ergebnisse zu erzielen. Darüber hinaus nahm bei konstanter tR die Intensität der Banden der Anhydridendgruppen in den ATR-FTIR-Spektren mit zunehmender TR ab (Abbildung 2 B). Während bei tR=2 h die Banden bei TRs bis zu 325 °C noch sichtbar sind, verschwinden sie bei TR=350 °C vollständig. Bei TRs von 250 °C bzw. 275 °C führte die Verlängerung der tRs zu keiner merklichen Abnahme der Intensität der Endgruppenbanden. Bei TRs von 300 °C und 325 °C führte jedoch eine Verlängerung der tR auf 12 h zu einem vollständigen Verschwinden der für die Anhydridendgruppen charakteristischen Banden. Darüber hinaus wurden bei keiner der Proben in den ATR-FTIR-Spektren Banden gefunden, die auf eine unvollständige Zyklisierung oder nichtlineare Verzweigung (z. B. Amid oder Imid) hindeuten.26, 31 Auf der Grundlage dieser Ergebnisse schließen wir, dass vollständig kondensiertes, lineares PP6 mit unterschiedlichen Polymerisationsgraden gezielt hydrothermal synthetisiert werden kann, ohne dass Colösungsmittel oder Kondensationskatalysatoren erforderlich sind, indem einfach TR und tR angepasst werden.
Im Anschluss untersuchten wir die thermischen Stabilitäten solcher vollständig kondensierter PP6-Proben mittels thermogravimetrischer Analyse (TGA; Abbildung 2 C). Ein anfänglicher Massenverlust zwischen rt und 120 °C, der in allen Proben vorhanden war, wird physisorbiertem H2O zugeschrieben. Es ist bekannt, dass aufgrund der Ausbildung von H-Brückenbindung zu den im Polymer enthaltenen Heteroatome (N, O), welche über freie Elektronenpaare verfügen, PP6 stets eine gewisse Menge an physisorbiertem H2O enthält.38, 39 Berücksichtigt man den anfänglichen Massenverlust durch physisorbiertes H2O, so beträgt die Temperatur, bei der 5 % Massenverlust auftreten, (T95 %) 664 °C und die Temperatur, bei der 10 % Massenverlust auftreten, (T90 %) 722 °C. Diese hohen Werte stimmen gut mit den Literaturdaten für vollständig kondensiertes PP6 überein.15, 26, 31 Darüber hinaus war es auch möglich, PP6 in Methansulfonsäure zu lösen, was die Herstellung von Dünnfilmen gemäß eines kürzlich in der Literatur beschriebenen Verfahrens ermöglichte.40 UV-Vis Absorptionsspektren verdünnter Lösungen sowie der hergestellten Dünnfilmen (SI) stimmen gut mit bisherigen Berichten überein und weisen auf die Ausbildung eines vollständig konjugierten Polymerrückgrats hin.41
Für lineare PIs und PA-Netzwerke führte die HT-Herstellung zu einer außergewöhnlich hohen Kristallinität, die den konventionell hergestellten Analoga überlegen ist.4, 7 Über konventionelle Methoden wurden bislang ausschließlich amorphe PPs hergestellt. Die Pulverröntgendiffraktometrie (powder X-ray diffraction, PXRD) Messungen von allen vollständig kondensiertem, hydrothermal hergestellten PP6-Proben sind völlig identisch (repräsentatives Diffraktogramm in Abbildung 2 D). Das Diffraktogramm enthält nur zwei breite Merkmale: eines mit einem Maximum bei 11.6° (2θ, Cu-Kα) (gekennzeichnet als M1) und eines mit einem Maximum bei 25.8° (2θ, Cu-Kα) (gekennzeichnet als M2). Während M2 dem Kettenabstand (n=1; dhkl(25.8°)≈3.5 Å) entspricht, der durch intermolekulares π-Stacking zwischen den vollständig planaren r.u.s entsteht, kann M1 der Länge der r.u. zugeordnet werden (n=2; dhkl(11.6°)≈15.2 Å). Diese Beobachtungen stimmen mit der Literatur überein.42, 43 Im Gegensatz zu PIs und PAs aus HTP,4, 7 weist hydrothermale hergestelltes PP6 keine verbesserte Kristallinität im Vergleich zu klassisch erzeugtem PP6 auf. Versuche, die Kristallinität von PP6 zu erhöhen, indem HTPs mit niedrigerer c(MS6) durchgeführt wurden, waren nicht erfolgreich (SI). Jedoch wurden die von Stewart et al. beschriebenen hoch geordneten PA-Netzwerke durch Devitrifikation von eingangs hergestellten amorphen Vorläufernetzwerken auf der Basis der Reversibilität von Amidbindungen unter HT-Bedingungen erhalten.7 Die PA-Devitrifikation erfordert TRs von 240–250 °C und tRs von 3–7 Tagen.7 Angeregt durch diesen Bericht haben wir unsere PP6-Proben nochmals 7 Tage lang HT-Bedingungen bei verschiedenen TRs (250 °C, 300 °C) ausgesetzt, in der Hoffnung, dass auch für PP6 eine Erhöhung der Kristallinität durch ähnliche Bindungsreversibilität realisiert werden kann. Leider wurden keine Veränderungen in den PXRD-Mustern beobachtet (SI). Wir glauben, dass die fehlende Reversibilität damit zusammenhängen muss, dass eine Bindung vom Perinontyp viel stabiler, linear konjugiert und deutlich weniger anfällig für Hydrolyse ist als eine Amidbindung. Da die ATR-FTIR-Spektren von PP6 vor und nach der Devitrifikationsbehandlung praktisch identisch waren, kommen wir zu dem Schluss, dass PP6 gegenüber einer längeren Exposition in “heißem H2O” völlig stabil ist.
Für hydrothermal erzeugte lineare PIs wurde ein Mechanismus beschrieben, der die Auflösung von MS gefolgt von in Lösung stattfindender Polymerisation und anschließender Kristallisation beinhaltet. Folglich wird die Reaktion von MS zum entsprechenden PI von einer signifikanten Veränderung der Morphologie begleitet.4, 44 Im Gegensatz dazu zeigten Rasterelektronenmikroskop (scanning electron microscope, SEM) Aufnahmen, dass die Morphologien von MS6 und PP6 tatsächlich auffallend ähnlich sind: Beide bestehen hauptsächlich aus Mikroblättern und Nadeln (≈2–10 μm in der Länge), die zu größeren Strukturen agglomeriert sind (Abbildung 3 A,B). Am interessantesten ist, dass diese Formerhaltung für alle Proben unabhängig von den Reaktionsbedingungen gefunden wird. Daraus schließen wir, dass die Umwandlung von MS6 zu PP6 hauptsächlich im festen Zustand stattfinden muss, während eine Auflösung oder ein Schmelzen nicht zu erfolgen scheint. Für verschiedene Arten von Kondensationspolymeren (PAs, Polyester, PIs) ist bekannt, dass eine Wärmebehandlung geeigneter MS-Vorstufen zu einer Festkörperpolymerisation (solid-state polymerization, SSP) unter Erhaltung der Form des MS führen kann.45, 46 Solche SSPs werden typischerweise unter lösungsmittelfreien Bedingungen durchgeführt, indem das MS auf einen T unterhalb seines Schmelzpunktes erhitzt wird.47 Allerdings gibt es auch Berichte über SSP in dispergierten Medien,48, 49 und für PIs ist SSP ein möglicher Reaktionsweg während der HTP, der je nach Löslichkeit des MS in HTW und seiner SSP-Temperatur in unterschiedlichem Ausmaß auftritt.5, 10 Hier weist jedoch die Beobachtung, dass die Morphologien von MS6 und PP6 quasi ident sind, stark auf eine Transformation hin, die praktisch ausschließlich über SSP stattfindet. Dieser eher unerwartete Befund warf die Frage auf, ob das Vorhandensein von H2O für die Umwandlung von MS6 zu PP6 überhaupt notwendig ist oder ob nur das Erwärmen von MS6 auf TRs≥250 °C ausreicht. Daher haben wir mehrere SSPs durchgeführt, bei denen reines MS6 auf verschiedene TRs (250 °C, 350 °C, 600 °C) unter N2-Atmosphäre erhitzt wurde. Interessanterweise ergab keines der SSP-Experimente vollständig kondensiertes PP6. (i) Die SSP bei 250 °C (tR=2 h, 12 h) ergab niedermolekulare Imidzwischenprodukte mit Anhydridendgruppen (νC=O(Imid)≈1710 cm−1, ≈1675 cm−1; νC=O(Anhydrid)≈1780 cm−1, ≈1740 cm−1; Abbildung 3 C und SI). Interessanterweise haben wir in keiner der HTPs zu PP6 solche Imide gefunden. Es ist außerdem zu beachten, dass im Falle von HTP TR=250 °C bereits für die PP6-Bildung ausreichend war. (ii) Die SSP bei 350 °C (tR=2 h) führte zur erfolgreichen Bildung von perinonartigen Verknüpfungsfunktionen, aber es waren immer noch deutlich ausgeprägte Banden, die auf Imid- und Anhydridendgruppen zurückzuführen sind, vorhanden (SI). (iii) Die ATR-FTIR-Analyse eines letzten bei 600 °C (tR=30 min; Abbildung 3 C) durchgeführten Experiments bestätigte eindeutig die Bildung eines PP6-Produkts, das keine Restimidanteile mehr enthielt. Allerdings sind immer noch Anhydridendgruppen sichtbar, was auf einen geringen Polymerisationsgrad hinweist. Dies deckt sich gut mit den Beobachtungen von Morgan und Scott, die feststellten, dass die vollständige Kondensation von MS6 zu PP6 erst bei ≈630 °C erreicht wurde.50 In diesem T-Bereich setzt jedoch bereits die Zersetzung ein, was die erreichbaren Polymerisationsgrade einschränkt.
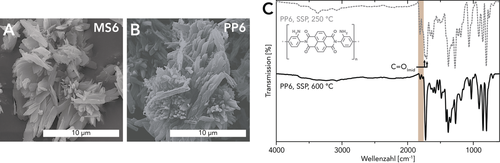
SEM-Aufnahmen von MS6 (A) und PP6 (HPA, c=0.01 mol L−1, TR=350 °C, tR=2 h) (B). C) ATR-FTIR-Spektren von PP6, welches mittels SSP bei TR=250 °C (tR=2 h) und TR=600 °C (tR=30 min) hergestellt wurde: die bei 600 °C hergestellte Probe zeigt identische Banden verglichen mit HT-PP6 sowie Banden von Ahnydridendgruppen (braune Box), während SSP bei 250 °C zu Imidbanden (Pfeile) und intensiven Banden von Anhydridendgruppen (braune Box) führt.
Diese SSP-Studie deutet stark darauf hin, dass H2O eine entscheidende Rolle bei der Umwandlung von MS6 zu PP6 spielt. Erstens senkt HTW die für die Gewinnung von PP6 erforderlichen TRs deutlich, zweitens ermöglicht es die Erzeugung von Produkten mit höherem Molekulargewicht und drittens hat es zusätzlich einen starken Einfluss auf den Mechanismus der Transformation und erleichtert die Doppelzyklisierung zu PP6. Prinzipiell sind mehrere mögliche Erklärungen denkbar: (i) Das erhöhte Ionenprodukt von H2O unter HT-Bedingungen51 könnte die Zyklokondensation fördern.52 Dies müsste eine Migration von H+ (H3O+) und/oder OH− in die festen MS-Partikel beinhalten. Es ist zu beachten, dass für viele (organische) Materialien – z. B. wässrige Dispersionen/Lösungen von fester Biomasse, Graphenoxid oder Zuckern – bekannt ist, dass deren HT-Behandlung Dehydratisierungsreaktionen erheblich erleichtern kann.53-55 (ii) Auch der autogen entstehende Druck beim Erhitzen von H2O in einem Autoklaven könnte eine vorteilhafte Rolle bei der Umwandlung spielen. Es gibt mehrere Literaturberichte, die belegen, dass PPs durch reaktives Heißpressen entweder von gut gemischten, reinen Comonomeren oder von MSs als Vorstufe, hergestellt werden können.50, 56 Allerdings mussten hierfür TRs von ≈450 °C und Drücke von mindestens 275 bar angewendet werden, um eine vollständige Zyklisierung und dichte Produkte zu erreichen. Dies steht im Vergleich zu Drücken von ≈165 bar im Rahmen einer HTP bei 350 °C.
HTP zur Herstellung von PP5
Nachdem die HT-Herstellung von PP6 erreicht war, beschlossen wir zu versuchen auch stärker gespannte fünfgliedrigen Amidverknüpfungen zu erzeugen, d. h. die HTP von PP5 durchzuführen (Schema 3). Daher haben wir zunächst ein geeignetes MS (MS5; SI) aus Pyromellitsäure (PMA) und DAB hergestellt. Die erfolgreiche Bildung von MS5 einschließlich der 1:1-Stöchiometrie von PMA:DAB wurde durch ATR-FTIR- und 1H-NMR-Analyse bestätigt (SI). Überraschenderweise ergab eine Reaktion, bei der MS5 unter HT-Bedingungen bei den bereits für die PP6-Synthese angewandten Bedingungen (MW, c=0.01 mol L−1, TR=250 °C, tH=10 min, tR=15 min) behandelt wurde, ein feines, dunkeloranges Pulver, das von einer durchscheinenden flüssigen Phase bedeckt war. Dieses Aussehen steht in starkem Kontrast zu der für PP5 beschriebenen tiefschwarzen Farbe.25 Außerdem fehlte im entsprechenden ATR-FTIR-Spektrum (Abbildung 4 B; obere Kurve) die für PP5 charakteristische intensive C=O-Bande bei ≈1755 cm−1. Dennoch unterscheidet sich das Spektrum signifikant von dem von MS5 (z. B. Verschwinden der NH2- und NH3+-Banden; SI). Weder das wohldefinierte ATR-FTIR-Spektrum noch das Aussehen des Produkts weisen auf eine unkontrollierte Zersetzung hin. Wir hielten es deshalb für wahrscheinlicher, dass eine bestimmte chemische Reaktion stattgefunden hatte, die jedoch kein PP5 ergab. In Übereinstimmung mit der Literatur bezüglich ähnlicher Verbindungen57-59 erschienen drei strukturelle Möglichkeiten wahrscheinlich (Abbildung 4 A): (i) Eine anfängliche Kondensation könnte eine Poly(amidaminosäure) (poly(amide aminoacid), PAAA) erzeugen. Durch einen zweiten Kondensationsschritt könnten sich als nächstes zwei verschiedene Spezies bilden: (ii) ein Poly(imidamin) (PI-NH2) oder (iii) eine Poly(benzimidazolsäure) (PBI-COOH). Theoretisch ist eine Mischung einiger oder sogar aller dieser verschiedenen Spezies sowie die Bildung eines Netzwerks (was notwendigerweise Amidbindungen impliziert) denkbar. Das ATR-FTIR-Spektrum des erhaltenen Produkts zeigte jedoch weder Amid- noch Imidbanden. Daher konnte die Bildung von PAAA, PI-NH2 oder eines amidvernetzten Netzwerks ausgeschlossen werden. Darüber hinaus konnten die kombinierte C=C/C=N-Ringschwingung bei ≈1620 cm−1, die in-plane Benzimidazol-Schwingung bei ≈1445 cm−1, und die C-N-Streckschwingung bei ≈1315 cm−1 gefunden werden. All diese Banden sind höchst indikativ für Polybenzimidazole (polybenzimidazoles, PBIs),30 und auch in Übereinstimmung mit einer niedermolekularen Modellverbindung, die aus PMDA und o-PDA synthetisiert wurde.58 Daher erwarteten wir, dass das durch die HT-Behandlung von MS5 gewonnene Material PBI-COOH sein würde. Interessanterweise weist das ATR-FTIR-Spektrum keine C=O-Bande von -COOH auf (charakteristischer Bereich in Abbildung 4 B durch orangefarbene Box gekennzeichnet), was wir auf einen intramolekularen Protonentransfer zurückführen, welcher Imidazolium- und Carboxylatgruppen erzeugt, die über H-Brückenbindungen verbunden sind (vgl. Struktur in Abbildung 4 B).58 Der Einfachheit halber bezeichnen wir das erhaltene Material hier jedoch als PBI-COOH.
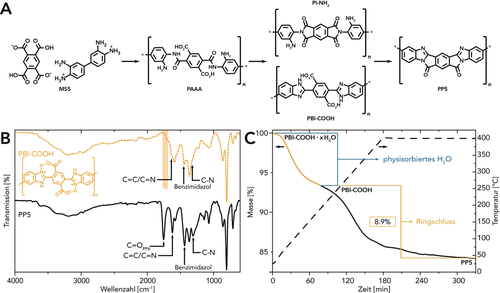
Identifizierung von PBI-COOH und PP5: A) Übersicht über mögliche Intermediate. B) ATR-FTIR-Spektren von PBI-COOH (MW, c=0.01 mol L−1, TR=250 °C, tH=10 min, tR=15 min) und PP5, welches durch Erhitzen (TR=400 °C, tR=2 h, N2 Atmosphäre) von festem PBI-COOH erhalten wurde: charakteristische Banden sind durch Pfeile markiert und die νC=O(COOH)-Region ist durch eine orange Box hervorgehoben. C) TGA-Kurve (N2, 2 °C min−1) von PBI-COOH (MW, c=0.01 mol L−1, TR=250 °C, tH=10 min, tR=15 min), die die Umwandlung zu PP5 anzeigt.
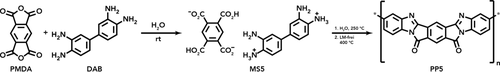
HTP zu PP5: Zuerst hydrolysiert PMDA zu PMA, welche dann mit DAB zu MS5 reagiert (Position der Ladungen in der Darstellung von MS5 ist willkürlich). Wenn MS5 daraufhin HT-Bedingungen ausgesetzt und das danach isolierte Zwischenprodukt einer Wärmebehandlung (400 °C, lösungsmittelfrei) unterzogen wird, erfolgt die Bildung von PP5.
Für die Umwandlung von PBI-COOH in PP5 ist nur ein einziger zusätzlicher Zyklokondensationsschritt erforderlich. Jedoch waren alle unsere Versuche, diesen finalen Ringschluss hydrothermal in nennenswertem Umfang zu erreichen, erfolglos (SI). Interessanterweise stellten wir beim Erhöhen der TR fest, dass im Rahmen einer HT-PP5-Synthese TRs≥300 °C (Experiment durchgeführt im HPA) zu Zersetzung führen. Dies steht in deutlichem Gegensatz zu PP6, wo nur HTPs bei solch hohen TRs die Erzeugung von hochmolekularen Produkten überhaupt erst ermöglichen. Wir vermuten daher, dass die intramolekularen H-Brückenbindungen zwischen Benzimidazolium und -COO− (von denen wir erwarten, dass es sich um siebengliedrige zyklische Motive handelt) PBI-COOH (insbesondere in einer protischen Umgebung wie HTW) energetisch stabilisieren und damit den endgültigen Ringschluss erschweren, wenn nicht sogar hydrothermal unmöglich machen. Nachdem wir für den Fall von MS6 gezeigt hatten, dass bei HTP und SSP unterschiedliche Reaktivitäten auftreten, beschlossen wir, auch für PBI-COOH eine Postpolymerisationsfestkörperwärmebehandlung zu untersuchen, um seine Umwandlung zu PP5 in Gang zu setzen. Glücklicherweise ermöglichte diese lösungsmittelfreie Wärmebehandlung tatsächlich die Umwandlung zu PP5: Durch Erhitzen von PBI-COOH auf 400 °C unter N2-Atmosphäre konnte der gewünschte zweite Ringschluss erreicht werden. Die ATR-FTIR-Analyse (Abbildung 4 B; untere Kurve) stimmt sehr gut mit der Literatur überein und bestätigt die PP5-Bildung.14, 60 Alle charakteristischen Banden sind vorhanden: νC=O(PP5)≈1755 cm−1; νC=C/C=N(PP5)≈1620 cm−1 (kombinierte Bande); ν(Benzimidazol)≈1440 cm−1 (in-plane Schwingung); νC-N(PP5)≈1310 cm−1. Banden, die auf einen unvollständigen Ringschluss hinweisen (Amid, Imid, Amino, Carbonyl/Carboxyl), fehlen.
Anschließend wurde ein TGA-Experiment durchgeführt, um die Reaktion von PBI-COOH zu PP5 nachzuverfolgen (Abbildung 4 C). Ein anfänglicher Massenverlust von ≈7 % wird physisorbiertem H2O zugeschrieben – ein bekanntes Phänomen für verschiedene PBIs und PPs.39, 61 Der zweite Massenverlust von ≈8.9 % stimmt perfekt mit dem berechneten m(H2O) für die vollständige Kondensation durch den gewünschten Ringschluss überein (SI). PXRD-Messungen (SI) ergaben, dass sowohl PP5 als auch PBI-COOH amorph sind und jeweils nur ein breites Halo aufweisen, welches um ≈26° (2θ, Cu-Kα) zentriert ist. Dies deutet auf niedrige Ordnung, aber sehr wohl intermolekulares π-Stacking zwischen den Polymerketten hin. SEM-Messungen von MS5, PBI-COOH und PP5 (Abbildung 5) zeigten starke morphologische Ähnlichkeiten zwischen PBI-COOH und PP5, was auf die Abwesenheit von Erweichungsphänomenen während der entsprechenden Umwandlung hinweist. Beide Materialien enthalten hauptsächlich aus Fasern aufgebaute Matten und einige wenige kugelförmige Partikel (≈0.5–1 μm Durchmesser), während MS5 ausschließlich aus kantigen Partikeln von ≈5–10 μm besteht. Diese Morphologien implizieren, dass die HTP zu PBI-COOH über einen Auflösungs-Polymerisations-Fällungsmechanismus erfolgen muss, während der zweite lösungsmittelfreie Reaktionsschritt von PBI-COOH zu PP5 im festen Zustand abläuft.

SEM-Aufnahmen von MS5 (A), PBI-COOH (MW, c=0.01 mol L−1, TR=250 °C, tH=10 min, tR=15 min) (B), und PP5 (C), welches durch Festkörperwärmebehandlung (TR=400 °C, tR=2 h, N2) von PBI-COOH erhalten wurde.
Insgesamt unterscheiden sich PP5 und PP6 in ihrer Synthese erheblich. Die Tatsache, dass isolierbares PBI-COOH erhalten wird, wenn MS5 HT-Bedingungen ausgesetzt wird, deutet darauf hin, dass auch reine, nicht funktionalisierte PBIs durch HTP zugänglich sein könnten.
HTP zur Herstellung von PBI
In Analogie zur HTP von PIs4-6, 44 und PPs (diese Arbeit) versuchten wir zunächst, eine MS aus Terephthalsäure (TA) und DAB herzustellen. Die Herstellung des entsprechenden MS konnte jedoch nicht realisiert werden, was wir darauf zurückführen, dass die pKa-Differenz zwischen TA (pKa(TA)=3.49) und DAB (pKa(DAB)=4.39) für die Salzbildung zu gering ist.62 Daher zielten wir zunächst darauf ab, PBI herzustellen, indem wir die in H2O suspendierten reinen Comonomere TA und DAB direkt HT-Bedingungen (MW, c=0.01 mol L−1, TR=250 °C, tH=10 min, tR=15 min) aussetzten. Im Rahmen dieses Versuchs wurde ein braunes Pulver am Boden des Liners erhalten. Da die ATR-FTIR-Messungen die PBI-Bildung nicht bestätigten, nahmen wir an, dass es TA an Reaktivität mangelte. Folglich entschieden wir uns, TA durch eine reaktivere Carbonylverbindung zu ersetzen: Inspiriert durch die Arbeit von Neuse et al. entschlossen wir uns Terephthalaldehyd (TDA) zu verwenden.63 Neuse et al. beschrieben die Herstellung eines Iminpräpolymers, das unter anaeroben Bedingungen bei TR≤25 °C in einem aprotischen, polaren Lösungsmittel erzeugt wurde. Anschließend konnte dieses Präpolymer durch Erhitzen auf 60 °C in Gegenwart eines Übergangsmetallkatalysators unter aeroben Bedingungen in PBI umgewandelt werden. Im Gegensatz dazu erfordert die von uns gewählte Synthesestrategie (Schema 4) weder Sauerstoffausschluss noch Übergangsmetallkatalysatoren. Das einzige verwendete Lösungsmittel und der einzige Katalysator ist H2O. Bereits beim Rühren einer wässrigen Dispersion von TDA und DAB bei rt beobachteten wir einen schnellen Farbwechsel der Lösung (von beige nach rot) sowie die Bildung eines roten Feststoffniederschlags. Mittels ATR-FTIR-Spektroskopie (Abbildung 6 A) konnte der Niederschlag als niedermolekulares Oligoiminzwischenprodukt identifiziert werden. Neben den charakteristischen Iminbanden (Pfeile in Abbildung 6 A; νC-H(Imin)≈2860 cm−1; νC=N(Imin)≈1615 cm−1; νC-N(Imin)≈1295 cm−1),63, 64 wurden auch Aldehyd- (νC=O(Aldehyd)≈1695 cm−1; braune Box) und Aminobanden (νN-H(NH2)≈3450 cm−1, ≈3355 cm−1; braune Box) gefunden. Solche Iminzwischenprodukte wurden bereits von Neuse et al. beobachtet.63 Die anschließende HT-Behandlung der wässrigen, roten Dispersion (MW, c=0.01 mol L−1 TR=250 °C, tH=10 min, tR=15 min) ergab einen orangenen Feststoff, der von einem durchscheinenden, klaren Überstand bedeckt war. ATR-FTIR-Messungen (Abbildung 6 A) belegten die Umwandlung des Zwischenprodukts zu PBI. Alle Banden, die auf das Vorhandensein von freien NH2- oder Aldehydgruppen (braune Boxen) sowie von Iminbindungen hinweisen, sind vollständig verschwunden. Darüber hinaus sind mehrere charakteristische PBI-Banden (Abbildung 6 A, Pfeile) vorhanden. Zudem wiesen TGA-Messungen (SI) auf das Vorhandensein von physisorbiertem H2O und eine hohe thermische Stabilität hin (T95 %=584 °C, T90 %=659 °C). PXRD-Messungen (SI) offenbarten, dass PBI vollständig amorph ist und nur eine breites und schwach ausgeprägtes Halo bei ≈15–35° (2θ, Cu-Kα) aufweist. Morphologisch gesehen enthält hydrothermal hergestelltes PBI einige kantige und plättchenförmige Partikel von breiter Größenverteilung (≈20–300 μm, Abbildung 6 B), die immer von deutlich kleineren kugelförmigen Partikeln mit recht enger Größenverteilung bedeckt sind (≈0.5–2.0 μm, Abbildung 6 B,C).
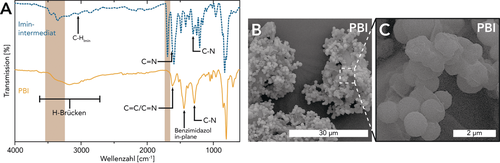
A) ATR-FTIR-Spektren vom Iminintermediat, welches durch Rühren der Comonomere in H2O bei rt erhalten wurde (c=0.01 mol L−1, tR=15 min), und von PBI, welches hydrothermal ausgehend vom Iminintermediat synthetisiert wurde (MW, c=0.01 mol L−1, TR=250 °C, tH=10 min, tR=15 min): breite Banden im Bereich von 3600–2800 cm−1 sind auf intermolekulare H-Brückenbindungen entweder zwischen verschiedenen Imidazoleinheiten oder zwischen Imidazoleinheiten und physisorbiertem H2O zurückzuführen.65 B,C) SEM-Aufnahmen von PBI (MW, c=0.01 mol L−1, TR=250 °C, tH=10 min, tR=15 min).
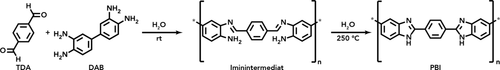
HTP zu PBI: Zuerst bilden TDA und DAB ein Iminintermediat (Position der Iminbindung in der Darstellung ist willkürlich). HT-Behandlung des Iminintermediats führt zur Bildung von PBI.
Zusammenfassend haben wir hier gezeigt, dass zusätzlich zu den bereits früher beschriebenen PIs und PA-Netzwerken über HTP als eine umweltfreundliche und experimentell einfache Strategie auch die Herstellung von PPs und PBIs möglich ist. Während die Hauptanwendungen von PBIs in feuerfester Kleidung, Lagern und Membranen für Brennstoffzellen liegen, sind PPs aufgrund ihrer konjugierten Natur für optische und elektronische Anwendungen interessant. Da HTP keine Katalysatoren verwendet, sind die erhaltenen Produkte sehr rein. Daher beschlossen wir, die elektrochemischen Eigenschaften von PP6 zu untersuchen, da dieses aufgrund der Naphthalingruppe in seinem Rückgrat als am vielversprechendsten angesehen wurde.
Elektrochemische Charakterisierung
PIs und chinondekorierte Polymere wurden kürzlich als wässrige Batterieelektroden in neutralen und sauren Elektrolyten untersucht.20-22 Während die Herstellung einer solchen Batterie unter Verwendung von PPs den Rahmen dieser Arbeit bei weitem übersteigen würde, haben wir uns entschieden, in einem ersten Schritt hydrothermal gebildetes PP6 mittels Cyclovoltammetrie (cyclic voltammetry, CV) in wässrigen Elektrolyten zu untersuchen. Abbildung 7 A zeigt die CV-Kurven, die mit PP6-Carbon Black (CB) Elektroden bei verschiedenen pH-Werten aufgenommen wurden. Bei 0.1 m HClO4 (pH 1) ist das bei ≈0.1 V zentrierte Redox-Merkmal gegenüber der Standard-Wasserstoffelektrode (standard hydrogen electrode, SHE) reversibel, was durch die Symmetrie der kathodischen und anodischen Wellen und durch die lineare Abhängigkeit der Spitzenströme von der Quadratwurzel der Scanrate bestätigt wird (Inset in Abbildung 7 B). Der Peakabstand (ΔEp) beträgt 25 mV (SI für Details). Der kathodischste Teil der CV ist teilweise geneigt, was auf das Auftreten der Wasserstoffentwicklungsreaktion zurückzuführen ist. Die Wasserstoffentwicklungsreaktion wird sowohl durch CB als auch durch PP6 gut katalysiert, insbesondere unter sauren Bedingungen (E =−0.059 V vs. SHE bei pH 1). Das Auftreten des beschriebenen Redox-Merkmals führen wir auf die Reduktion (und Protonierung)/ Reoxidation (und Deprotonierung) der C=O-Gruppen von PP6 zurück. Ein ähnliches Verhalten wurde in der Tat für molekulare Chinone und chinonhaltige Polymere beobachtet.66 Bei einer Scanrate von 10 mV s−1 beträgt die spezifische Konzentration der Redoxzentren (extrapoliert aus der in der CV übertragenen Ladung) 3.2 mmol g−1. Aus dem Vergleich mit der nominalen Konzentration der C=O-Gruppen in PP6 (4.9 mmol g−1) schließen wir, dass die Reduktion und Protonierung von PP6 (d. h. die H+-Interkalation) nicht auf die Oberfläche beschränkt ist, sondern sich auf das Bulk erstreckt, mit einer Protonierungseffizienz von ≈70 % (SI). Die Position des Redox-Peaks verschiebt sich bei Verwendung von mild sauren und neutralen Elektrolyten und die Reversibilität geht teilweise verloren (Zunahme von ΔEp). Die Asymmetrie und die allgemeinen Änderungen im elektrochemischen Verhalten könnten durch Veränderungen in der Kinetik der Redoxreaktion an der C=O-Gruppe verursacht werden, welche nachweislich in Abhängigkeit von der Art der Reaktionsmedien in gepufferten und ungepufferten Elektrolyten empfindlich variiert.67, 68 Darüber hinaus ist es plausibel zu erwarten, dass das Redoxverhalten durch die Koexistenz der Ioneninterkalation (K+ vom Puffer) und der Protonierungsreaktion bestimmt wird. Beim Monitoren der Verschiebung des Redoxpotentials (E1/2, berechnet durch Mittelwertbildung der Potentiale der anodischen und kathodischen Peaks, Tabelle S1) als Funktion des pH-Wertes des Elektrolyten wurde eine Steigung von 52 mV/pH-Einheiten beobachtet (Inset in Abbildung 7 A). Dies stimmt mit einer vorherrschenden protonengekoppelten Redoxreaktion überein. Während mehrere Redox-Polymere in organischen Elektrolyten charakterisiert worden sind,20, 21, 69, 70 gibt es nach unserem besten Wissen keine Studien über ähnliche PPs in wässrigen Elektrolyten. Für PIs und chinondekorierte Polymere, die als wässrige Batterieelektroden untersucht wurden, konnte gezeigt werden, dass diese für die Interkalation von Ionen (Mg+, Na+) verwendet werden können. PP6 scheint ähnliche Eigenschaften zu besitzen, die wir in zukünftigen Studien noch genauer untersuchen wollen.
=−0.059 V vs. SHE bei pH 1). Das Auftreten des beschriebenen Redox-Merkmals führen wir auf die Reduktion (und Protonierung)/ Reoxidation (und Deprotonierung) der C=O-Gruppen von PP6 zurück. Ein ähnliches Verhalten wurde in der Tat für molekulare Chinone und chinonhaltige Polymere beobachtet.66 Bei einer Scanrate von 10 mV s−1 beträgt die spezifische Konzentration der Redoxzentren (extrapoliert aus der in der CV übertragenen Ladung) 3.2 mmol g−1. Aus dem Vergleich mit der nominalen Konzentration der C=O-Gruppen in PP6 (4.9 mmol g−1) schließen wir, dass die Reduktion und Protonierung von PP6 (d. h. die H+-Interkalation) nicht auf die Oberfläche beschränkt ist, sondern sich auf das Bulk erstreckt, mit einer Protonierungseffizienz von ≈70 % (SI). Die Position des Redox-Peaks verschiebt sich bei Verwendung von mild sauren und neutralen Elektrolyten und die Reversibilität geht teilweise verloren (Zunahme von ΔEp). Die Asymmetrie und die allgemeinen Änderungen im elektrochemischen Verhalten könnten durch Veränderungen in der Kinetik der Redoxreaktion an der C=O-Gruppe verursacht werden, welche nachweislich in Abhängigkeit von der Art der Reaktionsmedien in gepufferten und ungepufferten Elektrolyten empfindlich variiert.67, 68 Darüber hinaus ist es plausibel zu erwarten, dass das Redoxverhalten durch die Koexistenz der Ioneninterkalation (K+ vom Puffer) und der Protonierungsreaktion bestimmt wird. Beim Monitoren der Verschiebung des Redoxpotentials (E1/2, berechnet durch Mittelwertbildung der Potentiale der anodischen und kathodischen Peaks, Tabelle S1) als Funktion des pH-Wertes des Elektrolyten wurde eine Steigung von 52 mV/pH-Einheiten beobachtet (Inset in Abbildung 7 A). Dies stimmt mit einer vorherrschenden protonengekoppelten Redoxreaktion überein. Während mehrere Redox-Polymere in organischen Elektrolyten charakterisiert worden sind,20, 21, 69, 70 gibt es nach unserem besten Wissen keine Studien über ähnliche PPs in wässrigen Elektrolyten. Für PIs und chinondekorierte Polymere, die als wässrige Batterieelektroden untersucht wurden, konnte gezeigt werden, dass diese für die Interkalation von Ionen (Mg+, Na+) verwendet werden können. PP6 scheint ähnliche Eigenschaften zu besitzen, die wir in zukünftigen Studien noch genauer untersuchen wollen.
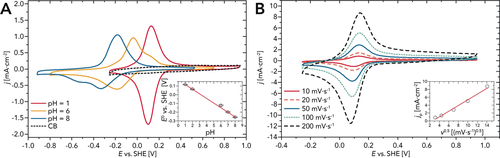
A) CV-Kurven, welche von PP6-CB-Elektroden in mit Ar gesättigter 0.1 m HClO4 (pH 1) und 0.2 m Phosphatbuffern (pH 6, and pH 8) aufgenommen wurden. Scanrate=20 mV s−1. Die gestrichelte Linie entspricht der CV, welche mit reinem CB (in 0.1 m HClO4) gemessen wurde. (Inset) Redoxpotential (E1/2, gemessen durch Mittelwertbildung der Potentiale der anodischen und kathodischen Peaks; SI) als eine Funktion des pH-Werts. Die CV-Kurven für pH 2 und pH 7 befinden sich in der SI. B) CV-Kurven, welche von PP6-CB-Elektroden in mit Ar gesättigter 0.1 m HClO4 bei unterschiedlichen Scanraten aufgenommen wurden. (Inset) Randles-Sevcik-Plot der anodischen Spitzenstromdichte (jp) als Funktion der Quadratwurzel der Scanrate.
Fazit
Hiermit zeigen wir, dass es in Übereinstimmung mit niedermolekularem Perinon möglich ist, ausgehend von einer geeigneten Monomersalzvorstufe MS6 (synthetisiert aus Naphthalinbisanhydrid und 3,3′-Diaminobenzidin) das Pyrronpolymer PP6 (in der Literatur auch als BBB bekannt) hydrothermal zu erzeugen. Bei Erhöhung der Reaktionstemperatur nimmt der Polymerisationsgrad zu. MS6 und PP6 sind morphologisch praktisch identisch. Daher wird eine in der Dispersion auftretende Festkörperumwandlung unter Formerhaltung angenommen. Hochtemperiertes Wasser muss jedoch eine entscheidende Rolle beim Ablaufen dieser Umwandlung spielen, aber seine genaue Wirkungsweise ist noch unklar. Darüber hinaus ist PP6 in wässrigen Elektrolyten elektrochemisch aktiv. Unter sauren Bedingungen führen wir das Redoxverhalten, das sich nachweislich auch auf das Bulk von PP6 erstreckt, auf die Reduktion und Protonierung/ Reoxidation und Deprotonierung der C=O-Gruppen zurück. Diese Eigenschaft könnte zum Beispiel in wässrigen Batterieanwendungen genutzt werden.
Interessanterweise liefert im Falle von MS5 (ein Monomersalz, das aus Pyromellitsäuredianhydrid und 3,3′-Diaminobenzidin synthetisiert wird) die hydrothermale Behandlung nicht direkt das entsprechende Pyrronpolymer PP5. Stattdessen wird ein Polybenzimidazolzwischenprodukt mit -COOH-Seitengruppen (PBI-COOH) erzeugt. Daher unterscheidet sich der mechanistische Reaktionsweg deutlich von der hydrothermalen Polymerisation zu PP6. Der effizienteste und effektivste Weg, PBI-COOH komplett in vollständig kondensiertes PP5 umzuwandeln, ist eine Wärmebehandlung bei 400 °C. Hinsichtlich der Morphologie können keine signifikanten Unterschiede zwischen PBI-COOH und PP5 beobachtet werden, was mit einer Festkörperumwandlung übereinstimmen. PBI-COOH und PP5 unterscheiden sich jedoch beide deutlich von MS5. Daraus schließen wir auf einen Auflösungs-Polymerisations-Fällungsmechanismus für die hydrothermale Erzeugung von PBI-COOH. Dies steht in krassem Gegensatz zur hydrothermalen Polymerisation zu PP6, bei der keine intermediären Auflösungsphänomene beobachtet werden.
Im Gegensatz zu PP6 und PP5 können für reines, nicht funktionalisiertes Polybenzimidazol (PBI) keine geeignete Monomersalzvorstufe hergestellt werden. Dennoch kann das gewünschte Produkt hydrothermal durch Reaktion von Terephthalaldehyd mit 3,3′-Diaminobenzidin erzeugt werden. Dabei wird zunächst unter Umgebungsbedingungen ein Iminzwischenprodukt gebildet, das anschließend hydrothermal zu PBI umgesetzt werden kann.
Wir betrachten die erfolgreiche Herstellung dieser beiden Klassen von Hochleistungspolymeren als eine bedeutende Erweiterung des Anwendungsbereichs der hydrothermalen Polymerisation. Die hier gezeigten Ergebnisse sind ein vielversprechender Ausgangspunkt für zukünftige Entwicklungen auf diesem Gebiet. Sie eröffnen Möglichkeiten für eine Vielzahl neuer Materialien, die auf unkomplizierte, experimentell einfache und umweltfreundliche Art und Weise hergestellt werden können.
Acknowledgements
M.J.T. und M.M.U. danken dem österreichischen Wissenschaftsfonds (FWF) und der Christian-Doppler-Forschungsgesellschaft (CDG) für die Finanzierung dieses Projekts unter der Förderungsnummer PIR 10-N28 und START Y1037-N28. F.G. dankt für die Finanzierung durch das Forschungs- und Innovationsprogramm Horizont 2020 der EU unter der Marie Skłodowska-Curie-Förderungsnummer 796024. S.M. dankt für das Imperial College Research Fellowship. S.M. und F.G. danken außerdem den Imperial College Fellows and Clinicians Seed Fund für die Unterstützung dieser Arbeit. Die PXRD-Messungen wurden am Röntgenzentrum der TU Wien (XRC) und SEM-Messungen an der fakultätsübergreifenden Elektronenmikroskopieeinrichtung der TU Wien (USTEM) durchgeführt. Darüber hinaus möchte M.J.T. Yazgan Mete und Leonie Deilmann für ihre Unterstützung danken.
Conflict of interest
Die Autoren erklären, dass keine Interessenkonflikte vorliegen.




