Reaktionswege in der photokatalytischen Umsetzung tertiärer Alkohole auf Rutil-TiO2(110)
Abstract
Laut Lehrbüchern sind tertiäre Alkohole inert gegenüber Oxidationen. Die Photokatalyse tertiärer Alkohole auf einem Titandioxideinkristall unter definierten Vakuumbedingungen offenbart unerwartete und neue Reaktionen, die Disproportionierung in ein Alkan und das entsprechende Keton. Im Gegensatz zu primären und sekundären Alkoholen führt die Abwesenheit eines α-H zu einem C−C-Bindungsbruch statt der üblichen Wasserstoffabspaltung. Die Bindung zu einer Methylgruppe wird nicht gespalten, wenn sich im Alkohol eine höhere Alkankette in α-Stellung zur Hydroxylgruppe befindet. Eine Platinbeladung erhöht nicht nur die Reaktionsrate, sondern ermöglicht einen neuen Reaktionsweg: die Bildung molekularen Wasserstoffs und eines langkettigen Alkans, das sich durch Rekombination zweier Alkylspezies bildet. Diese Arbeit zeigt, dass neue synthetische Routen durch Einführungen photokatalytischer Reaktionsschritte möglich gemacht werden, in denen der Cokatalysator eine entscheidende Rolle spielt.
Die selektive Oxidation von Alkoholen zu Aldehyden und Ketonen ist ein fundamentales Thema in diversen chemischen Disziplinen, von der heterogenen Katalyse bis zur synthetischen organischen Chemie.1 Im Gegensatz zur einfachen Oxidation primärer und sekundärer Alkohole sind tertiäre Alkohole gewöhnlich nicht auf ähnliche Weise umsetzbar, da eine C−C Bindung anstatt einer C−H Bindung gespalten werden muss, um die Carbonylfunktionalität zu erhalten.2 Da die Oxidation tertiärer Alkohole generell schwierig ist, insbesondere die selektive„ sind Publikationen diesbezüglich rar und das Produktspektrum ist oftmals breit.1c, 2, 3 Konventionelle synthetische Methoden sind häufig auf Auxiliare oder äquimolare Mengen von Oxidantien angewiesen, um die Reaktion zu ermöglichen.4 Oftmals wird die Umsetzung mit toxischen Metalloxiden wie Chrom(VI)-oxid durchgeführt.5
Die Halbleiter-Photokatalyse stellt einen alternativen Ansatz für die Alkoholreformierung dar.6 Zum Beispiel haben Teichner und seine Mitarbeiter 2-methyl-2-butanol durch UV-Bestrahlung auf einem nicht-porösen Anatas-Katalysator in Gegenwart von Sauerstoff erfolgreich photooxidiert. Die vorgeschlagenen Reaktionswege finden über Olefin-Zwischenprodukte statt, was zu den Reaktionsprodukten Aceton, Acetaldehyd und 2-Butanon führt.7
Generell ist Titandioxid dank seiner Reaktionseigenschaften und Verfügbarkeit das meist genutzte Material in der Photokatalyse.8 Während es meist in einer nanostrukturellen Form eingesetzt wird (z. B. als P25), erschwert die strukturelle Komplexität des Materials die Aufklärung genauer Reaktionsmechanismen.9 Analog zur thermischen Katalyse sind definierte Einkristalloberflächen unter sehr definierten Bedingungen im Ultrahochvakuum (UHV) für diese Fragestellung geeigneter.10 Die Rutil-TiO2(110) Oberfläche wurde für die thermische11 oder photochemische12 Umsetzung von Alkoholen in der heterogenen Photokatalyse umfassend eingesetzt. Daher ist dieses Material der Beste Kandidat für ein Modellsystem, auch wenn andere Titandioxid-Systeme (z. B. Anatas) möglicherweise eine höhere Photoaktivität aufweisen.
In dieser Arbeit untersuchen wir das photochemische Reaktionsverhalten von langkettigen tertiären Alkoholen (3-Methyl-3-Hexanol, 2-Methyl-2-Pentanol und 2-Methyl-2-Butanol) auf reinem und auf Platin-beladenem Rutil-TiO2(110) in UHV-Umgebung, die frei von Sauerstoff und Wasser ist. Wir zeigen unerwartete und neue photokatalytische Reaktionen dieser Alkohole, die ein generelles mechanistisches Verständnis ermöglichen. Des Weiteren zeigen wir, dass die reichhaltige Chemie tertiärer Alkohole sie zu einem interessanten Modellsystem für die Photokatalyse macht. Zum Beispiel ermöglicht sie die Aufklärung des Verhaltens von Alkylradikalen auf Oberflächen, was wichtig für die Photo-Kolbe-Reaktion13 und die Fischer–Tropsch-Synthese14 ist. Im letzteren Fall ist TiO2 ein übliches Trägermaterial.15
Die UV-Beleuchtung des TiO2(110)-Kristalls, dekoriert mit einer definierten Menge an Pt-Clustern (0.1 % Monolage (ML)) in einem Größenbereich von Pt8 bis Pt25, führt zu einer photokatalytischen Reaktion von 3-Methyl-3-Hexanol, das ein komplexes Fragmentierungsverhalten im Massenspektrum aufweist. Allerdings offenbart eine detaillierte Analyse (siehe Abbildung S2 in den Hintergrundinformationen), dass nur zwei Parallelreaktionen stattfinden, die beide eine Oxidation zu einem Keton und dem dazugehörigen Alkan darstellen (2-Pentanon und Ethan, 2-Butanon und Propan, siehe Schema 1). Während die Bildung höherer Alkane beobachtet wird, findet die Reaktion zu Methan nicht statt. Die spezifischen Massensignale (Abbildung 1) für ein bestimmtes Molekül zeigen, dass die Reaktion unter Beleuchtung tatsächlich katalytisch verläuft und dass die Bildung ungewollter Oberflächenspezies, die zu einer Vergiftung des Katalysators führen könnten, nicht stattfindet. Verglichen mit der Photoreformierung anderer Alkohole sind die beobachteten Reaktionswege unerwartet. Die Abwesenheit eines α-H schließt die übliche C−H Spaltung aus, die zu H2 und dem jeweiligen Aldehyd oder Keton führt, wie es für Primär- und Sekundäralkohole beobachtet wird.2, 16 Deshalb wäre das Abstoßen eines Radikals und die einhergehende stöchiometrische Produktion von H2 in Analogie zur tert-Butanol-Photoreformierung zu erwarten.17 Jedoch wird weder die Radikalabstraktion, noch eine signifikante Menge an molekularem Wasserstoff über einen längeren Reaktionszeitraum detektiert. Stattdessen kann diese Reaktion, die nach unserem besten Wissen bisher nicht beschrieben worden ist, als eine photokatalytische Disproportionierung, welche zu höheren Alkanen und dem entsprechenden Keton führt, angesehen werden. Interessanterweise treten keine Reaktionsprodukte auf, für deren Bildung ein Bindungsbruch zur Methylgruppe nötig wäre (Abbildung S9). Ebenfalls findet keine Dehydratisierungsreaktion statt, die eine übliche thermische Reaktion ist (Abbildung S9). Die gleiche Reaktion wird für tertiäre Alkohole mit zwei Methylgruppen am α-C (nämlich 2-Methyl-2-Butanol und 2-Methyl-2-Pentanol) beobachtet, bei denen ausschließlich die lange Kohlenstoffkette mit einer Selektivität von 100 % abgespalten wird (siehe Abbildung S3 und S4). Folglich wird exklusiv Aceton und das dazugehörige Alkan gebildet. Dies unterstreicht die Allgemeingültigkeit unserer Ergebnisse. Die gleichen Produkte werden selbst bei Umgebungsbedingungen für 2-Methyl-2-Butanol beobachtet, allerdings führt die Anwesenheit von Sauerstoff und Wasser zu zusätzlichen Nebenprodukten.7, 18
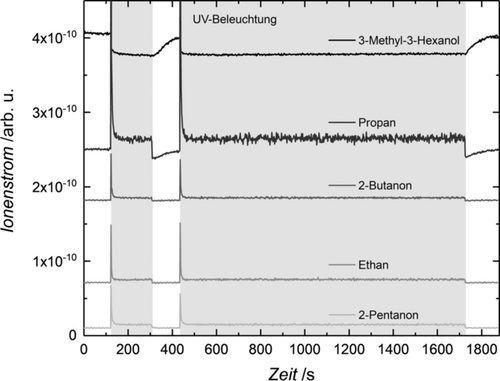
Photokatalytische Produkte der Photoreformierung von 3-Methyl-3-Hexanol auf Ptx/r-TiO2(110) (Clusterbedeckung beträgt 0.1 % einer Monolage (ML)). Es werden die Signale von 3-Methyl-3-Hexanol (m/z 73), Propan (m/z 29), 2-Butanon (m/z 72), Ethan (m/z 30), und 2-Pentanon (m/z 86) bei 340 K und einem 3-Methyl-3-Hexanol-Hintergrunddruck von 1.7×10−7 mbar gezeigt. Der graue Bereich hebt den Zeitraum der UV-Laserbestrahlung hervor. Der anfängliche Anstieg des Signals stammt von einer höheren Oberflächenkonzentration des Alkohols vor Beginn der Beleuchtung. Es gilt zu beachten, dass die Signallinien zur Veranschaulichung verschoben sind. Die Daten zeigen, dass zwei unterschiedliche photokatalytische Reaktionen parallel ablaufen, die ein Keton und das betreffende Alkan ergeben.
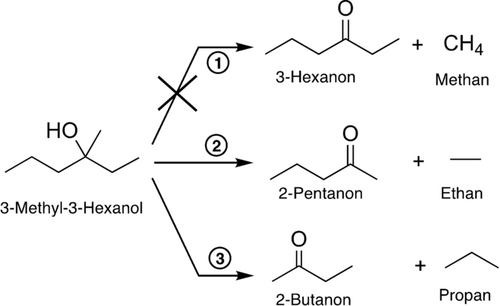
Reaktionsschema der Photoreformierung von 3-methyl-3-hexanol auf Ptx/r-TiO2(110) und auf r-TiO2(110) unter UV-Bestrahlung. Die Reaktion kann formell als eine lochvermittelte Disproportionierung angesehen werden, wobei ein Alkan und das korrespondierende Keton entstehen, jedoch kein Methan gebildet wird.
Diese neue Reaktion kann umfassend mit unserem vorgeschlagenen Mechanismus für die Photoreformierung von Alkoholen auf TiO2 in der Gasphase erklärt werden.17a Die photoaktiven Alkoxyspezien, die sich bereits bei der Oberflächenadsorption im Dunkeln12, 19 bilden, werden durch Photolöcher oxidiert, wobei eine C−C-Bindung gespalten wird. Die Arbeiten Hendersons und anderer haben überzeugend gezeigt, dass es sich bei den Alkoxies um die photoaktive Spezies bei der Alkohol-Photoreformierung auf TiO2(110) handelt.12, 20 Der Methylradikal-Ausstoß, der bei tert-Butanol beobachtet wird, zeigt, dass die photokatalytische Reaktion über einen homolytischen C−C-Bindungsbruch verläuft. Im Gegensatz zu Methylgruppen gehen längere Kohlenstoffketten wie Ethyl und Propyl in ihrer Adsorptionsgeometrie stärkere Wechselwirkungen mit TiO2 ein und verbleiben somit auf der Oberfläche. Dies stimmt mit deren Abwesenheit in den Massenspektren genau überein.
Die Oberflächenalkylspezies rekombinieren anschließend in einem thermischen Reaktionsschritt mit Wasserstoffatomen, welche von der dissoziativen Adsorption des Alkohols stammen. Im Gegensatz zur Rekombination zweier Wasserstoffatome ist diese Reaktion ebenfalls auf reinem TiO2(110) möglich (d. h. ohne Pt-Cluster). Demzufolge erfolgt die Photoreformierung höherer tertiärer Alkohole photokatalytisch sogar ohne jeglichen Cokatalysator (Abbildung 2 a) und auf einer hydroxylierten Oberfläche (siehe Abbildung S13 für die Photoreformierung von 2-Methyl-2-Pentanol) im Unterschied zu α-H-tragenden Alkoholen. Bei letzteren führt die Oberflächenhydroxylierung zu einer Vergiftung des Photokatalysators.17a Die Deposition kleiner Mengen von Pt-Clustern führt zu einer erheblichen Steigerung der Gesamtreaktionsrate, höhere Bedeckungsgrade steigern die Umsatzfrequenz (TOF) jedoch nur geringfügig (Abbildung 2 a). Dieser Trend steht im Einklang mit den Ergebnissen aus der Methanol-Photoreformierung im UHV17a sowie an kolloidalen Systemen.21
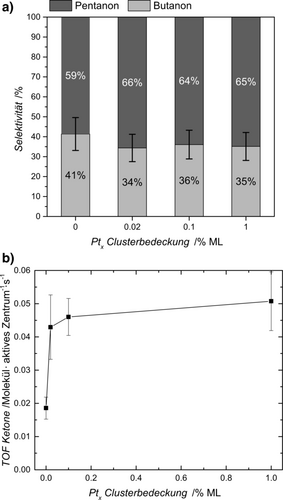
Photokatalytische Umsetzung von 3-Methyl-3-Hexanol auf Pt-dekoriertem r-TiO2(110). In a) wird die Umsatzfrequenz (TOF) der Ketone (Summe von 2-Butanon und 2-Pentanon) für verschiedene Ptx-Clusterbedeckungen gezeigt. In b) werden die Selektivitäten für 2-Pentanon und 2-Butanon basierend auf der TOF für den unbedeckten r-TiO2(110) und für verschiedene Pt-Bedeckungen auf r-TiO2(110) gezeigt. Eine ML bezieht sich auf die Oberflächenatome. 0 % ML steht für den unbedeckten r-TiO2(110). Während die Bedeckung mit Pt-Clustern die Selektivität der Reaktion nicht beeinflusst, steigert sie zunächst die TOF. Jedoch haben höhere Bedeckungsgrade keinen vergleichbaren Effekt.
In Übereinstimmung mit der Interpretation der Photooxidation am Halbleiter und der konsekutiven Alkanbildung, ist die Selektivität der Reaktion von 3-Methyl-3-Hexanol unabhängig vom Pt-Bedeckungsgrad (Abbildung 2 b). Des Weiteren bleibt die Selektivität im Temperaturbereich von 230 K und 360 K konstant (Abbildung S8 b), was zusätzlich die photokatalytische Natur der Reaktion verdeutlicht. Um die beobachtete Selektivität von Pentanon zu Butanon von etwa 2:1 zu erklären (d. h. die bevorzugte Abspaltung von Ethyl gegenüber Propyl und die generelle Abwesenheit von Methyl), ist die Thermochemie der Reaktionen für einen qualitativen Eindruck hilfreich. Alle drei möglichen Reaktionen, in Schema 1 dargestellt, sind endotherm mit rund 20 bis 30 kJ mol−1 (siehe das entsprechende Kapitel in den Hintergrundinformationen). Die Modellreaktionen für den photokatalytischen C−C Bindungsbruch legen nahe, dass für die Bildung von Methylradikalen deutlich mehr Energie notwendig ist, als für die Bildung von Ethyl- oder Propylradikalen (siehe Details in den Hintergrundinformationen). Hinzu kommt, dass längerkettige Kohlenstoffketten als Methyl stärkere Wechselwirkungen mit der Oberfläche aufweisen. Diese Radikale werden deshalb nicht in der Gasphase detektiert, im Gegensatz zur Methylradikal-Abstoßung bei der tert-Butanol-Photoreformierung. Für die Ethyl- und Propylbildung ist der Unterschied in der Thermochemie im Vergleich zu Methyl weniger ausgeprägt. Dennoch sind Reaktionen, aus denen ein Ethyl hervorgeht, generell stärker endotherm als eine Propylbildung. Dieser Trend spiegelt sich in der beobachteten Selektivität der Reaktion wider; Pentanon und das Ethylradikal werden gegenüber Butanon und dem Propylradikal bevorzugt gebildet. Aus diesem Grund könnten thermodynamische Werte als eine Art Daumenregel genutzt werden, um bevorzugte Bindungsbrüche in ähnlichen Photoreaktionen vorherzusagen.Das Bindungsbruchverhältnis von Ethyl zu Propyl wird ebenfalls nicht durch unterschiedliche Alkoholdrücke (3×10−8 mbar bis 5×10−6 mbar) am Pt-beladenen Photokatalysator beeinflusst (Abbildung S8 a). Die Gesamtumsatzfrequenz zeigt ein typisches Verhalten 1. Ordnung wenn die Reaktion Eduktadsorptionslimitiert ist und ein Verhalten 0. Ordnung im Fall der Produktdesorptionslimitierung (siehe Abbildung S5 und S6). In ähnlicher Weise deutet die lichtintensitätsabhängige TOF (siehe Abbildung S8) auf ein Verhalten 1. Ordnung bei niedrigen Bestrahlungsintensitäten hin, läuft jedoch mit höherem Photonenfluss in einen Sättigungsbereich (0. Ordnung), wie es für die Photoreformierung anderer Alkohole beobachtet wird.17a Für den Pt-bedeckten TiO2(110) ist die zusätzliche Nebenreaktion wichtig, die bei höheren Drücken sichtbar wird. Dies wird anhand der Photoreformierung von 2-methyl-2-pentanol deutlich (Schema 2), dessen Reaktionsprodukte eindeutig quantifizierbar sind und die nicht durch isobare Interferenzen gestört werden. Da deponierte Cluster eine effiziente thermische Rekombination von Wasserstoffatomen ermöglichen,17a steigt der Bedeckungsgrad von Alkylresten an der Oberfläche im stationären Zustand mit höherem Druck. Infolgedessen wird das Rekombinationsprodukt zweier Alkylreste (d. h. Hexan) neben der H2-Bildung oberhalb eines Alkoholdrucks von 5×10−6 mbar beobachtet (Abbildung 3 a).
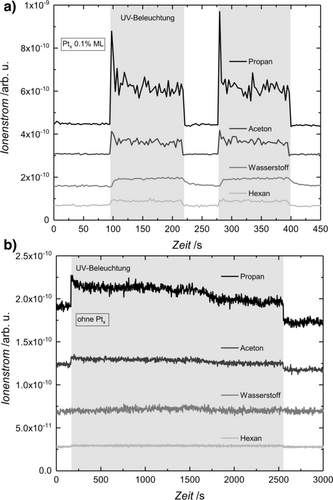
Photokatalytische Produkte der 2-Methyl-2-Pentanol-Photoreformierung auf a) Ptx/r-TiO2(110) (0.1 % ML Clusterbedeckung) und auf b) r-TiO2(110). Es werden die Signale von Propan (m/z 29), Aceton (m/z 58), Wasserstoff (m/z 2), und Hexan (m/z 86) bei 336 K und einem 3-methyl-3-hexanol-Hintergrunddruck von 5.0×10−6 mbar gezeigt. Der graue Bereich hebt den Zeitraum der UV-Laserbestrahlung hervor. Beachten Sie, dass die Signallinien zur Veranschaulichung verschoben sind. Anders als der unbedeckte TiO2(110), ermöglicht der Cokatalysator-beladene Halbleiter eine weitere Nebenreaktion, nämlich die Alkylradikalrekombination und die Bildung molekularen Wasserstoffs.
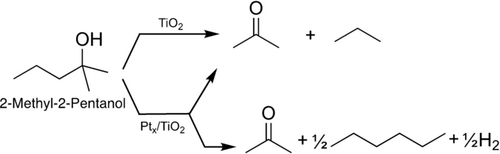
Reaktionsschema der Photoreformierung von 2-Methyl-2-Pentanol auf unbedecktem r-TiO2(110) und auf Ptx/r-TiO2(110) unter UV-Bestrahlung. Während auf dem unbedeckten Titandioxid einzig die lochvermittelte Disproportionierung stattfindet, aus der Aceton und Propan hervorgeht, wird auf dem Pt-bedeckten ein zweiter Reaktionsweg oberhalb eines Alkoholdrucks von 2.0×10−7 mbar ermöglicht. In dieser Reaktion rekombiniert Wasserstoff am Pt-Cluster und zwei Propylradikale bilden Hexan.
Da die Bildung von H2 auf unbedecktem Titandioxid nicht möglich ist, tritt diese Nebenreaktion in Abwesenheit des Cokatalysators nicht auf (Abbildung 3 b). Demnach zeigen diese Ergebnisse, dass mit der Zugabe eines Edelmetalls nicht nur ungewollte Nebenreaktionen (wie z. B. die Hydrierung von Ketonen, kürzlich mechanistisch untersucht in der Elektrochemie22) auftreten können, sondern auch intrinsisch unterschiedlich Ausgänge des Photoreaktionszyklus in angewandten Systemen betrachtet werden müssen.
Zusammengefasst entdeckten wir einen neuen Reaktionsweg für die Photoreformierung von tertiären Alkoholen auf Rutil, der als eine lochvermittelte Disproportionierung angesehen werden kann, die zu einem Alkan und dem entsprechenden Keton führt. Überraschenderweise wird die Methylgruppe nicht abgespalten und lediglich α-C-Bindungen mit einer längeren Alkylkette werden selektiv getrennt, was im Gegensatz zur Reaktion von tert-Butanol steht. Die Thermochemie der Radikalbildung stellt ein qualitatives Mittel für die Selektivitätsvorhersage einer Photoreaktion dar. Da die Rekombination von Alkylradikalen mit Wasserstoff auf unbedecktem Titandioxid im Gegensatz zur Rekombination zweier Wasserstoffatome möglich ist, verläuft die Reaktion sogar ohne Cokatalysator vollständig katalytisch. Während kleinste Mengen an Pt-Clustern auf dem Rutilkristall die Gesamtreaktionsrate steigern, eröffnen sie einen weiteren Reaktionsweg, der zu molekularem Wasserstoff und dem Rekombinationsprodukt zweier Radikale bei höheren Drücken führt.
Der beobachtete Mechanismus erklärt möglicherweise die breite Produktverteilung in Photoreformierungsstudien bei Umgebungsdruck oder in Flüssigphase und stellt die Mechanismenforschung in der Photokatalyse auf solides Fundament.
Acknowledgements
Die Autoren danken Martin Stutzmann (TU München) für die hilfreichen Diskussionen und der DFG für die Projektförderung über HE3435/ 22-1. CC bedankt sich für die Unterstützung durch den Fonds National de la Recherche (FNR) in Luxemburg, Projektcode 12531916, und durch die International Graduate School of Science and Engineering (TUM-IGSSE). Open access funding enabled and organized by Projekt DEAL.
Conflict of interest
Die Autoren erklären, dass keine Interessenkonflikte vorliegen.




