Effiziente chemoenzymatische Synthese von Dihydroartemisinaldehyd
Abstract
Artemisinin aus der Pflanze Artemisia annua ist das wirkungsvollste Arzneimittel zur Behandlung von Malaria. Die Sesquiterpen-Cyclase Amorphadien-Synthase, ein Cytochrom-abhängiges CYP450 und eine Aldehyd-Reduktase wandeln in der Pflanze Farnesyl-Diphosphat (FDP) in Dihydroartemisinaldehyd (DHAAl) um, welches ein Schlüsselzwischenprodukt in der Biosynthese von Artemisinin und eine halbsynthetische Vorstufe in der chemischen Synthese des Arzneimittels ist. Hier berichten wir über einen chemoenzymatischen Prozess, der in der Lage ist, DHAAl nur mithilfe der Sesquiterpen-Synthase aus einem gezielt synthetisierten, hydroxylierten FDP-Derivat herzustellen. Dieser Prozess, der die natürliche Sequenz aus Cyclisierung von FDP und Oxidation des Kohlenwasserstoffs umkehrt, stellt eine wesentliche Verbesserung der DHAAl-Synthese dar und zeigt das Potenzial neuer Substrate in der Terpen-Synthase-katalysierten Synthese hochwertiger Naturstoffe auf.
Das sesquiterpenoide Endoperoxid Artemisinin (1) ist weit verbreitet zur Erstbehandlung von Malaria in Kombinationstherapien.1 Obwohl elegante organische Synthesen von Artemisinin publiziert worden sind,2 beruht die weltweite Versorgung von 1 überwiegend auf der Extraktion der Pflanze Artemisia annua.3 Artemisinin wird hauptsächlich in Entwicklungsländern benötigt, die auf eine Versorgung mit dem Medikament zu geringen Kosten angewiesen sind. Die derzeit effizienteste Art, Artemisinin zu synthetisieren, ist eine Kombination aus Biosynthese und chemischer Synthese. Zentral für die Biosynthese von 1 (Schema 1) ist die Klasse-I-Sesquiterpencyclase Amorphadien-Synthase (ADS), die die Reaktion von (E,E)-Farnesyldiphosphat (FDP, 2) zu Amorpha-4,11-dien (3) katalysiert. In einer komplexen Reaktionskaskade werden in einem Schritt zwei sechsgliedrige Ringe, vier Stereozentren und zwei Doppelbindungen mit absoluter regio- und stereochemischer Kontrolle gebildet.4 Dihydroartemisin-Aldehyd (DHAAl) (4) kann aus Amorpha-4,11-dien (3) entweder durch eine dreistufige chemische Synthese oder durch Kombination einer biochemischen Oxidation mit zwei chemischen Stufen hergestellt werden.5 Die Verbindung 4 kann dann in vier etablierten Schritten chemisch oder enzymatisch in 1 umgewandelt werden.2a, 6 Es ist bemerkenswert, dass ein eleganter semisynthetischer Weg entwickelt wurde, der ADS und fünf weitere Enzyme zur Herstellung von Artemisinsäure (5) in Hefe nutzt, die dann durch übergangsmetallkatalysierte Hydrierung in Dihydroartemisinsäure (6) überführt wird. Die Pharmafirma Sanofi hat diesen Prozess im Jahr 2014 eingeführt, jedoch wurde die Herstellung aufgrund starker Marktkräfte eingestellt.7 Dies verdeutlicht nachdrücklich die Notwendigkeit von umweltverträglichen und kostengünstigen Alternativen zur Herstellung von Artemisinin.
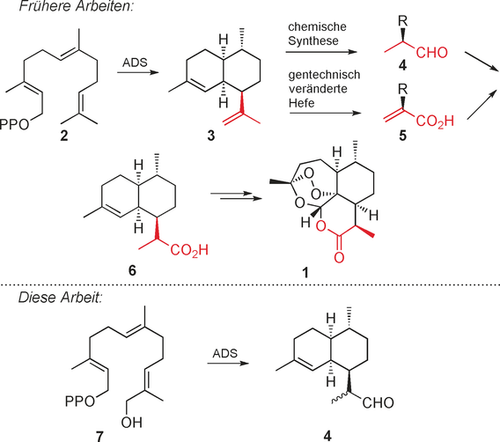
Oben: Gegenwärtige Wege zu Artemisinin. Unten: ADS- katalysierte einstufige Synthese von Dihydroartemisinaldehyd (DHAAl) (4) aus 12-Hydroxyfarnesyldiphosphat (7).
Hier berichten wir über ein neuartiges chemoenzymatisches Verfahren, das die Substrat-Promiskusität von ADS nutzt, um das hydroxylierte FDP-Analogon 7 in das synthetische Intermediat DHAAl (4) umzuwandeln. Im Vergleich zu bestehenden Verfahren wird bei diesem Prozess, der die natürliche Reihenfolge aus Cyclisierung von FDP und Oxidation des Sesquiterpen-Kohlenwasserstoffs umkehrt, die Synthese von 4 signifikant verkürzt, indem nur ein Enzym verwendet wird und nur ein einziger Oxidationsschritt vor der ADS-katalysierten Cyclisierung zu 4 erforderlich ist. Das Verfahren vermeidet nach der Cyclisierung mehrere Redoxschritte, da es die Bildung des intermediären Amorphadiens (3) völlig umgeht (Schema 1).
Amorphadien-Synthase (ADS) katalysiert die Mg2+-abhängige Umwandlung des natürlichen Substrats FDP (2) (siehe Abbildung S13 in den Hintergrundinformationen) entlang eines komplexen Reaktionsweges, der die Isomerisierung der 2,3-Doppelbindung von der E- zur Z-Konfiguration, die 1,6-Cyclisierung unter Bildung eines Bisabolyl-Kations (8) sowie eine 1,3-Hydridverschiebung von C1 zu C7 und eine 1,10-Cyclisierung zum Amorphylkation (9) beinhaltet. Die finale Deprotonierung an C12 oder C13 erzeugt Amorpha-4,11-dien (3) (siehe Schema 2 und die Abbildungen S4, S22–S23).8
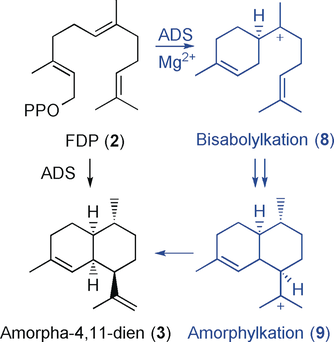
Synthese von Amorpha-4,11-dien (3) aus FDP (2) in der Pflanze A. annua.
Viele Sesquiterpen-Synthasen zeigen einen gewissen Grad an Substrat-Promiskuität und können methylierte und fluorierte Farnesyldiphosphat-Analoga zu modifizierten Terpenoiden konvertieren.9, 10, 11 Wir beschreiben hier erstmals das Potential einer Sesquiterpen-Synthase, ein hydroxyliertes FDP-Analogon als Substrat umzusetzen. Insbesondere untersuchten wir, ob ADS11b das Substrat 12-Hydroxyfarnesyldiphosphat (7)12 (Schema 1) über das 12-Hydroxyamorphyl-Kation (OH-9) zu Dihydroartemisin-aldehyd (4) umwandeln kann (Schema 3). Es ist bekannt, dass α-hydroxylierte Carbokationen wie OH-9 unter sauren Bedingungen zu Aldehyden isomerisieren können.13 Die elektrophile Natur der Terpen-Synthasen kombiniert mit der inhärenten Reaktivität von α-hydroxylierten Carbokationen wie OH-9 sollte daher zum Aldehyd 4 führen.
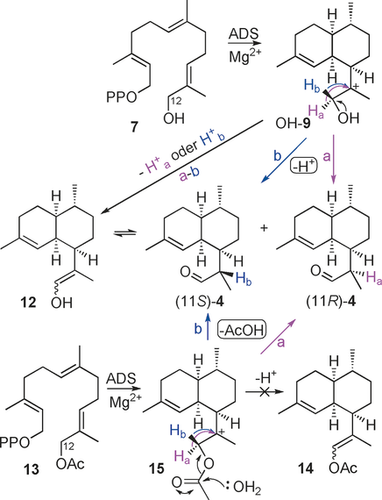
ADS-katalysierte Synthese von 4 aus 12-Hydroxyfarnesyldiphosphat (7) und 12-Acetoxyfarnesyldiphosphat (13) über Carbokationen OH-9 bzw. 15.
Das Diphosphat 7 wurde in zwei Schritten aus kommerziell erhältlichem (E,E)-Farnesylchlorid (10) synthetisiert (Schema 4). Die kurze Synthese erforderte eine Selendioxid-Oxidation von 1014 bei niedriger Temperatur mit tBuOOH und eine Diphosphorylierung des entstandenen Chlorids 1115 (siehe die Tabellen S1, S2 und S13–S16). Für den 1H-NMR- und GC-MS-Vergleich wurde eine authentische Probe des Aldehyds 4 aus handelsüblicher (11R)-Dihydroartemisinsäure (11R)-6 hergestellt (siehe Abbildungen S7, S8, S26, S27).6b, 16
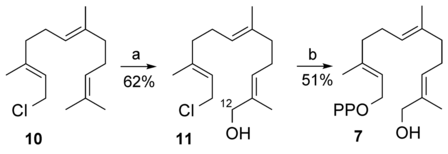
Synthese von 12-Hydroxyfarnesyldiphosphat (7) aus kommerziell erhältlichem Farnesylchlorid 10. a) SeO2 (0.3 Äquiv.), Salicylsäure (0.3 Äquiv.), tBuOOH (5 Äquiv.), CH2Cl2, 0 °C. b) (Bu4N)3HP2O7 (2 Äquiv.), CH3CN, Raumtemperatur.
Das 1H-NMR-Spektrum der gereinigten enzymatischen Produkte (siehe Abbildung 1 und die Abbildungen S24, S25) aus Inkubationen von 7 mit ADS zeigt ein Aldehydgemisch im Verhältnis 3:2 an, am deutlichsten durch die diagnostischen NMR-Signale bei δ=9,62 ppm (1 H, d, J=3.5 Hz, CHO, Hauptprodukt) und 9.57 ppm (1 H, d, J=3.5 Hz, CHO, Nebenprodukt). Das Nebenprodukt stellt (11R)-4 dar, bestimmt basierend auf 1H-NMR-Daten und dem Vergleich mit einer authentischen Probe von 4 (siehe die Abbildungen S26, S27).17a Die Struktur des Hauptaldehyds wurde als (11S)-4 ermittelt auf der Basis seiner diagnostischen 1H-NMR-Signale bei δ=5.27 (s, H2), 1.64 (s, 3-Me), 1.07 (d, J=6.8 Hz, 11-Me), 0.87 ppm (d, J=6,5 Hz, 7-Me), die komplementär zu denen von (11R)-4 bei δ=5.13 (s, Me), 1.06 (d, J=6.9 Hz, 11-Me), 0.87 ppm (d, J=6.5 Hz, 7-Me) sind (Abbildung 1). Auch die Epimerisierung der entsprechenden Ester (siehe Schema 6) unterstützt die Zuordnung von (11R)-4 und (11S)-4. Zusätzlich zu der 7:2-Mischung von (11S)-4 und (11R)-4 ergab die Analyse der NMR-Probe durch GC-MS etwa 10 % eines Nebenprodukts (Abbildung 2), das vermutlich die Enolform (12) des Aldehyds 4 auf der Basis des mit (11S)-4 identischen MS-Spektrums darstellt (Abbildung S3). Die MS-Spektren sowie die GC-Elutionszeiten von (11R)-4 (schneller) und (11S)-4 stimmen mit den zuvor beschriebenen überein.17 Der Reaktionsmechanismus für die Umwandlung von FDP in Amorphadien (Schema 2) legt nahe, dass das Enol 12 über eine Deprotonierung von Ha oder von Hb (Pfad a-b in Schema 3) aus dem Carbokation OH-9 gebildet werden kann, bevor 12 zu dem beobachteten Gemisch aus Epimeren von 4 außerhalb der aktiven Seite von ADS äquilibriert. Allerdings führte die Inkubation von Diphosphat 7 mit ADS in D2O zur ausschließlichen Synthese von deuteriertem (11S)-4 (siehe Abbildung S10). Es konnte kein deuteriertes (11R)-4 durch GC-MS nachgewiesen werden. Diese Beobachtung zeigt, dass nur (11S)-4 über das Enol 12 gebildet werden kann.
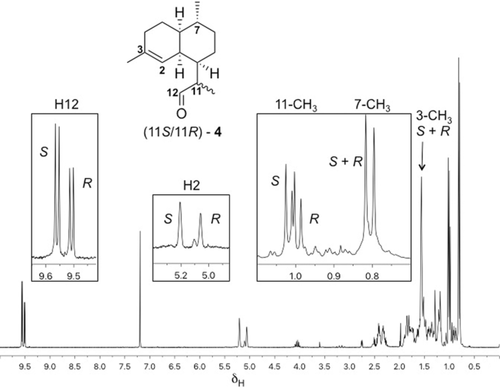
1H-NMR-Spektrum (500 MHz, CDCl3) des Produktgemisches der Pentanextrakte, das durch die Reaktion von 7 mit ADS nach Reinigung an Kieselgel erhalten wurde. Die Vergrößerungen zeigen die diagnostischen Signale H12, H2, 11-CH3 und 7-CH3.
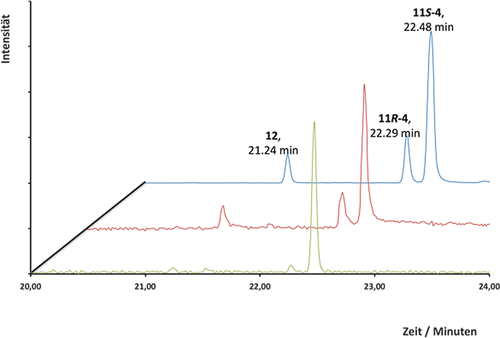
GC-Chromatogramm (TIC) der Pentanextrakte aus einer Inkubation von Diphosphat 7 (blau), 13 (rot) und 16 (grün) mit ADS. GC-Peaks wurden dem Enol 12 (21.24 min) und den Aldehyden (11R)-4 (22.29 min) und (11S)-4 (22.48 min) zugeordnet.
Um die Fähigkeit von ADS zur Umsetzung nichtnatürlicher Substrate weiter zu untersuchen, wurde 12-Acetoxyfarnesyldiphosphat (13) in drei Schritten (32 % Gesamtausbeute) aus dem bekannten 1-O-THP-geschützten 12-Hydroxyfarnesol14 hergestellt (siehe die Abbildungen S17, S18) und mit ADS inkubiert. Die GC-MS-Analyse ergab, dass die gleichen drei Produkte wie durch Inkubation mit Diphosphat 7 erhalten wurden (siehe Abbildung 2 und Abbildung S9). Die Beobachtung, dass kein Vinylacetat 14 aus 13 erzeugt wird (Schema 3), deutet darauf hin, dass das Enol 12 kein Produkt der ADS-Katalyse ist, sondern ausschließlich aus (11S)-4 nach der Freisetzung aus dem aktiven Zentrum des Enzyms gebildet wird. Kontrollversuche schlossen die Anwesenheit einer Esterhydrolase-Aktivität in unseren Enzympräparaten aus (siehe die Hintergrundinformationen). Bemerkenswerterweise ergab die Inkubation von 13-Acetoxyfarnesyldiphosphat (16) (siehe Abbildung S19) mit ADS (Schema 5) (11S)-4 (93 %) und Enol 12 (7 %) (siehe Abbildung 2 und die Abbildungen S5, S6). Das Fehlen signifikanter Mengen des Epimers (11R)-4 bedeutet, dass das Enol 12 unter den verwendeten Reaktionsbedingungen (pH-Wert 7.5) nicht zu (11R)-4 tautomerisiert (Schema 3). Diese Ergebnisse legen nahe, dass nur ein Weg die beobachtete Epimerenmischung der Aldehyde 4 ergibt. Die Bildung von 4 aus 7 (und 13) läuft daher wahrscheinlich über eine Sauerstoff-vermittelte, nicht-stereospezifische intramolekulare [1,2]-Hydridverschiebung des Carbokations OH-9 (oder 15 für 13) ab (Pfad a und b, Schema 3). Da das stabile Vinylacetat 14 nicht aus 13-Acetoxyfarnesyldiphosphat (16) gebildet wird, scheint auch eine Deprotonierung von 17 über das Enol 12 zu (11S)-4 unwahrscheinlich. Daher wird für die ausschließliche Bildung von (11S)-4 (Weg a, Schema 5) aus dem Diphosphat 16 eine stereospezifische [1,2]-Hydridverschiebung von Ha aus Carbokation 17 wahrscheinlich sein.
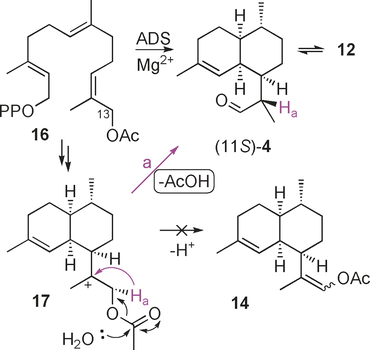
ADS-katalysierte Produktion von (11S)-4 aus 13-Acetoxyfarnesyldiphosphat (16) über Carbokation 17.
Um dieses neue chemoenzymatische Verfahren zur Herstellung von Artemisinin weiter zu entwickeln, wurde das 2:3-Gemisch aus (11R)-4 und (11S)-4 zu den entsprechenden Dihydroartemisinsäuren (6) in 93 % Ausbeute oxidiert (Schema 6) und anschließend in 94 % Ausbeute in die entsprechenden Dihydroartemisininsäuremethylester (18) umgewandelt (siehe Abbildung S11).18 Die Behandlung der Ester mit LDA unter kinetischer Kontrolle ergab eine 1:1-Mischung der (11R)- und (11S)-Methylester (siehe Abbildung S28). Verbindung (11R)-18 ist das gewünschte Intermediat für die Synthese von Artemisinin.19
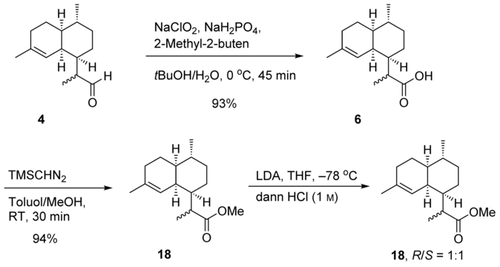
Synthese von Dihydroartemisinsäuremethylester (18).
Zusammenfassend haben wir eine effiziente chemoenzymatische Route zu Dihydroartemisinaldehyd (4) entwickelt. Dihydroartemisinaldehyd ist ein wichtiges Zwischenprodukt in der Produktion von Artemisinin (1), dem wichtigsten Medikament für die Behandlung von Malaria. Wir haben erstmalig gezeigt, dass hydroxylierte FDP-Analoga als Substrate von Sesquiterpen-Synthasen akzeptiert werden können. Daher bietet unsere Arbeit einen neuartigen “umgekehrten biosynthetischen” Ansatz für die Synthese von funktionell diversifizierten hydroxylierten Terpenoiden. Die chemische Synthese solcher Produkte ist oft schwierig, da mehrere Ringsysteme mit hoher Stereo- und Regiokontrolle hergestellt werden müssen. Die relativ hohe Substrat-Promiskusität und der Templateffekt des aktiven Zentrums ermöglicht es Terpensynthasen, nichtnatürliche Substrate entlang wohldefinierter Reaktionswege zu bestimmten Produkten mit hoher Reproduzierbarkeit umzusetzen. Dies bietet einen vielversprechenden Ansatz zur Herstellung von hochwertigen Terpenoiden und Terpenalkaloiden,11a der komplementär zu herkömmlichen Synthese- und Biosyntheseverfahren ist.
Acknowledgements
Diese Arbeit wurde vom Biotechnology and Biological Sciences Research Council (BBSRC) durch Zuschüsse (BB/H01683X/1, BB/M022463/1, BB/N012526/1) sowie durch das Engineering and Physical Sciences Research Council (EPSRC) unterstützt (EP/M013219/1. Wir danken Dr. Veronica Gonzalez (Cardiff University) für hilfreiche Diskussionen sowie Dr. Rob Jenkins und Thomas Williams für massenspektrometrische und NMR-spektroskopische Unterstützung.
Conflict of interest
Die Autoren erklären, dass keine Interessenskonflikte vorliegen.




