Synthetische Adhäsion von Integrin-Liposomen als minimales Zellmodell
Abstract
Um die mit der Zelladhäsion zusammenhängenden molekularen Signalwege aufzuklären, bieten synthetische Zellen den einzigartigen Vorteil eines gut kontrollierten Modellsystems mit reduzierter molekularer Komplexität. In der vorliegenden Arbeit zeigen wir, dass Liposome mit rekonstituiertem Blutplättchenintegrin αIIbβ3 als adhäsionsvermittelndes Transmembranprotein für ein funktionales, minimales Zellmodell dienen können, um zelluläre Adhäsionsmechanismen in einer definierten Umgebung zu studieren. Die Wechselwirkung dieser synthetischen Zellen mit unterschiedlichen extrazellulären Matrixproteinen wurde mithilfe der Quarzkristallmikrowaage mit Dissipationsanalyse (QCM-D; quartz crystal microbalance with dissipation monitoring) untersucht. Die Daten zeigten, dass Integrin funktionell in die Lipidvesikel inkorporiert wurde, wodurch die integrinspezifische Adhäsion der hergestellten Liposome auf mit Fibrinogen (Fg) und Fibronektin (Fn) funktionalisierten Oberflächen möglich war. Anschließend konnte das Ablösen der Integrin-Liposome von diesen Oberflächen bei Zugabe des Peptids GRGDSP eingeleitet werden. Effizienter erfolgte das Ablösen mit unserem neu synthetisierten Peptidmimetikum SN529, das spezifisch Integrin αIIbβ3 blockiert.
Die Zelladhäsion ist ein fundamentaler Prozess, der für die Entwicklung und Funktionalität multizellulärer Organismen von entscheidender Bedeutung ist. Neuere Untersuchungen haben ergeben, dass das koordinierte Verhalten von Gewebezellen, dazu zählen Proliferation, Migration und Differenzierung, zeitlich und räumlich über Zell-Zell- und Zell-EZM-Adhäsionsstellen reguliert wird (EZM=Extrazellulärmatrix). Von den verschiedenen Arten der Zelladhäsion spielt die Familie der Adhäsionsintegrine eine zentrale Rolle bei der Gewebephysiologie.1 Die Funktion und Signalweiterleitung dieser transmembranen Proteine wurde bereits ausführlich in lebenden Zellen untersucht.2 Ihre Wechselwirkung wird hauptsächlich durch molekulare Crowding-Effekte gesteuert, die von komplexen Wechselwirkungen zwischen dicht gepackten intrazellulären Makromolekülen herrühren.3 Daher sind Lipidvesikel ideale Kandidaten Modellsysteme für die Untersuchung zellulärer Adhäsionsmechanismen in einer sphärischen, zellähnlichen Einheit mit dichtgepackten Proteinen des Zelladhäsionskomplexes.
In den letzten Jahren wurden unterschiedliche Proteine des fokalen Adhäsionskomplexes in Lipidvesikel eingebaut, um damit die molekulare Beschaffenheit der Zelladhäsion biophysikalisch und biochemisch zu erklären.5 Im Einzelnen wurde Integrin αIIbβ3 aus Blutplättchen in kleinen Liposomen mithilfe der Detergens-Dialyse-Methode rekonstituiert.6 Die biologische Aktivität des rekonstituierten Integrins αIIbβ3 wurde durch Fg-Bindungsassays bestätigt.7 Im Allgemeinen kann Integrin durch die Zugabe von zweiwertigen Ionen, die in der extrazellulären Domäne der β-Untereinheit binden2b, 8 aktiviert werden, selbst wenn keine intrazellulären Bindungspartner des Adhäsoms (z. B. Talin) vorhanden sind,9 z. B. in synthetischen Zellsystemen mit rekonstituierten Integrinen.15
Die Quarzkristallmikrowaage mit Dissipationsanalyse (QCM-D) ist eine leistungsstarke markerfreie Technik, um die Adhäsion von Lipidvesikeln zu verfolgen. Dabei wird die adsorbierte Masse in Echtzeit gemessen und die viskoelastischen Eigenschaften der adhärierten Schicht können analysiert werden.16 Außerdem erleichtert der stete Durchfluss das Spülen mit Puffern und die Hinzugabe von Inhibitoren. In den vergangenen Jahren wurde die Immobilisierung von reinen Liposomen auf unterschiedlichen Kristallbeschichtungen ausführlich untersucht.17 Mithilfe von QCM-D-Experimenten wurden auch die Mechanismen des Vesikelplatzens und deren Transformation zu substratgestützten Lipiddoppelschichten (SLBs; supported lipid bilayers) analysiert.18 Die diesem Prozess zugrundeliegende Kinetik hängt von vielen Parametern ab, wie z. B. Vesikelgröße,17e, 19 Oberflächenchemie,17e Temperatur,17e, 20 Lipidladung,21 osmotischer Druck,17e, 22 Membranfluidität,17b elektrostatische Wechselwirkungen und das Vorhandensein von Calciumionen.23 In Kombination mit QCM-D haben Ellipsometrie, Oberflächenplasmonenresonanzmessungen, Kraft- und Fluoreszenzmikroskopie dazu beigetragen, zahlreiche Erkenntnisse über Vesikeladhäsion und SLB-Bildung zu gewinnen.17a, 21, 23, 24
Aufgrund ihrer vielseitigen Anwendungsmöglichkeiten ist die QCM-D die erste Wahl für die Analyse verschiedener molekularer Erkennungsprozesse. So wurde diese Methode angewendet, um die physikalisch-chemischen Eigenschaften von Hyaluronfilmen auf SLBs zu untersuchen, die als Modellsystem für perizelluläre Zuckerhüllen dienen.25 Die molekulare Erkennung zwischen biotinylierten Liposomen, die Integrine simulieren, und mit Avidin beschichteten Kristallen, die die EZM simulieren, wurde ebenso mit QCM-D erforscht.17d Wir präsentieren hier die erste Studie über die synthetische Adhäsion von mit Integrin funktionalisierten Liposomen und deren Modulation durch spezifisch lösliche Inhibitoren mithilfe von QCM-D und SiO2-Sensoren, die mit verschiedenen EZM-Proteinen beschichtet wurden. Dabei zeigte das neu synthetisierte Peptidmimetikum SN529 (siehe SI) eine höhere Aktivität gegenüber Blutplättchenintegrin αIIbβ3 im Vergleich zu RGD-Peptiden.
Zuerst verglichen wir die Wechselwirkung von Integrin-Liposomen und nicht funktionalisierten (“reinen”) Liposomen mit SiO2-beschichteten Sensoren (Abbildung 1 und Tabelle 1).21, 23, 26 Sowohl reine Liposomen als auch Integrin-Liposomen zeigten direkt nach der Injektion eine starke Bindung an die SiO2-Sensoren, wie aus dem jeweiligen Frequenzrückgang und Dissipationsanstieg ersichtlich ist (siehe Abbildung 1 a). Nach ca. 30 Minuten erreichte die Resonanzfrequenz des reinen Liposomenkanals ein Minimum und stieg dann wieder an, verursacht durch die Freisetzung von eingeschlossenem wässrigem Puffer, um einen stabilen Wert von Δffinal=−27±3 Hz zu erreichen (Tabelle 1). Das zugehörige Dissipationssignal zeigte eine ähnliche, jedoch weniger ausgeprägte entgegengesetzte Reaktion. Die Signalveränderungen weisen darauf hin, dass reine Liposomen aufgrund ihrer unzureichenden mechanischen Stabilität platzten und einen SLB bildeten wie in Abbildung 1 dargestellt. Dagegen resultierte die Bindung von Integrin-Liposomen auf SiO2-Sensoren in einem stetigen Frequenzrückgang und Dissipationsanstieg (Tabelle 1). Diese Beobachtung deutet darauf hin, dass die Integrin-Liposomen auf den SiO2-Sensoren intakt blieben. Beim nachfolgenden Waschen erhöhte sich die Frequenz wieder leicht und die Dissipation verringerte sich, was darauf hindeutet, dass Integrin-Liposomen nur unspezifisch an SiO2 binden und sich wieder lösen, wenn Puffer hinzugefügt wird. Im Gegensatz dazu ließen sich die von reinen Liposomen gebildeten SLBs nicht wieder entfernen.
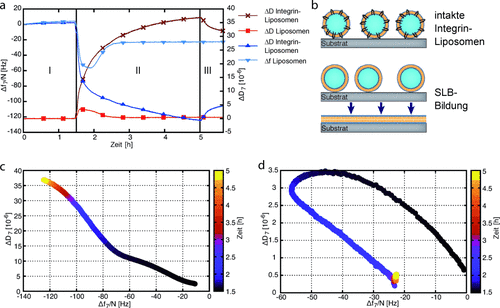
a) Frequenz- und Dissipationsaufzeichnungen für Liposome auf SiO2-Sensoren. Nach einem Waschschritt von 90 Minuten (Schritt I) wurden die Liposomen und Integrin-Liposomen für 3.5 Stunden auf die Sensoren geladen (Schritt II), gefolgt von einem 30-minütigen zusätzlichen Waschschritt (Schritt III). b) Schematische Darstellung von intakten Integrin-Vesikeln und der Bildung von SLB aus reinen Liposomen. Es kann gut sein, dass auch gegensätzlich orientierte Integrine sich in den Liposomen rekonstituieren. Da sie zur Adhäsion nicht beitragen, haben wir sie in die schematischen Darstellungen im Manuskript nicht eingezeichnet. c,d) Änderung der Viskoelastizität bei Anbindung der c) Integrin-Liposomen und d) reinen Liposomen. Der Farbcode in (c) und (d) stellt die Zeitabhängigkeit dar.
|
Proteinbeschichtung[a] |
Proteinbindung |
|
|---|---|---|
|
Δf [Hz] |
ΔD [10−6] |
|
|
1. Liposome |
−27±3 |
0.49±0.09 |
|
2. Integrin-Liposome |
−125.1±0.4 |
35.89±0.11 |
|
3. Fg |
−98.8±2.2 |
3.46±0.06 |
|
4. Fn |
−74.3±2.2 |
3.04±0.07 |
|
5. Col |
−151±4 |
34±1 |
- [a] 1. Reine Liposomen erzeugten Frequenz- und Dissipationssignale, die charakteristisch für die Bildung von SLBs sind. 2. Integrin-Liposome führten zu einem Frequenzrückgang und einer großen Veränderung der Dissipation, was darauf hinweist, dass diese Vesikel intakt blieben. 3.–5. Δf und ΔD nachdem SiO2-Sensoren mit verschiedenen EZM-Proteinen (Fg, Fn, Kollagen Typ I (Col)) 2.5 Stunden lang beschichtet und noch 30 Minuten lang gewaschen wurden. Frequenzrückgang und Dissipationsanstieg deuten auf eine erfolgreiche Bindung der EZM-Proteine an die SiO2-Sensoren hin.
Gemäß dem Modell von Sauerbrey für die Adhäsion von starren dünnen Schichten gibt es eine lineare Beziehung zwischen dem Frequenzrückgang (−ΔF) und der Zunahme der Masse pro Einheitsfläche (Δm/A).27 Da dieses Modell nicht für weiche organische Schichten entwickelt wurde, dient es nur als Näherung in unserem synthetischen Zellmodell. Jedoch lassen sich mithilfe der ΔD/Δf-Diagramme die Konformationsänderungen der adhärierten Schichten identifizieren.28 Abbildung 1 c und d zeigen die ΔD/Δf-Analyse für Integrin-Liposomen und reine Liposomen auf unbeschichteten SiO2-Sensoren. Bei den Integrin-Liposomen ergab sich eine fast lineare Relation nach der Äquilibrierungsperiode, was anzeigt, dass die Liposomen auf den SiO2-Sensoren nicht platzten. Dagegen konnte für reine Liposomen eine Umkehr des Kurvenverlaufs festgestellt werden, der die SLB-Bildung bestätigt. Somit ermöglichte die Rekonstitution von Integrin in intakte Liposomen die weitergehende Untersuchung ihrer Adhäsion an verschiedenen EZM-Proteine.
Der experimentelle Aufbau der QCM-D-Adhäsionsuntersuchungen ist schematisch in Abbildung 2 a dargestellt. Zuerst wurde der SiO2-Sensor des QCM-D-Geräts mit Fg, Fn oder Col beschichtet, wobei die Frequenz- und Dissipationsänderungen aufgezeichnet wurden (Abbildung 2 b,c,d und Tabelle 1). Aus diesen Daten lassen sich mit den Sauerbrey- und Voigt-Modellen jeweils die untere Grenze der Schichtdicke und die viskoelastische Dicke der Proteinbeschichtungen (Tabelle S1 in den Hintergrundinformationen) ermitteln. In allen Fällen betrug die Dicke mehr als 10 nm, was die volle Bedeckung des SiO2-Sensors anzeigt (Tabelle S1). Dynamische Lichtstreuungsmessungen ergaben einen durchschnittlichen Durchmesser von 100 bis 200 nm für reine Liposomen und Integrin-Liposomen. Mit diesen Liposomen und reinem Integrin untersuchten wir die Bindung an Fg-, Fn- oder Col-beschichtete SiO2-Sensoren (Abbildung 2 b,c,d; Tabelle 2).
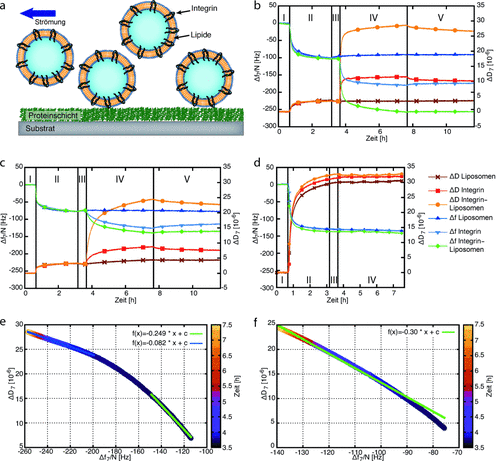
a) Schematische Darstellung der Integrin-Liposomen wie sie über proteinbeschichtete Sensoren in der QCM-D-Kammer gespült werden. b–d) Δf und ΔD für die Bindung von Liposomen, Integrin αIIbβ3 und Integrin-Liposomen auf verschiedenen EZM-Proteinbeschichtungen. Die ersten 40 Minuten floss Puffer A mit MnCl2 und MgCl2 über die Sensoren (Schritt I). In den nächsten 2.5 Stunden wurde eine Lösung mit 50 μg mL−1 b) Fg, c) Fn oder d) Col in die QCM-Kammer eingebracht (Schritt II). Nach einem zweiten 30-minütigen Waschschritt mit Puffer A (Schritt III) wurden drei verschiedene Proben je einem OCM-D-Sensor hinzugefügt: 1) Reine Liposomen, 2) 50 μg mL−1 aktiviertes Integrin αIIbβ3 einem weiteren Sensor und 3) Integrin-Liposomen einem dritten Sensor. e,f) Änderungen der Viskoelastizität für die Bindung von Integrin-Liposomen auf d) Fg- und f) Fn-beschichteten SiO2-Sensoren.
|
Protein- |
Reines Integrin |
Liposomen |
Integrin-Liposomen |
|||
|---|---|---|---|---|---|---|
|
beschichtung |
Δf [Hz] |
ΔD [10−6] |
Δf [Hz] |
ΔD [10−6] |
Δf [Hz] |
ΔD [10−6] |
|
Fg |
−73.6±0.1 |
6.78±0.04 |
4.93±0.15 |
0.14±0.04 |
−153.34±0.09 |
23.20±0.04 |
|
Fn |
−38.84±0.14 |
4.53±0.03 |
−0.02±0.08 |
0.17±0.03 |
−60.79±0.15 |
19.69±0.04 |
|
Col |
−5.1±0.2 |
0.32±0.09 |
−4.9±0.2 |
0.23±0.07 |
−4.5±0.2 |
−0.41±0.08 |
- [a] Die Frequenz- und Dissipationsänderungen wurden bestimmt durch Subtraktion des Mittelwerts während der letzten 5 Minuten des Waschschritts mit Puffer bevor die Proben hinzugefügt wurden (Schritt III) und des allerletzten Waschschritts mit Puffer (Schritt V). Die Fehler stellen die Summe beider Standardabweichungen dar.
Im Fall der Fg-Beschichtungen führten die reinen Liposomen nur zu einem geringfügigen Anstieg der Frequenz und einer sehr stabilen Dissipation. Die Bindung von Integrin resultierte in einem Frequenzrückgang und einem Anstieg der Dissipation. Bei den Integrin-Liposomen konnte der stärkste Frequenzrückgang und Dissipationsanstieg verzeichnet werden. In ähnlicher Weise verursachte die Zugabe von reinen Liposomen auf mit Fn beschichtete Oberflächen nur geringfügige Veränderungen der Frequenz- und Dissipationssignale. Die Bindung von Integrin und Integrin-Liposomen an diese Oberflächen ergab einen Rückgang der Resonanzfrequenz und einen Dissipationsanstieg, aber weniger ausgeprägt als bei den Fg-Beschichtungen. Diese Signalmessungen zeigen, dass Integrin-Liposomen und reines Integrin sehr gut an Fg- und weniger gut an die Fn-Beschichtungen binden, wogegen bei den reinen Liposomen in beiden Fällen keine Bindung stattfand. Bei den Fg-Beschichtungen ist auch bemerkenswert, dass die gemessenen Signale mit reinem Integrin ca. die Hälfte der Signalstärke der Integrin-Liposomen ausmachen (Tabelle 2). Wenn man bedenkt, dass das letztere Signal zum überwiegenden Teil eingeschlossenes Wasser enthält, liegt es nahe, dass sehr viel weniger Bindungsstellen von den Liposomen besetzt sind als von den Integrinen in Lösung. Möglicherweise bleiben die Integrin-Liposomen aufgrund ihrer polyvalenten Wechselwirkung über mehrere Stunden auf den Oberflächen haften.
Im Gegensatz zu Fn und Fg hat Col keine Bindungsstellen für Integrin αIIbβ3. Wie in Abbildung 2 dargestellt, gab es nur eine geringe Veränderung in der Resonanzfrequenz und dem Dissipationssignal, wenn reines Integrin oder Integrin-Liposomen auf die mit Col beschichteten SiO2-Sensoren geladen wurden. Diese Beobachtung unterscheidet sich nur geringfügig von den Ergebnissen für reine Liposomen auf Fg und Fn und bestätigt unsere Annahme, dass Integrin-Liposomen oder reines Integrin nicht spezifisch an Col binden.
Außerdem wurde die spezifische Bindung von Integrin-Liposomen an mit Fg und Fn beschichtete Sensoren mittels Analyse der ΔD/Δf-Kurven charakterisiert (Abbildung 2 e,f). Bei beiden Proteinbeschichtungen ergab sich eine lineare Relation. Im Fall von Fg (siehe Abbildung 2 e) teilten wir die lineare Anpassung in zwei Teile, da wir einen Wechsel in der Viskoelastizität von geringer Bedeckung (grüne Linie) zu dicht gedrängten Liposomen auf der Oberfläche (blaue Linie) beobachteten, wodurch bei zunehmender Vesikelbedeckung weniger Raum für seitliche Bewegungen auf dem oszillierenden Sensor bleibt.18a Die beobachtete lineare Relation zwischen gebundener Masse und Dissipation nach der Äquilibrierungsphase untermauert, dass die Liposomen nicht platzten oder einen SLB auf dem Fg bildeten. Wenn Integrin-Liposome an Fn adhärierten, ergab sich eine lineare ΔD/Δf-Abhängigkeit (Abbildung 2 f). Da die Frequenz- und Dissipationswechsel auf Fg höhere Werte erreichen als auf Fn, kann davon ausgegangen werden, dass die Integrin-Liposomen auf den Oberflächen dichter gepackt sind. Dies könnte eine Umordnung und Deformation der Liposomen zur Folge haben, was die beobachtete zeitliche Veränderung der ΔD/Δf-Ordnung auf Fn erklären würde.
Des Weiteren analysierten wir, wie das Adhäsionsverhalten unserer Zellmodellsysteme bei der QCM-D-Analyse moduliert werden könnte. Zunächst untersuchten wir die Wirkung freier Inhibitoren in Lösung auf die Adhäsion von Integrin-Liposomen auf mit Fg beschichteten SiO2-Sensoren (Abbildung 3 a und b). Das Peptidmimetikum SN529 mit einem IC=30.8 nM wurde zum ersten Mal synthetisiert (siehe Abbildung 3 a und Hintergrundinformationen). Außerdem wurde das RGD-Peptid GRGDSP mit einem IC>1000 nM als Kontrollinhibitor in unserer Adhäsionstudie verwendet. Zu Beginn wurden Integrin-Liposomen und reine Integrine spezifisch auf Fg beschichtete SiO2-Sensoren gebunden (Abbildung 3 c,d, Schritt I). Anschließend wurde das Peptid GRGDSP oder das Peptidmimetikum SN529 jeweils den gebundenen Integrin-Liposomen und Integrinen zugesetzt (Schritt II). Sowohl das Peptid als auch das Mimetikum wurden in Standardpuffer A mit 1 mM MgCl2 und 1 mM MnCl2 gelöst. Wir analysierten die Frequenz- und Dissipationsänderungen vom Ende der Bindung der Probe bis zum Ende des allerletzten Waschschritts (siehe Tabelle 3).
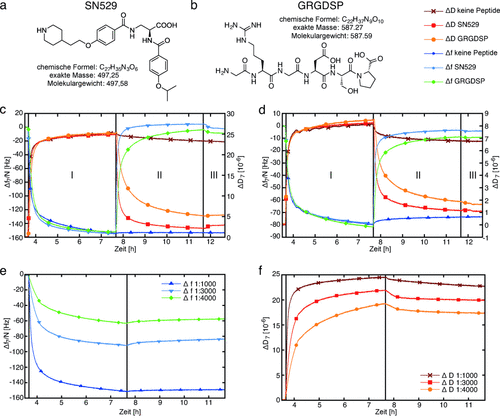
Modulierung der durch synthetisches Integrin vermittelten Adhäsion durch Zusatz von freien Inhibitoren und unterschiedliche Integrinkonzentrationen: a) Peptidmimetikum SN529 und b) RGD-Peptid GRGDSP. c,d) Vergleich von Δf und ΔD bzgl. des kompetitiven vs. nicht kompetitiven Ablösens von c) Integrin-Liposomen und d) Integrin αIIbβ3 auf Fg, wenn RGD-Peptide oder Mimetika vorhanden sind. Integrin-Liposome und 50 μg mL−1 reines Integrin αIIbβ3 wurden jeweils zwei mit Fg beschichteten SiO2-Sensoren hinzugefügt (Schritt I). Dann wurden 500 μM des RGD-Peptids GRGDSP oder des Mimetikums SN529 zugegeben (Schritt II). Eine Referenzkammer wurde mit dem Standardpuffer A gespült, der keinerlei Inhibitoren enthielt, bis alle Kanäle auf diesen Puffer in Schritt III umgestellt wurden. e,f) Adhäsion von Integrin-Liposomen mit unterschiedlichen Integrinkonzentrationen auf mit Fg beschichteten SiO2-Sensoren. Die molaren Verhältnisse von Lipiden zu Proteinen betrugen 1:1000, 1:3000 und 1:4000.
|
Regulärer Puffer (Kontrolle) |
SN529 |
GRGDSP |
||||
|---|---|---|---|---|---|---|
|
Integrin- Liposome |
Integrin |
Integrin- Liposome |
Integrin |
Integrin- Liposome |
Integrin |
|
|
Δf [Hz] |
0.68±0.15 |
6.1±0.1 |
135±13 |
77±11 |
129±18 |
74±13 |
|
ΔD [10−6] |
−2.10±0.05 |
−1.39±0.04 |
−26.9±1.1 |
−7.2±0.6 |
−23.2±1.9 |
−6.9±0.7 |
Für die spezifisch adhärierten Integrin-Liposomen ergab die Zugabe von SN529 einen Frequenzanstieg von 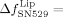 135±13 Hz und einen Dissipationsrückgang von
135±13 Hz und einen Dissipationsrückgang von 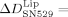 −26.9±1.1×10−6. Lediglich in Standardpuffer wurden keine nennenswerten Frequenz- und Dissipationsänderungen festgestellt. Diese Beobachtungen deuten auf eine starke Ablösung der Integrin-Liposome von den mit Fg beschichteten SiO2-Sensoren hin. Bei Zugabe des Peptids GRGDSP waren die entsprechenden Signalveränderungen weniger stark ausgeprägt, sodass bei diesem Peptid eine verringerte Ablösung der Integrin-Liposome von Fg beobachtet werden konnte. Die Zugabe von SN529 zu reinem Integrin, das an mit Fg beschichtete SiO2-Sensoren gebunden war, führte zu einem Frequenzanstieg von
−26.9±1.1×10−6. Lediglich in Standardpuffer wurden keine nennenswerten Frequenz- und Dissipationsänderungen festgestellt. Diese Beobachtungen deuten auf eine starke Ablösung der Integrin-Liposome von den mit Fg beschichteten SiO2-Sensoren hin. Bei Zugabe des Peptids GRGDSP waren die entsprechenden Signalveränderungen weniger stark ausgeprägt, sodass bei diesem Peptid eine verringerte Ablösung der Integrin-Liposome von Fg beobachtet werden konnte. Die Zugabe von SN529 zu reinem Integrin, das an mit Fg beschichtete SiO2-Sensoren gebunden war, führte zu einem Frequenzanstieg von 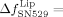 77±11 Hz und einem Dissipationsrückgang von
77±11 Hz und einem Dissipationsrückgang von 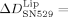 −7.2±0.6×10−6. Bei Zugabe von GRGDSP zu gebundenem Blutplättchenintegrin waren die Frequenz- und Dissipationsveränderungen weniger deutlich. Diese Messungen zeigen, dass reines Integrin auch durch RGD-Peptide und das Peptidmimetikum losgelöst wurde. Dennoch hatte SN529 eine stärkere ablösende Wirkung als das Peptid GRGDSP, da fast alles Integrin und alle Integrin-Liposome vollständig von Fg entfernt wurden.
−7.2±0.6×10−6. Bei Zugabe von GRGDSP zu gebundenem Blutplättchenintegrin waren die Frequenz- und Dissipationsveränderungen weniger deutlich. Diese Messungen zeigen, dass reines Integrin auch durch RGD-Peptide und das Peptidmimetikum losgelöst wurde. Dennoch hatte SN529 eine stärkere ablösende Wirkung als das Peptid GRGDSP, da fast alles Integrin und alle Integrin-Liposome vollständig von Fg entfernt wurden.
Diese Wirkung lässt sich auch an den jeweiligen Frequenzveränderungen ablesen: 30 Minuten nach der Zugabe von GRGDSP ging die Frequenz wieder auf 77.4 % des Wertes vor der spezifischen Bindung der Integrin-Liposomen zurück. Dagegen kam es bei SN529 im gleichen Zeitraum zu einer noch höheren Frequenzerholung von 98.6 %, was einer fast vollständigen Ablösung der Integrin-Liposome durch das Peptidmimetikum entspricht. Zusammenfassend zeigte das Mimetikum SN529 eine drastisch höhere Aktivität gegenüber rekonstituiertem Blutplättchenintegrin αIIbβ3 als das Peptid GRGDSP.
Um die Bindungsstärke unserer Modellzellen auf Fg noch besser zu modulieren und zu kontrollieren, verwendeten wir verschiedene molare Verhältnisse “Integrin:Lipid” von 1:1000, 1:3000 und 1:4000 während der Integrinrekonstitution (Abbildung 3 und Tabelle 4). DLS-Messungen ergaben eine Durchschnittsgröße für alle diese Proben von 111±2 nm. Diese Ergebnisse zeigen deutlich, dass die Frequenz- und Dissipationsveränderungen vom Verhältnis Integrin:Lipid abhängen, das zu Beginn des von Selbstassemblierung bestimmten Rekonstitutionsprozesses verwendet wird. Daher führte die Rekonstitution verschiedener Integrinkonzentrationen in unseren synthetischen Zellen zu einer geringeren Adhäsionsstärke bei verminderten Integrinkonzentrationen.
|
Verschiedene Integrinkonzentrationen |
|||
|---|---|---|---|
|
1:1000 |
1:3000 |
1:4000 |
|
|
Δf [Hz] |
−153.34±0.13 |
−82.8±0.3 |
−54.71±0.15 |
|
ΔD [10−6] |
23.20±0.03 |
19.84±0.04 |
16.9±0.03 |
Mit Biotin funktionalisierte Liposome wurden zuvor auf mit Avidin beschichteten Oberflächen verwendet, um molekulare Erkennungsprozesse bei der Zelladhäsion nachzuahmen.17d Dennoch besitzt dieses Modell eine geringere biologische Relevanz, da die Avidin-Biotin-Bindung nicht in nativen Zellen vorkommt, wo Integrine an der Zelladhäsion beteiligt sind.29 In unseren Untersuchungen haben wir diese Beschränkungen überwunden, indem wir funktionell aktive Integrine in Liposomen rekonstituiert haben, um die Zelladhäsion an EZM-Proteinen nachzuahmen. In solchen eingekapselten Modellzellen sind die molekularen Bindungsraten aufgrund verringerter Diffusionsraten erhöht, ähnlich wie bei nativen Zellen. Daher verkörpern synthetische Zellen eine leistungsfähige Plattform zur Untersuchung der Zelladhäsion unter dem Einfluss von molekularem Crowding wie in nativen Zellen – jedoch in einer gut kontrollierten Umgebung mit verminderter molekularer Komplexität.4
Wie bereits berichtet, wurde bei reinen Liposomen auf SiO2-Sensoren ein Platzen der Liposomen und die Bildung von SLBs beobachtet, wogegen Integrin-Liposome keine SLBs bildeten.21, 30 Dieser Effekt ließe sich mit den sich vorwölbenden extrazellulären Integrindomänen erklären, die die Lipidkopfgruppen von der SiO2-Oberfläche fernhalten, wodurch die Wechselwirkung zwischen Lipid und Oberfläche geschwächt wird und die Integrin-Liposomen intakt bleiben. Andererseits könnten auch rekonstituierte Integrine die Liposomen mechanisch stabilisieren.
Bei den mit RGD versehenen EZM-Proteinen Fg und Fn beobachteten wir die spezifische Adhäsion von Integrin-Liposomen, wenn zweiwertige Ionen vorhanden waren. Ebenso adhärierte reines Integrin spezifisch an Fg und Fn mit Frequenzänderungen, die vergleichbar sind mit der Bindung von Integrin-Liposomen an beide mit RGD versehenen EZM-Proteine. Dennoch war ΔD des reinen Integrins auf Fg und Fn weniger ausgeprägt als für die Integrin-Liposome. Diese Beobachtung zeigt, dass reines Integrin eine dichte Monoschicht auf den proteinbeschichteten SiO2-Sensoren bildet. Im Vergleich dazu schließen Integrin-Liposome eine wässrige Lösung ein, wenn sie an proteinbeschichtete Sensoren binden, was beträchtlich zu dem beobachteten Dämpfungseffekt beiträgt.
Darüber hinaus modulierten wir die synthetische Adhäsion unserer Modellzellen auf Fg mithilfe von verschiedenen Inhibitoren. Zunächst zeigen wir, dass die Zugabe von zwei strukturell unterschiedlichen Inhibitoren zum Puffer zu einem deutlichen Ablösen der Integrin-Liposome und des reinen Integrins führt. Hierbei konkurrierten die Bindungsstellen der mit Fg beschichteten Sensoren mit den viel dichteren Bindungsstellen der RGD-Peptide und Mimetika in Lösung. Integrin-Liposome lösten sich dabei noch stärker von den Fg-Oberflächen als reine Integrine. Dieses ausgeprägtere Ablösen der Integrin-Liposome könnte geschehen, weil reine Integrine eine dichte molekulare Schicht auf den Fg-Oberflächen bildeten und für die freien RGD-Peptide weniger zugänglich waren als die kugelförmigen Integrin-Liposome. Im Vergleich dazu führte das Mimetikum SN529 zu einem vollständigen und sehr viel schnelleren Ablösen der Integrin-Liposome und Integrine, wogegen GRGDSP-Peptide die adhärierten Integrin-Liposome und Integrine nicht so vollständig und schnell ablösten. Das unterschiedliche “kompetitive” Ablöseverhalten steht im Zusammenhang mit den sehr unterschiedlichen Bindungsaktivitäten für das Blutplättchenintegrin αIIbβ3: SN529 weist eine höhere Bindungsaffinität als das Peptid GRGDSP auf, was zusammengenommen zu einem ausgeprägteren Ablösen der Integrin-Liposomen und Integrine führt.
Zusammengefasst haben wir ein neues biomimetisches System zur Erforschung der synthetischen Adhäsion etabliert. QCM-D ist ein ideales Instrument, um die beteiligten molekularen Erkennungsprozesse zu untersuchen. Der nächste Schritt hin zu funktionellen synthetischen Zellen, die die Adhäsion nachahmen und kontrollieren, wird darin bestehen, weitere mit der Adhäsion assoziierte Proteine, wie z. B. Talin, FAK oder Vinculin, den eingekapselten Liposomen hinzuzufügen. Besonders spannend wird es sein, diese eingekapselten funktionellen Adhäsionskomplexe auch mittels Kryo-TEM-Analyse visuell zu charakterisieren und den Anwendungsbereich dieser synthetischen Minimalzellen auf komplexere Systeme auszudehnen.
Acknowledgements
Wir danken Peer Fischer für die Unterstützung bei den DLS-Messungen und Electra Gizeli für hilfreiche Diskussionen. Finanzielle Unterstützung kam vom Europäischen Forschungsrat im Rahmen des 7. Forschungsrahmenprogramms der EU (FP/2007-2013)/ERC Grant Agreement no. 294852 und dem BMBF/MPG-Netzwerk MaxSynBio. J.P.S. ist Weston Gastprofessor am Weizmann Institute of Science und Mitglied des Heidelberger Exzellenzclusters CellNetworks. B.G. ist E. Neter Professor für Zell- und Tumorbiologie.




