Bestimmung transienter Konformationszustände von Proteinen durch Festkörper-R1ρ-Relaxationsdispersions-NMR-Spektroskopie†
Diese Arbeit wurde durch die French Research Agency (ANR-10-PDOC-011-01 ProtDynByNMR) und das European Research Council (ERC-Stg-2012-311318-ProtDyn2Function) finanziert. Wir danken dem Grenoble Instruct Centre (ISBG; UMS 3518 CNRS-CEA-UJF-EMBL), unterstützt durch FRISBI (ANR-10-INSB-05-02) und GRAL (ANR-10-LABX-49-01) innerhalb des Programms Grenoble Partnership for Structural Biology (PSB). A. Krushelnitsky, T. Zinkevich und R. Sounier danken wir für anregende Diskussionen und I. Ayala für Probenvorbereitungen.
Abstract
Die Funktion von Proteinen basiert auf der Fähigkeit, eine Vielfalt an Zuständen einzunehmen, die sich in ihren Strukturen und freien Energien unterscheiden. Um eine Proteinfunktion zu verstehen, gilt es daher herauszufinden, wie die verschiedenen, thermisch zugänglichen Konformationen miteinander verbunden sind und welche Strukturen und relativen Energien sie aufweisen. Viele biomolekulare Reaktionen laufen innerhalb von Mikro- bis Millisekunden ab, weshalb diese Zeitskala von zentraler (und funktioneller) Bedeutung ist. Wir zeigen hier, dass R1ρ-Relaxationsdispersionsexperimente in Festkörper-NMR mit Rotation am magischen Winkel Einblicke in die Thermodynamik und Kinetik solcher Austauschprozesse gibt, und dass auch strukturelle Parameter über kurzlebige Zustände erhalten werden können.
NMR-Spektroskopie in Lösung ist ein erfolgreicher Ansatz zur Erforschung dynamischer Prozesse im Mikro- bis Millisekundenbereich und zur Charakterisierung kurzlebiger Konformationen.1 Eine spezielle Technik ist die Relaxationsdispersions(RD)-NMR-Spektroskopie. RD-NMR-Techniken nutzen den Effekt konformationeller Austauschprozesse auf die spektrale Linienbreite, also auf die Relaxationsraten von Kernspinkohärenzen (R2, R1ρ). Über die Bestimmung der Spin-Relaxationsraten in Anwesenheit eines veränderlichen Radiofrequenz(RF)-Feldes, bietet die RD-Technik einen Zugang zu relativen Populationen und Austauschraten sowie zu den chemischen Verschiebungen kurzlebiger Konformationen und somit zur lokalen Struktur.1, 2 Bei sehr großen molekularen Komplexen oder unlöslichen Aggregaten, bei denen Lösungs-NMR-Spektroskopie an ihre Grenzen gerät, bietet sich die Festkörper-MAS-NMR-Spektroskopie (MAS=magic angle spinning) zur Aufklärung von Struktur und Dynamik an. Jedoch bleibt auch im Festkörper die Charakterisierung der Dynamik konformationeller Änderungen mittels NMR-Spektroskopie eine Herausforderung. Wir beschreiben hier eine Festkörper-NMR-Technik, die Amid-15N-R1ρ-RD-Relaxationsdaten, d. h. die Kohärenzzerfallsraten mit 15N-Spinlock-Feldern unterschiedlicher Feldstärke, quantitativ bezüglich der konformationellen Dynamik analysieren und interpretieren kann. Die Daten gewähren Einblicke in die chemischen Verschiebungen (CS; chemical shift) und Bindungsvektorrichtungen kurzlebiger Zustände. Durch die Untersuchung eines konformationellen Flips in kristallinem Ubiquitin verifizierten wir die Robustheit des RD-Ansatzes.
Konformationelle Fluktuationen zwischen verschiedenen Zuständen, d. h. verschiedenen Bindungsgeometrien, bewirken, dass die beteiligten Kernspins wechselnden lokalen Umgebungen im Protein ausgesetzt sind. Der einfachste Fall, der Austausch zwischen zwei Zuständen, ist in Abbildung 1 a gezeigt. Aufgrund der Dynamik des konformationellen Austauschs erfährt ein Spin eine Fluktuation der isotropen chemischen Verschiebung. Da auch Bindungsvektorrichtungen vom Austausch betroffen sind, resultiert daraus auch eine Fluktuation der Anisotropie der chemischen Verschiebung (chemical shift anisotropy; CSA) und der dipolaren Kopplung zu benachbarten Spins. Beide Wechselwirkungen werden in einer Lösungs-NMR-Messung durch die Brownsche Teilchenbewegungen (molecular tumbling) zu null gemittelt. Folglich sind in Lösung nur Fluktuationen der isotropen chemischen Verschiebung für die Mikro- bis Millisekundendynamik relevant. Somit können R1ρ-RD-Experimente in Lösung auch nur dann eine konformationelle Dynamik erfassen, wenn diese eine Änderung der isotropen chemischen Verschiebung bewirkt. Die relevante Theorie für diese Austauscheffekte ist bereits erarbeitet worden und kann durch die Gleichungen von Bloch-McConnell beschrieben werden.3
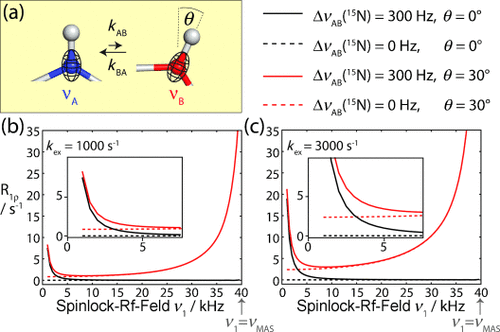
Numerische Simulationen zeigen den Effekt von konformationellen Austauschprozessen auf die 15N-R1ρ-Relaxation. a) Zwei-Spin-N-H-System, das zwischen gering und stark besetzten Zuständen austauscht, die sich durch die 15N-chemische Verschiebung und die Orientierung des NH-Bindungsvektors unterscheiden. Es wird angenommen, dass der 15N-CSA-Tensor kolinear zur NH-Bindung steht. b,c) Simulierte 15N-R1ρ-RD-Profile des Zwei-Spin-Systems unter der Annahme relativer Populationen von pB=10 % und pA=90 %. Es wurden unterschiedliche Szenarien in Bezug auf die isotrope 15N-Verschiebung (durchgezogene bzw. gepunktete Linie) sowie in Bezug auf die Änderung des Bindungswinkels θ (rot bzw. schwarz) angenommen, wie in der Legende angegeben. Weitere Simulationen sind in Abbildung S1 in den Hintergrundinformationen zu sehen. Die Einschübe in (b) und (c) zeigen vergrößerte Darstellungen des Bereichs niedriger RF-Feldstärken.
Im Festkörper findet eine molekulare Mittelungsbewegung (tumbling) nicht statt, und anisotrope Wechselwirkungen (dipolare Kopplungen und CSA) müssen durch sehr schnelle Rotation der Probe (MAS) periodisch moduliert und über eine Rotorperiode (auf einer Skala von μs) gemittelt werden. Diese zeitliche Mittelung führt zu einer Verringerung der Linienbreite, was ein essentieller Bestandteil für hochauflösende Messungen ist. Wenn wir jedoch molekulare Dynamik und RF-Einstrahlung (RF) in die Überlegungen mit einbeziehen, so kann es sein, dass mehrere zeitabhängige Prozesse (Probenrotation, RF-Einstrahlung und konformationeller Austausch) interferieren und unterschiedliche Zerfallsprozesse auftreten. Dies macht die Situation etwas komplizierter als in Lösung.4 Bevor wir die experimentelle Umsetzung betrachten, untersuchen wir zunächst die Eigenschaften des 15N-R1ρ-Zerfalls durch numerische Simulationen eines Systems mit Austausch und MAS.
Abbildung 1 b,c zeigt simulierte 15N-R1ρ-RD-Profile eines 1H-15N-Spinpaars, das zwischen zwei Zuständen mit relativen Population von 90 % und 10 % austauscht und einem 15N-Spinlock-RF-Feld mit veränderlicher Amplitude und MAS-Rotation ausgesetzt ist. Wir nahmen unterschiedliche Austauschszenarien an, in denen entweder die isotrope chemische Verschiebung des 15N-Spins fluktuiert oder eine Umorientierung des NH-Bindungsvektors innerhalb des Moleküls auftritt oder beides. Die Ergebnisse lassen sich wie folgt zusammenfassen: 1) Wenn ein Austausch zwischen zwei Zuständen stattfindet, die sich nur in der isotropen chemischen Verschiebung, aber nicht in der Bindungsorientierung unterscheiden, dann lassen sich R1ρ-RD-Profile durch den Bloch-McConnell-Formalismus beschreiben (schwarze Kurve in Abbildung 1 b,c).1a 2) Wenn der konformationelle Austausch Fluktuationen des Bindungswinkels mit sich bringt (d. h. Änderungen dipolarer Kopplungen und der CSA), dann wird die Situation etwas komplexer. In diesem Fall zeigen R1ρ-Raten einen allgemein höheren Wert, da fluktuierende anisotrope Wechselwirkungen Relaxation induzieren.5
Von besonderer Bedeutung für diese Untersuchung ist der Aspekt, dass R1ρ-Raten einen ausgeprägt hohen Wert annehmen, wenn sich die Spinlock-Feldstärke der Rotationsfrequenz der Probe (νMAS) annähert, was auf das Auftreten eines als Rotationsresonanz (rotary resonance) bezeichneten Effekts zurückzuführen ist.6
Wie kürzlich berichtet wurde4, 5 und in Abbildung 1 sowie S1 in den Hintergrundinformationen zu sehen ist, werden durch konformationellen Austausch die Wiedereinkopplungsbedingungen der Rotationsresonanz verbreitert. Damit hängen die R1ρ-Relaxationsraten, die unter ähnlichen Bedingungen gemessen wurden, auch von der Kinetik des Austauschs, den relativen Populationen und dem Austauschwinkel zwischen den beiden Konformationen ab.
Zusammenfassend zeigen diese Simulationen, dass MAS-Festkörper-NMR-R1ρ-RD-Experimente wertvolle Einblicke in den konformationellen Austausch liefern können. Es wird auch gezeigt, dass nicht nur die Fluktuation der chemischen Verschiebung zwischen zwei Zuständen zugänglich ist (wie in der Lösungs-NMR-Spektroskopie der Fall), sondern auch der Bindungswinkel, in dem sich der kurzlebige angeregte Zustand vom überwiegend vorliegenden Grundzustand unterscheidet.
Die Tatsache, dass dieses Potenzial der MAS-Festkörper-NMR-R1ρ-RD-Experimente zur quantitativen Untersuchung des konformationellen Austauschs in Proteinen bisher noch nicht umfangreich genutzt wurde, ist darauf zurückzuführen, dass nur ein gewisser Teil der R1ρ-Zerfallsraten von dynamischen Prozessen stammt und ein erheblicher Beitrag auch durch kohärenten Zerfall, d. h. Dephasierung über dipolare Kopplungen (“dipolare Dephasierung”), verursacht wird.
Vor allem in Mehrspinsystemen wie Proteinen mit ihren zahlreichen 1H-Spins trägt die dipolare Dephasierung zum R1ρ-Zerfall bei. Dieser Effekt muss unterdrückt werden, um den von dynamischen Prozessen stammenden Teil des R1ρ-Zerfalls zu erhalten. Kürzlich wurde gezeigt, dass durch hohe MAS-Frequenzen von ca. 40 kHz oder höher und einer Spinlock-Feldstärke von >15 kHz die dipolare Dephasierung so stark reduziert wird, dass selbst in der protonenreichen Umgebung eines Proteins dieser Effekt vernachlässigbar scheint.7 Die Bedingung hoher Spinlock-Felder verhindert jedoch, dass R1ρ-RD-Experimente auch im unteren Spinlock-Bereich von 5–10 kHz möglich sind, also dort, wo RD-Profile besonders empfindlich für isotrope Fluktuationen der chemischen Verschiebung sind.
Wir umgehen diese Einschränkung, indem wir die Probe in hohem Grad deuterieren, was den Beitrag der dipolaren Dephasierung zu den 15N-R1ρ-Raten stark reduziert.8 In hochdeuterierten Proben, d. h. Proben, die vollständig deuteriert und nur an austauschbaren Stellen (Amid-Protonen) teils reprotoniert sind, ist das Netzwerk aus starken dipolaren 1H,1H-Wechselwirkungen so hoch verdünnt, dass empfindliche und hochaufgelöste protondetektierte Festkörper-NMR-Spektren sowie lange 15N-Kohärenzzeiten gewährleistet sind.8, 9 Abbildung 2 a zeigt Beispiele von R1ρ-RD-Profilen von Aminosäuren einer hochdeuterierten Probe von mikrokristallinem Ubiquitin, in der 50 % der Amid-15N reprotoniert wurden. Die 15N-R1ρ-Raten wurden bei einer MAS-Frequenz von 39.5 kHz und einer RF-Feldstärke von 2–15 kHz gemessen, d. h. weit entfernt von der n=1-Rotationsresonanzbedingung (diese wäre bei 39.5 kHz Spinlock-Feldstärke). Damit die R1ρ-Relaxationsraten unter Resonanzbedingung erhalten werden, muss der Beitrag von R1 im geneigten rotierenden Koordinatensystem eliminiert werden (unter Verwendung von Standardformeln;1a siehe Hintergrundinformationen).
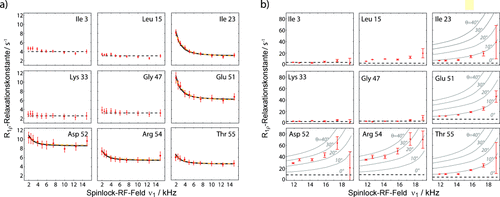
Protonendetektierte 15N-RD-Daten von perdeuteriertem Ubiquitin bei 300 K. Gezeigt sind On-Resonance-R1ρ-Raten, d. h. mit korrigiertem Offset der chemischen Verschiebung (siehe Hintergrundinformationen). a) RD-Profile einer volldeuterierten Ubiquitinprobe (50 % rückprotoniert), aufgenommen bei 39.5 kHz MAS und einer geringen Spinlock-Feldstärke von 2–15 kHz. Die durchgezogenen schwarzen Linien zeigen das Ergebnis des Bloch-McConnell-Angleichs eines Austauschs zwischen zwei Zuständen nur unter Verwendung der erhaltenen R1ρ-Daten. Die orangen Linien stammen von einem Angleich, der zusätzlich CPMG-Daten für die Aminosäuren 23, 27, 55 bei 600 MHz verwendet (siehe Abbildung S8). Die flachen gestrichelten Linien (konstante R1ρ-Raten) in (a) und (b) zeigen Relaxationsraten, die bei 39.5 kHz MAS und einer Spinlock-Feldstärke von 15 kHz gemessen wurden; man geht daher davon aus, dass sie nicht von Austauscheffekten betroffen sind. b) RD-Profile einer volldeuterierten Ubiquitinprobe (20 % rückprotoniert), aufgenommen bei 20 kHz MAS. Die durchgezogenen Linien zeigen simulierte R1ρ-RD-Profile, die eine Austauschrate von kex=2900 s−1 und eine Population von pB=9.3 % annehmen. Alle vorhandenen RD-Profile sowie experimentelle Details sind in den Hintergrundinformationen aufgeführt.
Eine große Mehrheit der Aminosäuren in Abbildung 2 a, z. B. Ile 3, Leu 15, Lys 33 und Gly 47, zeigen flache RD-Profile über den gesamten Bereich an RF-Feldstärken. Dies bestätigt, dass die kohärente Dephasierung tatsächlich ausreichend durch Deuterierung und schnelle MAS-Rotation unterdrückt wird, und besagt folglich auch, dass nicht-flache R1ρ-RD-Profile verlässlich auf dynamische Prozesse zurückzuführen sind. Tatsächlich finden wir für einige Aminosäuren nicht-flache R1ρ-RD-Kurven, d. h. erhöhte Relaxationsraten für niedrige Spinlock-Feldstärken, wie es die Bloch-McConnell-Gleichungen unter Annahme von Austauschprozessen voraussagen. All die Aminosäuren, die nicht-flache R1ρ-RD-Kurven erzeugen, befinden sich in einem definierten, abgegrenzten Bereich des Ubiquitins im N-terminalen Teil der Helix und in einem Loop, der an diese Helix über Wasserstoffbrücken gebunden ist (Ile 23, Lys 27, Glu 51, Asp 52, Arg 54, Thr 55; siehe Abbildungen 3 und S5). Dass in diesem Bereich des Proteins konformationeller Austausch stattfindet, wurde bereits in zahlreichen NMR-Studien in Lösung festgestellt.10 Kürzlich hatten wir auf der Grundlage von Carr-Purcell-Meiboom-Gill(CPMG)-RD- und Multiple-Quantum-Relaxationsexperimenten auch für mikrokristallines Ubiquitin über Austauschprozesse in diesem Bereich des Proteins berichtet.11
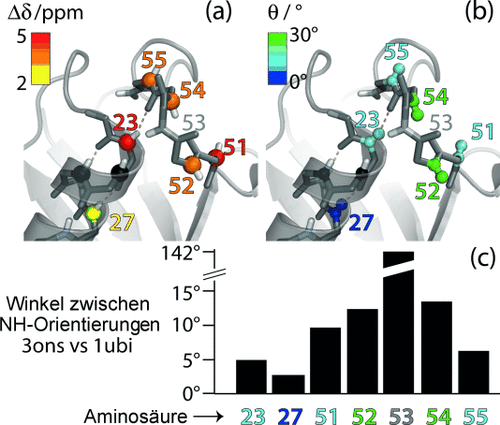
Aminosäuren, die am konformationellen Austausch in Ubiquitin beteiligt sind. a) Die Unterschiede der chemischen Verschiebung pro Aminosäurerest, Δδ (erhalten aus den Daten von Abbildung 2 a und b, und die Winkeländerungen, θ (erhalten aus Abbildung 2 b), sind auf die Struktur des hier verwendeten Ubiquitin-Kristalls (PDB 3ons) geplottet. Die Aminosäuren 24 und 25 (schwarzer Bereich) sind in NH-Korrelationsspektren nicht sichtbar, da die hier auftretende Dynamik vermutlich eine erhöhte Linienbreite hervorruft. c) Unterschiede der NH-Bindungsrichtung zwischen der von uns verwendeten Kristallstruktur (Typ-II-β-Turn) und einer Kristallstruktur mit Typ-I-β-Turn (PDB 1ubi). Indem man beide Strukturen nach allen Sekundärstrukturelementen ausrichtet, erhält man die Winkeldifferenz der jeweiligen NH-Bindung.
Um den Austauschprozess quantitativ zu erfassen, wurden die R1ρ-RD-Profile dieser Aminosäuren an ein Austauschmodell gefittet, das auf dem Bloch-McConnell-Formalismus basiert. Streng genommen ist dieser Formalismus für MAS-Festkörper-NMR nicht korrekt, wenn beim Austausch eine Änderung des Bindungsvektors auftritt (vgl. Abbildung 1). Jedoch scheint hier die Anwendung berechtigt, da die RD-Kurven in Abbildung 2 in einem Bereich weit außerhalb der Bedingungen für Rotationsresonanz aufgenommen wurden; in diesem Bereich haben Winkeländerungen nur einen sehr geringen Einfluss (vgl. Abbildung 1). Dass die Fluktuationen der Bindungswinkel tatsächlich eher klein ausfallen, wurde in unabhängigen Messungen bestätigt (siehe unten).
Wir haben die R1ρ-RD-Profile der Aminosäuren 23, 27, 51, 52, 54 und 55 an ein Modell angeglichen, das den Austausch zwischen zwei Zuständen annimmt (Abbildung 2 und S8). Aufgrund der räumlichen Nähe der Aminosäuren nahmen wir an, dass sie alle am selben Austausch beteiligt sind und dass folglich die Austauschrate kex=kAB+kBA und die Population (pB) des geringer besetzten Zustands für diese Aminosäuren identisch sind. Im Gegensatz dazu wurde angenommen, dass der Unterschied der chemischen Verschiebung zwischen dem stark und gering besetzten Zustand, Δδ, für diese Aminosäuren spezifisch ist, da die chemische Verschiebung sehr empfindlich auf lokale Änderungen reagiert. In Abbildung 2 a zeigen die durchgezogenen Linien die am besten passenden Kurvenangleiche. Der Angleich ergab eine Austauschrate kex von 8600±1700 s−1 und eine Population des geringer besetzten Zustands pB von 3.1±1.2 %. Die Δδ-Werte liegen im Bereich 2–5 ppm (alle Werte sind in Tabelle S1 aufgelistet). Um herauszufinden, wie zuverlässig die Ergebnisse einer einzelnen R1ρ-RD-Messung sind, untersuchten wir den Fall, wenn zusätzlich unabhängige Daten mit einbezogen werden. Eine Möglichkeit wären R1ρ-RD-Messungen bei zusätzlichen Magnetfeldstärken, wie es häufig in der Lösungs-NMR-Spektroskopie angewendet wird; dies setzt jedoch ein weiteres Spektrometer mit schnell rotierendem MAS-Probenkopf voraus. Alternativ verwenden wir hier einen kombinierten Angleich mit CPMG-RD-Daten, die in vorherigen Studien unter ähnlichen Bedingungen (Deuterierung, schnelles MAS und Magnetfeldstärke 14.1 T) aufgenommen wurden.11 Da CPMG-RD-Experimente auf einer Zeitskala von Mikro- bis Millisekunden empfindlich sind, ist die Kombination mit R1ρ-Daten möglich. Eine solche Analyse der R1ρ-RD und CPMG-Daten ergibt ähnliche Δδ-Werte wie der vorherige Angleich, der nur auf R1ρ-RD-Daten basierte (Tabelle S1). Die erhaltene Austauschrate kex beträgt 2900±140 s−1, und die Population pB 9.3±0.6 %. Auch wenn diese Werte von den auf R1ρ-RD-Daten allein basierenden Werten (kex=8600±1700 s−1, pB=3.1±1.2 %) etwas abweichen, ist dennoch bemerkenswert, dass die Kurven des kombinierten R1ρ/CPMG-Angleichs (orange in Abbildung 2 a) von den Kurven des R1ρ-Angleichs kaum zu unterscheiden sind. Dies beweist, dass die vorliegenden Daten in ausgezeichneter Übereinstimmung mit unabhängigen CPMG-Daten sind. Dass sich die ermittelten Parameter unterscheiden, weist auf die bekannte Schwierigkeit hin, alle Parameter aus einer einzigen Messung (hier einem B0-Feld) zu extrahieren.
Das R1ρ-RD-Experiment bietet Vorteile gegenüber dem zuvor vorgestellten CPMG-RD-Experiment:11 Im Unterschied zu den R1ρ-Raten enthalten die gemessenen R2-Relaxationsraten im Festkörper einen erheblichen Anteil an dipolarer Dephasierung, selbst bei hoher Deuterierung und schnellem MAS (Abbildung S10).7 Das hat zwei wichtige Konsequenzen: 1) Da ein schnellerer Kohärenzzerfall auftritt, ist das Signal-Rausch-Verhältnis des CPMG-Experiments11 deutlich geringer als im R1ρ-Experiment. 2) Der verbleibende kohärente Beitrag zu den effektiven R2-Raten im CPMG-Experiment ist annähernd, aber nicht vollständig unabhängig von der CPMG-Frequenz.11 Daher könnten beobachtete Schwankungen der R2-Raten in CPMG-Experimenten zu einem gewissen Grad mit Artefakten behaftet sein. Zu beachten ist, dass die Zeitskalen von R1ρ- und CPMG-RD-Experimenten teilweise überlappen, aber nicht identisch sind, sodass man beide als komplementäre Ansätze betrachten sollte.
In Lösung zeigt die gleiche Molekülregion des Ubiquitin einen konformationellen Austausch. Dieser ist jedoch sogar bei 20 K tieferer Temperatur noch deutlich schneller (kex=12 500–25 000 s−1) als in unserem Fall.10 Bei einer ähnlich hohen Temperatur von 298 K sind die Profile in Lösung flach (z. B. Ile 23), was in starkem Gegensatz zu den Festkörper-R1ρ-Dispersionen aus dieser Studie steht. Diese Beobachtung zeigt eindeutig, dass diese dynamischen Prozesse in Mikrokristallen langsamer ablaufen als in Lösung. Grund für die Verlangsamung im Festkörper sind intermolekukare Kontakte, die im Kristall die Energiebarrieren für dynamische Prozesse zusätzlich erhöhen.11
Nachdem wir gezeigt hatten, dass R1ρ-RD-Experimente bei hohen MAS-Frequenzen nicht nur Informationen über die Thermodynamik und die Kinetik des Austauschs enthalten, sondern auch über die ortsspezifische chemische Verschiebung des niedrig besetzten Zustands (ähnlich wie durch Lösungs-NMR), wollten wir untersuchen, ob zusätzlich strukturelle Informationen über den niedrig besetzten Zustand erhalten werden können. Wie in Abbildung 1 zu sehen, hängen 15N-R1ρ-RD-Profile in der Umgebung der Rotationsresonanz (wenn ν1≈νMAS) sehr empfindlich von der Winkeländerung ab, die mit dem konformationellen Austausch der NH-Bindung (d. h. der dipolaren Kopplung und 15N-CSA) einhergeht. Aus technischen Gründen wollten wir solche Messungen bei hohen MAS-Frequenzen nicht durchführen, da sehr hohe Spinlock-Feldstärken (ν1≈νMAS) die Hardware und die Probe beschädigen können. Stattdessen reduzierten wir die MAS-Frequenz auf 20 kHz, da hier die Rotationsresonanz schon bei geringeren RF-Feldstärken auftritt. Um sicherzugehen, dass der kohärente Anteil des 15N-R1ρ-Zerfalls auch bei langsamem MAS vernachlässigbar klein ist, erhöhten wir den Deuterierungsgrad (Reprotonierung von nur 20 % der Amide anstelle von 50 %). Die geringere Empfindlichkeit (durch erhöhte Verdünnung der Protonen) kann durch das größere Volumen des Probenrotors kompensiert werden, der bei geringeren MAS-Frequenzen einsetzbar ist. Abbildung 2 b zeigt repräsentative Beispiele für 15N-R1ρ-RD-Profile, die bei Spinlockstärken von 12–19 kHz aufgenommen wurden. Viele davon, wie z. B. Ile 3, Leu 15, Lys 33 und Gly 47, zeigen flache RD-Profile über den gesamten Bereich der untersuchten Spinlock-Feldstärken oder nur einen kleinen Anstieg bei Feldstärken, die in der Nähe (Abweichung von 2–3 kHz) der n=1-Rotationsresonanzbedingung liegen. Interessanterweise erhielten wir ähnliche Werte des Plateaus wie bei Messungen mit hohen MAS-Frequenzen, was impliziert, dass die kohärenten Beiträge zu R1ρ auch bei geringeren MAS-Frequenzen tatsächlich ausreichend unterdrückt sind. Einen Anstieg von R1ρ nahe der Rotationsresonanzbedingung (ν1=νMAS) kann durch Wiedereinkopplung der dipolaren Kopplungen und der CSA-Wechselwirkungen hervorgerufen werden.6 Ein Anstieg der R1ρ-Raten könnte daher auch auftreten, selbst wenn kein konformationeller Austausch stattfindet. Auffallend ist jedoch, dass für die Aminosäuren, deren R1ρ-Rate die größte Abhängigkeit von der Spinlock-Feldstärke zeigt, auch ein konformationeller Austausch durch den isotropen CS-Mechanismus festgestellt werden konnte. Dies gilt für die Aminosäuren 23, 27, 51, 52, 54 und 55 (Abbildung 2). Basierend auf den Simulationen in Abbildung 1 (die zeigen, dass RD-Profile von der Änderung des Austauschwinkels abhängen) schließen wir umgekehrt auf die Winkel des möglichen Austauschs der RD-Profile in Abbildung 2 b. Die Simulationen, die unterschiedliche Winkel annehmen, sind in Abbildung 2 b als graue Kurven gezeigt. Die entnommenen Austauschwinkel variieren zwischen den einzelnen Aminosäuren, und die größte Winkelfluktuation wird für Asp 52 und Arg 54 (20–30°) festgestellt, während Ile 23, Lys 27, Glu 51 und Thr 55 mit Winkelfluktuationen von 10° oder weniger eine geringere Dynamik zeigen. Für Gly 53 sind wegen Überlappung im Spektrum keine Daten vorhanden.
Interessant ist nun, diese Daten mit konkreten Strukturmodellen eines Austauschprozesses zu vergleichen. Wie aus zahlreichen NMR-Daten, Mutationsexperimenten und Untersuchungen unterschiedlicher Kristallformen von Ubiquitin hergeleitet, beruht der vorgeschlagene Austauschmechanismus auf einem 140°-Flip der Peptidebene D52/G53 und einer Umlagerung der Wasserstoffbrücke zwischen diesem Loop und der Helix der Aminosäuren 23–33. Abbildung 3 zeigt, dass in dem hier verwendeten Mikrokristall die NH-Bindung der Aminosäure 53 in Richtung der Helix deutet (ein Typ-II-β-Turn), während in den meisten anderen Strukturen der Protein Data Bank sich die Bindung nach außen richtet (Typ-I-β-Turn, siehe Abbildung S9). Wir vermuten deshalb, dass der hier beobachtete konformationelle Austausch der Übergang zwischen diesen zwei Typen von β-Turns ist. Um diese Hypothese zu prüfen, haben wir die NH-Bindungswinkel von Kristallstrukturen verglichen, die stellvertretend den Typ-I-β-Turn und den Typ-II-β-Turn enthalten. Der größte Unterschied der NH-Bindungsorientierung wurde für Asp 52 und Arg 54 gefunden, die beide an die drehende Peptidebene von Gly 53 angrenzen. Die Aminosäuren 23, 27, 51 und 55 zeigen geringere Winkelfluktuationen der jeweiligen Bindungsvektoren (Abbildung 3 c). Dies ist qualitativ in guter Übereinstimmung mit unseren Daten aus Abbildung 2 b, die ebenfalls die größte Dynamik, d. h. den größten Winkelunterschied, für Asp 52 und Arg 54 zeigen – und deutlich kleinere Winkel für die anderen am Prozess beteiligten Aminosäuren. Diese Daten zeigen, dass R1ρ-RD-Experimente zusätzlich zu CS-Daten strukturelle Einblicke auf angeregte Zustände geben können. Diese Eigenschaft könnte von großem Wert für die Strukturaufklärung von kurzlebigen Konformationen sein, auch in Anbetracht der zunehmenden Möglichkeiten, die chemische Verschiebung für die Strukturbestimmung zu verwenden. Diese Möglichkeit schließt auch Systeme ein, die bisher außer Reichweite für atomar aufgelöste Studien waren, wie z. B. sehr große oder unlösliche Proteine.




