AP-UV-MALDI mit flüssigen Matrizes: stabile Ionenausbeuten von mehrfach geladenen Peptid- und Proteinionen für die empfindliche Massenspektrometrie†
Diese Arbeit wurde von der Alexander von Humboldt-Stiftung (R.C.) unterstützt. K.D. und A.P. werden von der DFG (DR416/10-1) und dem Programm “Innovative Medizinische Forschung” der Medizinischen Fakultät der Westfälischen Wilhelms-Universität Münster (DR520805) unterstützt. Wir danken Prof. Jürgen Klingauf für die Unterstützung des Projekts.
Graphical Abstract
Hohe und andauernde Ionenausbeuten von mehrfach geladenen Peptid- und Proteinionen können in der MALDI-MS erzeugt werden, indem eine AP-Ionenquelle mit einem heizbaren Ionentransferröhrchen und flüssige Matrizes eingesetzt werden. Mehrfach geladene Ionen wurden mit Laserenergien von 1–10 μJ nachgewiesen, was einer Fluenz von <200–2000 J m−2 entspricht und innerhalb des Bereichs von typischen UV-MALDI-MS-Fluenzen liegt.
In der biologischen Massenspektrometrie (MS) werden überwiegend zwei Ionisationstechniken für die Analyse von größeren Biomolekülen wie Polypeptiden eingesetzt. Dies sind die Nano-Elektrospray-Ionisation1, 2 (nanoESI) und die matrixunterstützte Laserdesorption/-ionisation3, 4 (MALDI). Beide Techniken werden als “sanft” bezeichnet, weil sie die Desorption und Ionisation von intakten Analytmolekülen und damit ihre erfolgreiche massenspektrometrische Analyse erlauben. Einer der wichtigsten Unterschiede zwischen diesen beiden Ionisationstechniken liegt in ihrer Fähigkeit, mehrfach geladene Ionen zu erzeugen. MALDI erzeugt typischerweise einfach geladene Peptidionen, während nanoESI leicht mehrfach geladene Ionen produziert, sogar für Peptide mit einer Masse von weniger als 1000 Da. Die Erzeugung von hoch geladenen Ionen ist wünschenswert, da dies die Verwendung von Massenanalysatoren wie Ionenfallen (inkl. Orbitraps) und Hybrid-Quadrupolinstrumenten ermöglicht, die typischerweise nur einen begrenzten m/z-Bereich (<2000–4000) bieten. Hohe Ladungszustände ermöglichen auch die Aufnahme von informativeren Fragmentionenspektren, wenn Methoden wie die kollisionsinduzierte Dissoziation (CID), die Elektroneneinfang-Dissoziation (ECD) und die Elektronentransfer-Dissoziation (ETD) in Kombination mit der Tandem-MS (MS/MS) verwendet werden.5, 6 Somit besteht ein klarer Vorteil in der Verwendung von ESI in Forschungsbereichen, wo die Peptidsequenzierung oder grundsätzlich die Strukturaufklärung von Biomolekülen mithilfe der MS/MS erforderlich ist. Dennoch ist die MALDI mit ihrer höheren Toleranz gegenüber Verunreinigungen und Zusatzstoffen, der Einfachheit in der Handhabung, dem hohen Potenzial für eine schnelle und automatisierte Probenpräparation und Analyse, sowie der Möglichkeit zur bildgebenden MS eine Ionisationsmethode, die vorteilhaft in bioanalytischen Bereichen eingesetzt werden kann, in denen die ESI weniger geeignet ist.7, 8 Sollte es gelingen, diese Stärken mit dem analytischen Potenzial der mehrfach geladenen Ionen zu vereinen, würden neue instrumentelle Konfigurationen und Proteomanalysen von größeren Ausmaßen basierend auf der MALDI-MS(/MS) möglich werden.
In früheren Arbeiten wurden Vorteile der flüssigen Matrizes in der IR- und UV-MALDI-MS gezeigt.9–11 Für die flüssige UV-MALDI-MS gehören zu diesen eine stabile und langanhaltende Analytionenausbeute über Tausende von Laserschüssen und die Möglichkeit, leicht Additive hinzugeben zu können, die die Eigenschaften der MALDI-Probe positiv verändern können. Es hat sich gezeigt, dass diese Eigenschaften der flüssigen Matrizes für eine hochgenaue Analytquantifizierung11 und zur Einstellung eines erweiterten pH-Wertebereichs der MALDI-Probe12 genutzt werden können. Letzteres ermöglicht es, tryptische Verdaue in der MALDI-Probe durchzuführen und die Verdauprodukte direkt durch die Massenspektrometrie nachzuweisen.
Weiterhin wurde gezeigt, dass atmosphärische (AP)-MALDI, obwohl bei niedrigerer Empfindlichkeit und durch die Verwendung eines Infrarotlasers, die Bildung von mehrfach geladenen Protein- sowie Peptidionen ermöglicht.13 Zweifach geladene Peptidionen wurden auch unter Feinvakuum mit der UV-MALDI-MS und unter Hochvakuum mit der IR-MALDI-MS detektiert, jedoch mit viel geringerer relativer Intensität als einfach geladene Ionen.14 In der gleichen Veröffentlichung wurde auch die Möglichkeit der Erzeugung mehrfach geladener Ionen mit einer höheren Ausbeute durch Veränderung des Designs der Matrix und der Ionenquelle diskutiert. Zenobi et al. berichteten später über alternative MALDI-Probenpräparationsmethoden, um die Ausbeute an mehrfach geladenen Ionen zu erhöhen. Eine dieser Methoden setzte Elektrospraydeposition von ≥200 pmol Analyt auf verschiedenen vorgefertigten MALDI-Matrixschichten ein. Diese Ergebnisse zeigten, dass unter bestimmten Bedingungen hoch geladene Insulin-Ionen detektiert werden können, allerdings bei niedrigem Signal-Rausch-Verhältnis.15
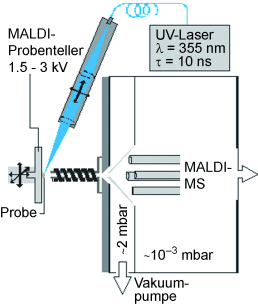
Hier berichten wir über Fortschritte hinsichtlich des Erreichens hoher und andauernder Ionenausbeuten von mehrfach geladenen Peptid- und Proteinionen durch die Verwendung von flüssigen UV-MALDI-Matrizes und einer AP-Ionenquelle mit einem Ionentransferröhrchen, das bei variablen, erhöhten Temperaturen von bis zu 400 °C betrieben werden kann. Die in dieser Studie verwendeten flüssigen Matrizes basieren entweder auf der 2,5-Dihydroxybenzoesäure (DHB) oder auf der α-Cyano-4-hydroxyzimtsäure (CHCA) unter Zusatz von Glycerin und Triethylamin in verschiedenen Konzentrationen. Die verwendete Laseroptik und das Design der Ionenquelle, zusammen mit einer maximalen Laserenergie auf dem Probenteller von rund 10 μJ, ermöglichten eine erreichbare maximale Fluenz von <2000 J m−2. Im Vergleich zur Laserspray-Ionisation (LSI), einer kürzlich eingeführten Methode zur laserinduzierten Bildung mehrfach geladener Ionen, liegt dieser Wert um mehr als eine Größenordnung unterhalb des berichteten LSI-Fluenzbereichs von 40–150 kJ m−2.16, 17 Ein großer Nachteil der LSI-Bestrahlungsbedingungen ist der in der Regel rasche Verbrauch der Probe. In der hier beschriebenen Studie wurden jedoch mehrfach geladene Ionen mit Laserenergien von rund 1 µJ erzeugt, was einer Fluenz von <200 J m−2 entspricht und innerhalb des Bereichs von typischen UV-MALDI-MS-Fluenzen18 und mehr als zwei Größenordnungen unter dem berichteten LSI-Fluenzbereich liegt. Somit konnte ein kontinuierlicher Analytionennachweis über Zehntausende von aufeinanderfolgenden Laserschüssen bei gleichzeitig geringem Probenverbrauch erreicht werden.
In diesen ersten Messungen konnte bislang gezeigt werden, dass Analytmengen aus dem mittleren Femtomolbereich ausreichend sind, um überwiegend mehrfach statt einfach geladene Ionen mit einem stabilen Analytionensignal über bis zu 36 000 Laserschüsse (d. h. über eine 1-stündige Datenaufnahme) zu erzeugen. Die Ionenladungszustände variierten in Abhängigkeit von der genauen Zusammensetzung der flüssigen MALDI-Matrix, und die Alkalikationisierung wurde mit zunehmendem Ladungszustand geringer, während beträchtliche Signale aufgrund von Matrixadduktionenbildung nur bei einfach geladenen Ionen detektiert wurden.
Abbildung 1 zeigt ein AP-UV-MALDI-Massenspektrum von MK-Bradykinin (Sequenz: MKRPPGFSPFR), das mithilfe einer flüssigen Matrix aufgenommen wurde. Es zeigt einfach, zweifach und dreifach geladene Analytionen. Die Adduktionenbildung war generell weit geringer für die mehrfach als für die einfach geladene Ionen. Wie in Abbildung 1 zu sehen ist, gab es keine signifikanten Adduktionen für die dreifach geladenen MK-Bradykinin-Ionen, während für die einfach geladenen Ionenspezies signifikante Mengen an Analyt/Kationen-Clustern mit Alkalimetallen und Matrix-Chromophorverbindungen detektiert wurden. Das weitgehende Fehlen von Adduktionen für die mehrfach geladenen Ionen ist eine wichtige Beobachtung, da flüssige MALDI-Proben typischerweise eine gute Quelle von Salzkationen darstellen und damit in der Regel eine Kationenadduktbildung unterstützen.
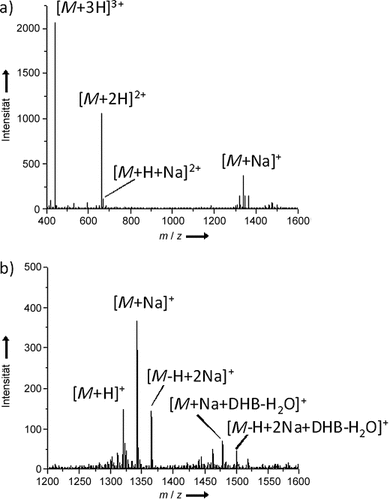
AP-UV-MALDI-Massenspektrum von MK-Bradykinin (MKRPPGFSPFR), das den m/z-Bereich a) von 400 bis 1600 und b) von 1200 bis 1600 zeigt. Matrix: DHB-basierte Flüssigmatrix mit ca. 20 % Glycerin vor der Verdampfung volatiler Lösungsmittel.
Wie erwartet erleichtert die Bildung mehrfach geladener Peptidionen deren Fragmentierung und somit deren Sequenzierung. Abbildung 2 zeigt die CID-MS/MS-Fragmentionenspektren der zwei- und dreifach geladenen MK-Bradykinin-Ionen. Im Allgemeinen sind diese Fragmentionenspektren, die hauptsächlich b- und y-Typ-Ionenserien und einige andere assoziierte Fragmentionen sowie Iminiumionen offenbaren, den CID-MS/MS-Spektren von zwei- und dreifach geladenen Peptidionen anderer sanfter Ionisationsmethoden wie der ESI ähnlich.
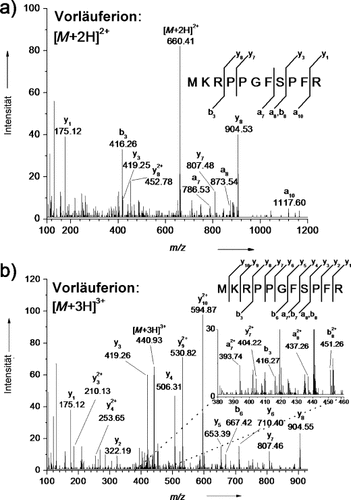
AP-UV-MALDI-CID-MS/MS-Spektren der a) zweifach und b) dreifach protonierten MK-Bradykinin-Ionen. Matrix: DHB-basierte Flüssigmatrix mit ca. 20 % Glycerin vor der Verdampfung volatiler Lösungsmittel. CID-Kollisionspotentiale: a) 35 V und b) 20 V.
Obwohl die Bildung von mehrfach geladenen Ionen dominierte, war es möglich, wie bei der ESI für Analyte im niedrigen Massenbereich erhebliche Mengen von einfach geladenen Ionen zu detektieren. Es sollte jedoch betont werden, dass es in allen untersuchten Fällen, in denen die hier beschriebenen flüssigen Matrizes eingesetzt wurden, einfacher war, den Analyten als mehrfach anstatt einfach geladene Ionenspezie zu detektieren. Dies ist auch in den Ergebnissen von zwei Optimierungsexperimenten ersichtlich. Das erste wurde durchgeführt, um die Temperatur des Ionentransferröhrchens hinsichtlich der höchsten Ionenausbeute an mehrfach geladenen Analytionen zu optimieren (siehe Hintergrundinformationen, Abbildung S1). Neben der Ermittlung der optimalen Temperatur von 200–250 °C für die flüssige Matrix 1-3-5-10 (siehe Experimentelles), offenbarten die Daten auch, dass die Bildung von einfach geladenen Ionen weit weniger stark von der Temperatur beeinflusst ist als die Bildung von mehrfach geladenen Ionen. Dies kann auch in der zweiten Untersuchung gesehen werden, in der die optimale Menge an Glycerin in der flüssigen Matrix bestimmt wurde (Abbildungen S2 und S3). Hier nimmt sogar das Signal der einfach geladenen Ionen ab, während die Ausbeute der mehrfach geladenen Ionen ansteigt. Für alle untersuchten flüssigen Matrizes galt, dass Glycerin (oder besser die Liquidität der Probe) ein wesentlicher Faktor für die Bildung von mehrfach geladenen Ionen war. Typischerweise erschien eine ausreichende Menge an Glycerin, das eine vollständig flüssige MALDI-Probe garantierte, am besten. Zugabe weiterer Mengen an Glycerin führte schließlich zu einer Abnahme der mehrfach geladenen Ionensignale, vermutlich aufgrund der verringerten optischen Absorption und eines Analytverdünnungseffekts, während eine geringere Menge an Glycerin zur (teilweisen) Kristallisation der festen Matrix-Komponenten führte, die gleichzeitig mit einer Abnahme der Detektion von mehrfach geladenen Ionen einherging.
Eine Änderung der Zusammensetzung der flüssigen Matrizes scheint drastische Auswirkungen auf die detektierbaren Ladungszustände und deren Verteilung zu haben. Für Melittin ermöglicht die 1-1-10-Matrix (siehe Experimentelles) nur die Detektion der zweifach geladenen Ionen, während die DHB-basierte flüssige Matrix (siehe Experimentelles) den Nachweis der drei- und vierfach geladenen Ionen ermöglicht, mit vernachlässigbarem Signal für die zweifach geladenen Ionen (Abbildungen S2 und S3). Die Fähigkeit der DHB-basierten flüssigen Matrix, höhere Ladungszustände erzeugen zu können, wurde auch für MK-Bradykinin beobachtet.
Einer der Vorteile von flüssigen MALDI-Proben ist die relativ stabile Ionenausbeute und die Integrität des Probenspots während der Laserablation aufgrund der “selbstheilenden” Eigenschaften der Flüssigkeit. Abbildung 3 zeigt das MALDI-MS-Spektrum und Gesamtionenchromatogramm (total ion chromatogram; TIC) von 1800 Scans (30-minütige Datenaufnahme) einer Melittin-Probe, die mithilfe einer DHB-basierten flüssigen Matrix analysiert wurde. Das EIC (extracted ion chromatogram) für die [M+4 H]4+-Melittin-Ionen zeigt eine ähnlich stabile Ionenausbeute, und Spektren, die nur aus der Summation der Scans von der ersten Minute generiert wurden, waren nahezu identisch mit den Spektren der letzten Minute (Abbildung S4). In diesem Fall wurden 500 fmol Melittin und eine Laserpulsfrequenz von 10 Hz verwendet, d. h. 18 000 Laserschüsse für die gesamte Datenaufnahme. Der Analytverbrauch pro Laserschuss lässt sich somit zu durchschnittlich <30 amol abschätzen. Stichproben der einzelnen Scans über die gesamte Datenaufnahme zeigten, dass jeder Scan (1 s, 10 Laserschüsse) ein für die eindeutige Detektion der mehrfach geladenen Ionen ausreichendes Signal-Rausch-Verhältnis aufwies.
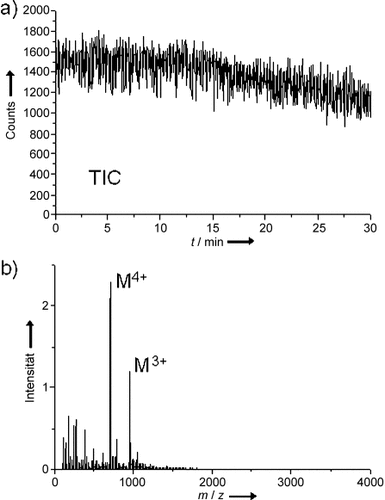
a) Gesamtionenchromatogramm (TIC) einer 30-minütigen MALDI-MS-Datenaufnahme unter der Verwendung einer flüssigen Probe mit einer Gesamtmenge von 500 fmol Melittin. b) AP-UV-MALDI-Massenspektrum der Summe aller Scans der obigen Datenaufnahme. Matrix: DHB-basierte Flüssigmatrix mit ca. 20 % Glycerin vor der Verdampfung volatiler Lösungsmittel. Laserpulsfrequenz: 10 Hz.
Die niedrigste Analytmenge, die bislang erfolgreich analysiert wurde, war 50 fmol Melittin direkt auf dem Probenteller präpariert (Abbildung S5). Andere Analyte, die getestet wurden, waren Insulin und Myoglobin (Abbildung 4). Die aufgenommenen Verteilungen der Ladungszustände dieser drei Analyte erscheinen sehr schmal. Es kann angenommen werden, dass die Erzeugung von spezifischen Ladungszuständen und ihrer Verteilungen aufgrund der Wahl der Matrix sehr unterschiedlich sein können und sich auch von denen der ESI unterscheiden. Jedoch sind einige der Effekte möglicherweise auf Veränderungen des pH-Wertes, der Lösungsmittel oder Tenside sowie der Extraktionsspannung und der Temperatur des Ionentransferröhrchens zurückzuführen. Diese sind vergleichbar mit Effekten, die schon für die ESI beschrieben wurden.19–22
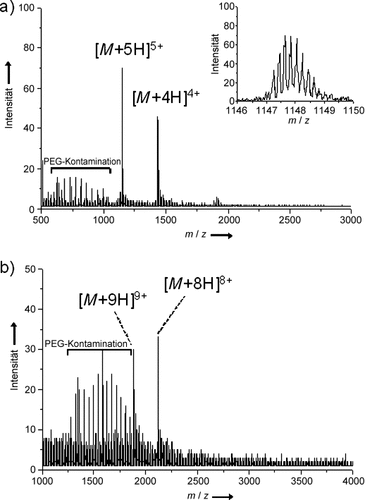
a) AP-UV-MALDI-Massenspektrum von 5 pmol Insulin vom Schwein. Matrix: DHB-basierte Flüssigmatrix mit ca. 15 % Glycerin vor der Verdampfung volatiler Lösungsmittel. b) AP-UV-MALDI-Massenspektrum von 5 pmol Myoglobin vom Pferd. Matrix: CHCA-basierte 1-1-10-Flüssigmatrix mit ca. 30 % Glycerin vor der Verdampfung volatiler Lösungsmittel. pH-Wert: >7 (bestimmt mittels pH-Testpapier). Die detektierten [M+8 H]8+- und [M+9 H]9+-Analytionen können der Apo-Form des Myoglobins zugeordnet werden. In beiden Spektren sind auch verschiedene Polyethylenglycol(PEG)-Verunreinigungen erkennbar (möglicherweise aufgrund ungünstiger Lagerbedingungen der beiden Proben als verdünnte Lösungen in Plastikgefäßen über zwei Jahre).
Experimentelles
Der erste Schritt bei der Herstellung der MALDI-Matrizes war die Zugabe von 20–100 mM Ammoniumphosphat/Methanol (1:1, v:v) in einem Verhältnis von 10:1 (v[μl]:w[mg]) zur festen UV-Matrixverbindung DHB oder CHCA. Für die DHB-basierten flüssigen Matrizes wurde Glycerin zugesetzt, und die resultierende Mischung wurde gründlich gevortext und dann für 5–10 min einem Ultraschallbad ausgesetzt. Für die CHCA-basierte flüssige Matrix 1-1-10 wurde Triethylamin unter Verwendung eines Zehntels des Volumens des Ammoniumphosphat/Methanol-Lösungsmittels zugegeben und gevortext. Anschließend wurden verschiedene Mengen an Glycerin zugegeben, während die CHCA-basierte 1-3-5-10-Matrix spezifisch durch die Zugabe von Triethylamin unter Verwendung von 30 % des Volumens des Ammoniumphosphat/Methanol-Lösungsmittels und einem weiteren Zusatz von Glycerin mit einem 50%-Volumen hergestellt wurde. Nach jeder Zugabe wurde die Mischung gründlich gevortext und dann für 5–10 min einem Ultraschallbad ausgesetzt. Peptide und Proteine wurden zu Konzentrationen von 10−7–10−3 M in Wasser gelöst. MALDI-Proben wurden direkt auf dem Edelstahlprobenteller durch das Auftragen von 0.5–1 μL der Analytlösung und anschließendes Auftragen von 0.5–1 μL der Matrixlösung hergestellt. Die Proben wurden in normaler Laborumgebung für 15–30 min liegen gelassen, um eine Verdampfung der flüchtigen Lösungsmittelkomponenten zu ermöglichen.
Massenspektren wurden an einem modifizierten Q-Star Pulsar i (AB Sciex, Toronto, Kanada) mit einer maßgeschneiderten AP-MALDI-Quelle, die auf einem zuvor berichteten Design beruht,23 aufgenommen. Details der Quelle befinden sich in den Hintergrundinformationen. Sofern nicht anders angegeben, wurden die Massenspektren mit einer Ionentransferröhrchen-Temperatur von 225 °C durch Akkumulation von ca. 60 Scans mit einer Scan-Zeit von 1 s aufgezeichnet.