Potenzial von Membranen zur verbesserten Reaktionsführung von Selektivoxidationen: Katalysator-, Reaktor- und Prozessebene Potential of Membranes for Process Intensification of Selective Oxidations on Catalyst, Reactor and Total Process Level
Herrn Prof. Dr. rer. nat. Jürgen Caro zum 70. Geburtstag gewidmet
Abstract
deDie Selektivität und Ausbeute gewünschter intermediärer Produkte ist oft thermodynamisch und kinetische begrenzt. Alternative Synthese- und Prozessführungen sind nötig und gewinnen vor dem Hintergrund der Rohstoff- und Energiewende zusätzlich an Bedeutung. Jürgen Caro hat hierzu systematisch Pionierarbeit in Form der membranunterstützten Reaktionslenkung und Prozessintensivierung geleistet. In diesem Beitrag wird eine hierarchische Betrachtung membranunterstützter Reaktionsprozesse auf den drei Ebenen Katalysator, Reaktor und Prozess vorgestellt. Zur Illustration werden vier heterogen katalysierte Selektivoxidationen analysiert. Die Reaktionskinetik nimmt dabei eine Schlüsselrolle ein, um durch membranunterstützte Reaktionsführung optimale Konzentrationsprofile einzustellen. Durch die abschließende Betrachtung der gesamten Prozessebene inkl. Rückführungsstrategien wird das signifikante Verbesserungspotenzial mittels Membranreaktoren aufgezeigt.
Abstract
enSelectivity and yield of desired intermediate products are of often limited by thermodynamics and reaction kinetics. Alternative syntheses and processes are gaining in importance against the background of sustainable material and energy use. Jürgen Caro has systematically pioneered membrane-assisted reaction control and process intensification. This paper presents a hierarchical study of membrane-assisted reaction processes on the three levels catalyst, reactor and process. For illustration, four heterogeneously catalyzed selective oxidations are considered. It is shown that the reaction kinetics plays a key role adjusting optimal concentration profiles by membrane-assisted reaction control. Finally, by considering the total process level, including feedback strategies, the significant potential for improvement using membrane reactors is demonstrated.
1 Einführung und Illustration des Selektivitäts-Umsatz-Problems
-
Die Reaktionsgeschwindigkeiten chemischer Reaktionen sind für eine wirtschaftliche Nutzung oft zu gering.
-
Erreichbare Umsätze sind oft thermodynamisch limitiert.
-
In Reaktionsnetzwerken sind die Selektivitäten und Ausbeuten zu gewünschten Zielprodukten begrenzt.
-
Die mit der Durchführung verbundene Energieeffizienz ist nicht ausreichend.
In Anbetracht dieser offenen Probleme wurden in den letzten Jahrzehnten zahlreiche neue Ansätze und innovative Reaktorkonzepte vorgeschlagen und entwickelt 3-7. Ein breit und intensiv erforschtes Konzept zielt dabei auf den Einsatz von Membranen, um Komponenten selektiv aus Reaktionsräumen zu entfernen („Extraktor”) oder in den Reaktionsraum zu dosieren („Distributor”). Weiterhin wurde die Möglichkeit entwickelt, katalytisch aktive Membranen einzusetzen („Kontaktor”).
Zur Entwicklung von Membranreaktoren hat insbesondere Jürgen Caro mit seiner Arbeitsgruppe und in zahlreichen Kooperationen durch systematische Forschung wesentliche Beiträge geleistet. Hier sei lediglich auf einige seiner wesentlichen Ergebnisse hingewiesen. So konnte er u. a. zeigen, dass durch den Einsatz dichter Palladium-Membranen beim Steamreforming ein gezielter Abzug von gebildetem H2 möglich ist 8 sowie durch Einsatz von O2-selektiven Perowskitmembranen in Partialoxidationen die Selektivität bezüglich der Bildung von Intermediaten 9-17 signifikant erhöht werden kann.
Jürgen Caro hat sich weiterhin intensiv dem Einsatz von Zeolithmembranen zur Prozessintensivierung in Mikromembranreaktoren und mikrostrukturierte Membranreaktoren gewidmet. Betrachtet wurden beispielsweise die selektive Abtrennung von Wasser, Wasserstoff, Alkohol, p-Xylol sowie die aktuell so breit untersuchte Problematik der CO2-Abtrennung 14, 18. In den neuesten Arbeiten wurden die Synthese von Dimethylether aus Methanol 19 und die Aufreinigung von H2 20 untersucht, die von großer Bedeutung für den bevorstehenden Energie- und Rohstoffwechsel sind. Erwähnt seien auch Untersuchungen zur membranbasierten Aufreinigung von Antibiotika, welche die Breite der Arbeiten von Jürgen Caro aufzeigen 21. In einem Übersichtsartikel gab Caro unter dem Titel „Quo Vadis, MOF?” 22 einen Überblick über Membranentwicklungen in der letzten 30 Jahren und zum Entwicklungsstand von metal organic frameworks (MOFs).
Die Problematik begrenzter Selektivitäten und Ausbeuten stellt für den Fall des Vorliegens komplexer Reaktionsnetzwerke eine besonders schwierige Aufgabe dar. Liegen mehrere Parallel- und Folgereaktionen vor, in denen z. B. aus einem wertvollen Reaktanden (A) außer dem gewünschten Zielprodukt (C) auch unerwünschte Nebenprodukte (NP) gebildet werden, spielt neben der gewünschten Maximierung des Umsatzes des Reaktanden (XA) die Steuerung der Reaktionen in die gewünschte Richtung eine entscheidende Rolle. Bei günstiger Reaktionsführung kann eine Produktion von Nebenprodukten und damit ihre aufwendige und kostenintensive Abtrennung vermieden und damit zur Nachhaltigkeit beigetragen werden 23. Eine Verschaltung von Reaktor und Trennapparat ist in Abb. 1 illustriert.
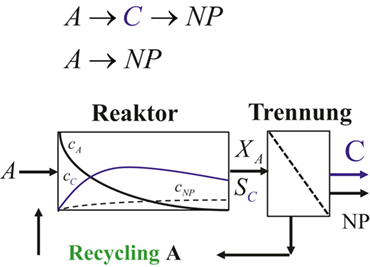
Laufen, wie in Abb. 1 dargestellt, simultan eine Folge- (A→C→NP) und eine unerwünschte Nebenprodukte bildende Parallelreaktion (A→NP) ab, ist eine an die Reaktionskinetik angepasste optimale Konzentrations- und Temperaturführung zur Maximierung der Selektivität/Ausbeute zu realisieren 3. Lässt sich das in Abb. 1 gebildete gewünschte Produkt C kostengünstig vom Ausgangsstoff A abtrennen, kann ein niedriger Umsatz verbunden mit einem hohen Rücklauf von A attraktiv sein. Der Umsatz ist dann von untergeordneter Bedeutung und vor allem die Selektivität ist zu maximieren, um die zugeführten Rohstoffe effizient zu nutzen.
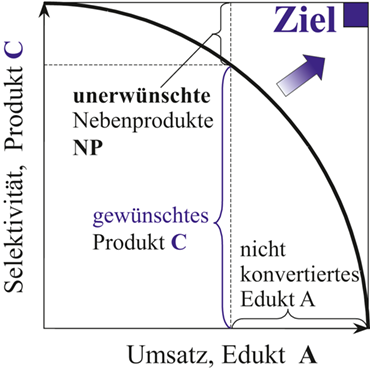
Selektiv- bzw. Partialoxidationen unterliegen dem klassischen Selektivitäts-Umsatz-Problem, die Hodnett 24 für die Oxidation einer großen Zahl kurzkettiger Kohlenwasserstoffe (u. a. Alkane zu Alkenen) diskutiert. Weitere Beispiele interessanter Selektivoxidationen zu technisch bedeutsamen aktivierten Olefinen und Oxo-Produkten geben 16, 25-30. Ziel ist es, eine maximale Selektivität an gewünschten intermediären Produkten (z. B. Alkene) zu realisieren. Die Selektivität ist jedoch begrenzt (Abb. 2), da Parallel- und Folgeoxidationsreaktionen simultan ablaufen. Die unerwünschten Nebenprodukte (Kohlenstoffoxide) reduzieren die Zielproduktselektivität (SC), wie Abb. 1 für Komponente C mit einem typischen Intermediatverhalten illustriert. Prozessziel ist es, möglichst nahe an die rechte obere Ecke des in Abb. 2 dargestellten Selektivitäts-Umsatz-Diagramms heranzukommen (dream corner). Dies ist charakterisiert durch einen Umsatz und eine Selektivität von 100 %. Die unterhalb der Kurve liegende attainable region ist explizit von der Reaktionskinetik abhängig 31, 32.
-
Katalysatorebene: Selektivitätsverbesserung durch andere Katalysatoren
-
Reaktorebene: Beeinflussung der Selektivität durch gezielte Eduktdosierung
-
Prozessebene: Beeinflussung der Selektivität durch Recyclingstrategien
Auf jeder Ebene besteht das Potenzial zur Steigerung von Umsatz und Selektivität.
Im Folgenden wird zunächst kurz auf die Katalysatorebene eingegangen. In Hinblick auf die Reaktorebene werden dann Konzepte zur verteilten Dosierung in Membrandistributoren untersucht (Abb. 3). Dabei kann neben etablierten mehrstufigen Temperaturführungsstrategien ein lokal oder temporär steuerbarer Stoffstrom einer Komponente i (ji) als zusätzlicher Freiheitsgrad genutzt werden 3, 32.
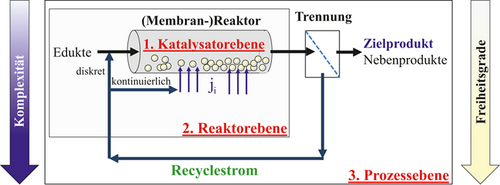
Bei abschließender Betrachtung des Gesamtprozesses eröffnet sich dann auf Prozessebene die zusätzliche Möglichkeit, die Selektivität durch Recyclingstrategien weiter zu beeinflussen. Eine kontinuierliche, verteilte Rückführung nicht konvertierter Reaktanden gestattet, die im Reaktor vorliegenden Konzentrationsprofile zielgerichtet zu beeinflussen. Durch Einstellung des Rücklaufverhältnisses und der Konzentrationen der Komponenten im Rücklaufstrom entstehen neue Freiheitsgrade. Dabei können Konzentrationsbeeinflussungen der lokalen Reaktionsgeschwindigkeiten verstärkt werden, die sich durch eine alleinige Optimierung des Reaktionssystems auf Katalysator- oder Reaktorebene nicht realisieren lassen.
2 Bilanzen und Selektivitäten
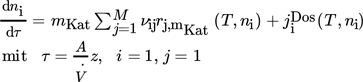 ()
()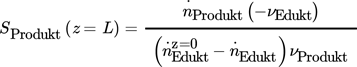 ()
()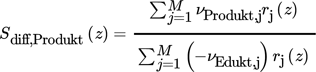 ()
()Sdiff ist damit von der temporär bzw. lokal vorhandenen Konzentration und der Temperatur im Reaktor abhängig und daher eine Zustandsfunktion, deren Änderung entlang der Reaktionskoordinate (Länge L) durch die Reaktionsgeschwindigkeiten definiert ist.
3 Beeinflussung der Selektivität auf Katalysatorebene
Hier berichten wir kurz über eigene Ergebnisse der Untersuchung der heterogen katalysierten oxidativen Dehydrierung (ODH) und der Partialoxidation (POX). Durch die aktive Doppelbindung gehört Propen neben Ethen zu den bedeutendsten Primärprodukten in der Petrochemie und ist Ausgangsstoff für eine Vielzahl organischer Verbindungen, insbesondere für Kunststoffprodukte 23. Gegenwärtig wird großtechnisch kein Verfahren zur oxidativen Dehydrierung realisiert. Konventionelle Cracker der Erdölraffinerien produzieren Ethen und Propen noch wirtschaftlicher und in großen Mengen, z. B. aus Naphtha 35. Im Sinne der Nachhaltigkeit und Substitution der petrochemischen Rohstoffbasis gewinnen gegenwärtig alternative Verfahren erheblich an Bedeutung 36.
Die in Abb. 4 illustrierten Reaktionsnetzwerke für die ODH von Ethan und Propan entsprechen in ihrer Struktur simultan ablaufenden Parallel- und Folgereaktionen und sind bezüglich der Nebenproduktbildung überschaubar. Eine theoretische Betrachtung auf Reaktor- und Prozessebene als Modellsysteme wird somit signifikant vereinfacht 37 und eine Übertragbarkeit auf weitere Selektivoxidationen ist gegeben 29, 38-45. Das Reaktionsnetzwerk für die ODH von Ethan (Abb. 4a) wurde in detaillierten kinetischen Laborstudien in 37, 46-49 ermittelt. Das Reaktionsnetzwerk der ODH von Propan in Abb. 4b) ist an Untersuchungen von 50, 51 mit vergleichbaren Katalysatoren angelehnt und konnte durch eigene Studien bestätigt werden 6, 38, 41, 47, 49. In allen Reaktionen tritt Sauerstoff als Reaktand auf. Bei der gewünschten Reaktion, r1, handelt es sich um eine Selektivoxidation des Alkans zum gewünschten Alken 24. Die Parallelreaktion, r2, limitiert die erreichbare Alkenselektivität. Weiterhin reduzieren die unerwünschten Folgereaktionen, r3–r5, die Selektivität am gewünschten Intermediärprodukt Ethen bzw. Propen.
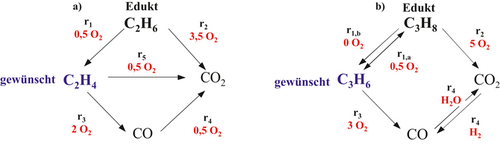
Zum gewünschten Intermediat Propen führt simultan die endotherme thermische Dehydrierung r1,b. Letztere wird durch Anwesenheit von Sauerstoff thermodynamisch gehemmt, d. h. ein signifikanter Einfluss liegt erst bei hoher Temperatur bzw. Sauerstoffmangel vor 51. Nach Abb. 4 ist Reaktion r4 durch einen reversiblen Mechanismus bestimmt. Die Reaktion r1 ist nach 36 hoch selektiv für Propen. So besitzt die ODH von Propan eine wirtschaftliche Applikation.
Ziel einer lokalen Steuerung der Reaktionsgeschwindigkeiten r(t, z) ist es, möglichst viel Alkan umzusetzen, um das in Abb. 1 geschilderte Trennproblem zu minimieren und die Selektivität auf Katalysatorebene gleichzeitig zu maximieren, und so Nebenprodukte wie CO/CO2 zu reduzieren. Folglich nähert man sich der dream corner im Selektivitäts-Umsatz-Diagramm in Abb. 2 an. Vor diesem Hintergrund ist die Identifikation eines Katalysators mit hoher Selektivität essenziell. Die Identifikation eines Katalysators mit maximaler Selektivität/Aktivität erfolgt am Modellsystem der ODH von Ethan und wird auf Propan übertragen. In Abb. 5 sind die Selektivitäts-Umsatzdiagramme für die Übergangsmetalloxide V, Fe, Cr, und Mn sowie für den undotierten Träger γ-Al2O3 als Ergebnis von Aktivitätsmessungen dargestellt 6, 37. Die höchste Performance wird für das Übergangsmetalloxid V (Abb. 5a) beobachtet und für die weiteren Betrachtungen auf Reaktor- und Prozessebene als geeignetes System ausgewählt. Der reine Träger γ-Al2O3 katalysiert bei T > 500 °C unabhängig die Totaloxidation durch die Parallelreaktion 2. Der Selektivität zum Zielprodukt sind somit Grenzen gesetzt. Da in der Reaktion 2 aber stöchiometrisch mehr Sauerstoff als in der gewünschten Reaktion der Ethenbildung benötigt wird, ist durch Absenkung der lokalen O2-Konzentration durch eine geeignete Reaktionsführung mittels Membrandistributoren auf Reaktor- bzw. Prozessebene eine Steigerung der Selektivität gegeben, die in den Folgekapiteln diskutiert werden soll.
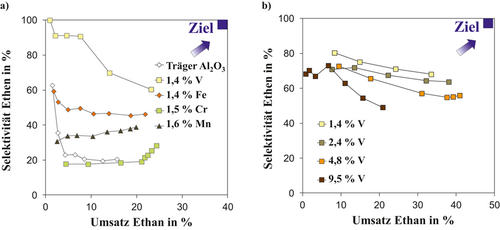
Mit der Auswahl von Vanadium als aktives Übergangsmetall stellt dessen Dotierungsgrad einen weiteren Freiheitsgrad dar. V2O5 ist unzureichend aktiv. Bei geringen Beladungen kommt es zur Ausbildung von 2D-Vanadat-Mono-Schichten, die sich durch eine hohe Dispersion an V bzw. eine hohe katalytische Aktivität auszeichnen, während eine sehr hohe Dotierung mit V (größer 6) Agglomerate mit 3D-V2O5-Kristallen katalytisch geringerer Aktivität ausbildet 6, 52, 53 (Abb. 5b). Mit steigendem V-Gehalt steigt der Ethanumsatz von 1,4 % auf 4,8 % an, während er bei 9,5 % V bereits unterhalb dessen von 1,4 % liegt. Korrespondierend zur Umsatzerhöhung mit steigender V-Dotierung sinkt die Ethenselektivität für 2,4–9,5 % V. Eine Dotierung mit 1,4 % V führt zu einem hohen Dispersionsgrad bzw. hoher katalytischer Aktivität und wird für die Betrachtung der Reaktor- und Prozessebene mit Recycling als Modellkatalysator ausgewählt.
4 Beeinflussung der Selektivität durch Dosierung auf Reaktorebene
Im Folgenden soll ausführlicher die Erhöhung der Selektivität auf Reaktorebene durch gezielte Einstellung lokaler Konzentrationsprofile unter Verwendung von Membranen am Beispiel der ODH von kurzkettigen Alkenen beschrieben werden. Membranreaktoren gehören zur Klasse der reaktiven Trennverfahren, die chemische Reaktion und membranbasierte Stofftrennung in einem technischen Apparat vereint 54. Damit werden sie den multifunktionalen Reaktoren zugeordnet 2, da zur eigentlichen Reaktion eine weitere Grundoperation in einem Reaktionsraum integriert wird 4, 55. Die Kopplung von Membran und Reaktor erlaubt eine multiple Anzahl von Konfigurationen entsprechend der Funktion der Membran. Diese können in Extraktoren zur selektiven Produktentfernung, in Kontaktoren zur kontrollierten Kontaktierung der Edukte und in Distributoren zur verteilten Reaktandendosierung differenziert werden 5, 6, 47-49, 56. Diese Klassifikation ist etabliert und wird auch in einschlägigen Übersichtsartikeln 57-63 verwendet. Der in Abb. 6 illustrierte Distributor mit asymmetrischer Al2O3-Membran benötigt im Gegensatz zu Extraktoren keine selektive Membran. Die Anforderungen an das Membranmaterial sind somit nach Caro wesentlich geringer als bei Zeolithen, Perowskiten und MOFs (9, 13, 18, 22. Der Distributor ermöglicht eine getrennte Reaktandenzufuhr (hier CnHm und O2), wobei O2 in den Reaktionsraum über die Membranlänge dosiert werden soll. Durch die verteilte Dosierung wird die lokale O2-Konzentration abgesenkt und die Folgereaktion des gewünschten Intermediats CnHm–2 zum unerwünschten Folgeprodukt CO/CO2 minimiert 6, 38, 39, 41, 58, 64-68.
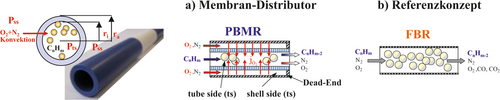
Als Membranmaterialien kommen insbesondere Polymere 69, 70, Gläser 71, 72, Metalle 73, 74 und Keramiken/Zeolithe/Mischoxide 19, 75-77, Ionische Flüssigkeiten 78, 79 und MOFs 22 in Betracht.
Im Folgenden soll der Einsatz von Distributoren zur kontrollierten Sauerstoffzufuhr mittels poröser, asymmetrischer Al2O3-Membranen diskutiert werden. Das Problem der Kompatibilität von Membran und Reaktion ist dabei von großer Bedeutung 41: Die Schwierigkeit, diese zu erreichen, limitiert bisher den Einsatz von Membranreaktoren 6, 80, 81. In diesem Beitrag wurde für eine verteilte Dosierung von O2 eine asymmetrische α-Al2O3-Membran im Pilotmaßstab (Inocermic, Länge: 350 mm, permeable Zone: 104 mm, ri = 10,5 mm, ra = 16 mm) mit einem mechanisch stabilen Träger (dPore: 3 μm; Dicke: 5,5 mm), zwei Zwischenschichten (dPore: 1/60 nm; Dicke: 25 μm) und der Trennschicht (dPore: 10 nm; Dicke: 2 μm) betrachtet. Eine Charakterisierung hinsichtlich Morphologie und Stofftransport erfolgte in 82, 83.
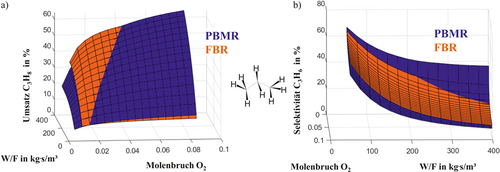
Auf der Grundlage der in Abb. 4 eingeführten Parallel- und Folgereaktionsnetzwerke und der ermittelten Reaktionskinetik für die ODH von Propan 6, 38 soll eine Bewertung des Potenzials der verteilten Eduktdosierung in einem einstufigen packed bed membrane reactor (PBMR) als Distributor zunächst durch Simulationsstudien erfolgen. Hierzu wird das 1D-Modell (Gl. 1) eingesetzt 38, 41, 84, 85. In Abb. 7 ist der Umsatz der ODH von Propan illustriert. Dieser zeigt oberhalb eines O2-Molenbruchs von ca. 2 % nahezu unabhängig von der untersuchten Verweilzeit (W/F = weight catalyst/flow rate (s)) einen signifikanten Vorteil für den PBMR. Unterhalb einer Sauerstoffkonzentration von ca. 0,5–1,5 % zeigt der Festbettreaktor (FBR) leicht höhere Umsätze an Propan. In diesem Bereich ist der Membranreaktor aufgrund der verteilten O2-Zufuhr bereits sauerstofflimitiert 84. Dieses Fenster verschiebt sich mit höherer Verweilzeit zu höheren Sauerstoffkonzentrationen. In Abb. 7b weist der Distributor eine höhere Selektivität an gewünschtem Propen im Vergleich zum etablierten FBR im sauerstoffkontrollierten Bereich (xO20 < 3 %) und bei hohen Kontaktzeiten (W/F) auf. Eine Erhöhung der O2-Konzentration im PBMR führt hingegen zu einer Verringerung der Selektivität an gewünschtem Intermediärprodukt aufgrund der dann ablaufenden Folgereaktionen mit höherem stöchiometrischen O2-Bedarf (vgl. Abb. 4). Im Hinblick auf die im nächsten Schritt folgende experimentelle Validierung hat eine Maximierung von Selektivität und Umsatz bei hohen Verweilzeiten (W/F > 300 kg s m−3) und niedrigen O2-Konzentrationen (xO2 < 3 %) deutliches Potenzial 6, 47-49, 85.
Zur experimentellen Untersuchung der verteilten Reaktandendosierung in Distributoren wurde eine Pilotanlage eingesetzt, die im Detail in 6, 84, 85 beschrieben ist. Die experimentellen Befunde sind in Abb. 8 exemplarisch für ein Verhältnis xO20/xC3H80 = 1 veranschaulicht. Des Weiteren sind die Ergebnisse für eine niedrige W/F = 100 und mit 400 kg s m−3 für hohe Verweilzeiten abgebildet. Das in den Simulationsstudien aufgezeigte Potenzial des Distributors (PBMR) kann dabei durch die Experimente validiert werden. Aufgrund des Verweilzeiteffekts ist ein höherer Umsatz an Alkan im PBMR zu verzeichnen, solange Sauerstoff nicht limitierend ist. Diese Aussage kann durch den experimentell ermittelten Propanumsatz für W/F = 400 kg s m−3 bestätigt werden und ist im Bereich eines Sauerstoffüberschusses wesentlich ausgeprägter, wie in 6, 85 gezeigt werden konnte. Für das betrachtete O2/C3H8-Verhältnis von 1 tritt ab einer Reaktionstemperatur von ca. 450 °C bei Propan in Abhängigkeit der Kontaktzeit bereits eine Limitierung durch Sauerstoff ein. Korrespondierend dazu ist hier ein höherer Umsatz im FBR zu verzeichnen. Die Selektivität an Propen kann im Distributor sichtbar, nahezu unabhängig von der Verweilzeit, gesteigert werden, wie der Selektivitäts-Umsatz-Plot verdeutlicht. Eine Verschiebung in die gewünschte obere rechte Ecke im PBMR wird damit nach der Zielstellung (Abb. 2) erreicht.
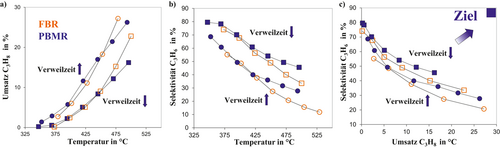
Es werden höhere Propenselektivitäten bei vergleichbaren Alkanumsätzen im Distributor auf Reaktorebene erhalten. Folglich führt eine Verringerung der lokalen O2-Konzentration durch verteilte Dosierung mittels Membranen zur effektiven Reduktion der Folgereaktionen, die zur Bildung unerwünschter Oxidationsprodukte führen 6, 47-49, 65, 66, 85.
5 Selektivitätsbeeinflussung auf Prozessebene durch Recyclingstrategien
Zur Demonstration des Potenzials einer weiteren Prozessverbesserung soll die Beeinflussung und gezielte Steuerung der Selektivität gewünschter Zwischenprodukte auf der Prozessebene am Beispiel heterogen katalysierter Selektivoxidationen betrachtet werden. Dabei wird auf die in Abb. 1 illustrierte Dosierung inkl. Recyclingstrategie zurückgegriffen und für Parallel-/Folgereaktionsnetzwerke zunächst am Beispiel der ODH von Propan durch Modell- und experimentelle Studien bewertet. Eine Bewertung der Übertragbarkeit bzw. eine Verallgemeinerung von Merkmalen dieses Dosierkonzepts mit Recyclingstrategie auf Prozessebene erfolgt dann mittels Simulationsstudien für die Selektivoxidationen von Propan zu Acrolein sowie von n-Butan zu Maleinsäureanhydrid.
5.1 Oxidative Dehydrierung von Propan mit Rückführungsstrategie
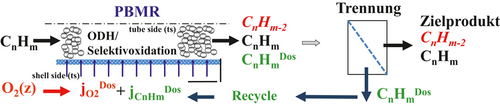
Das Prinzip einer membranbasierten Dosierung mehrerer Edukte inklusive Rückführungsstrategie für die ODH oder Selektivoxidation kurzkettiger Kohlenwasserstoffe ist in Abb. 9 konkretisiert.
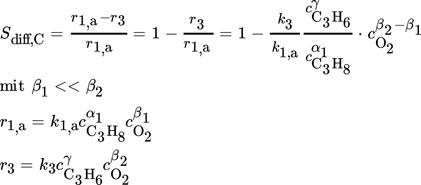 ()
()Danach können die differentielle Selektivität bzw. die lokalen Reaktionsgeschwindigkeiten entlang der Reaktorlänge in einer Folgereaktion durch hohe Konzentrationen an Alkan (CnHm) und niedrige Konzentrationen an Sauerstoff (O2) für den Fall β1 < β2 durch verteilte Dosierung gesteigert werden. Die genaue Kenntnis der Reaktionskinetik, insbesondere die Konstellation der Reaktionsordnungen, ist dabei der Schlüssel für eine verteilte Dosierung. Ein hoher Umsatz an Alkan kann aber nur realisiert werden, wenn die zusätzlich über die Membran dosierte Menge CnHmDos im Kreislauf geführt und in einer nachgeschalteten Trenneinheit (membranbasiert oder über einen thermischen Trennprozess) abgetrennt und recycelt wird. Der Bilanzraum für die integrale Betrachtung von Umsatz und Ausbeute muss demnach die Trenneinheit und die Rückführung beinhalten, um bei einer Dosierung mehrerer Komponenten (d. h. O2 und dem im Kreislauf geführten und zusätzlich über die shell-side (ss) verteilt dosiertem Kohlenwasserstoffstrom CnHmDos) eine signifikante Erhöhung der integralen Selektivität herbeizuführen. Um das beschriebene Dosierkonzept zu bewerten, wurden bezüglich des dosierten Propans folgende Bedingungen verwendet: ts: xC3H8ts,0 = 1 %; ss: CnHmDos ≡ xC3H8ss = 0,25 oder 0,75 xC3H8ts,0 bzw. nach Einführung eines Recyclingverhältnisses R = xC3H8ss/xC3H8ts,0 = 0,25 oder 0,75.
Die Ergebnisse der Simulationsstudien sind in Abb. 10a–c für den PBMR mit bzw. ohne Recycling in 3D-Illustrationen konventionellen FBR gegenübergestellt. Es zeigt sich, dass für niedrige O2-Konzentrationen und hohe Verweilzeiten der Membranreaktor ohne zusätzliche Dosierung von Propan mittels Membran eine leicht höhere Leistung als der konventionelle Festbettreaktor erzielt, solange keine Limitierung des verteilt dosierten Sauerstoffs vorliegt. Demgegenüber führt die zusätzlich verteilte Dosierung von Propan im Distributor und dessen internes Recycling zu einem signifikanten Anstieg des integralen Propanumsatzes, aufgrund der durch die höhere CnHm-Konzentration gesteigerten Reaktionsgeschwindigkeit (r1,a). Das Potenzial des membranbasierten Dosierkonzepts mit Recyclingstrategie nimmt dabei mit Erhöhung der über die shell-side zusätzlich dosierten Menge an Propan (CnHmDos) stetig zu, wie die differentielle Propenselektivität in Abb. 10c aufzeigt. Das betrachtete Konzept offenbart somit die Möglichkeit, die lokale Konzentration von Sauerstoff und Kohlenwasserstoff (Propan) mit dem neuen Reinheitsgrad R optimal einzustellen.
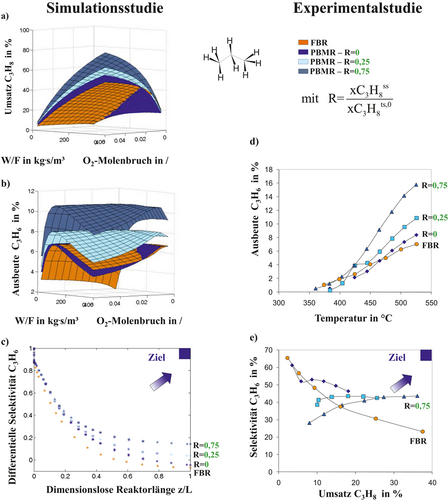
Die sich aus den Simulationsrechnungen ergebenden Trends wurden im Pilotmaßstab experimentell validiert. Um das Konzept einer Dosierung von Sauerstoff und Propan inkl. Propanrecycling technisch zu realisieren, wurde bei –45 °C eine kryogene Trennung von Propan und Propen aufgrund der unterschiedlichen Siedepunkte (ΔT = 6 K) vorgenommen 38. In Abb. 10d ist die experimentelle Propenausbeute als Funktion der Temperatur mit den zwei diskutierten Recyclingverhältnissen R = 0,25 und R = 0,75 illustriert. Wie durch die Simulationen vorhergesagt, steigt die Reaktorleistung eines Distributors mit steigendem Recyclingverhältnis signifikant an. Die lokale O2- und CnHm-Konzentration kann somit positiv Selektivität und Propenausbeute auf Prozessebene beeinflussen, wodurch eine Steigerung der Propanausbeute von 5,5 % (FBR) auf 11 % mit R = 0,75 zu verzeichnen ist. Die höchste Propenausbeute von 16 % wurde im Experiment bei T = 520 °C beobachtet. Hieraus resultiert eine Steigerung der Propenausbeute um den Faktor 2,7 bei eine Recycleverhältnis von R = 0,75 im Vergleich zum konventionellen FBR. Die so erreichten Ausbeuten sind mit denen im Steamcracker bei signifikant niedrigeren Prozesstemperaturen vergleichbar 1. Auch der Selektivitäts-Umsatz-Plot (Abb. 10e) zeigt eindeutig das Potenzial der verteilten Dosierung binärer Reaktandenmischungen mit Recycling. Die dream corner in Abb. 1 rückt durch Minimierung von Nebenprodukten bei maximalem Umsatz deutlich näher, ohne höhere Anforderungen an die Membran selbst zu stellen.
Das Konzept der Nutzung von Membranreaktoren auf Prozessebene unter Einbeziehung einer Rückführungsstrategie soll im Folgenden bzgl. seiner Übertragbarkeit auf weitere Selektivoxidationen bewertet werden. Betrachtet werden die Direktsynthesen von Propan zu Acrolein sowie n-Butan zu Maleinsäureanhydrid unter besonderer Berücksichtigung der spezifischen der Literatur entnommenen Reaktionsordnungen.
5.2 Selektivoxidation von Propan zu Acrolein
Acrolein aus Propan wird gegenwärtig technisch in einem zweistufigen Prozess hergestellt. Primär erfolgt die Bereitstellung von Propen durch konventionelle Steamcracker. In einem sekundären Prozessschritt wird Propen dann zu Acrolein bzw. Acrylsäure als weiteres technisch bedeutendes Zwischenprodukt oxidiert. Aus ökonomischen und ökologischen Gründen ist die Direktsynthese durch selektive Oxidation von Propan über Propen zu Acrolein in einem einstufigen Verfahren eine sehr attraktive Alternative, die technisch aufgrund unerwünschter Folgereaktionen bisher jedoch noch nicht realisiert werden konnte 29. Vor diesem Hintergrund wurde in 29, 44 eine einstufige partielle Oxidation von Propan zu Acrolein im konventionellen Festbettreaktor und im Distributor an einem Ag0.01Bi0.85V0.54Mo0.45O4-Katalysator untersucht. Der Distributor mit ausschließlich verteilter Dosierung von Sauerstoff offenbarte dabei eine signifikante Erhöhung der Selektivität und Ausbeute an Acrolein. Das in 29, 44 verifizierte Reaktionsnetzwerk und die Reaktionskinetik bilden nun den Ausgangspunkt der modellbasierten Untersuchung zur Abschätzung des Potenzials einer verteilten Dosierung von Sauerstoff und Propan inkl. Propanrückführung. Das in Abb. 11 illustrierte Reaktionsnetzwerk folgt in seiner Struktur dem Parallel-/Folgereaktionsnetzwerk der ODH von Ethan und Propan (Abb. 4). In einem einzigen Distributor wird Propan über die Reaktion 1 mit der Rate r1 zu Propen und über die Reaktion 2 mit der Rate r2 zum gewünschten Produkt Acrolein selektiv oxidiert, wobei stöchiometrisch jeweils nur 0,5 mol Sauerstoff benötigt werden. Im Gegensatz dazu ist in Analogie zur zuvor diskutierten ODH von Propan durch unerwünschte Folgeoxidationen zu CO (r4) oder direkt zu CO2 (r6) die Acroleinselektivität deutlich limitiert. Auch der Reaktand Propan selbst kann durch die unerwünschten Parallelreaktionen (r3) zu CO (bzw. r5) zu CO2 totaloxidiert werden. Die unerwünschten Parallel-/Folgeoxidationen benötigen deutlich höhere Mengen an O2, so dass eine Absenkung der lokalen O2-Konzentration durch verteilte Dosierung im Distributor vielversprechend erscheint.
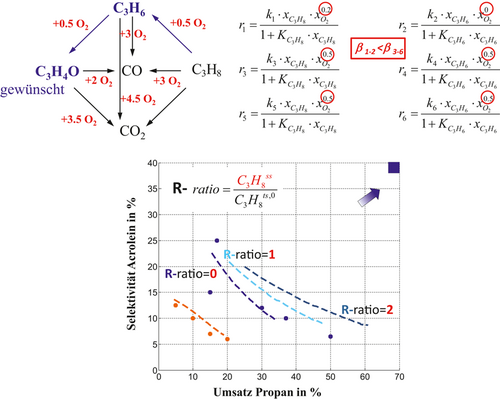
Das Potenzial der verteilten Dosierung lässt sich anhand der Reaktionsordnung des Sauerstoffs wieder abschätzen 6, 66, 86, 87. Die in 44 publizierten kinetischen Ansätze (Abb. 11) zeigen eindeutig, dass die Reaktionsordnungen der gewünschten Reaktionen β1–2 kleiner als die der unerwünschten Reaktionen β3–6 sind, so dass im Distributor eine höhere Selektivität als bei der Dosierung von O2 zu erwarten ist. Diese Aussage kann durch die Ergebnisse der durchgeführten Simulationsstudie für den Distributor ohne (R = 0) und mit Dosierung (R ≠ 0) von Sauerstoff und Propan inkl. Propanrecycling für die Recyclingverhältnisse R = 1 und 2, die in Abb. 11 in Form der Acroleinselektivität als Funktion des Propanumsatzes illustriert sind, eindeutig bestätigt werden. Wie bereits in 29 experimentell beobachtet, liefert der Distributor mit verteilter Dosierung von Sauerstoff (R = 0) signifikant höhere Selektivitäten bei vergleichbaren Propanumsätzen. Wird nun zusätzlich zum Sauerstoff als zweite Komponente Propan verteilt über die Membran dosiert, kann die lokale Konzentration an Propan auf hohem Niveau entlang der Reaktionskoordinate gezielt eingestellt werden, was positiv für die differentielle Selektivität, aber auch für die Reaktionsgeschwindigkeit r1 und damit für den Propanumsatz ist. Mit steigendem Recyclingverhältnis R können der Umsatz und die Selektivität an Acrolein signifikant erhöht werden.
Neben der Dosierung binärer Gemische mittels Membran wäre auch die Anwendung von ternären Gemischen (Sauerstoff, Propan und Propen) denkbar, um sowohl die Geschwindigkeit r1 als auch r2 gezielt entlang des Reaktionswegs im Distributor zu intensivieren. Im Vergleich zur ODH von Propan vereinfacht sich im vorliegenden Fall das nachgeschaltete Trennproblem, da Acrolein (TS = 52 °C) deutlich einfacher von Propan/Propen sowie den Kohlenstoffoxiden abgetrennt werden kann, wodurch die Kosten für das interne Recycling deutlich reduziert werden.
5.3 Selektivoxidation vonn-Butan zu Maleinsäureanhydrid
Abschließend soll auf Basis von Simulationsstudien das Potenzial der Selektivoxidation von n-Butan zu Maleinsäureanhydrid (MSA) evaluiert werden. Neben Acrolein stellt auch MSA ein wichtiges technisches Intermediat dar. Es ist eines der bedeutendsten, großtechnischen Verfahren 24, 45, 88. Die Herstellung erfolgt durch eine Selektivoxidation von n-Butan, das ebenfalls ein Nebenprodukt des Steamcrackers ist 35. Die Selektivoxidation von n-Butan zu MSA wird vorwiegend an Vanadylpyrophosphat-Katalysatoren ((VO)2P2O7) durchgeführt. Die gegenwärtig realisierbaren Selektivitäten und Ausbeuten an MSA sind relativ gering 45. Um die bisher vorliegende Reaktorperformance durch geeignete reaktionstechnische Maßnahmen zu verbessern und den Einsatz innovativer Reaktorkonzepte in Form von Membranreaktoren zu eruieren, ist wieder ein Verständnis der Reaktionskinetik essenziell. Die Reaktionskinetik wurde in 45 durch stationäre und dynamische Experimente in einem kontinuierlichen, gradientenfreien Reaktor (CSTR) vom Berty-Typ untersucht und das Reaktionsnetzwerk identifiziert. Abb. 12 gibt das Reaktionsnetzwerk in reduzierter Struktur wieder, das identisch mit den in Abb. 4 und 11 diskutierten Modellnetzwerken, einer klassischen Parallel-/Folgereaktion, ist. Demnach wird MSA durch die partielle Oxidation r1 direkt aus n-Butan gebildet bzw. in der unerwünschten Folgereaktion r2 zu Kohlenstoffdioxiden weiteroxidiert. Parallel kann n-Butan durch r3 ebenfalls zu COx totaloxidiert werden. Die unerwünschten Reaktionen reduzieren dabei die MSA-Selektivität und werden in Anbetracht der Stöchiometrie bezüglich O2 insbesondere bei hohen Konzentrationen begünstigt, so dass eine verteilte Dosierung von Sauerstoff im Distributor definitiv von Vorteil ist.
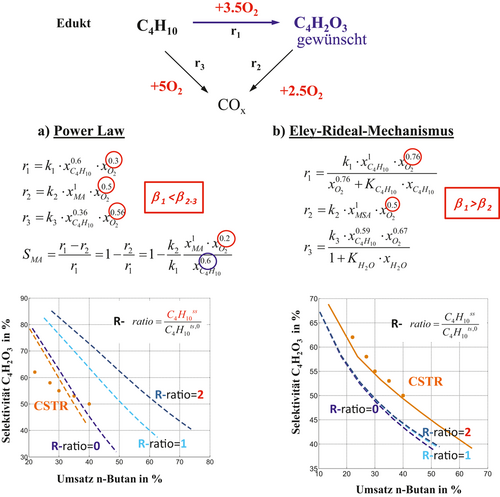
Die in 45 durchgeführten kinetischen Messungen gestalteten sich schwierig, da weitere Nebenreaktionen, wie homogene Reaktionen in der Gasphase oder an der Reaktorwand, ablaufen und die Messungen in hohem Maß mit Unsicherheiten behaftet waren. Vor diesem Hintergrund wurden in 45 verschiedene kinetische Mechanismen postuliert und in Form unterschiedlicher kinetischer Ansätze quantifiziert. Ein Potenzansatz (Abb. 12) gestattet, die differentielle MSA-Selektivität unter Vernachlässigung der Parallelreaktion r3 zu formulieren. Aus den Reaktionsordnungen (β1 < β2 = 0,3 < 0,5) ist direkt ersichtlich, dass durch eine Absenkung der lokalen O2-Konzentration sowie eine zusätzliche simultane Erhöhung der lokalen Konzentration an n-Butan durch verteilte Dosierung mit internem n-Butan-Recycling im Distributor eine gezielte Steuerung der MSA-Selektivität gegeben ist. Diese Aussage kann anhand der Kinetik von 45 in einer modellbasierten Studie bestätigt werden, deren Ergebnis in Abb. 12 illustriert ist.
Für den Potenzansatz wird eine höhere MSA-Selektivität im Distributor gegenüber dem gradientenfreien Reaktor (CSTR) beobachtet, wenn ausschließlich Sauerstoff (R = 0) über eine Membran verteilt wird. Durch Übertragung des Konzepts auf Prozessebene, d. h. der verteilten Dosierung von Sauerstoff und n-Butan, kann mit steigendem Anteil an zusätzlich dosiertem n-Butan, d. h. mit steigendem Recyclingverhältnis R, die MSA-Selektivität signifikant zu höheren Umsätzen verschoben werden, wie der Selektivitäts-Umsatz-Plot in Abb. 12 zeigt.
Eine Übertragung des Konzepts der membranbasierten Dosierung auf die Selektivoxidationen von n-Butan und Sauerstoff unter Verwendung der Recyclingstrategie scheint somit prinzipiell möglich zu sein. Eine positive Steuerung der Selektivität von Zwischenprodukten im Distributor auf Reaktor- und Prozessebene setzt aber grundsätzlich eine geeignete Reaktionskinetik bzw. Reaktionsordnungen in der Konstellation (βO2,gewünscht < βO2,unerwünscht) voraus. In Abb. 12 wird offensichtlich, dass der bisher in den Simulationsstudien verwendete Potenzansatz die experimentellen Befunde nur unzureichend mathematisch abbilden kann. In 45 wurden aus diesem Grund weitere kinetische Ansätze parametrisiert. Eine Kombination aus Potenzansatz und semi-empirischen Eley-Rideal-Mechanismus, unter Berücksichtigung der Wassersorption, ist in Abb. 12 gegeben. Dieser Ansatz kann die im gradientenfreien Reaktor gewonnenen kinetischen Daten deutlich besser beschreiben. Hingegen liefert der Distributor mit verteilter Dosierung von Sauerstoff für R = 0 jetzt eine erheblich geringere Selektivität bei gleichen Umsätzen. Grund hierfür ist die Reaktionsordnung bezüglich des Sauerstoffs. Diese beträgt in der gewünschten Reaktion 1 β1 = 0,76 und ist damit offensichtlich größer als in der unerwünschten Folgeoxidation des MSA (Reaktion 2 mit β2 = 0,5). Die Konstellation der Exponenten von Sauerstoff β1 > β2 verletzt damit die Grundlage der verteilten Dosierung von Sauerstoff und damit das Ziel der lokalen Absenkung der O2-Konzentration. Dieses Ergebnis ist im Hinblick auf die in Abb. 12 veranschaulichten Ergebnisse und den für Reaktion r1 stöchiometrisch notwendigen Einsatz an Sauerstoff kritisch zu überprüfen. Überlegungen in 45 legen den Verdacht nahe, dass unberücksichtigte Nebenreaktionen oder homogene Gasphasenreaktionen zu dem postulierten semi-empirischen Ansatz geführt haben. Wird nun zusätzlich zum Sauerstoff n-Butan über die Membran verteilt dosiert und damit lokal die n-Butan-Konzentration erhöht (von R = 0 auf 1 bzw. 2), ist tendenziell ein leichter aber weitgehend vernachlässigbarer Anstieg der MSA-Selektivität zu verzeichnen.
6 Zusammenfassung und Bewertung des Einsatzes von Membranen in Reaktoren
Aus reaktionstechnischer Sicht wurden Möglichkeiten diskutiert, Konzentrationsprofile in Reaktoren sowie auf Prozessebene optimal zu steuern, um Umsätze, Selektivitäten und Ausbeuten zu verbessern. Für verschiedene Modellreaktionen konnte unter Einsatz asymmetrischer, keramischer Membranen das Potenzial von Distributoren im Labor- und Pilotmaßstab aufgezeigt werden. Dabei wurden sukzessive die Katalysator-, die Reaktor- und die Prozessebene betrachtet. So wurde für die ODH eine Steigerung der Propenausbeute um den Faktor 2,7 in Membranreaktoren durch Dosierung von binären Eduktgemischen und internes Recycling verglichen mit dem konventionellen Festbettreaktor erreicht. Eine erfolgreiche Prüfung der Übertragbarkeit und Verallgemeinerung des Konzeptes erfolgte für die Selektivoxidation von Propan zu Acrolein sowie n-Butan zu MSA in Simulationsstudien. Es wurde für alle untersuchten Beispiel deutlich, dass die Kenntnis der Reaktionskinetik eine essenzielle Voraussetzung für eine gezielte Selektivitätslenkung ist.
Weitere, hier nicht vorgestellte Ergebnisse wurden in unserer Arbeitsgruppe bzgl. des Einsatzes H2-selektiver Kohlenstoffmembranen im Extraktormodus für die gleichgewichtslimitierte Methandehydroaromatisation und weitere Reaktionssysteme erzielt 81, 89.
Jürgen Caro gab in seinem eingangs zitierten Übersichtsartikel „Quo Vadis, MOF?” 22 einen Einblick in die Entwicklungsaktivitäten der Membran-/Membranreaktorentwicklung der letzten Jahrzehnte. Er wies allerdings auch kritisch auf Schwächen und Grenzen der Membranreaktorkonzepte hin und konstatiert, dass ein breiterer industrieller Einsatz noch mehr Zeit und Forschung benötigen wird. Insbesondere gilt es, die Kosten für die Membranen weiter deutlich zu reduzieren. Daneben sind die Gewährleistung der Kompatibilität der Bedingungen für Membrantrennung und Reaktion 41, 80, die Membranabdichtung in den Reaktoren sowie die Membranstandzeit nach wie vor große Herausforderungen.
Vielversprechende neue Ansätze wurden 2019 auf der 14th International Conference on Catalysis in Membrane Reactors in Eindhoven u. a. von den Arbeitsgruppen Dittmeyer, Gallucci und van Sint Annaland zur Thematik Wasserstoffperoxidsynthese, oxidative Methankopplung und Wasserstoffproduktion vorgestellt 90-92.
Die momentan ablaufenden Veränderungen unserer Rohstoff- und Energiebasis, der Bedarf an Prozessen zur Abtrennung und Nutzung von CO2 wie zur effizienten Bereitstellung und Verwendung von Wasserstoff, werden sicherlich zu neuen Entwicklungen auf dem Gebiet der Membranreaktoren führen. Um erfolgreich zu sein, erfordert dies eine intensive Zusammenarbeit von Experten aus der Katalyse, den Materialwissenschaften und der chemischen Verfahrenstechnik.
Acknowledgements
Die Autoren danken für die finanzielle Unterstützung der Deutschen Forschungsgemeinschaft (Projekte: „Membranforschergruppe – Membranunterstützte Reaktionsführung, FOR 447/1-1”, „Kontrolle und Intensivierung von Reaktionen durch Einsatz zyklisch betriebener Distributoren „SE 568/23-1/HA 6762/2-1/2/3” und dem „SFB TRR 63 „Integrierte chemische Prozesse in flüssigen Mehrphasensystemen – 56091768” sowie dem BMBF (Projekt: „ConNeCat, 03C0343A”). Open Access Veröffentlichung ermöglicht und organisiert durch Projekt DEAL.
Formelzeichen
-
- A [m2]
-
Fläche
-
- c [mol L−1]
-
Konzentration
-
- jiDos [mol s−1]
-
Transmembranstrom
-
- L [m]
-
Reaktor- bzw. Membranlänge
-
- mKat [kg]
-
Katalysatormasse
-
- n [mol]
-
Stoffmenge
-
- rj [mol s−1kg−1]
-
Reaktionsgeschwindigkeit der Reaktion j
-
- R [–]
-
Recyclingverhältnis
-
- S [%]
-
Selektivität
-
- t [s]
-
Zeit
-
- T [K]
-
absolute Temperatur
-
- W/F [kg s m−3]
-
Masse Katalysator/Flow Rate
-
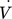 [m3s−1]
[m3s−1] -
Volumenstrom
-
- x [–]
-
Molenbruch
-
- X [%]
-
Umsatz
-
- z [m]
-
axiale Laufvariable
Griechische Symbole
-
- α [–]
-
Reaktionsordnung
-
- β [–]
-
Reaktionsordnung
-
- γ [–]
-
Reaktionsordnung
-
- ν [–]
-
stöchiometrischer Koeffizient
-
- τ [s]
-
Verweilzeit
Indizes
-
- 0
-
Eintritt
-
- diff
-
differentiell
-
- i
-
Index der laufenden Komponenten (N)
-
- j
-
Index der ablaufenden Reaktionen (M)
-
- ss
-
shell side
-
- ts
-
tube side
Abkürzungen
-
- A
-
Edukt A
-
- B
-
Edukt B
-
- C
-
Zielprodukt C (gewünscht)
-
- Dos
-
Dosierung
-
- FBR
-
Festbettreaktor
-
- Kat
-
Katalysator
-
- MSA
-
Maleinsäureanhydrid
-
- NP
-
Nebenprodukt
-
- ODH
-
oxidative Dehydrierung
-
- PBMR
-
Festbettmembranreaktor




