Abstract
deDie Extraktion von Indium aus einer synthetischen, sulfathaltigen Lösung unter Verwendung von handelsüblichen Reagenzien (Cyanex 272, DEHPA und Cyanex 923) wird vergleichend bewertet. Die Extraktionsprofile von Indium (III) wurden im Hinblick auf die Reagenzkonzentration, den pH-Wert der wässrigen Lösung und die Indiumkonzentration in einem niedrigen Phasenverhältnis von 1:10 untersucht. DEHPA und Cyanex 272 sind im Gegensatz zu Cyanex 923 sehr gut zur Extraktion von Indium geeignet. Die Reextraktion mit HCl und H2SO4 wird vergleichend betrachtet.
Abstract
enThe extraction of indium from a synthetic sulfate-containing solution using commercial reagents (Cyanex 272, DEHPA, and Cyanex 923) is evaluated on a comparative basis. The extraction profiles of indium (III) were examined with regard to the reagent concentration, the pH value of the aqueous solution, and the indium concentration in a low phase ratio of 1:10. DEHPA and Cyanex 272 are, in contrast to Cyanex 923, very well suited for the extraction of indium. Re-extraction with HCl and H2SO4 is compared.
1 Einleitung
Indium kommt in der Natur in Verbindung mit sulfidischen Metallerzen hauptsächlich in den Mineralen Sphalerit oder Galenit vor. Dementsprechend sind auch die Hauptquellen von Indiummetall eng mit der Produktion von Zink und Blei verbunden. Bei der Herstellung von unedlen Metallen wird Indium in Schlacken und anderen Rückständen konzentriert, aus denen es dann unter Verwendung komplexer hydrometallurgischer oder pyrometallurgischer Verfahren gewonnen wird.
Der Großteil des raffinierten Indiums wird in Indiumzinnoxid (ITO), einem transparenten, halbleitenden Mischoxid, verarbeitet 1. Es besteht aus 90 Gew.-% In2O3 und 10 Gew.-% SnO2, was einer Indiumkonzentration von 78 Gew.-% entspricht. Dünne Schichten aus ITO werden in Flüssigkristallanzeigen, Bildschirmen für Mobiltelefone, Tablets und anderen elektronischen Geräten verwendet. Da der Markt für solche Geräte, insbesondere Touchscreens, rasant wächst, wird Indiummetall innerhalb der kommenden fünf Jahre einer deutlich steigenden Nachfrage unterliegen.
Beim Sputtern von ITO gehen mit derzeitig eingesetzten Technologien mindestens 70 % als Abfall verloren 2. Daher konzentrieren sich viele aktuelle Forschungen auf die Verarbeitung dieser indiumreichen Abfälle 3-8. Abgesehen von eher reinem ITO-Abfall werden große Anstrengungen unternommen, um das Metall auch aus indiumarmen Abfällen sowie aus End-of-Life(EoL)- und End-of-Use(EoU)-Produkten zu gewinnen. Ein Schwerpunkt der gegenwärtigen Untersuchungen liegt auf dem Recycling von LCD-Bildschirmen mithilfe der Flüssig/Flüssig-Extraktion. Das am intensivsten untersuchte Extraktionsmittel ist DEHPA (Bis (2-ethylhexyl)phosphat), das zur Konzentration und Abtrennung von Indium von Begleitmetallen eingesetzt wird 9-12. Zwar extrahiert es Indium effektiv bei niedrigem pH-Wert, das extrahierte Metall ist jedoch aus der organischen Phase nur mit konzentrierten Säuren und damit auch nur schwer wiederzugewinnen, was der Grund für die Suche nach alternativen Extraktionsmitteln war. So hat sich für 2-Ethyllexylhydrogen-2-ethylhexylphosphonat (PC88A) gezeigt, dass es leichter als DEHPA reextrahiert werden kann 13. Auch Carbonsäuren und Amine wurden untersucht, wie z. B. für die Trennung von Indium und Gallium 14. Andere Arbeiten verwendeten Cyanex 923 15 sowie Ketone und Phosphinoxide 16.
Den publizierten Arbeiten ist gemein, dass das Extraktionsverhalten fast ausschließlich in Systemen mit einem Phasenverhältnis von VO/VA = 1:1 untersucht wurde. Für die industrielle Anwendung ist jedoch auch die Konzentration von verdünnten Aufschlusslösungen entscheidend. Vor diesem Hintergrund wurde die Indiumextraktion systematisch mit einem niedrigeren Phasenverhältnis (VO/VA = 1:10) untersucht, um den Einfluss einer höheren Beladung der organischen Phase auf die Extraktion beurteilen zu können. Ferner stand die Reextrahierbarkeit des Indiums im Fokus, eine für technische Anwendungen maßgebliche Größe.
2 Experimentelles
2.1 Materialen und Methoden
Die Extraktionsversuche von Indium (III) wurden außer den Beladungsversuchen unter Verwendung von 1 mmol L−1 In2(SO4)3 in Schwefelsäure (0,01 mol L−1) durchgeführt. Diese wurde durch Verdünnen einer 0,1 mol L−1 Indium-Stammlösung hergestellt, die durch Auflösen von 13,88 g Indiumoxid (99,9 % Alfa Aesar GmbH, Deutschland) in 16 mL heißer 10 mol L−1 Schwefelsäure unter Rühren hergestellt und mit destilliertem Wasser auf 1 L verdünnt wurde. In dieser Arbeit wurden drei Extraktionsreagenzien verwendet: Cyanex 272, 85 % Bis(2,4,4-trimethylpentyl)phosphinsäure, Cyanex 923, ein Gemisch aus Octyl- und Hexylphosphinoxiden, beide der Firma Cytec Industries BV, Niederlande, und DEHPA, 95 % Di-(2-ethylhexyl)phosphorsäure der Firma Merck KGaA, Deutschland. Die Extraktionsmittel wurden mit geruchsarmem Kerosin (Siedepunkt 200 – 250 °C, Alfa Aesar GmbH) verdünnt. Alle Chemikalien wurden ohne weitere Reinigung verwendet.
2.2 Extraktion von Indium aus Schwefelsäurelösung
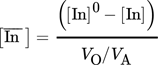 (1)
(1)
 und [In] stellen die Konzentration von Indium in der organischen und wässrigen Phase nach der Extraktion dar. [In]0 ist die Konzentration von Indium vor der Extraktion und VO/VA stehen für das volumetrische Phasenverhältnis.
und [In] stellen die Konzentration von Indium in der organischen und wässrigen Phase nach der Extraktion dar. [In]0 ist die Konzentration von Indium vor der Extraktion und VO/VA stehen für das volumetrische Phasenverhältnis.
2.3 Einfluss des pH-Wertes
Es wurden Extraktionsuntersuchungen unter Verwendung von 1 mol L−1 Cyanex 272, 0,05 mol L−1 DEHPA und 0,2 mol L−1 Cyanex 923 durchgeführt. Um den Einfluss des pH-Wertes auf die Verteilung von Indium zwischen organischer und wässriger Phase zu ermitteln, wurde der Säuregehalt mit 5 mol L−1 Schwefelsäure so eingestellt, dass ein Bereich von 0,01 mol L−1 bis 1 mol L−1 abgedeckt wird. Die zu extrahierenden Lösungen wurden durch Zusammenführen von 1 mL indiumhaltiger Stammlösung 0,1 mol L−1 mit geeigneter Menge von H2SO4 und anschließender Verdünnung mit destilliertem Wasser auf 100 mL hergestellt. Nach der Extraktion wurde der Gleichgewichts-pH-Wert mit einer Glas-pH-Elektrode gemessen.
2.4 Einfluss von Sulfationen auf die Indiumextraktion mit Cyanex 923
Als Basislösung für die Untersuchungen wurde eine 0,3 molare Schwefelsäurelösung genutzt, der zuvor 1 mmol L−1 Indiumionen zugesetzt wurden. Zu dieser Basislösung wurden außerdem unterschiedliche Mengen an Natriumsulfat zugegeben und anschließend mit einer 1 molaren Cyanex 923-Lösung in Kerosin im Phasenverhältnis VO/VA = 1:10 für 5 min extrahiert. Nach der Extraktion wurden die in der wässrigen Phase verbliebenen Indiumionen mittels AAS ermittelt und der Verteilungskoeffizient berechnet.
2.5 Einfluss der Konzentration der Extraktionsmittel
Eine Lösung mit einem konstanten pH-Wert von 2 wurde mit den Reagenzlösungen unterschiedlicher Konzentrationen gemischt, wobei 0,0005 – 0,05 mol L−1 für DEHPA, 0,01 – 1 mol L−1 für Cyanex 272 und 0,002 – 1 mol L−1 für Cyanex 923 einsetzt wurden. Die Bestimmung des pH-Wertes und der Indiumkonzentration in der wässrigen Phase nach der Extraktion erfolgte nach der Phasentrennung.
2.6 Strippen
Mit 1150 mg L−1 Indium beladene organische Phasen wurden mit HCl- und H2SO4-Lösungen unterschiedlicher Konzentrationen im Phasenverhältnis von VO/VA = 1:1 extrahiert. Zum Strippen wurden 5 mL beladene organische Phase mit 5 mL wässriger Reextraktionslösung 5 min lang geschüttelt. Der Indiumgehalt in der wässrigen Phase nach der Extraktion wurde anschließend mittels AAS bestimmt.
3 Ergebnisse und Diskussion
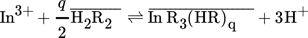 (2)
(2)mit X als Spezies in der wässrigen Phase, und 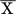 als Spezies in der organischen Phase.
als Spezies in der organischen Phase.
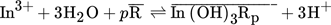 (3)
(3)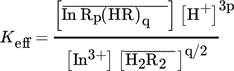 (4)
(4)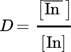 (5)
(5) notiert. Das Indium in wässrigen Sulfatlösungen mit einem pH-Wert von 0 bis 2 liegt ausschließlich als ein dreiwertiges Kation vor. Daher müssen keine komplexen Gleichgewichte in wässriger Phase berücksichtigt werden. Bei Kombination der Gln. 4 und 5 gehorcht die Extraktion mit DEHPA bzw. Cyanex 272 als Extraktionsmittel der Gl. 6 bzw. bei solvatisierend wirkenden Extraktionsmitteln der Gl. 7:
notiert. Das Indium in wässrigen Sulfatlösungen mit einem pH-Wert von 0 bis 2 liegt ausschließlich als ein dreiwertiges Kation vor. Daher müssen keine komplexen Gleichgewichte in wässriger Phase berücksichtigt werden. Bei Kombination der Gln. 4 und 5 gehorcht die Extraktion mit DEHPA bzw. Cyanex 272 als Extraktionsmittel der Gl. 6 bzw. bei solvatisierend wirkenden Extraktionsmitteln der Gl. 7:
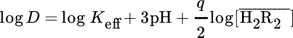 (6)
(6)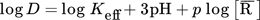 (7)
(7)Die Ergebnisse der Extraktionsexperimente mit verschiedenen Extraktionsreagenzien in Abhängigkeit vom Gleichgewichts-pH-Wert nach der Extraktion sind in Abb. 1 dargestellt. Es ist zu beobachten, dass beide sauren Extraktionsmittel sehr ähnliche Ergebnisse zeigen, obwohl sie in unterschiedlichen Konzentrationen vorlagen. Die Extraktion war ab einem pH-Wert von 1,5 nahezu vollständig. Bei Verwendung des neutralen Cyanex 923 war es jedoch nicht möglich, mehr als 30 % des gelösten Indiums zu extrahieren, selbst bei pH ≥ 2, bei dem bereits die Ausfällung von Indium einsetzt.
Für Cyanex 923 wurde eine quantitative Extraktion aus sulfatischen Medien bei pH > 1,5 im Phasenverhältnis von 1:1 beschrieben 18. Diese Diskrepanz ist auf das von Gupta et. al. 18 benutzte höhere Phasenverhältnis zurückzuführen.
3.1 Einfluss des pH-Wertes
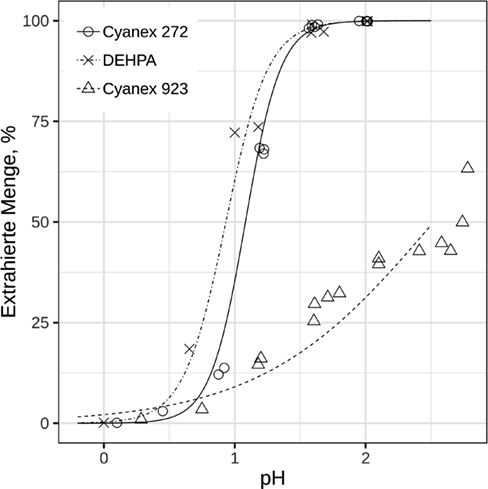
Wie in Abb. 2 ersichtlich ist, wächst der Logarithmus des Verteilungskoeffizienten für DEHPA und Cyanex 272 zwischen pH 0 und 2 linear. Die Abhängigkeit der pH-Werte liegt für beide saure Extraktionsmittel sehr nahe bei 3, so dass drei Protonen für jedes komplexierte In3+-Ion während des Extraktionsprozesses freigesetzt werden. Dieses Extraktionsverhalten stimmt mit der Theorie überein und entspricht Literaturberichten für beide Extraktionsmittel 11, 21, 22. Somit kann die Indiumextraktion aus sulfatischen Lösungen mit Gl. 6 treffend beschrieben werden.
Ein linearer Anstieg der Logarithmen des Verteilungskoeffizienten für Cyanex 923 kann allein im pH-Bereich von 0,7 bis 1,6 beobachtet werden, während er bei höheren pH-Werten im Ergebnis der geringen Beladungskapazität von Cyanex 923 nahezu unverändert bleibt.
3.2 Einfluss von Sulfationen
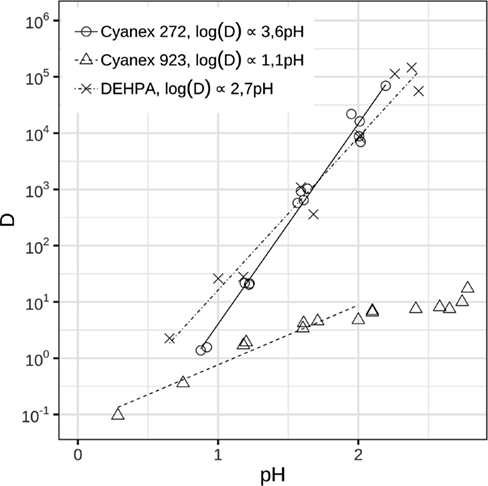
Wurde die Extraktion mit 1 mol L−1 Cyanex 923 anstelle von 0,2 mol L−1 durchgeführt, ergab sich ein abweichendes Bild. Wie in Abb. 3 deutlich wird, nimmt die Kurve für 0,2 mol L−1 Cyanex 923 ab pH ≈ 1,5 keinen linearen Verlauf mehr, sondern knickt ab. Der Verlauf der Kurve für 1 mol L−1 Cyanex 923 bleibt im ganzen untersuchten Bereich linear.
Der Verteilungskoeffizient ändert sich mit 1,5-facher Potenz des pH-Wertes. Es ist davon auszugehen, dass der Mechanismus der Extraktion mit Cyanex 923 deutliche Unterschiede zur Extraktion mit sauren Extraktionsmitteln aufweist und somit nicht alleine mit Gl. 3 beschreibbar ist.
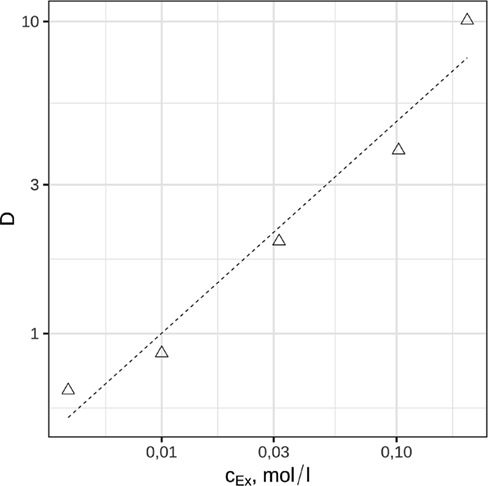
Der Schlüssel zur Erklärung des beobachteten Extraktionsverhaltens liegt in der Einbeziehung von Sulfat, dessen Gegenwart das Extraktionsergebnis ganz offensichtlich beeinflusst. Sulfatquelle ist Schwefelsäure, mit der der pH-Wert eingestellt wurde. Aus Abb. 4 geht der Einfluss der Sulfationen auf den Verteilungskoeffizienten hervor. Um eventuell überlagernde Wechselwirkungen mit Protonen auszuschließen, wurde hier Na2SO4 verwendet.
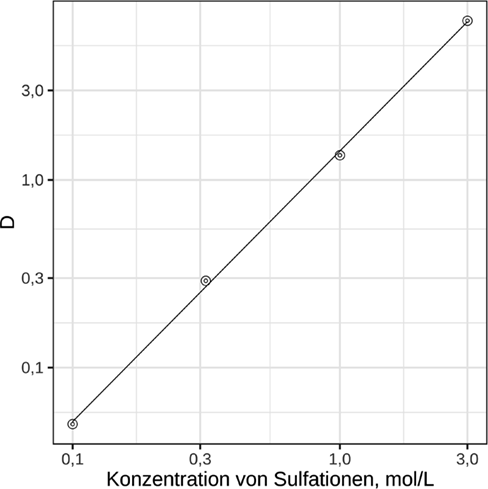
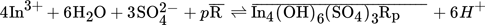 (8)
(8)3.3 Einfluss der Konzentration der Extraktionsmittel
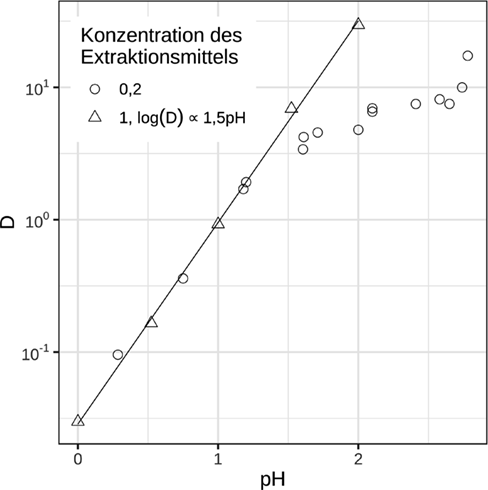
Im vorherigen Abschnitt wurde gezeigt, dass bei der Extraktion mit brønstedtsauren Extraktionsmitteln drei H+-Ionen freigesetzt werden. Somit ist es möglich, die Abhängigkeit der Extraktion von der Konzentration des Extraktionsmittels zu ermitteln, indem der Term log(D) – 3pH gegen die Konzentration des Reagenzmoleküls aufgetragen wird. Diese Auftragung ist in Abb. 5 dargestellt. Die Steigung der Regressionsgeraden stimmt mit dem Ausdruck q/2 in Gl. 3 überein. Ergebnisse für die Extraktion mit 0,01 bis 1 molaren Lösungen von Cyanex 272 und 0,0005 bis 0,05 molaren Lösungen von DEHPA zeigen, dass die Steigung der Abhängigkeitslinie des Terms log(D) – 3pH von dem Logarithmus der Reagenzkonzentration für DEHPA bzw. Cyanex 272 1,5 und 1,6 beträgt. Dies bedeutet, dass in dem untersuchten Bereich die Konstante q in Gl. 3 den Wert zwischen 3 und 4 annimmt. Diese Beobachtung stimmt mit Ergebnissen von Gupta et. al. überein, die bei der Extraktion mit 0,5 mol L−1 Cyanex 272 in Toluol in einer 0,05 molaren HCl-Lösung eine Steigung von m = 2 erhielten 19. Analoge Untersuchungen von Lee et. al. mit 0,05 mol L−1 DEHPA in Kerosin ergaben in ähnlichen Experimenten eine Steigung von q/2 = 1,5 11.
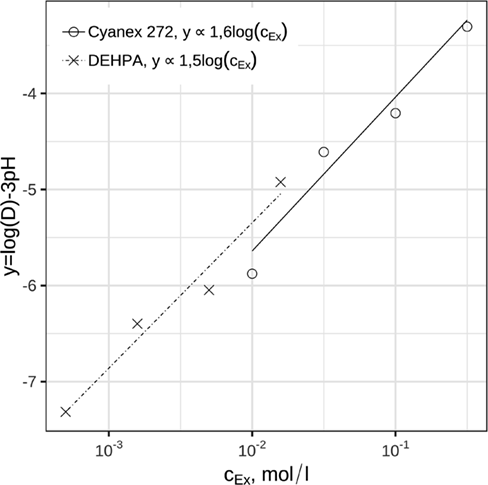
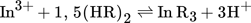 (9)
(9)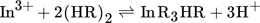 (10)
(10)Die Steigung der Abhängigkeit wird für DEHPA und Cyanex 272 von verschiedenen Autoren unterschiedlich angegeben und beträgt bei pH = 1 entweder 3/2 oder 3 20. Die Stöchiometrie der Extraktion hängt demnach von der Beladung der organischen Phase ab, wobei unterschiedliche Steigungen unterschiedlichen Stöchiometrien entsprechen. Dies bestätigen Extraktionsversuche unter verschiedenen Bedingungen, die zu unterschiedlichen Beladungen der organischen Phase führen. Darüber hinaus stellten Inoue et al. fest, dass sich die Zusammensetzung der extrahierten Spezies ändert, wenn die Anfangskonzentration von Indium erhöht wird 20. Dabei bleibt die anfängliche Menge an Extraktionsmittel konstant, d. h. es steht weniger freies Extraktionsmittel für die Reaktion zur Verfügung 21.
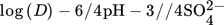 auf log(cEx) den entsprechenden Wert. Unter Annahme, dass für jedes Sulfation zwei Protonen freiwerden, geht der abhängige Term laut Gl. 11 in lediglich log(D) über:
auf log(cEx) den entsprechenden Wert. Unter Annahme, dass für jedes Sulfation zwei Protonen freiwerden, geht der abhängige Term laut Gl. 11 in lediglich log(D) über:
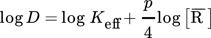 (11)
(11)Die doppeltlogarithmische Auftragung von Verteilungskoeffizient und Konzentration des Extraktionsmittels liefert eine Gerade mit der Steigung m = 0,57, wie in Abb. 6 ersichtlich wird.. Das heißt, ein Molekül des solvatisierend wirkenden Extraktionsmittels nimmt an der Extraktion von zwei Indiumionen teil. Diese Abhängigkeit ist aber nur für geringe Beladungen gegeben, wie aus Sect. 3.4 hervorgeht.
3.4 Untersuchung der Ladekapazitäten
Die Beladungskapazitäten der Extraktionsmittellösungen wurden für eine wässrige InCl3-Lösung mit c = 87 mmol L−1 und bei einem pH-Wert = 2 für unterschiedliche Phasenverhältnisse ermittelt. Die Ergebnisse dieser Beladungsexperimente (Abb. 7) verdeutlichen, dass mit Cyanex 272 aufgrund seiner relativ hohen Konzentration der höchste Indiumgehalt in der organischen Phase erreicht werden konnte. Eine quantitative Extraktion (> 95 %) wurde bei einer Beladung von 17 mmol L−1 und 10 mmol L−1 Indium in der organischen Phase für 1 mol L−1 Cyanex 272 bzw. 0,05 mol L−1 DEHPA beobachtet.

Während der Beladungstests wurde neben einer starken Zunahme der Viskosität bei 25 °C von 1 auf 20 mPa s für DEHPA-Extrakt bzw. von 2 auf 50 mPa s für Cyanex 272-Extrakt die Bildung einer dritten Phase beobachtet. Bei Verwendung von Cyanex 272 trat diese dritte Phase bei Indiumkonzentrationen > 80 mmol L−1 in der organischen Phase als feiner weißer Niederschlag auf. Oberhalb von 130 mmol L−1 ging der Niederschlag in eine gelatinöse Substanz über, mit der Konsequenz einer erheblich erschwerten Phasenseparation. Im DEHPA-Extrakt trat diese dritte Phase bereits ab einer Indiumkonzentration von 10 mmol L−1 als weißer feiner Niederschlag auf. Dahingegen wurde für höheren Indiumkonzentration (25 mmol L−1) in der organischen Phase kein Niederschlag beobachtet. Die Viskosität des Extrakts stieg jedoch mit zunehmender Indiumkonzentration an. Für Cyanex 923 wurde sogar bei der höchsten Indiumbeladung (30 mmol L−1) keine dritte Phase (Niederschlag) beobachtet und die Viskosität des Extraktes stieg bei 25 °C von 2 auf 10 mPa s, womit der Anstieg deutlich weniger ausgeprägt war als bei anderen untersuchten Extraktionsmitteln.
3.5 Reextraktion
Reextraktionsuntersuchungen wurden nur für Cyanex 272 und DEHPA durchgeführt, da Cyanex 923 keine zufriedenstellende Extraktion ermöglichte. Abb. 8 zeigt die Reextraktion von beladenen 1 mol L−1 Cyanex 272- und 0,05 mol L−1 DEHPA-Lösungen in Kerosin mit HCl(aq.) und H2SO4(aq.) in Abhängigkeit von der Säurekonzentration. Die Reextraktion der DEHPA-Lösung benötigte generell eine stärker konzentrierte Säure als diejenige von Cyanex 272, wobei sich HCl besser eignet als H2SO4.
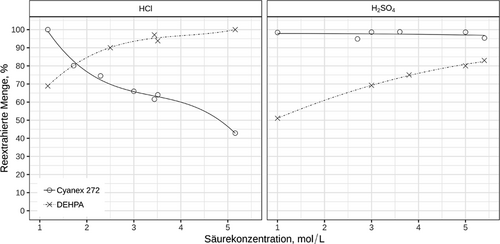
Um eine Indiumrückgewinnung von 95 % aus der organischen Phase zu ermöglichen, wurde 3,5 molare HCl für die DEHPA-Reextraktion benötigt, wohingegen bereits eine 1,2 molare HCl-Lösung für die Reextraktion von mehr als 99 % Indium aus Cyanex 272 ausreichte. Im Falle von Cyanex 272 hatte eine höhere HCl-Konzentration der Stripp-Phase sogar zur Folge, dass die reextrahierte Indiummenge sinkt. Dieses Verhalten kann dadurch erklärt werden, dass Cyanex 272 über die Fähigkeit verfügt, Indium aus sauren chloridhaltigen Lösungen als neutrales Molekül zu extrahieren. Die Reextraktion von Cyanex 272 funktionierte auch mit Schwefelsäure einwandfrei und Indium ließ sich bereits mit 1 M H2SO4 mit 98 % Reextraktionsrate nahezu quantitativ wieder in die wässrige Phase überführen.
Das hier beschriebene Extraktionsverfahren geht weit über literarturbeschriebene Werte hinaus. Dort werden für Indium im Falle von 0,5 mol L−1 Cyanex 272-Lösungen in Toluol mit 5 M HCl Reextraktionsraten von 40 % berichtet, entsprechend einem Strippen von 60 % 19. Für DEHPA ließen sich mit 5,4 M H2SO4 bis zu 83 % ausbringen.
4 Schlussfolgerung
Diese Arbeit zeigt, dass DEHPA und Cyanex 272 ausgezeichnete Extraktionsmittel für Indium darstellen. Die Extraktion von Indium mit Lösungen von Cyanex 272 (1 mol L−1) und DEHPA (0,05 mol L−1) in Kerosin zeigt vergleichbare Extraktionsprofile. Die DEHPA-Lösung weist jedoch eine deutlich geringere Beladungskapazität auf. Andererseits konnte Cyanex 923 keine zufriedenstellende Extraktion von Indium erbringen, was dieses Extraktionsmittel ungeeignet für eine effektive Extraktion von Indium aus sulfatischen Medien macht. Die Extraktionsexperimente mit Cyanex 923 zeigen, dass Sulfationen eine wichtige Rolle in der Extraktion von Indium spielen können. Folgeuntersuchungen haben ein tiefergehendes Verständnis bezüglich des Einflusses von Sulfationen auf die Extraktion zum Ziel, um daraus entsprechende Betriebsparameter ableiten zu können.
Reextraktionsuntersuchungen zeigten, dass HCl für DEHPA ein besseres Extraktionsmittel ist als H2SO4, wohingegen für Cyanex 272 beide Säuren bereits bei niedrigeren Konzentrationen gut geeignet sind und eine nahezu quantitative Ausbringung des Indiums erlauben. Für Anwendungen, bei denen die Konzentrierung aus verdünnten Lösungen erreicht werden soll, hat sich Cyanex 272 als die beste Variante der drei untersuchten Extraktionsmittel erwiesen. Es besitzt die für diese Zwecke notwendige hohe Beladungskapazität, lässt sich leicht reextrahieren und weist ein günstiges Arbeitsverhalten auf.
Acknowledgements
Die Autoren danken der Dr.-Erich-Krüger-Stiftung und dem Bundesministerium für Wirtschaft und Energie (Förderkennzeichen 03EFLSN135) für die finanzielle Unterstützung dieser Arbeiten sowie der Firma Cytec Industries BV für die Bereitstellung von Cyanex 272 und Cyanex 923. Open Access Veröffentlichung ermöglicht und organisiert durch Projekt DEAL. [Correction added on November 04, 2020, after first online publication: Projekt Deal funding statement has been added.]




