Tricyanmethan oder Dicyanketenimin – Silylierung macht den Unterschied
Abstract
Pseudohalogenide wie Tricyanmethanid, [C(CN)3]−, sind in der Chemie sowie Biochemie weit verbreitet. Die protonierte Spezies HC(CN)3, eine klassische Pseudohalogen-Wasserstoff-Brønsted-Säure, ist eine sehr starke Säure mit einem pKS-Wert von −5. HC(CN)3 ist jedoch schwer zu handhaben, da es dazu neigt, sich schnell zu zersetzen oder – genauer gesagt – zu oligo- und polymerisieren. Daher sind silylierte Pseudohalogenid-Verbindungen mit dem [Me3Si]+ als „großem metallorganischen Proton“ von Interesse, die ähnliche chemische Eigenschaften, aber eine bessere kinetische Stabilisierung aufweisen. Hier wird von der schrittweisen Silylierung des Pseudohalogenid-Anions [C(CN)3]− berichtet, wobei das schwerere Homolog von HC(CN)3, nämlich [Me3Si][C(CN)3], und in Gegenwart von zwei zusätzlichen [Me3Si]+-Kationen sogar die dikationische Spezies [(Me3Si−NC)3C]2+ als stabiles [B(C6F5)4]-Salz gebildet wird. Überraschenderweise erfolgt im Gegensatz zur protonierten Spezies HC(CN)3, bei der das Proton an das zentrale C-Atom von [C(CN)3]− gebunden ist, die Silylierung des [C(CN)3]−-Anions an einem der drei terminalen N-Atome, wodurch das lange gesuchte Dicyanketenimin [Me3Si−NC−C(CN)2] gebildet wird. Alle weiteren Silylierungsschritte finden ausschließlich an den terminalen N-Atomen der drei CN-Gruppen und nicht am zentralen C-Atom statt, bis schließlich das bis dato unbekannte, hochsymmetrische Dikation, [(Me3Si−NC)3C]2+, gebildet wird. Die experimentellen Daten werden durch quantenchemische Berechnungen in Bezug auf Thermodynamik und chemische Bindungen unterstützt.
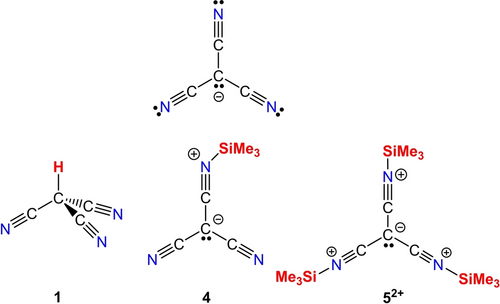
Während das Cyanid-Ion, CN−, das kleinste Pseudohalogenid ist, werden die Cyanid-Derivate [C(CN)3]−, Tricyanmethanid, und [N(CN)2]−, Dicyanamid, als nicht-lineare, resonanzstabilisierte Pseudohalogenide bezeichnet.1, 2 Sie können formal als Pseudohalogenide abgeleitet werden, indem man das Grimm′sche Hydridverschiebungsgesetz ausgehend von [CH3]− und [NH2]− anwendet, wobei die Wasserstoffatome durch CN-Gruppen ersetzt werden, was eine Delokalisierung des freien Elektronenpaares des zentralen Kohlenstoff- oder Stickstoff-Atoms ermöglicht.3, 4 Der letztgenannte Effekt verringert die Basizität des Anions, erhöht aber stark die Azidität der entsprechenden protonierten Spezies (z. B. pKSH2O(CH4)=44 vs. pKSH2O(HC(CN)3)=−5).5-7 Neben der Verringerung der Basizität des [C(CN)3]−-Anions bedeutet die Einführung der CN-Gruppen auch, dass das zentrale C-Atom und die terminalen N-Atome, die ebenfalls über ein freies Elektronenpaar verfügen, nun miteinander konkurrieren, so dass beide Atome formal als basisches Zentrum für die Protonierung zur Verfügung stehen (Schema 1, oben). Das π-Bindungssystem in [C(CN)3]− kann formal als eine delokalisierte 8π-Elektronen-7-Zentren-Bindung beschrieben werden (s. u.).
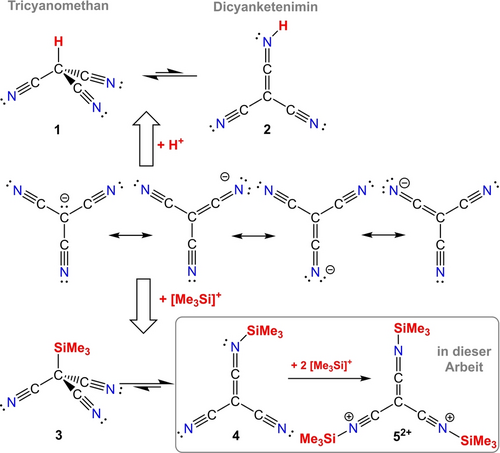
Tricyanmethan versus Dicyanketenimin.
Das Gleichgewicht zwischen Tricyanmethan und Dicyanketenimin kann beeinflusst werden, indem beispielsweise eine starke Lewis-Säure wie B(C6F5)3 zu einer oder mehreren CN-Gruppen hinzugefügt wird, wodurch das Gleichgewicht auf die Seite des Dicyanketenimins verschoben wird.8 Banert et al. waren experimentell in der Lage zu zeigen,9 dass das Tricyanmethan (1, auch Cyanoform genannt) in Übereinstimmung mit quantenchemischen Rechnungen10 das thermodynamisch stabilere Isomer im Vergleich zum Ketenimin-Tautomer (2) ist. Dies gilt sowohl in Lösung, als auch in der festen Phase.9 Einer der ersten Hinweise auf die Existenz des Cyanoforms 1 kam von Kornath et al., denen die Bildung von 1 durch die Protonierung von Ca[C(CN)3]2 mit HF gelang,11 während Banert et al. verschiedene Synthesewege verfolgten, darunter die Umsetzung der Alkalimetallsalze des [C(CN)3]− mit H2SO4 und anschließende Sublimation, welches sich als die beste Variante herausstellte.9
Das tautomere Gleichgewicht zwischen Tricyanmethan (1) und Dicyanketenimin (2) in Lösung ist von Kornath, Banert und anderen diskutiert worden (Schema 1).12, 13 Dieses Gleichgewicht wird für die thermodynamische Instabilität der Brønsted-Säure in Lösung verantwortlich gemacht, da das Dicyanketenimin dazu neigt, schnell zu oligomerisieren (Abbildung S1).9 Das durch Photolyse gebildete Dicyanketenimine (2) wurde bisher nur in einer Argon-Matrix nachgewiesen,9 jedoch nicht in quantitativen Mengen, da es in Lösung sofort polymerisiert. Hier berichten wir, dass die Substitution von H+ durch das “große metallorganische Proton”14-16 [Me3Si]+ zu einem Austausch von Kohlenstoff als Donoratom gegen Stickstoff als Donoratom im [C(CN)3]−-Anion führt und das lange gesuchte Ketenimin-Tautomer (4) als einkristallines Material erhalten wurde. Dies gilt auch für alle weiteren Silylierungsschritte, die letztlich zur Bildung eines stabilen [(Me3Si−NC)3C]2+-Dikation führen, bei dem ausschließlich alle drei terminalen N-Atome als Donoratome fungieren.
Dieses Projekt wurde mit der Optimierung der Literatursynthese von 1 und dem Silbersalz Ag[C(CN)3] begonnen (siehe ESI). Ausgehend von hochreinem Ag[C(CN)3], Na[C(CN)3] und HC(CN)3 sind verschiedene Ansätze ausprobiert worden, um entweder die silylierte Tricyanmethan-Spezies [Me3Si−C(CN)3] (3) oder Dicyanketenimin-Spezies [Me3Si−NC−C(CN)2] (4) zu erhalten (Schema 2, Weg A–C). Die Synthese ausgehend von Na[C(CN)3] und (Me3Si)2SO4 führte in Abwesenheit des Lösungsmittels zu schlechten Ausbeuten und in Gegenwart von DMSO-d6 wurde keine Reaktion beobachtet (Weg B); die Reaktion von HC(CN)3 mit Me3SiH funktionierte ebenfalls nicht, obwohl molekularer Wasserstoff als Nebenprodukt hätte gebildet werden sollen (Weg C). Der beste Syntheseweg in Hinblick auf Durchführbarkeit, Ausbeute und Reinheit der Produkte ist die Reaktion von Ag[C(CN)3] mit Me3Si−I in Diethylether bei −80 °C (Weg A). Nach 4.5 h Reaktionszeit bei −80 °C wurden alle flüchtigen Bestandteile entfernt und es blieb ein hellgelber Rückstand zurück. Die Umkristallisation aus Diethylether bei −40 bis −80 °C führte zur Bildung farbloser Einkristalle mit einer Ausbeute von 54 %. Zu beachten ist, dass die gelbe Farbe bereits durch Spuren von Oligomeren verursacht wird. Selbst bei Temperaturen von bis zu −80 °C lässt sich das Einsetzen der Oligomerisation nicht vollständig verhindern.
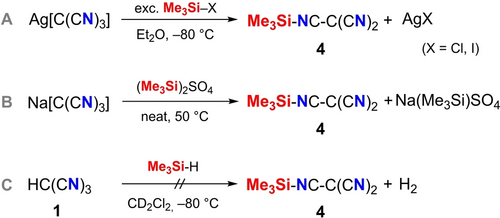
Silylierungsreaktionen vom Tricyanmethanid-Salz und HC(CN)3.
Einkristallröntgenstrukturdaten bewiesen eindeutig das Vorhandensein des bisher unbekannten Dicyanketenimin-Tautomers [Me3Si−NC−C(CN)2] (4) im Festkörper (Abbildung 1, Mitte). Im Gegensatz zu HC(CN)3 ist das Ketenimin 4 bereits im festen Zustand bei Raumtemperatur instabil, sodass es bei Temperaturen von unter −40 °C nur wenige Tage im Kühlschrank gelagert werden kann. Nach dieser Zeit ist bereits eine erhebliche Polymerisation zu beobachten. In Lösung beginnt 4 bei RT sofort zu oligomerisieren; bei niedrigerer Temperatur verläuft diese langsamer, d. h. die Analytik in Lösung muss sehr schnell durchgeführt werden. Dennoch konnten 1H-, 13C-, 15N- und 29Si-NMR-Daten erhalten werden (siehe ESI). Wie für eine kovalent gebundene Me3Si-Gruppe erwartet, wird das Signal für Me3Si bei δ[29Si] = 7.4 und für die N-Atome eine breite Resonanz bei δ[15N] = −231.8 ppm beobachtet [vgl. 2.4 und −345.0 ppm in N(SiMe3)3].17 Die Bildung des Ketenimin-Tautomers kann auch durch Raman-Spektroskopie bestätigt werden. Während für das C3v-symmetrische HC(CN)3 zwei Raman-Banden beobachtet werden (νs(CN, A1) = 2287, νas(CN, E) = 2269 cm−1),9 was auch für das silylierte Tricyanmethan erwartet worden wäre (3, Schema 1), werden im Raman-Spektrum drei CN-Schwingungsbanden (ν1(CN, A′) = 2243, ν2(CN, A′′) = 2207, ν3(CN, A′) = 2180 cm−1) aufgrund der Symmetrieerniedrigung von C3v auf Cs in 4 gefunden.
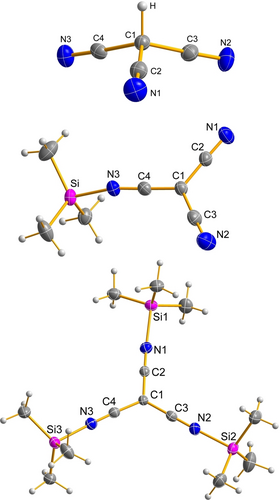
ORTEP von 1 (oben), 4 (Mitte) und 5[B(C6F5)4]2 (unten, Anionen zur besseren Übersicht nicht dargestellt) im Festkörper. Thermische Ellipsoide mit 50 % Wahrscheinlichkeit (123 K). Ausgewählte Strukturdaten sind in Tabelle 1 aufgeführt. Intermolekulare Wechselwirkungen in 1 und 4 sowie im Anion von 5[B(C6F5)4]2 sind in den Abbildungen S1–S5 abgebildet.
Die erfolgreiche Synthese des Ketenimins 4 veranlasste dazu, weitere Silylierungsreaktionen mit dem Ziel zu versuchen, das Monokation [(Me3Si−NC)2C(CN)]+ (6+) und das persilylierte Dikation [(Me3Si−NC)3C]2+ (52+) als [B(C6F5)4]−-Salz darzustellen (Schema 3). Zu diesem Zweck wird das Borat-Salz [Me3Si−H−SiMe3][B(C6F5)4] in Toluol gelöst und mit einer Suspension von HC(CN)3 (1) in Toluol bei −80 °C umgesetzt. Es ist wichtig zu beachten, dass die Suspension von 1 in Toluol bei RT sehr schnell hergestellt und zum Borat-Salz zugegeben werden muss, da die Oligomerisierung von 1 bei RT schnell erfolgt. Nach einer Reaktionszeit von 2 h bei −80 °C beginnt die Aufarbeitung mit einer langsamen Erwärmung auf 50 °C, bei der die Bildung einer gelben Lösung mit einem orangefarbenen Niederschlag beobachtet wird. Die Umkristallisation aus Fluorbenzol/n-Hexan führte zur Isolierung farbloser Kristalle (Ausbeute 77 %), die für die Einkristallröntgenstrukturanalyse geeignet waren. Diese Untersuchungen zeigten das Vorhandensein eines [B(C6F5)4]−-Salzes mit dem ungewöhnlichen [(Me3Si−NC)3C]2+ (52+) Dikation, bei dem alle drei Silylgruppen an das Stickstoff-Atom der drei CN-Gruppen gebunden sind (Abbildung 1, unten). Das Dikation-Salz 5[B(C6F5)4]2 mit drei Silylgruppen ist wesentlich stabiler als das monosilylierte, neutrale Ketenimin 4; eine spontane Zersetzung tritt im Festkörper erst oberhalb von 105 °C auf. Lösungen von 52+ können bei Raumtemperatur gehandhabt werden und sind auch robuster in Bezug auf Oligomerisation. Die chemische Verschiebung bei 42.4 ppm im 29Si-NMR-Spektrum ist im Vergleich zu der von 4 (vgl. 7.4 ppm) leicht tieffeldverschoben. Dasselbe gilt für das 15N-NMR-Signal bei −209.2 ppm (vgl. −231.8 ppm für 4). IR-spektroskopische Untersuchungen zeigen eine Bande bei 2245 cm−1, die der νas(CN) (E-Symmetrie; vgl. 2269 cm−1 in 1) für das C3v-symmetrische 52+ in Übereinstimmung mit Rechnungen zugeordnet werden kann (siehe ESI). Schließlich wurde die Synthese der disilylierten, monokationischen Spezies, [(Me3Si−NC)2C−CN]+ als [B(C6F5)4]−-Salz (6[B(C6F5)4], Schema 3) durch die Umsetzung von 5[B(C6F5)4]2 mit dem monosilylierten Ketenimin 4 bei −60 °C in CH2Cl2 versucht. Reaktionskontrollversuche unter Verwendung von 1H- und 29Si-NMR-Experimenten zeigten jedoch, dass sich bei RT ein hochdynamisches Gleichgewicht einstellt und gleichzeitig eine Zersetzung beobachtet wird, während das Salz 5[B(C6F5)4]2 bei niedrigen Temperaturen auskristallisiert, da es eine geringere Löslichkeit als das monokationische Salz 6[B(C6F5)4] aufweist. Daher scheiterten alle Versuche, das hochlabile 6[B(C6F5)4] zu isolieren.
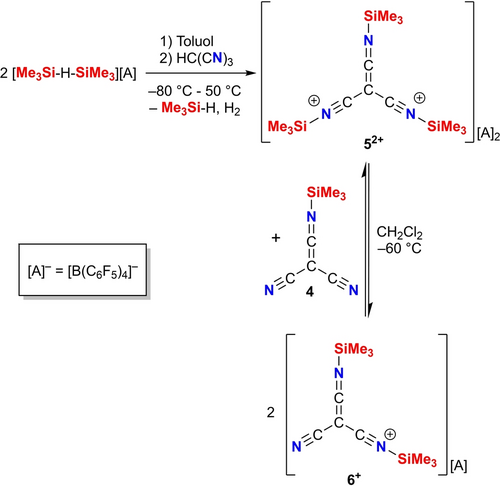
Synthese von 5[B(C6F5)4]2 und 6[B(C6F5)4].
Alle drei formalen [C(CN)3]-Derivate (1, 4 und 5[B(C6F5)4]2) konnten isoliert und mittels Einkristallröntgenstrukturanalyse untersucht werden (Abbildung 1). Ketenimin 4 und das Salz 5[B(C6F5)4]2 kristallisieren in den monoklinen Raumgruppen C2/c bzw. P21/n, während für die Kristalle von 1 die orthorhombische Raumgruppe Pna21 gefunden wurde.9 Für alle drei Strukturen wurde eine C(CN)3-Einheit als strukturelles Kernmotiv gefunden. Darüber hinaus findet man für 1 drei Wasserstoffbrückenbindungen (C−H⋅⋅⋅N) pro C−H-Bindung mit Stickstoff-Atomen von drei benachbarten HC(CN)3-Molekülen (Abbildung S1). Kurze
Si−C(H2)−H⋅⋅⋅N-Kontakte, die auf schwache van-der-Waals-Wechselwirkungen hindeuten, werden auch in 4 beobachtet, was zur Bildung eines 3D-Netzwerks innerhalb des Kristalls führt (Abbildung S3), während in 52+ keine signifikanten interionischen Wechselwirkungen beobachtet werden. Das auffälligste Strukturmerkmal in allen betrachteten Spezies ist die Struktur der C(CN)3-Einheit, die bei 1 und 52+ C3v-symmetrisch, bei 4 jedoch nur annähernd Cs-symmetrisch ist. Während 1 jedoch eine stark verzerrte tetraedrische Molekülstruktur mit einer starken Abweichung von der Planarität der C(CN)3-Einheit aufweist (Σ∢C1=335.9(6)°), nimmt 4 eine nahezu trigonal-planare Umgebung um das zentrale C-Atom ein (Σ∢C1=360.0(3)°), gleiches gilt für 52+ (Σ∢C1=360.0(6)°, Tabelle 1). Die Planarität der C(CN)3-Einheit sowie die etwas kürzeren C−C- und etwas längeren C−N-Abstände in 4 und 52+ im Vergleich zu 1 weisen auf eine bessere Resonanzstabilisierung der π-Elektronen innerhalb der C(CN)3-Einheit in den silylierten Verbindungen hin.
|
1 |
4 |
52+ |
|---|---|---|---|
C1−C2 |
1.478(3) |
1.417(2) |
1.405(4) |
C1−C3 |
1.477(3) |
1.419(2) |
1.401(4) |
C1−C4 |
1.478(4) |
1.372(2) |
1.405(4) |
C2−N1 |
1.134(3) |
1.147(2) |
1.146(3) |
C3−N2 |
1.136(3) |
1.145(2) |
1.147(3) |
C4−N3 |
1.130(4) |
1.156(2) |
1.141(3) |
N1−Si1 |
– |
1.8035(9) |
1.863(2)[a] |
C2−C1−C3 |
112.0(2) |
119.63(9) |
120.1(2) |
Σ∢C1[b] |
335.9(6) |
360.0(3) |
360.0(6) |
C4−N3−Si1 |
– |
161.62(9) |
173.4(5)[a] |
C2−C1−C3−C4 |
127.1(3) |
179.7(2) |
176.8(5) |
N1−C1−N2−N4 |
129.8(2) |
178.9(1) |
176.1(3) |
- [a] Durchschnittswert. [b] Summe der Winkel um C1.
Um die Thermodynamik und die Bindungssituation insbesondere in Bezug auf die Tautomere 1/2 und 3/4 zu untersuchen, wurden DFT- (PBE(0)-D3 zur Strukturoptimierung) und ab-initio-Rechnungen (DPLNO-CCSD(T) für exakte Energien) unter Verwendung eines def2-QZVP-Basissatzes durchgeführt. Für das tautomere Gleichgewicht in CD2Cl2-Lösung wurde eine klare Präferenz für Tricyanmethan 1 gegenüber Dicyanketenimin 2 mit einer Gibbs-Enthalpie-Differenz von 38.5 kJ mol−1 berechnet (Tabelle S10). Diese Situation verändert sich, wenn Wasserstoff gegen Me3Si ausgetauscht wird. In diesem Fall kehrt sich die Situation um und das Ketenimin-Tautomer 4 ist gegenüber 3 energetisch um ca. 39.9 kJ mol−1 begünstigt. Interessanterweise ist die Verzerrung der planaren C(CN)3-Einheit nicht für diese Trendumkehr verantwortlich, da die Differenz der Verzerrungsenergien zwischen Methan und Ketenimin mit ca. 18 kJ mol−1 überraschend gering (Tabelle S15) und vor allem für die beiden Systeme 1/2 (17.6) und 3/4 (17.8 kJ mol−1) nahezu identisch ist. Das wiederum bedeutet, dass die verbesserte Delokalisation der π-Elektronen in den Ketenimin-Tautomeren nicht für diese entgegengesetzten Energietrends verantwortlich sind. Der NBO-Analyse zufolge zeigt der Vergleich der sterischen Austauschenergie, dass diese in den Ketenimin-Tautomeren deutlich kleiner ist, allerdings nimmt diese Differenz beim Übergang vom H-substituierten Paar 1/2 zum silylierten Paar 3/4 deutlich zu (−174 kJ mol−1, Tabelle S13). Es ist daher anzunehmen, dass die deutlich größere Me3Si-Gruppe zu einer wesentlich größeren sterischen Abstoßung im Methan-Tautomer führt, sodass es energetisch günstiger wird, wenn es die Ketenimin-Struktur annimmt, bei der die sterische Abstoßung deutlich geringer ist (Tabelle S13).
Die energetisch günstigsten NBO-Lewis-Darstellungen von [C(CN)3]−, 1, 4 und 52+ sind in Schema 4 dargestellt. Sie zeigen für alle das Vorliegen einer 8π-Elektronen-7-Zentren-Bindung (gebildet aus einem freie Elektronenpaar am zentralen Kohlenstoff-Atom zusammen mit drei CN-π-Bindungen). Das am zentralen Kohlenstoff-Atom lokalisierte freie Elektronenpaar ist stark in die leeren, antibindenden π*(CN)−Bindungen delokalisiert, was zu einer Resonanz mit Lewis-Formeln führt, die eine Czentral=C=N(−)-Einheit enthalten (Schema 1 und Schemata S5–S10). Die Delokalisation des freien Elektronenpaares am zentralen C-Atom (pz-Elektronenpaar-NBO) lässt sich auch an den Besetzungszahlen ablesen, die mit 1.34 (4), 1.42 (52+) und 1.43 ([C(CN)3]−) deutlich vom Idealwert von 2 abweichen. Neben dem π-System ober- und unterhalb der Molekülebene, gibt es auch ein π-System in der Ebene, das in allen Spezies zu der erwarteten CN-Dreifachbindung führt. In den silylierten Verbindungen ist das π-System teilweise noch weiter in die Me3Si-Gruppen delokalisiert, wobei der hyperkonjugative Effekt nur schwach ausgeprägt ist (Schema S7). Eine genauere Betrachtung der Molekülorbitale ergab ein ähnliches Bild (Abbildung 2). Im Fall der silylierten Verbindungen zeigen die π-MOs eine weitere schwache Wechselwirkung mit den Silylgruppen, was zu einer zusätzlichen Stabilisierung führt. Schließlich zeigen die berechneten Partialladungen ein negatives C-Atom (ca. −0.5) und eine alternierende Polarität in den Bindungen entlang C(zentral)(−)−C(+)−N(−). Protonierung oder Silylierung erhöhen den Ladungstransfer von [C(CN)3]− zu H+/Me3Si+ entlang der Reihe:
Bevorzugte Lewis-Darstellungen von 1, 4, und 52+ gemäß der NBO-Analysen im Vergleich zu [C(CN)3]−.
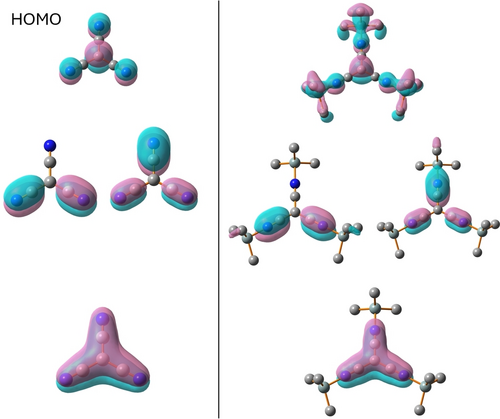
Molekülorbitale von [C(CN)3]− und 52+, die die 8π-Elektronen-Bindung beschreiben.
4 (−0.38e) < 1 (−0.66e) < 52+ (−0.71e).
Zusammenfassend lässt sich sagen, dass es zum ersten Mal gelungen ist, das lange gesuchte, sehr labile Dicyanketenimin (4) zu synthetisieren und vollständig zu charakterisieren, indem das Proton im Cyanoform (1) durch ein Trimethylsilyl-Kation ersetzt wird, wodurch diese Lücke in der Chemie der Methanide und Cyanide geschlossen wird. Berechnungen zeigen, dass die größere sterische Abstoßung im Tricyanmethan-Tautomer im Vergleich zum Dicyanketenimin die Stabilitätsänderung verursacht, wenn der Wasserstoff durch Me3Si ersetzt wird. Eine weitere Silylierung des silylierten Ketenimins (4) führt zur Bildung eines neuen, persilylierten Dikations [(Me3Si-NC)3C]2+ (52+), welches durch ein schwach koordinierendes Gegenion weiter stabilisiert wird, wodurch das einst negativ geladene Anion [C(CN)3]− formal zu einem Dikation wird.
Hintergrundinformationen
Die Autoren haben zusätzliche Referenzen in den Hintergrundinformationen angegeben.[18–55,56] Die Einträge 2158912 (für 1), 2370187 (für 4) und 2370188 (für 5[B(C6F5)4]2) enthalten die ergänzenden kristallographischen Daten für die Arbeit. Diese Daten werden vom Cambridge Crystallographic Data Centre und dem Fachinformationszentrum Karlsruhe kostenlos zur Verfügung gestellt.
Danksagung
J.S. möchte der Deutschen Forschungsgemeinschaft (DFG, SCHU 1170/12-2) für die finanzielle Unterstützung danken. Der Universität Rostock und insbesondere M. Willert wird für den Zugang zum Clusterrechner und die Unterstützung bei der Software-Installation gedankt. Open Access Veröffentlichung ermöglicht und organisiert durch Projekt DEAL.
Interessenkonflikt
Die Autoren erklären, dass keine Interessenkonflikte vorliegen.
Open Research
Data Availability Statement
Die Daten, die die Ergebnisse dieser Studie unterstützen, sind in den Hintergrundinformationen zu diesem Artikel verfügbar.




