Anodisches Recycling von gängigen Polymeren: Die Kombination von Eisen-Elektrokatalyse und skalierbarer Wasserstoffentwicklungsreaktion
Abstract
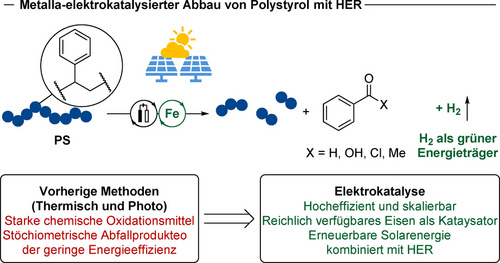
Kunststoffe sind in unserem Alltag allgegenwärtig, und die Akkumulation von Kunststoffabfällen in unserer Umwelt stellt ein großes gesellschaftliches Problem dar. Daher sind Methoden für das Recycling von Kunststoffabfällen im Hinblick auf eine künftige Kreislaufwirtschaft von hohem Interesse. Insbesondere der Abbau von Polymeren nach Nutzung durch Verbraucher hin zu wertschöpfenden kleinen Molekülen stellt eine nachhaltige Strategie für eine Kohlenstoff-Kreislaufwirtschaft dar. Trotz jüngster Fortschritte ist der chemische Polymerabbau nach wie vor weitgehend auf chemische Redox-Reagenzien beschränkt oder durch eine geringe Energieeffizienz photochemischer Prozesse limitiert. In dieser Arbeit berichten wir über einen leistungsstarken eisenkatalysierten Abbau von Polystyrolen mit hohem Molekulargewicht durch Elektrochemie, um effizient monomere Benzoylprodukte zu liefern. Die Robustheit der Ferraelektrokatalyse wurde durch den Abbau von verschiedenen realen Nach-Gebrauchs-Kunststoffen, ebenfalls im Gramm-Maßstab, bestätigt. Die kathodische Halbreaktion wurde weitgehend durch die Wasserstoffentwicklungsreaktion (HER) dargestellt. Der skalierbare elektrolytische Polymerabbau konnte ausschließlich mit Solarenergie über ein handelsübliches Solarpanel betrieben werden, was auf ein herausragendes Potenzial für eine dezentralisierte, grüne Wasserstoffwirtschaft hinweist.
Einleitung
Aufgrund ihrer geringen Kosten, der Wasserbeständigkeit, Langlebigkeit und der einfachen Herstellung spielen Kunststoffe in vielen Bereichen unserer modernen Gesellschaft eine wichtige Rolle.1 Allerdings werden derzeit weniger als 10 % der weltweit produzierten Kunststoffe recycelt, während weniger als 1 % mehr als einmal recycelt wird.1b, 2 Als unmittelbare Folge dieser niedrigen Recyclingrate häufen sich die Kunststoffabfälle auf Deponien und in Gewässern an und bedrohen die Tierwelt und die Umwelt. Es wird erwartet, dass diese Ansammlung von Kunststoffen bis 2025 auf 40 Milliarden Tonnen anwachsen wird.2, 3
Unter den dort vertretenden Kunststoffen hat Polystyrol (PS), häufig verwendet für Verpackungen und im Bauwesen,4 eine geringe Recyclingquote von 1 % und macht weltweit einen Anteil von ungefähr 33 % in Mülldeponien aus.5 Die globale Produktionskapazität von Polystyrol erreichte im Jahr 2022 mehr als 15.4 Millionen Tonnen und wird in den nächsten Jahren voraussichtlich leicht ansteigen.6 Daher stellt das Recycling von Kunststoffen, insbesondere von Polystyrol, eine große gesellschaftliche Herausforderung für die Menschheit dar. Daher ist der Zugang zu effektiven, skalierbaren, nachhaltigen und kostengünstigen Methoden eine wesentliche Voraussetzung für das Kunststoffrecycling.
In den letzten Jahrzehnten wurden verschiedene Ansätze für das Polymerrecycling in Betracht gezogen.7 Eine häufig verfolgte Strategie ist die Funktionalisierung einer bestehenden Polymerkette, wodurch ein neues, funktionalisiertes Material mit vom Ausgangspolymer verschiedenen Eigenschaften entsteht.8, 9, 10, 11, 12
Der Abbau des Polymerrückgrats durch C−C-Spaltung in kleine nutzbare Moleküle stellt eine zweite Hauptstrategie für das chemische Kunststoffrecycling dar.13 In den letzten Jahrzehnten wurde dieser vielversprechende Ansatz mit thermischen Methoden14 sowie mit photokatalytischen Strategien erforscht.15 In diesem Zusammenhang berichtete Sen über eine Hochtemperatur-/Hochdruck-Depolymerisation von Polystyrol unter Sauerstoffatmosphäre, bei der Benzoesäure gewonnen wird.14a Dieser Ansatz wurde von Stahl und Beckham unter Übergangsmetallkatalyse und Hochdruck-Sauerstoffatmosphäre weiter untersucht.14b Aufgewertete Chemikalien konnten ebenfalls durch Biokonversion erhalten werden.14b Kürzlich berichtete Lim über eine organokatalysierte Depolymerisation von Polystyrol unter Luftatmosphäre, bei der ein Gemisch aromatischer Säuren entsteht.14c In den letzten Jahren wurden photokatalytische Ansätze aufgrund der im Allgemeinen milden Bedingungen oder der geringeren Kosten intensiv erforscht.15 In diesem Zusammenhang beschrieb Stache einen katalysierten Abbau von Polystyrol unter weißer LED-Bestrahlung.15a Verbesserte Ausbeuten wurden von Das auf elegante Weise durch Photooxidation von verarbeiteten Polystyrolen mit N-Bromsuccinimid realisiert.15b Während in jüngster Zeit elektrochemische organische Transformationen erheblich an Aufmerksamkeit gewonnen haben,16 ist der elektrochemische Abbau von Polymeren nach wie vor kaum untersucht.7, 17-23 Zwar wurde bereits ein NHPI/PINO-vermittelter (N-Hydroxyphthalimid/Phthalimid-N-Oxyl) elektrochemischer Abbau von Polystyrol beschrieben, so ist dieser Ansatz aber auf geringe Molekulargewichte beschränkt und das elektrokatalytische Recycling von PS-Abfällen hat sich als schwer durchführbar erwiesen.18 Im scharfen Kontrast dazu haben wir, auch im Rahmen unseres Programms zur Aufwertung von Polymeren durch C−H-Aktivierung,12, 24 nun eine Übergangsmetall-Elektrokatalyse entwickelt, um eine C−C-Spaltung innerhalb des Polystyrol-Rückgrats durch elektrokatalysierte Depolymerisation von Polystyrol zu erzielen. Hierbei konzentrierten wir uns auf die Verwendung von ungiftigen, kostengünstigen Übergangsmetallkatalysatoren mit hoher natürlicher Verfügbarkeit für ein nachhaltiges Elektro-Upcycling von Polystyrol. Zu den herausragenden Merkmalen unseres elektrochemischen Polymerrecyclings gehören a) eine hohe Effizienz, b) häufig vorkommendes Eisen als Katalysator, c) Elektrokatalyse betreibbar durch Sonnenenergie und d) synthetisch nutzbare anodische Reaktion für HER (Abbildung 1).
Elektrochemischer eisenkatalysierter Abbau von Polystyrol mit gekoppelter HER.
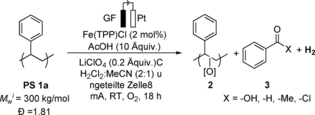
Ergebnisse und Diskussion
Während unserer vorherigen Studien zur elektrokatalysierten Aufwertung von Polymeren durch C(sp3)−H-Azidierung12 deuteten orientierende Experimente darauf hin, dass 3d-Übergangsmetall-Katalysatoren eine benzylische Oxidation durchführen können,24 die zu einer C−C-Spaltung des Polymerrückgrats führt. Daher verwendeten wir zunächst Eisen(III)- und Kobalt(II)-Salze als Präkatalysatoren unter elektrokatalytischen Bedingungen, um den Abbau von Polystyrol durchzuführen.12 So wurde kommerziell erhältliches PS 1 a (Mwi von 300 kg/mol) unter konstantem Strom bei 8 mA unter Verwendung einer Platin-Kathode und einer Graphitfilz (GF)-Anode in einer Mischung aus Dichlormethan und Acetonitril unter Sauerstoffatmosphäre elektrolysiert. Erfreulicherweise konnten wir eine signifikante Abnahme des Molekulargewichts von PS 1 a mit einer Retention des Molekulargewichts von weniger als 1 % beobachten. Allerdings konnten nur 7.0 % und 5.6 % der angestrebten Benzoylprodukte 3 nachgewiesen werden (Tabelle 1, Einträge 2–3). Ermutigt von diesen initialen experimentellen Ergebnissen wurden verschiedene Metallsalze für den elektrochemischen Polystyrolabbau untersucht (siehe Hintergrundinformationen Tabelle S3). So wurde ein Porphyrin-basierter Mangankatalysator (Mn(TPP)Cl) verwendet, wodurch die Benzoylprodukte mit einer Ausbeute von 4.7 % und PS-Oligomere mit einem mittleren Molekulargewicht von 5.6 kg/mol erhalten wurden (Tabelle 1, Eintrag 4). Ebenso erwiesen sich ungiftige und kosteneffiziente Eisenkatalysatoren als geeignet, um Polystyrol unter elektrokatalytischen Bedingungen effizient zu depolymerisieren (siehe Hintergrundinformationen Tabelle S3). Wir entschieden uns anschließend für den Einsatz von Tetraphenylporphyrin- und Phthalocyanin-Eisen(III)-chlorid-Komplexen (Tabelle 1, Einträge 1 und 5). Der Abbau von Polystyrol verlief effizient und führte zu Oligomeren 2 mit niedrigem Molekulargewicht (weniger als 1 kg/mol) und 13.9 % (±0.5 %) bzw. 12.2 % Benzoylprodukten (Tabelle 1, Einträge 1 und 5). Hierbei wurde Benzoesäure (11.3 %±0.7 %) als Hauptabbauprodukt identifiziert, zusammen mit Benzaldehyd (1.5 %±0.2 %), Spuren von Benzoylchlorid (0.6 %±0.1 %) und Acetophenon (0.5 %±0,1 %) (Tabelle 1, Eintrag 1), sowie Oligomere mit niedrigem Molekulargewicht (0.8±0.1 kg/mol; Đ=1.85), wobei diese für den Großteil der Massenbilanz verantwortlich sind (Tabelle 1, Eintrag 1). Als nächstes wurden verschiedene Reaktionsmedien (siehe Hintergrundinformationen Tabelle S1) untersucht, und ein Lösungsmittelgemisch erwies sich ebenfalls als praktikabel und erzielte 14.1 % der Benzoylprodukte (Tabelle 1, Eintrag 6). Um die Verwendung einer teuren Platin-Kathode zu vermeiden, wurde Edelstahl (StSt) als Elektrodenmaterial verwendet, wobei 12 % der Benzoylprodukte und 1.3 kg/mol Oligomere 2 erhalten wurde (Tabelle 1, Eintrag 7). Ohne Strom wurden keine Benzoylprodukte erhalten, und es wurde fast kein Abbau des Polymerrückgrats beobachtet (Tabelle 1, Eintrag 8). Der elektrokatalytische Polymerabbau war ebenso unter Luft möglich, wenn auch mit etwas geringerer Wirksamkeit (Tabelle 1, Eintrag 9). Eine Verlängerung der Elektrolysezeit auf 64 h führte zu 18.5 % der Benzoylprodukte 3 und niedermolekularen Oligomeren 2 (Tabelle 1, Eintrag 1[e]).
|
|||
Eintrag |
Abweichung |
Mwf (kg/mol)[b] [Mwf/Mwi (%)][c] |
Summe Benzoylprodukte (%)[d] |
|---|---|---|---|
1 |
Keine[e] |
0.8 (±0.1)[f] [0.2 %] |
13.9 % (±0.5 %)[f] |
2 |
FeCl3 |
2.6 [0.9 %] |
7.0 % |
3 |
CoCl2 ⋅ 6H2O |
1.4 [0.5 %] |
5.6 % |
4 |
Mn(TPP)Cl |
5.6 [1.9 %] |
4.7 % |
5 |
Fe(Pc)Cl |
0.9 [0.3 %] |
12.2 % |
6 |
DCE/MeCN (2 : 1) |
1.3 [0.4 %] |
14.1 % |
7 |
StSt-Kathode |
1.3 [0.4 %] |
12.0 % |
8 |
Ohne Strom |
287 [95.3 %] |
– |
9 |
Unter Luft |
3.6 [1.2 %] |
8.3 % |
- [a] Unter Verwendung von 1 mmol (104 mg) PS basierend auf der Monomereinheit mit 2 mol % des Katalysators, LiClO4 (0.2 Äquiv.), AcOH (10 Äquiv.), Platin (Kathode) und GF (Anode) in 6 mL eines Gemischs von CH2Cl2:MeCN (2 : 1) unter galvanostatischen Bedingungen bei 8 mA für 18 h bei Raumtemperatur. [b] Bestimmung durch Gelpermeationschromatographie in Bezug auf Polystyrol-Standards mit THF als Eluent. [c] Mwf: Molekulargewicht nach der Abbaureaktion, Mwi: Molekulargewicht des Polystyrol-Startmaterials. [d] Bestimmt durch GC in Bezug auf 1,3,5-Trimethoxybenzol. [e] Eine Verlängerung der Reaktionszeit auf 64 h führte zu 18.5 % der Produkte 3. [f] Mittelwert mit Standardabweichung basierend auf fünf Durchläufen. GF: Graphitfilz. TPP: Tetraphenylporphyrin. Pc: Phthalocyanin.
Weiterhin untersuchten wir die Oligomere, die wir nach dem Metalla-Elektroabbau des Polystyrols 1 a unter den angegebenen Standardbedingungen erhielten (Tabelle 1, Eintrag 1). Die Analyse der resultierenden Oligomere 2 deutet auf einen signifikanten Abbau von Polystyrol durch C−C-Spaltung hin (Schema 1). Darüber hinaus wies das IR-Spektrum der Oligomere eine charakteristische Schwingung bei 1715 cm−1 auf, die als C=O-Streckschwingung identifiziert wurde (siehe Hintergrundinformationen für detaillierte Informationen), was auf einen Oxidationsprozess des Polymerrückgrats während der elektrokatalytischen Depolymerisation schließen lässt.
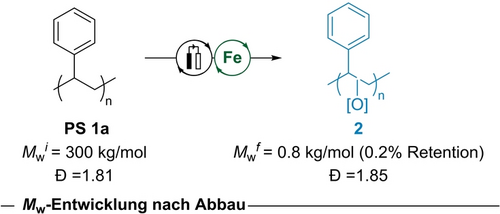
Molekulargewicht der resultierenden Oligomere nach dem Metalla-elektrochemischen Abbau von Polystyrol 1 a.
Mit den optimierten Bedingungen in der Hand untersuchten wir eine mögliche Anwendungsbreite für unseren elektrochemischen Polystyrolabbau. Zunächst untersuchten wir den Einfluss des Molekulargewichts von Polystyrol 1 und stellten erfreut fest, dass sich das Molekulargewicht nicht auf das Ergebnis der Abbaureaktion (1 a–1 f) auswirkt. Alle diese PS (1 a–1 f) produzierten Oligomere 2, die ein reduziertes Molekulargewicht aufwiesen (0.7 kg/mol), sowie bis zu 15.2 % der Monomereinheiten. 4-Methylpolystyrol 1 g wurde ebenfalls der Elektrolyse unterzogen, um Oligomere (2.3 kg/mol) und eine mäßige Ausbeute an Benzoyl-Produkten zu erhalten. Bei der Zersetzung von tert-Butylpolystyrol 1 h konnten 7.7 % tert-Butylbenzoylprodukte erzeugt werden. Es ist hervorzuheben, dass auch Kunststoffabfälle die Additive wie Farbstoffe beinhalten, welche die C−C-Spaltung möglicherweise inhibieren,15a unter unserer elektrokatalytischen Depolymerisation eingesetzt wurden. So zeigte unser elektrokatalytischer Abbau eine gute Kompatibilität mit einer Vielzahl von bereits verwendeten Polystyrol-Produkten. Tatsächlich konnte in allen Fällen eine signifikante und effiziente Verringerung des durchschnittlichen Molekulargewichts festgestellt werden. Darüber hinaus wurden gefärbte Polystyrolabfälle (1 i–1 l), wie Kaffeedeckel, Becher, Joghurtbecher oder Käseverpackungen, effizient zu Benzoylprodukten 4 depolymerisiert, wenn auch mit reduzierter Wirksamkeit, was zu einer Benzoesäureausbeute von bis zu 9.7 % führte. Mehrere alltägliche Polystyrolabfälle (1 m–1 o) wurden ebenfalls unter unseren elektrokatalytischen Bedingungen abgebaut. Es wurde eine effiziente Zersetzung der verschiedenen Polystyrol-Komposite mit geringer Mw-Retention beobachtet, allerdings wurden die entsprechenden Benzoylprodukte in reduzierter Ausbeute gewonnen, was auf einen leichten Einfluss von Additiven auf die Reaktionseffizienz hinweist. Darüber hinaus wurde der in der Gebäudeisolierung4 weit verbreitete Schaumstoff auf Polystyrolbasis 1 p effizient depolymerisiert. Es wurden Benzoylprodukte mit einer Ausbeute von 14.2 % erhalten, wobei Benzoesäure das Hauptabbauprodukt ist (Schema 2).
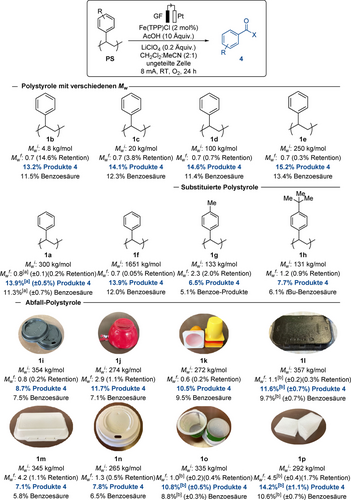
Abbau von Polystyrolen mit unterschiedlichem Molekulargewicht, substituierten Polystyrolen und Polystyrolabfällen. [a] Durchschnittliche Ausbeute auf Grundlage von fünf Reaktionen. [b] Durchschnittliche Ausbeute auf Grundlage von drei Reaktionen. Mw angegeben in kg/mol.
Ermutigt durch diese Ergebnisse und um die Anwendbarkeit und den Nutzen dieser Depolymerisation weiter zu demonstrieren, führten wir eine Depolymerisation von Polystyrol 1 a im Gramm-Maßstab durch. Der Eisen-elektrokatalysierte Abbau von Polystyrol wurde in einem 30 mmol-Maßstab (3.14 g) durchgeführt, wobei 9.4 % Benzoesäure (5) isoliert werden konnte (Schema 3A). In Anbetracht der gezeigten Anwendungsbreite und herausragenden Robustheit wurde ein Gemisch von 3 g ungereinigtem Polystyrol aus alltäglichen Anwendungen unter ansonsten identischen Reaktionsbedingungen verwendet. Hierdurch wurden Oligomere mit niedrigem Molekulargewicht 2 (1.5 kg/mol) und 8.7 % Benzoesäure (5) erhalten (Schema 3A). Um das Potenzial unseres elektrokatalysierten Kunststoffabbaus für die Umwandlung erneuerbarer Energieformen in Benzoylverbindungen und molekularen Wasserstoff weiter zu demonstrieren, führten wir die galvanostatische Elektrolyse ausschließlich mit erneuerbarer Solarenergie durch.25 Unter Verwendung einer handelsüblichen Photovoltaikzelle als Stromquelle lieferte die Abbaureaktion von Polystyrol 1 a 9.3 % der gewünschten Produkte 3 (Schema 3B).
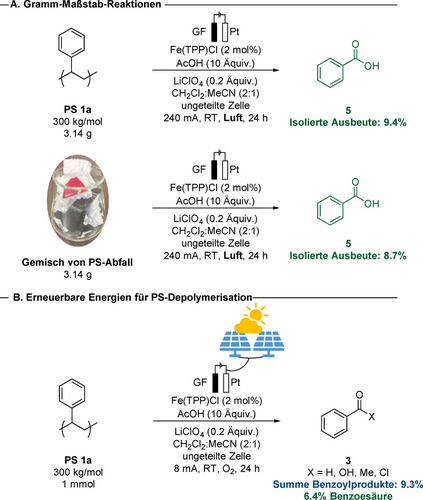
A. Abbau von Polystyrol im Gramm-Maßstab und von einem Gemisch verschiedener Abfälle. B. PS-Abbau betrieben durch Solarenergie.
Um die Wasserstoffentwicklungsreaktion zu verifizieren, führten wir eine gaschromatographische Analyse der Gasphase des Reaktionsgefäßes durch und konnten die Bildung von molekularem Wasserstoff als Hauptnebenprodukt qualitativ bestätigen (Abbildung 2A). Darüber hinaus verfolgten wir die Gasentwicklung während des Eisen-elektrokatalysierten Abbaus von Polystyrol. Nach Abschluss der Depolymerisation wurden 35 mL (1.56 mmol basierend auf dem Modell des idealen Gases) Gas produziert, was die HER als vorherrschenden kathodischen Prozess bestätigt. Da allerdings aus der Literatur bekannt ist, dass CO2 während der Depolymerisationsreaktion freigesetzt werden kann,15b, 15c, 15f wurde die Bildung von CO2 gravimetrisch quantifiziert (siehe Hintergrundinformationen für detaillierte Informationen). Hieraus ergab sich, dass insgesamt 1.50 mmol Wasserstoff während des Abbauprozesses freigesetzt wurde, was einer Faraday-Effizienz von 42 % entspricht. Der beobachtete initiale Gasverbrauch steht im Einklang mit der Reduktion von Sauerstoff zur Bildung von Benzoylprodukten, was eine gute Übereinstimmung mit einer kathodischen Sauerstoffreduktionsreaktion (ORR) darstellt. Es wurde gezeigt, dass Metall-Porphyrin-Katalysatoren die Sauerstoffreduktionsreaktion fördern.26 Sobald der Strom abgeschaltet wurde, wurde keine weitere Gasentwicklung festgestellt, was darauf hindeutet, dass die Gasentwicklung ein rein elektroinduzierter Prozess ist. Insgesamt bestätigen unsere mechanistischen Studien die HER als die wichtigste kathodische Halbreaktion, die ein enormes Potenzial für eine umweltfreundliche Wasserstoffproduktion in Verbindung mit einem skalierbaren Recycling von Kunststoffabfällen im Sinne einer kreislauforientierten Kohlenstoffwirtschaft birgt (Abbildung 2B).
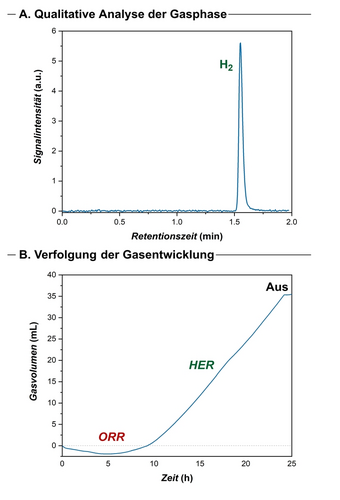
A. Qualitativer Nachweis von molekularem Wasserstoff mittels GC-Analyse der Gasphase nach der Degradation. B. Gasentwicklung während der Elektrokatalyse. Die Reaktionen wurden unter Standardbedingungen und unter Sauerstoffatmosphäre durchgeführt. Siehe unterstützende Informationen für experimentelle Details.
Um den Modus Operandi der Depolymerisation weiter zu untersuchen, führten wir kinetische Studien und An/Aus-Experimente durch. Die Ausbeute an kleinen Molekülen, die durch den Depolymerisationsprozess erhalten wurden, stieg innerhalb der ersten 18 h linear an. Danach erreichte die Menge der Benzoylprodukte ein vorübergehendes Plateau bei 14 %, was darauf hindeutet, dass die Oxidation des Polystyrolrückgrats deutlich langsamer verlief. Die Bildung von Benzaldehyd (13) wurde während der ersten 12 h nachgewiesen. Danach wurde eine Abnahme von Benzaldehyd (13) beobachtet, was auf die lediglich transiente Bildung mit anschließender Oxidation zu Benzoesäure – dem vorherrschenden Polystyrol-Abbauprodukt – hindeutet (Schema 4A). Anschließend wurde das Molekulargewicht des resultierenden Polymers im Verlauf der Reaktion überwacht (Schema 4A). Während der ersten 2 h nahm das Molekulargewicht des Polymers nur geringfügig ab. Innerhalb der nächsten 6 h des Abbaus wurde jedoch ein deutlicher Abfall auf 4.9 kg/mol beobachtet. Die Abspaltung des Polymerrückgrats nahm dann langsam ab, so dass nach 24 h Elektrokatalyse Oligomere mit niedrigem Molekulargewicht entstanden (Schema 4A). Wir führten darüber hinaus auch An/Aus-Experimente durch und verfolgten die Veränderung der durch die Depolymerisationsreaktion erzeugten Benzoesäure sowie das Molekulargewicht der abgebauten Polymere (Schema 4B). Das Anlegen eines konstanten Stroms von 8 mA unter den Standardbedingungen für 3 h führte zu einer Abnahme des Molekulargewichts auf 238 kg/mol, wobei gleichzeitig 0.9 % Benzoesäure gebildet wurden. Eine signifikante Änderung des Molekulargewichts des Polymers oder der Ausbeute an Benzoesäure wurde während der 2 h ohne Strom nicht beobachtet, was darauf hindeutet, dass die Depolymerisation von PS ausschließlich durch Strom hervorgerufen wird. Anschließend wurde erneut ein konstanter Strom von 8 mA angelegt, wobei 10.9 kg/mol Polystyrol und 3.4 % Benzoesäure erhalten wurde. Danach wurde die Elektrolyse erneut für 2 h unterbrochen, und während dieser Zeit wurde keine Änderung des Molekulargewichts oder der Menge an Benzoesäure beobachtet. Abschließend wurde der Strom für weitere 16 h angelegt, um 15.3 % Benzoesäure und Oligomere mit einem Molekulargewicht von 0.8 kg/mol zu erhalten, was den Nutzen von Elektrizität für die Depolymerisation von Polystyrol unterstreicht (Schema 4B). Basierend auf diesen Ergebnissen, unseren Kontrollexperimenten und früheren Erkenntnissen in der Literatur15, 27 schlugen wir den folgenden Mechanismus für den C−C-Spaltungsprozess des Polystyrolgerüsts vor (Schema 4C). Das zentrale, tertiäre Radikal 7 könnte durch einen direkten Wasserstoffatomtransfer (HAT) des Polymerrückgrats erzeugt werden. Der Eisen-(IV)-Porphyrin-Oxo-Komplex 6, der zuvor aus Fe(TPP)Cl durch Aktivierung mit Wasserstoffperoxid gebildet wurde,28 kann anschließend ein benzylisches Wasserstoffatom abstrahieren, um das kohlenstoffzentrierte Radikal 7 zu bilden.9b, 29 Es wurde gezeigt, dass Letzteres mit molekularem Sauerstoff reagiert, um Intermediat 8 zu erzeugen.15a-15c Dieses Zwischenprodukt wird einer kathodischen Reduktion unterzogen, um das O-zentrierte Radikal 9 zu bilden. Anschließend kommt es zu einer β-Spaltung der C−C-Bindung, die die Kettenspaltung des Polymerrückgrats fördert, wodurch die Oligomere 10 und 11 entstehen. Durch weitere oxidative Kettenspaltung des Oligomers 10 entsteht Phenylglyoxylsäure (12), die einer Decarboxylierung unterzogen wird, was durch den Nachweis von CO2 bestätigt wird, um Benzaldehyd (13) zu bilden. Aldehyd 13 kann unter Sauerstoffatmosphäre weiter zu Benzoesäure oxidiert werden, dem wichtigsten identifizierten Benzoylprodukt der Elektro-Polystyrol-Depolymerisation. Die Bildung des FeIII-(TPP)-Katalysators kann durch einen direkten radikalischen Angriff9b mit dem Primärradikal 11 und einer weiteren anodischen Oxidation erreicht werden. Darüber hinaus tritt während der Depolymerisationsreaktion von Polystyrol die kathodische Wasserstoffentwicklungsreaktion auf (Schema 4C).

A. Kinetische Studien für die Depolymerisation von Polystyrol mit der Bildung von Benzoylprodukten (rot) und der Änderung des Molekulargewichts von Polystyrol 1 a (schwarz) während der Reaktion. Die Reaktionen wurden unter Standardbedingungen und unter Sauerstoffatmosphäre durchgeführt. Das Molekulargewicht ist in einer logarithmischen Skala dargestellt. Siehe unterstützende Informationen für experimentelle Details. B. Zeit- und Stromabhängigkeit der Benzoesäurebildung und des Molekulargewichts während des Abbaus von Polystyrol. Das Molekulargewicht ist in einer logarithmischen Skala dargestellt. Die Reaktionen wurden unter Standardbedingungen und unter Sauerstoffatmosphäre durchgeführt. Siehe unterstützende Informationen für experimentelle Details. C. Vorgeschlagener Mechanismus für die Zersetzung von Polystyrol.
Zusammenfassung
Das chemische Recycling von Polymerabfällen zu wertschöpfenden Chemikalien stellt eine große gesellschaftliche Herausforderung dar und birgt ein enormes Potenzial für eine kreislauforientierte Kohlenstoffwirtschaft. Mit dieser Arbeit berichten wir über einen oxidationsmittelfreien, elektrochemischen Abbau von Polystyrolen unter Verwendung eines ungiftigen und leicht erhältlichen Eisen(III)-Katalysators unter Sauerstoffatmosphäre. Das elektrochemische Recycling ermöglichte die Depolymerisation verschiedener Polystyrole, darunter auch Polystyrolabfälle erhalten aus alltäglichen Anwendungen, was die Robustheit gegenüber Additiven und Farbstoffen demonstriert, wobei bis zu 18.5 % der Benzoylprodukte mit Benzoesäure als Hauptabbauprodukt gewonnen wurden. Die Robustheit des ferra-elektrokatalysierten Abbaus von Polystyrol wurde durch eine Elektrolyse im Gramm-Maßstab unter Verwendung eines Gemischs verschiedener Kunststoffabfälle untermauert. Hochmolekulare Polystyrole wurden effizient zu kleinen Oligomeren (bis zu 0.7 kg/mol) mit weniger als 1 % Retention des Molekulargewichts abgebaut. Die kathodische Wasserstoffentwicklungsreaktion (HER) spiegelte das einzigartige Potenzial unseres skalierbaren Kunststoff-Elektrorecyclings für eine umweltfreundliche Wasserstoffproduktion unter Verwendung erneuerbarer Sonnenenergie wider.
Danksagung
Die großzügige Unterstützung durch die Werner Siemens-Stiftung (WSS100-Forschungspreis an L.A.) und ERC Advanced Grant Agreement (Nr. 101021358 an L.A.) wird dankend anerkannt. Open Access Veröffentlichung ermöglicht und organisiert durch Projekt DEAL.
Interessenkonflikt
Die Autoren erklären, dass keine Interessenkonflikte vorliegen.
Open Research
Data Availability Statement
Die Daten, die die Ergebnisse dieser Studie unterstützen, sind in den Hintergrundinformationen zu diesem Artikel verfügbar.