Ferroptose-induzierender Co(III) Polypyridin Sulfasalazin Komplex für die verbesserte Krebstherapie
Abstract
Trotz erheblicher Verbesserungen bei der Behandlung von Krebstumoren in den letzten Jahrzehnten bleibt Krebs eine der tödlichsten Krankheiten weltweit. Um die Unzulänglichkeiten der derzeit angewandten chemotherapeutischen Behandlungen zu überwinden, wurden viele Forschungsanstrengungen auf die Entwicklung von Ferroptose-induzierenden Antikrebsmitteln gerichtet. Die Ferroptose ist eine neu beschriebene Form des regulierten, nicht-apoptotischen Zelltods, der in der Klinik ein hohes Potenzial besitzt. In diesem Artikel wird über die chemische Synthese und biologische Evaluation eines Co(III) Polypyridin Sulfasalazin Komplexes als Ferroptose-Induktor berichtet. Nach dem Eindringen in die Krebszellen reicherte sich der Metallkomplex vor allem in den Mitochondrien an und löste dort die Produktion von Hydroxy-Radikalen und Lipidperoxiden aus, was schließlich zum Zelltod durch Ferroptose führte. Die Verbindung vernichtete nachweislich verschiedene Krebszellen sowie multizelluläre Kolonkarzinom-Tumor-Sphäroide. Soweit wir wissen, handelt es sich bei dieser Studie um das erste Beispiel für einen Co(III)-Komplex, der Ferroptose auslösen kann.
Einleitung
Krebs ist eine der häufigsten Todesursachen weltweit. Jüngste Statistiken der Weltgesundheitsorganisation haben ergeben, dass allein im Jahr 2020 etwa 10 Millionen Menschen an Krebs gestorben sind. Hochrechnungen zufolge wird die Zahl der jährlichen Krebsdiagnosen auf 29,5 Millionen und die Zahl der krebsbedingten Todesfälle bis zum Jahr 2040 auf 16,4 Millionen ansteigen.1 Die überwiegende Mehrheit der klinisch eingesetzten Chemotherapeutika wirkt in Krebszellen durch die Induktion von Apoptose. Trotz ihrer häufigen klinischen Anwendung sind diese Wirkstoffe in der Regel mit einer geringen therapeutischen Wirksamkeit und einer hohen Tendenz zur Arzneimittelresistenz verbunden.2 Um diese Einschränkungen zu überwinden, müssen neue Arten von Chemotherapeutika entwickelt werden, die über andere Mechanismen wirken.
Zu den vielversprechendsten Krebsbekämpfungsmechanismen zählen die Ferroptose-induzierenden Verbindungen,3 eine besondere Form des programmierten Zelltods, die durch die von Eisen katalysierte Produktion und Akkumulation von Lipidperoxiden (LPO) gekennzeichnet ist. Die Lipidperoxid-Produktion tritt auf, wenn Oxidantien wie reaktive Sauerstoffspezies (ROS) mehrfach ungesättigte Fettsäuren angreifen.4 Das Hydroxylradikal (⋅OH) ist ein hochreaktives und mobiles ROS, das sich besonders stark auf Lipide auswirkt. ⋅OH-Radikale können in biologischen Systemen durch die Fenton- oder Haber-Weiss-Reaktion aus Wasserstoffperoxid oder Superoxid gebildet werden.5 Die Ferroptose kann durch intrinsische Signalwege ausgelöst werden, bei denen die Glutathionperoxidase 4 (GPX4) gehemmt oder verringert wird, oder durch extrinsische Signalwege, bei denen der Cystin/Glutamat-Transporter gehemmt wird.6
Sobald die von Glutathion abhängigen antioxidativen Abwehrkräfte überlastet sind, gerät die Lipidperoxid-Produktion außer Kontrolle und führt schließlich zum Zelltod durch Ferroptose.7 Auf der Grundlage dieser mechanistischen Erkenntnis könnte der ferroptotische Zelltod durch eine chemische Verbindung ausgelöst werden, die ⋅OH-Radikale produziert oder das antioxidative Abwehrsystem hemmt/ausschaltet, was beides zu einer unaufhaltsamen intrazellulären Lipidperoxid-Produktion führt. Während über mehrere molekularen organischen Wirkstoffe und Nanopartikelformulierungen als Ferroptose-Auslöser berichtet wurde,8 sind molekulare Metallkomplexe als Ferroptose auslösende Verbindungen nach wie vor sehr selten (Übersicht über bisher berichtete Ferroptose auslösende Metallkomplexe: Abbildung S1).9 Soweit wir wissen, gibt es in der Literatur keine Berichte über Co-Komplexe als Ferroptose-auslösende Substanzen.
In diesem Artikel wird über die chemische Synthese und biologische Evaluation eines Co(III) Polypyridin Sulfasalazin Komplexes (3, Abbildung 1) als Ferroptose-Induktor berichtet. Der Metallkomplex erwies sich als aktiv gegen verschiedene Krebszelllinien mit einer Zytotoxizität im niedrigen mikromolaren Bereich. Mechanistische Untersuchungen zeigten, dass sich die Verbindung selektiv in den Mitochondrien anreichert und die Produktion von ⋅OH und LPO induziert. Sobald die von GSH und GPX4 abhängige antioxidative Abwehr überwältigt ist, schreitet die Lipidperoxid-Produktion unkontrolliert voran und führt schließlich zum Zelltod durch Ferroptose. Eine tiefergehende biologische Bewertung in multizellulären Sphäroiden von Mäusekolonkarzinomen, die ein Modellsystem für klinische solide Tumore darstellen, zeigte eine starke therapeutische Wirkung innerhalb des Kerns der dreidimensionalen Zellstruktur.
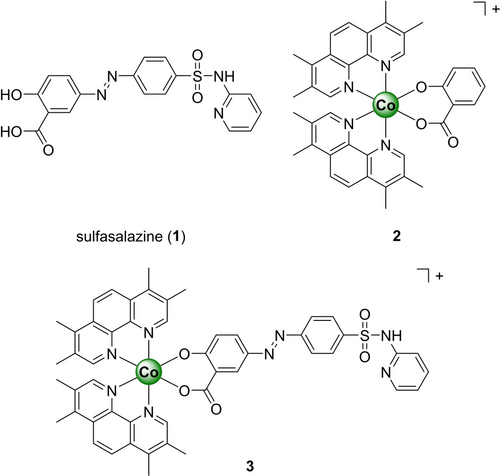
Chemische Strukturen der in dieser Studie untersuchten Verbindungen. Die Metallkomplexe wurden als Hexafluorophosphat-Salze isoliert.
Ergebnisse und Diskussion
Sulfasalazin (1, Abbildung 1, verkauft unter dem Markennamen Azulfidin) ist ein entzündungshemmendes Medikament, das klinisch zur Behandlung von rheumatoider Arthritis, Colitis ulcerosa oder Morbus Crohn eingesetzt wird.10 Jüngste Studien haben berichtet, dass die therapeutische Wirkung häufig eingesetzter Krebsmedikamente wie Piperlongumin,11 Gemcitabin12 oder Cisplatin13 bei einer Kombinationsbehandlung mit Sulfasalazin verstärkt werden kann. Mechanistische Befunde haben gezeigt, dass Sulfasalazin in der Lage ist, das von Glutathion abhängige antioxidative Abwehrsystem durch den Verbrauch von GSH in den Zellen zu schwächen, wodurch die Krebszellen anfälliger für die Krebsbehandlung werden.14
Frühere Studien haben gezeigt, dass der Einbau eines organischen therapeutischen Wirkstoffs in ein Co(III)-Komplexgerüst die krebsbekämpfende Wirkung verstärken kann.15 Insbesondere Co(III) Polypyridin Komplexe wurden bereits als hochstabile und therapeutisch wirksame Verbindungen beschrieben.16 Ausgehend davon wurde hier die Anwendung eines Co(III) Polypyridin Sulfasalazin Komplexes 3 als krebsbekämpfendes Mittel vorgeschlagen und eingehend untersucht. Co(II)-Chlorid wurde mit Chlorgas, das in situ durch Mischen von Kaliumpermanganat und konzentrierter Salzsäure erzeugt wurde, zu einem Co(III)-Zwischenprodukt oxidiert. Dieses Zwischenprodukt wurde bei Rückflusstemperaturen mit zwei Äquivalenten des Liganden 3,4,7,8-Tetramethyl-1,10-Phenanthrolin erhitzt, um den Precursor [Co(3,4,7,8-tetramethyl-1,10-phenanthroline)2Cl2][Cl] zu bilden. Der Precursor wurde mit einer Mischung aus Silber(I)-triflat und Silber(I)-oxid weiterbehandelt und das gebildete Silberchlorid, das aus der Lösung ausfiel, durch Filtration entfernt. Unter basischen Bedingungen wurden Hydroxybenzoesäure (Schema S1) oder 1 (Schema S2) zugegeben und die gewünschten Metallkomplexe 2 und 3 erhalten. Alle Verbindungen wurden durch NMR-Spektroskopie und Elektronenspray-Ionisations-Massenspektrometrie charakterisiert, und die Reinheit wurde durch Hochdruck-Flüssigkeitschromatographie (HPLC) und Elementaranalyse bestätigt (Abbildungen S2–S5).
Die Löslichkeit der Metallkomplexe 2 und 3 wurde mittels dynamischer Lichtstreuungsmessungen bewertet. Es wurden Dimethylsulfoxid-Stammlösungen der Co(III)-Komplexe hergestellt und in phosphatgepufferter Kochsalzlösung (PBS) verdünnt, um eine Dimethylsulfoxidkonzentration von 0,1 % zu erreichen. Die Bildung von Präzipitaten oder Partikeln wurde durch dynamische Lichtstreuungsmessungen überwacht. Es wurde keine Partikelbildung oder Aggregation beobachtet, was auf eine wässrige Löslichkeit unter physiologischen Bedingungen schließen lässt. Die Stabilität von Verbindungen unter physiologischen Bedingungen ist für eine biologische Anwendung von entscheidender Bedeutung, um eine sichere und effiziente therapeutische Wirkung zu gewährleisten, da ein unerwünschter Abbau zu geringer Wirksamkeit und Nebenwirkungen führen kann.17 Um die Stabilität der Metallkomplexe unter physiologischen Bedingungen zu bewerten, wurden die Metallkomplexe 48 h lang in PBS inkubiert und mittels HPLC analysiert. Es wurden keine Veränderungen im Chromatogramm beobachtet (Abbildung S6–S7), was auf die Stabilität dieser Metallkomplexe unter physiologischen Bedingungen hindeutet. Um die potenzielle Ligandenfreisetzung aus dem Metallkomplex zu untersuchen, wurde 3 mit GSH oder Natriumascorbat als zelluläre Reduktionsmittel inkubiert und die Stabilität mittels HPLC überwacht. Es wurden keine signifikanten Veränderungen beobachtet, was auf die Stabilität unter zellulären reduzierenden Bedingungen hindeutet (Abbildung S8). Insgesamt erwiesen sich die Metallkomplexe unter physiologischen Bedingungen als löslich und stabil.
Die Fähigkeit der Komponenten Sulfasalazin 1 und 3,4,7,8-Tetramethyl-1,10-Phenanthrolin sowie der Co(III)-Komplexe 2 und 3, ⋅OH-Radikale, Singulett-Sauerstoff (1O2) oder ⋅O2− zu erzeugen, wurde mittels Elektronenspinresonanz-Spektroskopie untersucht. Die Verbindungen wurden in DMEM-Zellmedium, das mit GSH als zellulärem Reduktionsmittel ergänzt wurde, aufgelöst, mit dem ⋅OH und ⋅O2−-Fänger 5,5-Dimethyl-1-pyrrolin-N-oxid oder dem 1O2-Fänger 2,2,6,6-Tetramethylpiperidin inkubiert und anschließend das Elektronenspinresonanz-Spektrum aufgezeichnet. Während für 1, 3,4,7,8-Tetramethyl-1,10-phenanthrolin und 2 keine Signale in den Spektren beobachtet wurden, wurde das charakteristische Signal für ⋅OH-Radikale bei der Inkubation von 3 gemessen (Abbildung S9–S10). Als ergänzende Technik wurde die zeitabhängige Produktion von 1O2 mit der spezifischen Sonde Singulett-Sauerstoff-Sensorgrün, ⋅O2− mit der spezifischen Sonde DHR123 oder ⋅OH mit der spezifischen Sonde 3′-p-(Hydroxyphenyl)-Fluorescein untersucht. Während diese Sonden in wässriger Lösung nur schwach fluoreszieren, werden die Verbindungen durch die spezifische Art von ROS oxidiert und bilden ein stark fluoreszierendes Fluorescein-Derivat, das durch Fluoreszenzspektroskopie überwacht werden kann. Während bei den 1O2 und ⋅O2−-spezifischen Sonden bei der Inkubation mit 3 keine Veränderungen beobachtet wurden, wurde bei der ⋅OH-spezifischen Sonde ein starkes Fluoreszenzsignal beobachtet (Abbildung S11). Zusammenfassend deuten diese Ergebnisse darauf hin, dass 3 in der Lage ist ⋅OH-Spezies zu erzeugen.
Die Lipophilie der Co(III)-Komplexe 2 und 3 wurde durch Messung ihres Verteilungskoeffizienten zwischen der PBS- und der Octanolphase (logP) mit der “Schüttelkolben”-Methode bewertet. Die Metallkomplexe wurden sowohl in der PBS- als auch in der Octanol-Phase gefunden und sind daher von kombinierter lipophiler und hydrophiler Natur (2: logP=+0,6±0,1, 3: logP=0,4±0,1), was als ideal für einen Arzneimittelkandidaten angesehen wird (Tabelle S1). Die Zellmembranpermeabilität wurde mit Hilfe eines parallelen künstlichen Membranpermeabilitätstests simuliert. Die Metallkomplexe 2 und 3 wiesen hohe Permeabilitätsraten auf (2: 0,034±0,003 μm/s, 3: 0,047±0,003 μm/s), basierend auf Vergleichen mit gut charakterisierten Kontrollverbindungen mit bekannten Permeabilitätsraten (Tabelle S2). Insgesamt erwiesen sich die Metallkomplexe als teilweise hydrophil und teilweise lipophil und konnten eine künstliche Zellmembran effizient durchdringen.
Auf Grundlage dieser vielversprechenden pharmakologischen Eigenschaften wurden die therapeutischen Wirkungen der Metallkomplexe 2 und 3 im Vergleich zu ihren Bestandteilen (Sulfasalazin 1, 3,4,7,8-Tetramethyl-1,10-phenanthrolin, Hydroxybenzoesäure, Co(II)-chlorid) sowie dem Krebsmedikament Cisplatin in krebsartigen Mauskolonkarzinom (CT-26), menschlichem Brustadenokarzinom (MCF-7), menschlichem hepatozellulärem Karzinom (Hep G2), menschlicher Leukämie (THP-1), menschlichem Pankreas-Adenokarzinom (PT-45) und nicht-kanzerösen menschlichen Fibroblasten (GM-5657), embryonale Mausfibroblasten (MEF) und menschlichen embryonalen Nieren (HEK-293) Zellen untersucht (Übersicht: Tabelle 1, Arzneimittelwirkungskurven: Abbildung S12–S19). Die Zellen wurden 4 h lang mit den Verbindungen inkubiert, anschließend gewaschen, um die Verbindungen zu entfernen, die in diesem Zeitraum nicht internalisiert wurden, und die Zellviabilität mit dem Farbstoff 3-(4,5-Dimethylthiazol-2-yl)-2,5-diphenyltetrazoliumbromid (MTT) untersucht. Die einzelnen Komponenten, einschließlich der jeweiligen Liganden und Metallvorläufer 3,4,7,8-Tetramethyl-1,10-phenanthrolin, Hydroxybenzoesäure und Co(II)-chlorid, erwiesen sich bei allen getesteten Zelllinien als nicht toxisch (IC50>100 μM). Die Zytotoxizität von 1 erwies sich als stark abhängig von der untersuchten Zelllinie. Während sich die Verbindung in Hep-G2, PT-45, GM-5657, MEF und HEK-293 Zellen als nicht toxisch erwies (IC50>100 μM), zeigte die Verbindung in CT-26- (IC50=71.32±7.46 μM), THP-1- (IC50=41.53±2.40 μM) und MCF-7-Zellen (IC50=27.61±1.33 μM) eine schwache therapeutische Wirkung. Der Co(III) Polypyridin Komplex 2 zeigte bei allen untersuchten Zelllinien eine schwache Zytotoxizität (IC50>100 μM). Die Mischung aus 1 und 2, welche im Folgenden als 1+2 bezeichnet wird, erwies sich als wenig zytotoxisch ähnlich wie 1 allein. Auffallend ist, dass der Co(III) Polypyridin Sulfasalazin Komplex 3 bei allen Krebszelllinien eine zytotoxische Wirkung im niedrigen mikromolaren Bereich aufweist (CT26: IC50=1.04±0.32 μM, MCF-7: IC50=2.45±0.26 μM, Hep G2: IC50=4.63±0.37 μM, THP-1: IC50=2.33±0.46 μM, PT-45: IC50=1.91±0.13 μM). Interessanterweise wurde für diese Krebszelllinien eine höhere Zytotoxizität festgestellt als für die untersuchten nicht krebsartigen Zelllinien (GM-5657: IC50=12.05±1.37 μM, MEF: IC50=11.16±1.22 μM, HEK-293: IC50=13.69±1.57 μM). Insbesondere wurde bei Verlängerung der Inkubationszeit auf 48 h eine therapeutische Wirkung der Liganden im mikromolaren Bereich und des Metallkomplexes im nanomolaren Bereich beobachtet (Tabelle S3, Arzneimittelwirkungskurven: Abbildung S20). Die zelluläre Aufnahme der Metallkomplexe 2 und 3 wurde nach 4 h Inkubation mittels induktiv gekoppelten Plasmas optische Emissionsspektroskopie (ICP-OES) bestimmt. Die Ergebnisse zeigten, dass 3 eine höhere zelluläre Aufnahme als 2 aufwies, was den Unterschied in der Zytotoxizität teilweise erklären könnte (Abbildung S21). Aufgrund der hohen therapeutischen Wirkung in CT-26-Zellen wurden weitere Studien mit 3 in krebsartigen CT-26-Zellen durchgeführt. Als ergänzende Technik wurde die therapeutische Wirkung konzentrationsabhängig mit der Calcein AM/Propidiumjodid-Färbung (lebende/tote Zellen) sichtbar gemacht. Während die Zellpopulation, die mit einer niedrigen Konzentration von 3 behandelt wurde, aus lebenden Zellen bestand, nahm die Zahl der toten Zellen bei der Behandlung mit höheren Konzentrationen von 3 zu (Abbildung S22), was die therapeutische Wirkung des Metallkomplexes bestätigte. Zusammenfassend deuten diese Ergebnisse auf die Zytotoxizität von Verbindung 3 im niedrigen mikromolaren Bereich im Vergleich zu ihren einzelnen Bestandteilen hin.
Verbindung |
Krebszelllinien |
Gesunde Zelllinien |
||||||
|---|---|---|---|---|---|---|---|---|
CT-26 |
MCF-7 |
Hep G2 |
THP-1 |
PT-45 |
GM-5657 |
MEF |
HEK-293 |
|
cisplatin |
6.04±0.34 |
7.48±0.36 |
9.04±0.45 |
5.86±0.51 |
8.06±1.17 |
8.64±1.03 |
12.17±1.53 |
8.43±0.87 |
phenme [a] |
>100 |
>100 |
>100 |
>100 |
>100 |
>100 |
>100 |
>100 |
sal [b] |
>100 |
>100 |
>100 |
>100 |
>100 |
>100 |
>100 |
>100 |
CoCl2 |
>100 |
>100 |
>100 |
>100 |
>100 |
>100 |
>100 |
>100 |
1 |
71.32±7.46 |
27.61±1.33 |
>100 |
41.53±2.40 |
>100 |
>100 |
>100 |
>100 |
2 |
>100 |
>100 |
>100 |
>100 |
>100 |
>100 |
>100 |
>100 |
1+2 |
64.71±5.30 |
23.29±4.86 |
86.70±8.35 |
36.04±5.27 |
>100 |
>100 |
>100 |
>100 |
3 |
1.04±0.32 |
2.45±0.26 |
4.63±0.37 |
2.33±0.46 |
1.91±0.13 |
12.05±1.37 |
11.16±1.22 |
13.69±1.57 |
- [a] phenme=3,4,7,8-tetramethyl-1,10-phenanthroline. [b] sal=hydroxybenzoic acid.
Um einen Einblick in den Wirkmechanismus zu erhalten, wurde die subzelluläre Lokalisierung des Metallkomplexes nach sorgfältiger Extraktion der wichtigsten Zellorgane (Zellkern, Lysosomen, Mitochondrien und Zytoplasma) und Bestimmung des jeweiligen Metallgehalts mittels ICP-OES untersucht. Während im Zellkern (4.1±3.4 %) und in den Lysosomen (10.0±4.2 %) nur geringe Mengen der Verbindung lokalisiert waren, wurde 3 hauptsächlich in den Mitochondrien (51.2±7.5 %) gefunden (Abbildung 2). Frühere Studien haben gezeigt, dass eine subzelluläre Lokalisierung in den Mitochondrien aufgrund ihrer Funktion bei der Energieregulierung, dem Stoffwechsel und der Auslösung des programmierten Zelltods ideal für die Entwicklung von Krebsmedikamenten ist.18
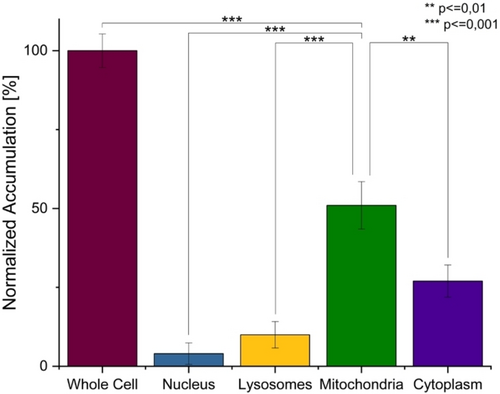
Subzelluläre Akkumulation von 3 in CT-26-Zellen nach 4 h Inkubation bestimmt durch ICP-OES. Die statistische Analyse wurde mittels einseitiger ANOVA mit Tukey's multiplem Vergleichstest durchgeführt. Die Fehlerbalken entsprechen der Standardabweichung von drei Wiederholungen.
Die Fähigkeit der Metallkomplexe, ROS in den Krebszellen zu erzeugen, wurde durch Fluoreszenzmikroskopie unter Verwendung der ROS-spezifischen Sonde 2′,7′-Dichlordihydrofluoresceindiacetat bewertet. Während dieser Farbstoff in menschlichen Zellen nicht emittiert, wird der Fluorophor in Gegenwart von ROS oxidiert, wodurch ein stark grün fluoreszierendes Molekül entsteht. Die Mikroskopie-Bilder der Krebszellen, die mit 1 oder 2 behandelt wurden, zeigten keine grüne Emission, was darauf hindeutet, dass diese Verbindungen keine ROS erzeugen. Im Gegensatz dazu wurde bei der Behandlung mit 3 ein starkes grünes Fluoreszenzsignal im Inneren der Krebszellen beobachtet, was darauf hindeutet, dass diese Substanz in der Lage ist, effizient ROS zu erzeugen (Abbildung S23). Um ein tieferes Verständnis zu erlangen, wurden Studien zur Identifizierung der Art von ROS, einschließlich von ⋅OH, 1O2, oder ⋅O2− Spezies, die durch den Metallkomplex erzeugt werden, durchgeführt. Die Krebszellen wurden mit ⋅OH (D-Mannit), 1O2 (Natriumazid) oder ⋅O2− (4,5-Dihydroxy-1,3-benzoldisulfonsäure-Dinatriumsalz-Monohydrat) spezifischen Fängern, die die Fähigkeit des Metallkomplexes zur Erzeugung zytotoxischer ROS-Spezies limitieren, vorinkubiert, 4 h lang mit dem IC50-Wert von 3 (1,26 μM) behandelt und die Zellviabilität mit einem MTT-Test bestimmt. Da bei der Vorinkubation mit 1O2 and ⋅O2− Fängern keine Veränderungen der Zellüberlebensrate beobachtet wurden, konnten diese Arten von ROS ausgeschlossen werden. Im Gegensatz dazu wurde festgestellt, dass die Vorinkubation mit ⋅OH Fänger die Lebensfähigkeit der Zellen stark erhöhte (Abbildung 3A), was auf einen Wirkmechanismus von 3 hinweist an dem ⋅OH-Spezies beteiligt sind. Als ergänzende Technik wurde die Identifizierung der Art der durch den Metallkomplex erzeugten ROS durch Fluoreszenzmikroskopie unter Verwendung der spezifischen Fluorophore ⋅OH (3′-p-(Hydroxyphenyl)-Fluorescein), 1O2 (Singulett-Sauerstoff-Sensorgrün) oder ⋅O2−-(Dihydroethidium) untersucht. Während bei den 1O2 and ⋅O2-Sondenmolekülen keine Emission beobachtet wurde, wurde bei der Behandlung der Krebszellen mit 3 und der Inkubation mit der ⋅OH-Sonde eine starke grüne Emission beobachtet (Abbildung 3B). Insgesamt deuten diese Ergebnisse darauf hin, dass 3 in der Lage ist, innerhalb der Krebszellen effizient ⋅OH zu produzieren.
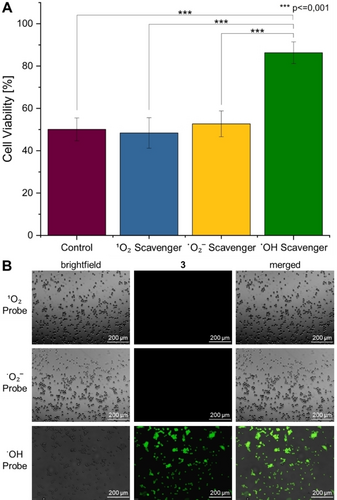
Identifizierung der Art der durch 3 in CT-26-Zellen erzeugten ROS. A) Quantifizierung der Zelllebensfähigkeit nach Vorinkubation mit ⋅OH (50 mM, D-Mannitol), 1O2 (5 mM, Natriumazid) oder ⋅O2− (5 mM, 4,5-Dihydroxy-1,3-benzoldisulfonsäure-Dinatriumsalz-Monohydrat) spezifischen Fängern, die die Fähigkeit des Metallkomplexes zur Erzeugung zytotoxischer ROS-Spezies limitieren, Behandlung mit dem IC50-Wert von 3 (1. 26 μM) und die Bestimmung der Zellviabilität mit einem MTT-Assay. Die statistische Analyse wurde mittels einseitiger ANOVA mit Tukey's multiplem Vergleichstest durchgeführt. Die Fehlerbalken entsprechen der Standardabweichung der drei Wiederholungen. B) Fluoreszenzmikroskopaufnahmen von CT-26-Zellen nach Ko-Inkubation mit dem IC50-Wert von 3 (1. 26 μM) und den spezifischen Fluorophoren OH (3′-p-(hydroxyphenyl) fluorescein, λex=460–490 nm, λem=517–527 nm), 1O2 (singlet oxygen sensor green, λex=460–490 nm, λem=517–527 nm), oder ⋅O2− (dihydroethidium, λex=545–580 nm, λem=617 nm).
Die Fähigkeit, oxidativen Stress in den Mitochondrien, der primäre Lokalisation des Metallkomplexes, zu induzieren, wurde durch die Überwachung des Membranpotenzials der Mitochondrien mit dem spezifischen Farbstoff JC-1 untersucht. Während der Fluorophor mit roter Fluoreszenz aggregiert, wenn die Zelle intakte Mitochondrien enthält, bildet der Fluorophor mit grüner Fluoreszenz Monomere, wenn das Membranpotenzial der Mitochondrien abfällt. Die Mikroskopaufnahmen zeigten, dass bei der Behandlung der Krebszellen mit 3 nur die monomere Spezies des Farbstoffs zu beobachten war, was auf den Verlust des mitochondrialen Membranpotenzials hindeutet (Abbildung S24). Der Verlust des mitochondrialen Membranpotenzials konnte auch durch morphologische Untersuchungen mittels ultrastruktureller Transmissionselektronenmikroskopie (TEM) nachgewiesen werden. Im Gegensatz zu den unbehandelten Proben (Abbildung 4A und B, Pfeile) wiesen die mit 3 behandelten Zellen eine dramatische Veränderung der mitochondrialen Ultrastruktur auf, insbesondere in ihren Cristae. Die Cristae wiesen eine gelockerte bis vollständig aufgelöste Anordnung auf, was den in der Literatur beschriebenen Befunden entspricht (Abbildung 4C–G, Pfeile).19 Diese Ergebnisse deuten darauf hin, dass die Behandlung mit 3 zu einer morphologischen Deformation der Mitochondrien führt, was einen Verlust des mitochondrialen Membranpotenzials und damit inaktive oder dysfunktionale Mitochondrien zur Folge hat.
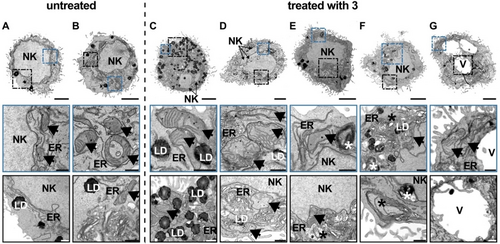
Ultrastrukturelle TEM-Analyse von CT-26-Zellen ohne und nach Behandlung mit 3. A–B. Repräsentative TEM-Bilder von unbehandelten Zellen zeigen keine ultrastrukturellen Schäden an den Zellorganellen. C–G. Ultrastrukturelle Analyse von CT-26-Zellen mit Behandlung 3 (n=3) zeigte beschädigte mitochondriale Cristae (Pfeile), eine Vergrößerung der Zelle ohne Riss in der Zellmembran und vermutlich eine anfängliche Fragmentierung des Zellkerns (NK). Darüber hinaus waren ein vergrößertes und vermehrtes Auftreten des endoplasmatischen Retikulums (ER) und eine Anhäufung von Lipidtröpfchen (LD) sowie Lysosomen, Autophagosomen und multilaminaren Körpern (Sternchen) zu erkennen. Die wahrscheinlich fortschreitende Ferroptose zeigte auch die Bildung von Vakuolen (V) an. Übersicht Maßstabsbalken: 3 μm und Detailaufnahmen: 0,5 μm.
Um den Wirkmechanismus des Co(III) Polypyridin Sulfasalazin Komplexes weiter aufzuklären, wurde der durch den Metallkomplex ausgelöste Zelltodmechanismus untersucht. Die Krebszellen wurden mit Autophagie (3-Methyladenin), Apoptose (Z-VAD-FMK), Paraptose (Cycloheximid), Nekrose (Necrostatin-1), Ferroptose (Ferrostatin-1) Inhibitoren oder einem Eisenchelator (Deferoxamin), die die Fähigkeit des Metallkomplexes einen spezifischen Zelltodmechanismus auszulösen inhibieren, vorinkubiert und mit dem IC50-Wert von 3 (1. 26 μM) für 4 h behandelt und die Zellviabilität mit einem MTT-Test bestimmt. Da die Vorinkubation mit Autophagie-, Paraptose- und Nekrose-Inhibitoren die Zellviabilität nicht signifikant veränderten, wurden diese Zelltodmechanismen ausgeschlossen. Im Gegensatz dazu erhöhte die Vorinkubation mit Apoptose-Inhibitoren die Zellviabilität der Zellen leicht und mit Ferroptose-Inhibitoren und Eisenchelatoren drastisch (Abbildung S25). Diese Ergebnisse deuten darauf hin, dass 3 Zelltod durch einen multimodalen Mechanismus auslöst, an dem in erster Linie die Ferroptose und in zweiter Linie die Apoptose beteiligt ist. Um weitere Einblicke in den Apoptose-Zelltod-Mechanismus zu erhalten, wurde seine Abhängigkeit vom Caspase 3/7-Signalweg mit Hilfe eines Caspase 3/7-Glo-Assays untersucht. Diese Caspasen sind als Ausführende der extrinsischen und intrinsischen Apoptose Signalwege bekannt.20 Die Ergebnisse des Assays zeigten, dass die Behandlung der Krebszellen mit 3 die Caspase 3/7-Aktivität erhöhte (Abbildung S26).
Die Fähigkeit des Co(III) Polypyridin Sulfasalazin Komplexes, Zelltod durch Ferroptose auszulösen, wurde anhand der Überwachung der Ferroptose-spezifischen Merkmale weiter untersucht. Die Ferroptose ist insbesondere durch die Reaktion von ⋅OH-Spezies mit natürlich vorkommenden mehrfach ungesättigten Fettsäuren gekennzeichnet, die hochgradig zytotoxische LPO-Spezies erzeugen. Das Vorhandensein von LPO in mit Metallkomplexen behandelten Krebszellen wurde durch Fluoreszenzmikroskopie unter Verwendung der spezifischen Sonde BODIPY581/591 C11 untersucht. Die Mikroskopieaufnahmen zeigten keine Emission bei der Behandlung mit 2 und nur geringe Fluoreszenzsignale in den Zellen bei der Behandlung mit 1. Diese Ergebnisse stimmen mit früheren Studien überein, die gezeigt haben, dass 1 in bestimmten Arten von Krebszellen LPO erzeugen kann.21 Bei gleicher Konzentration wurde bei der Behandlung mit 3 ein viel stärkeres rotes Fluoreszenzsignal der LPO-spezifischen Sonde beobachtet, was auf hohe Konzentrationen von LPO in den Krebszellen hindeutet (Abbildung 5).

Bewertung der Bildung von LPOs durch 1–3 in CT-26-Zellen. Fluoreszenzmikroskopaufnahmen von CT-26-Zellen nach Ko-Inkubation von 1–3 (1,26 μM) und der LPO-spezifischen Sonde BODIPY581/591 C11 (5 μM, λex=460–490 nm, λem=510 nm).
Mit Hilfe von TEM-Analysen wurden dann die Auswirkungen der erhöhten LPO-Konzentration morphologisch genauer untersucht. Diese bestätigten, dass der zelluläre Stress, der durch die erhöhte LPO-Konzentration verursacht wurde, zu ultrastrukturellen Schäden an mehreren Zellorganellen führte (Abbildung 4). Zusätzlich zu den Veränderungen der mitochondrialen Cristae (C–G, Pfeile) konnten auch andere morphologische Merkmale der Ferroptose beobachtet werden. Die TEM-Analyse zeigte eine offensichtliche Vergrößerung der Zellen mit einer anfänglichen Verformung der Zellmembran, die zu diesem Zeitpunkt der Behandlung jedoch noch intakt und nicht zerrissen war. Obwohl zellulärer Stress auch zu DNA-Schäden führt, sah der Zellkern der ferroptotischen Zellen normal aus und zeigte keine DNA-Kondensation. Lediglich eine frühe Fragmentierung des Zellkerns (NK) konnte vermutet werden. Weitere Kennzeichen der Ferroptose waren ein vergrößertes und vermehrtes endoplasmatisches Retikulum (ER) sowie eine vermehrte Anhäufung von Lipidtröpfchen (LD), was insgesamt auf eine gestörte Homöostase hinweist. Da Ferroptose eine verstärkte Autophagie fördert, wurde auch ein vermehrtes Auftreten von Lysosomen, Autophagosomen und multilamellaren Körpern (Sternchen) beschädigter Zellorganellen beobachtet. Es wurde auch festgestellt, dass in einem vermutlich fortgeschrittenen Stadium der Ferroptose eine Zellschwellung mit begleitender Vakuolen-Bildung auftritt. Alle diese morphologischen Veränderungen deuten auf einen Zelltod infolge von Ferroptose hin und entsprechen den in der Literatur beschriebenen Befunden.19
In Krebszellen werden natürlich vorkommende LPO als Teil des antioxidativen Abwehrsystems mit GSH neutralisiert, was zu einer Abnahme der GSH-Konzentration führt. Mit Hilfe der GSH-spezifischen Sonde ThiolTrackerTM Violet konnte die GSH-Konzentration in der Zelle durch Fluoreszenzmikroskopie bestimmt werden. Während die mit 2 behandelten Krebszellen eine starke violette Emission zeigten, was auf das Vorhandensein von viel GSH hindeutet, wiesen die mit 1 oder 3 behandelten Zellen nur eine sehr geringe Fluoreszenz auf, was auf eine Verringerung des GSH-Spiegels hindeutet (Abbildung S27). Ergänzend dazu wurde die GSH-Konzentration in den Krebszellen mit einem handelsüblichen kolorimetrischen GSH-Assay quantifiziert. Im Vergleich zu den unbehandelten Zellen zeigten die mit 3 behandelten Krebszellen eine Verringerung der GSH-Konzentration um 67±6 % (Abbildung S28). Die Umwandlung von NADPH in NADP+ wurde durch Überwachung des NADPH/NADP+-Verhältnisses mit einem kommerziellen Glo-Assay untersucht. Während die Inkubation mit den Verbindungen 1 und 2 das NADPH/NADP+-Verhältnis nicht beeinflusste, reduzierte 3 das NADPH/NADP+-Verhältnis stark (Abbildung S29). Neben der Reduzierung der GSH-Level während der Ferroptose ist auch die Expression des Enzyms GPX4 in der Regel reduziert. Um zu untersuchen, ob sich die intrazellulären Spiegel von GPX4 während der Behandlung mit den Metallkomplexen verändern, wurde eine Western-Blot-Analyse mit GAPDH als interner Referenz durchgeführt. Der Western-Blot zeigte, dass die Behandlung mit 1 und 2 die Expressionswerte von GPX4 in den Krebszellen nicht signifikant beeinflusste. Im Gegensatz dazu reduzierte die Behandlung der Krebszellen mit 3 die GPX4-Konzentration stark (Abbildung S30). Insgesamt deuten diese Ergebnisse darauf hin, dass die bei der Behandlung mit 3 entstehenden ⋅OH-Spezies in der Lage sind, LPOs zu produzieren, die das Antioxidationssystem der Krebszellen durch die Reduzierung von GSH und GPX4 überwältigen. Auf der Grundlage dieser Erkenntnisse wird als biologischer Wirkmechanismus die Reduktion des Co(III)-Komplexes zu einem stabilen Co(II)-Zwischenprodukt mit GSH vorgeschlagen. Mit Hilfe der Fenton-ähnlichen Chemie könnte dieses Zwischenprodukt ⋅OH produzieren, welches die Bildung von LPO und oxidativem Stress innerhalb der Krebszellen fördert. Als zelluläre Antioxidantien sind GSH und GPX4 in der Lage, diese hochreaktiven Spezies in harmlose Alkohole umzuwandeln, was den Abbau von GSH und NADPH sowie die Reduzierung der Expression von GPX4 zur Folge hat (Abbildung S31). Die Kombination dieser Effekte führt zu einer effizienten Induktion des Zelltods durch Ferroptose.
Auf Grundlage der vielversprechenden biologischen Wirkungen in zweidimensionalen Krebszellen wurden die therapeutischen Eigenschaften in multizellulären CT-26-Tumor-Sphäroiden weiter untersucht. Multizelluläre Tumor-Sphäroide (MCTS) sind ein weit verbreitetes Modell zur Nachahmung der pathologischen Bedingungen solider Tumoren.22 Zur Bewertung der therapeutischen Wirksamkeit von 3 wurde ein kommerzielles CellTiter-Glo 3D Viabilitäts-Kit verwendet, das die intrazelluläre ATP-Konzentration in lebenden Zellen bestimmt. Der Co(III) Polypyridin Sulfasalazin Komplex 3 zeigte eine zytotoxische Wirkung im niedrigen mikromolaren Bereich (IC50=6.34±1.87 μM) gegen multizelluläre CT-26-Tumor-Sphäroide mit einem durchschnittlichen Durchmesser von etwa 250 μm. Zum besseren Verständnis der langfristigen therapeutischen Wirkungen wurden die multizellulären CT-26-Tumorsphäroide mit 1 bis 3 oder Cisplatin (6.34 μM) behandelt und das Tumorwachstum des Sphäroids täglich über einen Zeitraum von neun Tagen beobachtet (Abbildung S32). Die Behandlung mit 1 oder 2 zeigte ein ähnliches exponentielles Tumorwachstum wie die mit PBS behandelten multizellulären Kontrolltumorsphäroide. Die Behandlung mit Cisplatin führte zu einem leicht reduzierten Tumorwachstum. Im Gegensatz dazu hatte die Behandlung mit 3 eine starke Hemmung des Tumorwachstums zur Folge (Abbildung 6A), was auf die überlegene therapeutische Effizienz von 3 im Vergleich zu Cisplatin hinweist. Um einen Einblick in die Behandlung größerer Tumore zu erhalten, wurde die therapeutische Wirkung der Verbindungen in multizellulären CT-26-Tumorsphäroiden mit einem durchschnittlichen Durchmesser von etwa 500 μm weiter untersucht. Frühere Studien haben gezeigt, dass größere multizelluläre Tumorsphäroide aufgrund von Proliferationsgradienten und hypoxischen Regionen im Tumorzentrum wesentlich schwieriger behandelbar sind als kleinere multizelluläre Tumorsphäroide.23 Während die Behandlung mit 1–2 oder Cisplatin keine statistisch signifikante therapeutische Wirkung zeigte (die Behandlung mit Cisplatin lag innerhalb der Standardabweichung des Experiments), zeigte die Behandlung mit 3 eine starke Hemmwirkung auf das Tumorwachstum (Abbildung 6B). Zusammengenommen weisen diese Ergebnisse auf die Fähigkeit von 3 hin, sowohl bei kleinen als auch bei großen multizellulären Tumorsphäroiden therapeutisch einzugreifen. Für ein mechanistisches Verständnis der beobachteten tumorwachstumshemmenden Wirkung des Metallkomplexes wurden die multizellulären Tumor-Sphäroide mit einem durchschnittlichen Durchmesser von etwa 500 μm mit 3 (1,26 μM) behandelt, mit Fluorophoren angefärbt, die spezifisch für den Zelltod und insbesondere für Ferroptose-Merkmale sind, und dann die biologischen Effekte durch Fluoreszenzmikroskopie sichtbar gemacht. Die Calcein AM/Propidiumjodid-Färbung für lebende und tote Zellen zeigte, dass die Behandlung mit 3 zu einer Mischung aus lebenden und toten Zellen innerhalb des Tumorsphäroids führte. Bemerkenswerterweise wurden auch in der Mitte des Sphäroids tote Zellen beobachtet, was auf eine gute Penetration des Co(III)-Sulfasalazin-Komplexes schließen lässt (Abbildung 6C). Die Fähigkeit des Metallkomplexes, ROS in den Tumorsphäroiden zu erzeugen, wurde durch Fluoreszenzmikroskopie unter Verwendung der ROS-spezifischen Sonde 2′,7′-Dichlordihydrofluorescein-Diacetat bewertet. Die Mikroskopieaufnahmen der mit 3 behandelten Sphäroide zeigten die charakteristische grüne Emission, die auf die effiziente ROS-Erzeugung von 3 hinweist (Abbildung 6D). Die Fähigkeit des Metallkomplexes, die Lipidperoxid-Produktion in den Tumor-Sphäroiden auszulösen, wurde durch Fluoreszenzmikroskopie unter Verwendung der spezifischen Sonde BODIPY581/591 C11 bewertet. Die Mikroskopie-Bilder zeigten ein starkes rotes Fluoreszenzsignal nach der Behandlung mit 3, was auf hohe LPO-Werte im gesamten Tumor-Sphäroid hinweist (Abbildung 6E). Die GSH-Reduzierung wurde durch Fluoreszenzmikroskopie unter Verwendung der spezifischen Sonde ThiolTrackerTM Violet bewertet. Die Mikroskopieaufnahmen zeigten keine ausgeprägte violette Emission, die für das Vorhandensein von GSH charakteristisch ist, im Kern des Tumorsphäroids nach der Behandlung mit 3 (Abbildung 6F), was auf den GSH-Abbau hindeutet. Zusammengenommen deuten diese Ergebnisse auf die Fähigkeit von 3 hin, Zelltod des Tumor-Sphäroids durch Induktion der Ferroptose effizient zu auszulösen.
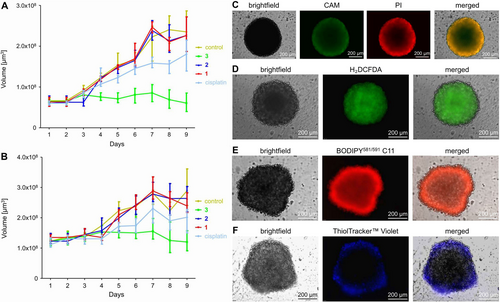
Bewertung der biologischen Wirkungen auf multizelluläre CT-26-Tumor-Sphäroide. A) Kurven zur Hemmung des Tumorwachstums von multizellulären CT-26-Tumor-Sphäroiden mit einem durchschnittlichen Durchmesser von 250 μm nach Behandlung mit 1–3 oder Cisplatin (IC50=6.34 μM) und tägliche Überwachung des Tumorwachstums. B) Kurven zur Hemmung des Tumorwachstums von multizellulären CT-26-Tumor-Sphäroiden mit einem durchschnittlichen Durchmesser von 500 μm nach Behandlung mit 1–3 oder Cisplatin (IC50=6.34 μM) und täglicher Überwachung des Tumorwachstums. Die Fehlerbalken entsprechen der Standardabweichung der drei Wiederholungen. C) Fluoreszenzmikroskopieaufnahmen nach Ko-Inkubation von 3 mit dem Zelllebensfarbstoff Calcein (CAM, λex=460–490 nm, λem=515 nm) und dem Zelltodfarbstoff Propidiumiodid (PI, λex=545–580 nm, λem=617 nm). D) Fluoreszenzmikroskopieaufnahmen nach Ko-Inkubation von 3 mit der ROS-spezifischen Sonde 2′,7′-Dichlorhydrofluoresceindiacetat (λex=460–490 nm, λem=527 nm). E) Fluoreszenzmikroskopieaufnahmen nach Ko-Inkubation von 3 mit der LPO-spezifischen Sonde BODIPY581/591 C11 (λex=460–490 nm, λem=510 nm). F) Fluoreszenzmikroskopieaufnahmen nach Ko-Inkubation von 3 mit der GSH-spezifischen Sonde ThiolTracker™ Violet (λex=330–385 nm, λem=526 nm). MCTS mit einem durchschnittlichen Durchmesser von etwa 500 μm wurden mit 3 (1.26 μM) behandelt.
Zusammenfassung
Diese Studie berichtet über die chemische Synthese und biologische Evaluation eines Co(III) Polypyridin Sulfasalazin Komplexes für die Krebstherapie. Die Verbindung erwies sich unter physiologischen Bedingungen als äußerst stabil. Der Metallkomplex erwies sich als teilweise hydrophil und teilweise lipophil, was eine hohe Wasserlöslichkeit unter biologischen Bedingungen sowie eine hohe zelluläre Penetration ermöglicht. Während sich die einzelnen Komponenten, die jeweiligen Liganden, Metallsalze sowie Metallprecursor als nicht toxisch in Krebszellen erwiesen, zeigte die Zielverbindung eine zytotoxische Wirkung im niedrigen mikromolaren Bereich. Einblicke in den biologischen Wirkmechanismus ergaben, dass sich der Metallkomplex vorzugsweise in den Mitochondrien der Krebszellen anreichert und dort die Bildung zytotoxischer reaktiver Sauerstoffspezies bewirkt. Weitere Analysen ergaben, dass die Verbindung selektiv Hydroxy-Radikale erzeugt, die letztlich die Bildung von Lipidperoxiden verursachen. Sobald die antioxidativen Abwehrkräfte, die auf Glutathion und das Enzym Glutathionperoxidase 4 angewiesen sind, überwältigt sind, schreitet die Lipidperoxid-Produktion unkontrolliert voran und führt schließlich zum Zelltod durch Ferroptose. Auf der Grundlage dieser vielversprechenden biologischen Wirkungen wurden die therapeutischen Eigenschaften in kleinen und großen multizellulären Tumor-Sphäroiden als Tumorgewebekulturmodell für klinische solide Tumoren weiter untersucht. Der Metallkomplex zeigte eine zytotoxische Wirkung, die zu einer Hemmung des Tumorwachstums über mehrere Tage führte. Wir sind zuversichtlich, dass die Entwicklung von Ferroptose induzierenden Metallkomplexen neue Wege für die Behandlung von Krebs eröffnen wird. Die Fähigkeit therapeutisch durch einen multimodalen Wirkungsmechanismus, durch hohe Level von zytotoxischen Hydroxylradikale, einzugreifen, könnte eine vielversprechende Alternative für die Behandlung von medikamentenresistenten oder hypoxischen Tumoren darstellen.
Danksagung
J.K. dankt für die finanzielle Unterstützung durch das Liebig-Stipendium des Fonds der Chemischen Industrie, den Life Sciences Bridge Award der Aventis Foundation und den Paul Ehrlich & Ludwig Darmstaedter Early Career Award 2024 – ein Preis der Paul-Ehrlich-Stiftung, Deutschland. Open Access Veröffentlichung ermöglicht und organisiert durch Projekt DEAL.
Interessenkonflikt
Die Autoren erklären, dass keine Interessenkonflikte vorliegen.
Open Research
Data Availability Statement
Die Daten, die die Ergebnisse dieser Studie unterstützen, sind in den Hintergrundinformationen zu diesem Artikel verfügbar.




