Fragment-Screening und schnelle mikromolare Detektion mit einem Benchtop-NMR-Spektrometer ermöglicht durch photoinduzierte Hyperpolarisation
Abstract
Fragmentbasiertes Wirkstoffdesign ist eine gut etablierte Strategie für rationales Arzneimitteldesign, wobei die Kernspinresonanzspektroskopie (NMR) auf Hochfeldspektrometern als Referenzmethode für das Screening und die Hit-Validierung dient. Hochfeld-NMR-Spektrometer sind jedoch nicht nur teuer, sondern erfordern auch eine spezielle Wartung, einen speziellen Raum und sind auf die Kühlung mit flüssigem Helium angewiesen, was angesichts der wiederkehrenden weltweiten Heliumknappheit kritisch geworden ist. Wir schlagen eine Alternative zum Hochfeld-NMR-Screening vor, indem wir den kürzlich entwickelten Ansatz des Fragment-Screenings durch photoinduzierte hyperpolarisierte NMR auf einem kryogenfreien 80-MHz-Benchtop-NMR-Spektrometer anwenden, der Signalverstärkungen von bis zu drei Größenordnungen ermöglicht. Es wird gezeigt, dass es möglich ist, mit einem Benchtop-NMR-Spektrometer bei niedrigen mikromolaren Konzentrationen sowohl von Proteinen als auch von Liganden neue Hits zu entdecken und die Entwicklung von Medikamenten einzuleiten. Der vorgestellte Ansatz arbeitet mit höherer Geschwindigkeit als moderne Hochfeld-NMR-Ansätze und weist eine Nachweisgrenze im nanomolaren Bereich auf. Die photoinduzierte Hyperpolarisation ist bekanntlich kostengünstig und einfach zu implementieren, was der Philosophie von Benchtop-NMR-Spektrometern sehr entgegenkommt. Diese Ergebnisse ebnen den Weg für den Einsatz von Benchtop-NMRunter nahezu physiologischen Bedingungen für die Entwicklung von Arzneimitteln und weitere Life-Science-Anwendungen.
 (1)
(1)Dabei ist Γ die Polarisation, HFCC die Hyperfeinkopplungs-konstante, gPS und gM die g-Faktoren des Photosensibilisators bzw. des Moleküls, μB das Bohrsche Magneton, B0 das Magnetfeld und ħ die reduzierte Planck-Konstante.
In früheren Arbeiten beobachteten wir eine stärkere photo-CIDNP-induzierte Polarisierung, wenn wir das Magnetfeld reduzierten,22 und andere beobachteten kürzlich Photo-CIDNP mit einem Benchtop-NMR-Spektrometer.23 Wir haben auch gezeigt, dass die photo-CIDNP-induzierte Polarisation im Falle eines Bindungsereignisses zwischen dem polarisierten kleinen Molekül und einem Target, z. B. einem Protein, schneller relaxiert.24 Dieser Effekt hängt mit der Änderung der longitudinalen Relaxation bei der Bindung zusammen und ermöglicht das Screening kleiner Moleküle in Konzentrationen von nur wenigen Mikromol innerhalb von Sekunden mit einem Hochfeld-NMR-Spektrometer. Die Kombination aus inverser Feldabhängigkeit der Polarisation und erhöhten longitudinalen Relaxationsraten bei intermolekularer Wechselwirkung ist vorteilhaft für die Etablierung einer Screening-Methode für kleine Moleküle, die mit einem Benchtop-NMR-Spektrometer kompatibel ist. In den folgenden Abschnitten stellen wir unsere Ergebnisse vor, die den Nachweis von Protein-Fragment-Wechselwirkungen bei mikromolaren und niedrigen mikromolaren Konzentrationen sowie eine Nachweisgrenze im niedrigen mikromolaren bis hohen nanomolaren Bereich umfassen.
Die Polarisation durch Photo-CIDNP bei 80 MHz wurde mit dem bewährten Farbstoff-Ligandenpaar Fluorescein und Tryptophan25 (Verbindung 1) sowie den beiden anderen Verbindungen 5-Methyl-2-(m-tolyl)-1H-imidazol-4-carbonsäure (Verbindung 2) und 2-(2-Aminothiazol-4-yl)propan-2-ol (Verbindung 24) untersucht. Die Messung mikromolarer Konzentrationen dieser Verbindungen in Gegenwart von Fluorescein (25 μM) nach Lichtbestrahlung bei 450 nm (1 W) ergab die Beobachtung starker anomaler Linien innerhalb von 3 Minuten Messzeit (Abbildung 1). Der Vergleich mit den Signalintegralen von nicht bestrahlten Spektren, die bei 80 MHz für 52 Minuten gemessen wurden, ergab eine Signal-Rausch-Verstärkung (SNE) von 39, 21 bzw. 1300-fach für die Verbindungen 1, 2 und 24. Die Berechnungsdetails der SNE sind in den Hintergrundinformationen (Gl. S1) zu finden. Um ein Signal-Rausch-Verhältnis zu erreichen, das mit dem der Photo-CIDNP-Spektren vergleichbar ist, würde das Experiment ohne Lichtbestrahlung daher je nach Verbindung eine Messzeit von 22 bis 85′000 Stunden erfordern. Mit anderen Worten: Die photoinduzierte Hyperpolarisation reduziert die Versuchszeit um den Faktor 440 bis 1′700′000.
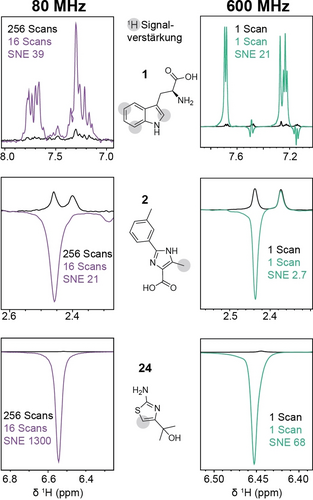
Photo-CIDNP polarisierte 1D 1H NMR-Spektren der Verbindungen 1, 2 und 24 bei 80 MHz und 600 MHz im Vergleich zu nicht bestrahlten Spektren. Abgebildet sind die Peaks mit der höchsten Polarisation für jedes Molekül, für die SNEs von 39, 21 und 1300 bei 80 MHz und 21, 2.7 und 68 bei 600 MHz für die Verbindungen 1, 2 und 24 beobachtet wurden. Die Verbindungen wurden bei 500 μM in Photo-CIDNP-Puffer mit Bestrahlungszeiten von 6 s vor jedem Scan bei 80 MHz bzw. 2 s bei 600 MHz gemessen. Die grauen Kreise zeigen die hyperpolarisierten Protonen an, für die in der Abbildung Peaks dargestellt sind. Die vollständigen Spektren mit Protonenzuordnungen für alle hyperpolarisierten Peaks und die entsprechenden Verstärkungen sind in den Hintergrundinformationen (Abbildung S1) enthalten.
Zum Vergleich wurden dieselben Experimente bei 600 MHz wiederholt, wobei für die Verbindungen 1, 2 und 24 eine 21-, 2.7- bzw. 68-fache SNE erzielt wurde (Abbildung 1). Die grössere SNE bei niedrigerem Magnetfeld steht im Einklang mit Gleichung 1, und das Ausmass der Verstärkung hängt von den HFCC-Werten des Moleküls und der Differenz zwischen den g-Faktoren von Photosensibilisator und Molekül ab.22, 26, 27
 (2)
(2)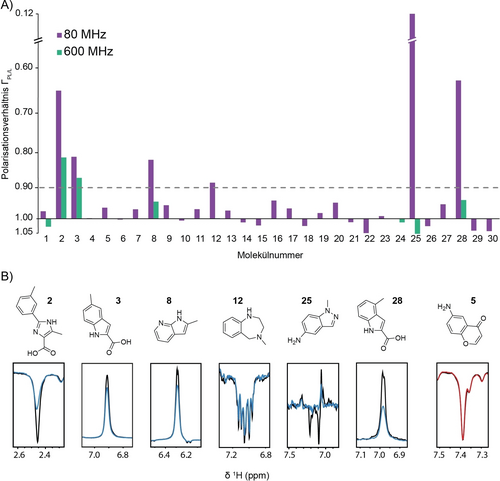
Ergebnisse des Photo-CIDNP-basierten PIN1-Fragment-Screenings bei 80 MHz mit 500 μM Fragmenten und 10 μM PIN1. A) Polarisationsverhältnisse (invertierte Skala) für alle gescreenten Fragmente bei 80 MHz und für ausgewählte Verbindungen (d. h. 1, 2, 3, 8, 12, 24, 25 und 28) bei 600 MHz. Der Grenzwert für die Hit-Erkennung wurde auf ΓPL/L=0.9 gesetzt. B) 80 MHz 1D 1H-Photo-CIDNP-Spektren aller Hits in Abwesenheit (schwarz) und Anwesenheit (blau) von Protein und ein Beispiel für einen Nicht-Hit in Abwesenheit (schwarz) und Anwesenheit (rot) von Protein. Die Spektren wurden mit 16 Scans in 3 Minuten mit einer Bestrahlungszeit von 6 Sekunden vor jedem Scan gemessen.
Dabei sind ΓPL und ΓL die Integrale der polarisierten Ligandensignale in Anwesenheit bzw. Abwesenheit von Protein, wobei ein Wert von ΓPL/L=1 keinem Bindungsereignis und ΓPL/L=0 einem vollständigen Verschwinden des Photo-CIDNP-Signals aufgrund einer verstärkten longitudinalen Relaxation durch die Wechselwirkung des Liganden mit dem Protein entspricht.
Abbildung 2A zeigt die Polarisationsverhältnisse der 30 Fragmente, die bei 80 MHz gegen PIN1 getestet wurden. Alle Verbindungen mit einem Polarisationsverhältnis von weniger als 0.9 wurden als Treffer betrachtet, d. h. sie interagieren mit PIN1. Die nicht interagierenden Moleküle zeigten eine enge Streuung der Polarisationsverhältnisse mit einem Mittelwert von 0.99 und einer Standardabweichung von 0.03, was wir durch das robuste Probenvorbereitungsprotokoll erklären (Hintergrundinformationen: Material und Methoden). Abbildung 2B zeigt die Spektren der Hits bzw. eines nicht interagierenden Fragments. Insgesamt wurden sechs Hits mit einem Polarisationsverhältnis unter 0.9 beobachtet, von denen vier (d. h. 2, 3, 12 und 25) bereits zuvor bekannt und durch [1H,15N]-HSQC-Experimente bei 600 MHz über Änderungen der chemischen Verschiebung von Proteinen (CSPs) validiert wurden (Tabelle S1).24, 32, 33 Die Verbindungen 2 und 3 wiesen Polarisationsverhältnisse von 0.65 bzw. 0.81 auf und hatten Affinitäten im Bereich von 1.7–4.5 mM bzw. 1.5–3.6 mM.24 Verbindung 12 wies ein Polarisations-verhältnis von 0.89 auf, und Verbindung 25 zeigte ein nahezu vollständiges Polarisationsverhältnis von 0.12. Die beiden neuen Treffer, Verbindungen 8 und 28, weisen Polarisationsverhältnisse von 0.82 bzw. 0.63 auf. Zur Validierung wurden [1H,15N]-HSQC-Spektren bei 600 MHz durchgeführt (Abbildung S2), welche die Interaktion mit Verbindung 28 bestätigten, während die Verbindung 8 keine beobachtbaren CSPs ergab. Interessanterweise weist die neue Verbindung 28 eine große strukturelle Ähnlichkeit mit der zuvor gemeldeten Verbindung 3 auf, mit dem einzigen Unterschied, dass die Methylposition am Indolring von Position 5 auf Position 4 verschoben wurde (Abbildung 2B).
Zum Vergleich wurden die Screening-Experimente bei 600 MHz für eine Auswahl von Verbindungen, darunter 1, 24 und alle Hits, unter denselben experimentellen Bedingungen wiederholt, mit Ausnahme des NMR-Magnetfeldes, der Lichtbestrahlungszeit und der Anzahl der Scans (Abbildung 2A). Es wurde festgestellt, dass die Bestrahlungszeit keinen Einfluss auf das Polarisations-verhältnis hat22, 34 und Bestrahlungszeiten über 2 Sekunden bei 600 MHz tragen nicht zu einer höheren SNE bei.22 Insgesamt war die Verringerung des polarisierten Signals bei Protein-Fragment-Interaktion bei 600 MHz weniger ausgeprägt als bei 80 MHz, und die schwächsten Hits wurden bei 600 MHz in diesem Konzentrationsbereich nicht mehr beobachtet (Tabelle S1, Abbildung 2A). Dieser Befund wird auf den größeren Polarisationsunterschied zwischen Fragment und Protein bei 80 MHz als bei 600 MHz nach der Beleuchtung zurückgeführt, was zu einer höheren selektiven Relaxation im niedrigen Feld im Vergleich zum hohen Feld führt. Der Polarisationsunterschied zwischen dem hyperpolarisierten Liganden und dem Protein im thermischen Gleichgewicht lässt sich direkt aus den SNEs ableiten, die bei niedrigem Feld vergleichsweise höher sind als bei hohem Feld (2- bis 19-fach). Zusammengenommen deuten unsere Daten darauf hin, dass der Kontrast des Polarisationsverhältnisses bei niedrigeren Magnetfeldern besser ist und dass daher NMR-Benchtop-Spektrometer den Hochfeld-NMR-Spektrometern beim Nachweis schwach wechselwirkender Liganden durch Photo-CIDNP-Screening-Experimente überlegen sind.
Ermutigt durch die oben beschriebenen Ergebnisse haben wir die Durchführbarkeit eines photoinduzierten Hyperpolarisations-screenings bei niedrigeren Konzentrationen untersucht. Eine Verringerung der Probenkonzentration ist von Vorteil, wenn Fragmente eine begrenzte Löslichkeit aufweisen oder um den Verbrauch von mühsam hergestelltem rekombinantem Protein zu reduzieren. Das Screening-Experiment wurde daher mit 50 μM der Verbindungen 2 (Binder) bzw. 24 (Nicht-Binder) und verschiedenen Proteinkonzentrationen wiederholt, d. h. 0, 1, 5 und 10 μM, was einem 0-, 5-, 10- bzw. 50-fachen Ligandenüberschuss entspricht. Die Polarisationsverhältnisse für die Verbindungen 2 und 24 wurden gemäß Gleichung 2 berechnet und sind in Abbildung 3A dargestellt. Die Polarisationsverhältnisse von Verbindung 2 zeigen eine dosisabhängige Signalverringerung bei Zugabe von PIN1-Protein, während das Polarisationsverhältnis von Verbindung 24 während der PIN1-Titration stabil bleibt. Diese Ergebnisse zeigen, dass ein Screening bei niedrigen mikromolaren Fragment- und Proteinkonzentrationen auf einem Benchtop-NMR-Spektrometer mit einem dreiminütigen Experiment (d. h. 16 Scans) möglich ist. Es ist anzumerken, dass die Verwendung von Integralen zur Berechnung des Polarisationsverhältnisses anstelle von Signalintensitäten genauere Ergebnisse liefert, wie dies für Verbindung 24 gezeigt wird (Abbildung S3). Dies könnte auf die Inhomogenität der Proben in verschiedenen NMR-Röhrchen zurückzuführen sein, die Linienverbreiterungseffekte verursachen kann, da das Benchtop-Spektrometer nicht vor jeder Messung geshimmt wird.
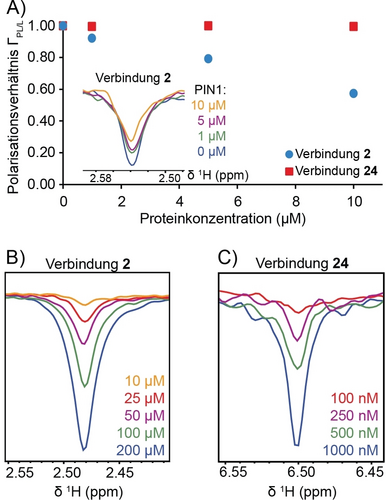
Photo-CIDNP 1D 1H NMR bei 80 MHz unter Verwendung niedriger mikromolarer Konzentrationen. A) Der Nachweis der Bindung wird für Verbindung 2 bei 50 μM durch Vergleich der Polarisationsverhältnisse in Gegenwart von 1, 5 und 10 μM des Proteins PIN1 gezeigt. Der Vergleich mit Verbindung 24 zeigt, dass das aus den Signalintegralen ermittelte Polarisationsverhältnis für einen Nicht-Binder im gleichen Konzentrationsbereich nicht beeinflusst wird. B) Konzentrationstitration für Verbindung 2 mit der niedrigsten Konzentration von 10 μM, die ein Signal-Rausch-Verhältnis von 7.3 und eine SNE von 48 im Vergleich zu den nicht bestrahlten Referenzspektren bei 500 μM ergibt. C) Konzentrationstitration für Verbindung 24, die zu einer Nachweisgrenze von 250 nM für ein Photo-CIDNP-Spektrum bei 80 MHz führt, mit einem Signal-Rausch-Verhältnis von 6.1 und einer SNE von 3200-fach im Vergleich zur Referenz bei 500 μM. Alle Spektren wurden mit 16 Scans in 3 min gemessen, mit Ausnahme des Spektrums von Verbindung 24 bei 100 nM, das mit 32 Scans in 6 min aufgenommen wurde.
Um die Nachweisgrenze zu ermitteln, wurden die Verbindungen mit dem höchsten Signal-Rausch-Verhältnis unter den Bindern und Nicht-Bindern für weitere Untersuchungen ausgewählt, d. h. die Verbindungen 2 und 24. Konzentrationsreihen von reinen Fragment-Photo-CIDNP-Experimenten wurden mit 200, 100, 50, 25 und 10 μM für Verbindung 2 und 200, 100, 50, 25, 10, 5, 2.5, 1, 0.5, 0.25 und 0.1 μM für Verbindung 24 durchgeführt. Die Spektren bei verschiedenen Konzentrationen und die Entwicklung des Signal-Rausch-Verhältnisses sind in Abbildung 3B und C dargestellt. Die Verbindung 2 war bis zu 10 μM in 16 Scans nachweisbar (Abbildung 3B). Obwohl Verbindung 24 bei 100 nM nach 32 Scans (6 min) beobachtet werden konnte, waren Konzentrationen von 250 nM oder höher für eine deutlichere Auslesung erforderlich und konnten in 16 Scans (3 min) nachgewiesen werden. Für die Quantifizierung des Polarisationsverhältnisses von Verbindung 24 schätzen wir eine erforderliche Konzentration im Bereich von 1 μM (Abbildung 3C). Soweit uns bekannt ist, wurden submikromolare Konzentrationen noch nie mit einem Benchtop-NMR-Spektrometer unter Verwendung von Photo-CIDNP nachgewiesen. Über den Nachweis von 20 nM Tryptophan mittels Photo-CIDNP-NMRwurde in der Literatur berichtet, doch dazu war eine Kombination aus spezifischer Markierung mit stabilen Isotopen, einem Kryo-Probenkopf und einem Hochfeld-NMR-Spektrometer erforderlich.35 In der vorliegenden Studie wurde die unmodifizierte natürliche Verbindung 24 verwendet (d. h. mit ihren natürlichen Isotopen), und der Nachweis wurde mit einem kryogenfreien Benchtop-Spektrometer durchgeführt. Die SNE für eine Konzentration von 250 nM wurde auf der Grundlage des Referenzspektrums bei 500 μM berechnet, da die Verbindung schätzungsweise 500′000 Stunden (21′000 Tage) lang gemessen werden müsste, um bei 250 nM bei 80 MHz nachgewiesen zu werden.
Wir führen die hohe SNE von schätzungsweise 3200-fach für Verbindung 24 auf ihren 2-Aminothiazol-Ring zurück, der für seine Redox-Aktivität bekannt ist, die für den Photo-CIDNP-Mechanismus wesentlich ist.36 Der Thiazolring kommt auch in Vitamin B1 (Thiamin) vor, das ein bekannter Radikalfänger ist. Diese Erkenntnis deutet darauf hin, dass durch die Erforschung des chemischen Raums ultrahohe SNE-Eigenschaften erreicht werden können. Beispielsweise könnte ein neuer, bisher nicht getesteter heteroaromatischer Ring noch höhere Verstärkungen ergeben, ohne dass eine teure Isotopenmarkierung erforderlich ist. Darüber hinaus können verschiedene Probenbedingungen weiter optimiert werden, um eine optimale Polarisationseffizienz zu erreichen, z. B. die Photosensibilisatorkonzentration, die Zugabe von Vitamin C oder die Wiederholung von Scans mit kürzerer Bestrahlung.25, 35, 37 Es wird erwartet, dass die weitere Untersuchung der Auswirkungen dieser Parameter zu einer Senkung der derzeitigen Nachweis- und Quantifizierungsgrenzen führen wird.
Zusammenfassend lässt sich sagen, dass der vorgestellte Ansatz unter Verwendung der photoinduzierten Hyperpolarisation die Durchführbarkeit des Fragment-Screenings auf einem 80-MHz-Benchtop-NMR-Spektrometer bei niedrigen mikromolaren Fragment- und Proteinkonzentrationen in dreiminütigen Experimenten mit einer Nachweisgrenze von 250 nM und einer Quantifizierungsgrenze von 1 μM zeigt. Unter Hyperpolarisations-bedingungen haben selbst schwache Bindungsereignisse einen bedeutenden Einfluss auf die spezifische Relaxation des NMR-Signals, wodurch ein ausreichender Kontrast zum Nachweis von Protein-Fragment-Wechselwirkungen selbst bei hohem Ligandenüberschuss erreicht wird. In Kombination mit der bei niedrigen Feldern erzielten Empfindlichkeitsverbesserung können photo-CIDNP-basierte Ligand-Protein-Wechselwirkungs-studien auf dem Benchtop-Spektrometer die negativen Aspekte der NMR für FBDD ausgleichen und eine relativ kostengünstige und kryogenfreie Alternative zu Hochfeldspektrometern bieten. Gleichzeitig bleiben die Vorteile der NMR für das Fragment-Screening erhalten, nämlich die Empfindlichkeit für schwache Bindungsereignisse, markierungsfreie Messungen in Lösung und minimale Assay-Entwicklung. Darüber hinaus eröffnen bestehende kommerzielle Lösungen, bei denen Benchtop-NMR-Spektrometer mit einem leistungsstarken Probenwechsler kombiniert werden, einen neuen Weg zu höherem Durchsatz und Automatisierung, so dass auch Laien zu vertretbaren Kosten sehr zuverlässige Wirkstoff-Screenings durchführen können. Eine weitere Verbesserung des Durchsatzes könnte durch die Verwendung von 19F photo-CIDNP NMR38 und fluorierter Bibliotheken39 erreicht werden, um mehrere Fragmente in einer einzigen Probe zu bündeln und gleichzeitig die geringe Streuung der chemischen Verschiebung und die Auswirkungen von Skalarkopplungen bei niedrigeren Magnetfeldern zu überwinden. Insgesamt glauben wir, dass unser Ansatz das Potenzial hat, die Einschränkungen der NMR für das Design von Arzneimitteln zu überwinden und NMR-Methoden für eine breitere Life-Science-Gemeinschaft zugänglich zu machen.
Hintergrundinformationen
Die Autoren haben zusätzliche Referenzen in den Hintergrundinformationen angegeben (Refs. [40, 41]).
Danksagung
Die Autoren danken der ETH (ETH-42 20-2), dem Schweizerischen Nationalfonds (40B1−0_211796) und der Stiftung Krebsforschung Schweiz (KFS-4903-08-2019) für die finanzielle Unterstützung. Die Autoren möchten auch David Stapfer und Margaux Kobelt für die Unterstützung beim Screening danken. Open Access funding provided by Eidgenössische Technische Hochschule Zürich.
Interessenkonflikt
M.B., F.T. und R.R. sind Mitbegründer der Firma NexMR GmbH, die auf der vorgestellten Arbeit aufbaut.
Open Research
Data Availability Statement
Die Daten, die die Ergebnisse dieser Studie unterstützen, sind auf begründete Anfrage beim Autor erhältlich.




