Diboriranid σ-Komplexe von d- und p-Blockmetallen
Abstract
Diboriranide sind die kleinstmöglichen monoanionischen Aromaten; dennoch sind bisher nur wenige Beispiele bekannt und ihre Reaktivität sowie Koordinationschemie noch völlig unerforscht. Wir berichten über einen einfachen Syntheseweg in drei Stufen zum ersten Peraryldiboriranid c-(DurB)2CPh− in Form seines Lithiumsalzes über das entsprechende nicht-klassische Diboriran, das seinerseits aus dem leicht zugänglichen 1,2-Dichlordiboran(4) (Dur=2,3,5,6-Tetramethylphenyl) erhalten wird. Mit der Herstellung und vollständigen Charakterisierung repräsentativer Komplexe mit Zinn, Kupfer, Gold und Zink demonstrieren wir die starke Präferenz des Diboriranids für σ-Koordination gegenüber Hauptgruppen- und Übergangsmetallzentren unter Erhalt des 2e− π-Systems des B2C-Rings.
Einleitung
Die Koordinationschemie von Aromaten wie Benzol,1 Cyclopentadienid-Anionen2 und Tropylium-Kationen3 wird durch die dative Bindung des π-Systems an elektronenarme Akzeptoren aus dem p- und d-Block des Periodensystems dominiert. Der isoelektronische Austausch von Kohlenstoffatomen der Ringsysteme durch ein oder zwei Boratome führte zu verschiedenen Beispielen von Borol-Dianionen,[4] Boratabenzolen5 und Diboratabenzolen6 sowie zu den siebengliedrigen Borepinen.7 Während monoanionische Boratabenzole und neutrale Borepine als konzeptioneller Ersatz für Cyclopentadienid-Liganden dienen, ermöglichen die dianionischen Spezies einen unkomplizierten Zugang zu verschiedenen Tripeldecker-Komplexen.8 Im Vergleich dazu ist die Koordinationschemie dreigliedriger Aromaten weit weniger entwickelt: Cyclopropenium-Kationen I (Schema 1) wurden zwar als Liganden eingesetzt, reagieren aber überwiegend unter reduktiver Ringöffnung, d. h. oxidativer Addition des σ-Gerüsts an das Übergangsmetall.9 Borirene II, die sich formal durch isoelektronischen Ersatz eines Kohlenstoffs durch ein Boratom ableiten lassen, haben aufgrund der einfachen Zugänglichkeit durch Borylentransfer auf Alkine besondere Aufmerksamkeit erfahren.10 Diese Methode ermöglicht auch einen einfachen Zugang zu Borirenen in X-Koordination an Übergangsmetalle.11 Die L-Koordination zu Übergangsmetallen ist dagegen selten und erfolgt ausschließlich über η3-Koordination über das π-System.12
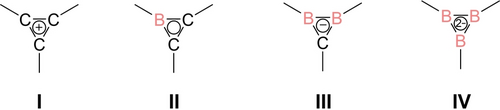
Schematische Darstellung von isoelektronischen Cyclopropenium Analoga mit Bor Atomen.
Während einige wenige Beispiele von Diboriraniden III von Berndt et al. beschrieben wurden,13 waren Triborirandiide IV nur als homoaromatische Derivate bekannt,14 bis Braunschweig et al. 2015 ein monocyclisches Beispiel beschrieben.15 Stabile Komplexe mit d- oder p-Block Elementen sind in beiden Fällen unbekannt. Tatsächlich ist die Reaktivität der Diboriranide III allgemein kaum erforscht, vermutlich aufgrund (a) der relativ sperrigen Substituenten in allen bekannten Beispielen und (b) des komplizierten Zugangs, der typischerweise in mehrstufigen Synthesen und/oder schlechten Ausbeuten erfolgt.
Die ersten Diboriranide, über die Berndt et al. 1985 berichteten, wurden durch Überreduktion von 1,1-Bis(chloroboryl)-2,2-bis(trimethylsilyl)alken hergestellt.13a Bei dieser Reaktion wird das borylsubstituierte Ende der C=C-Bindung Teil des anionischen B2C-Rings und das silylsubstituierte Ende wird in eine exocyclische Methylgruppe mit einer zusätzlichen anionischen Ladung umgewandelt, die selektiv protoniert werden kann, um A zu erhalten (Schema 2). Das Verfahren erfordert zwar, ausgehend von einem 1,2-Dichlordiboran(4), nur drei Schritte ist aber auf nur wenige Substituenten begrenzt. Alle anderen Diboriranide, über die nach 1985 berichtet wurde, wurden aus neutralen Diboriranen B durch reduktive Abspaltung des B−B-verbrückten Wasserstoffatoms, vermutlich als Hydrid, hergestellt.16
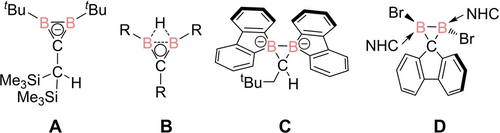
Literaturbekannte B2C Ringsysteme (NHC=1,3-Diisopropyl-4,5-dimethylimidazol-2-ylidene).
Ausgehend von 1,2-Dichlordiboranen(4), erfordern die literaturbekannten Diboriran-Synthesen aber oft mehr als sechs Schritte und führen nur zu mittelmäßigen Ausbeuten.13a, 17 Aromatische Substituenten am Ringkohlenstoffatom bleiben bisher unzugänglich, was eine Erweiterung des konjugierten Systems zur Untersuchung der besonderen elektronischen Eigenschaften der borhaltigen π-Systeme ausschließt. Eine ähnliche Einschränkung gilt für die beiden klassischen Diborirane C und D, die von den Gruppen von Wagner18 und Liu19 beschrieben wurden und die aufgrund der tetrakoordinierten Ringkohlenstoffatome und des Fehlens einer geeigneten Abgangsgruppe in dieser Position ohnehin nicht als Vorstufen für Diboriranide geeignet sind. Wir berichten nun über die unkomplizierte und ergiebige dreistufige Synthese eines einfachen Diboriranids mit einem, sterisch wenig anspruchsvollen und potenziell konjugierten Phenylsubstituenten am Ringkohlenstoffatom ausgehend von einem leicht zugänglichen 1,2-Diaryl-1,2-dichlordiboran(4). Wie wir zeigen werden, dominiert die B−B σ-Bindung die Koordination der so erhaltenen Diboriranide an Elemente des p- und d-Blocks, wodurch das 2e− π-System weitestgehend unbeeinflusst bleibt und ausnahmslos Spezies mit einer anti-van't Hoff/Le Bel-Geometrie an den Borzentren erhalten werden.
Ergebnisse und Diskussion
Synthese des Lithium Diboriranids
Kohlenstoffatome in α-Position zu einem elektronenarmen Bor-Zentrum können leicht deprotoniert werden, um so die entsprechenden Methylenborate mit einer B−C-Doppelbindung zu erhalten.20 Wir nahmen daher an, dass die oben genannten Einschränkungen durch die Deprotonierung eines geeignet substituierten Derivats eines 1-Methyl-2-Halodiborans(4) und dem anschließenden Ringschluss zum entsprechenden Diboriran unter Salzeliminierung überwunden werden könnten. Anstelle der ursprünglichen Methyl- haben wir uns für eine Benzylgruppe entschieden, um die Deprotonierung weiter zu erleichtern und eine wenn auch geringe kinetische Stabilisierung zu erreichen. So wird eine vergleichsweise geringe sterische Belastung aufrechterhalten unter gleichzeitiger Erweiterung des konjugierten Systems des Diboriranids.
Das benötigte 1-Benzyl-2-chlor-1,2-diduryldiboran(4) 1 wurde durch die überraschend selektive Reaktion von 1,2-Dichlor-1,2-diduryldiboran(4)21 mit einem Äquivalent Benzylmagnesiumchlorid22 bei −78 °C in 97 % Ausbeute erhalten. Es wurde mithilfe von multinuklearen NMR-Experimenten und Röntgenbeugung am Einkristall analysiert (siehe Hintergrundinformationen). Die Deprotonierung von 1 in benzylischer Position ist mit Lithiumtetramethylpiperidid (LiTMP) tatsächlich möglich und führt über sofortigen Ringschluss zum nichtklassischen Diboriran 2 (Schema 3), welches aus einer konzentrierten Toluol Lösung bei −23 °C als farblose Kristalle in 85 % Ausbeute isoliert wurde. Die chemische Verschiebung im 11B NMR bei δ=25.7 ppm ist sehr ähnlich zu denen der zuvor berichteten Diborirane mit Durylsubstituenten an den Boratomen (δ11B=24 bis 29 ppm).17 Das 1H NMR-Signal bei δ=7.3 ppm ist der BHB-Brücke zuzuordnen (BHB der literaturbekannten 1,2-Diduryldiborirane δ1H=7.36 bis 7.83 ppm).17 Das verbreiterte Signal, das durch die Kopplung zu den beiden Bor-Quadrupolkernen zustande kommt, bestätigt diese Zuordnung.
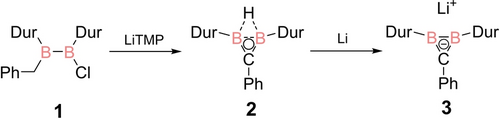
Synthese von Lithiumdiboriranid 3 aus 1-Benzyl-2-chlorodiborane(4) 1 über das nicht-klassische Diboriran 2 (Dur=Duryl=2,3,5,6-Tetramethylphenyl; TMP=2,2,6,6-Tetramethylpiperidid).
In Anlehnung an Synthesen von Berndt et al.16, 23 führt die Zugabe eines Überschusses an Lithiumpulver zu einer Lösung von 2 in Diethylether zur Bildung von Diboriranid 3 (Schema 3), das in Form blassgelber Kristalle in 60 % Ausbeute durch Kristallisation aus Et2O/thf isoliert wurde. Das 11B NMR-Spektrum in thf-d8 zeigt ein breites Signal bei δ=44.2 ppm. Die Entschirmung im Vergleich zu Diboriran 2 ist wahrscheinlich auf die stärker ausgeprägte Hückel-Aromatizität des B2C-Ringsystems zurückzuführen. Entsprechend ist auch das Ringkohlenstoffatom von Diboriranid 3 mit δ13C=151.9 ppm im Vergleich zum Diboriran 2 (13C=135.7 ppm) entschirmt und liegt damit im Bereich der Cyclopropenium-Kationen I,12a Borirene II10 und anderer Diboriranide.13 Das Lithium-Kation von 3 liegt in thf-d8 vermutlich solvent-separiert vor, wie aus dem Fehlen einer signifikanten Verbreiterung des 7Li-NMR-Signals bei der unauffälligen chemischen Verschiebung von δ=0.4 ppm zu schließen ist.
Synthesen der Lithium Diboriranid Metallkomplexe
Im Hinblick auf die 2e3c σ-BHB-Brücke, die den Erhalt der 2e−-Hückel-Aromatizität des Dreirings der nicht-klassischen Diborirane ermöglicht, haben wir die Möglichkeit ähnlicher Koordinationsmodi für Metallkomplexe von Diboriraniden in Betracht gezogen. Unter den in Tabelle 1 angegebenen Bedingungen führt die Addition der entsprechenden Metallhalogenide an Lithiumdiboriranid 3 zu einer (laut NMR-Spektroskopie) fast quantitativen Umwandlung in neue, metallverbrückte Diboriranide 4 bis 7 (Schema 4).
Verbindung |
Reagens |
Äquiv. |
Lösemittel |
Dauer |
Ausbeute |
|---|---|---|---|---|---|
4 |
AuCl(PPh3) |
1 |
thf |
15 min |
47 % |
5 |
CuCl or CuI(PPh3)3 |
0.5 |
thf |
1 h |
39 % |
6 |
CuCl |
1 |
thf |
12 h |
42 % |
7 |
ZnCl2 |
1 |
thf |
15 min |
96 % |
8 |
Me3SnCl |
1 |
Hexan |
1 h |
50 % |
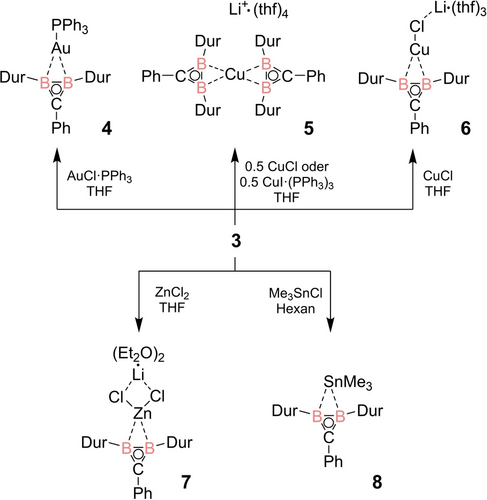
Synthese der Metallkomplexe 4 bis 8 ausgehend von Diboriranid 3 (Dur=2,3,5,6-tetramethylphenyl).
Die Reaktion von einem Äquivalent Me3SnCl in Hexan mit Diboriranid 3 bei Raumtemperatur ergibt das zinnverbrückte Diboriranid 8, mit geringen Spuren (10 %) des Diborirans 2 als Nebenprodukt. In allen Fällen zeigen die 1H NMR-Spektren in Lösung nur je ein Singulett für die ortho- und meta-Methylgruppen der Durylsubstituenten, was ihre chemische Äquivalenz und damit die symmetrische Struktur der Produkte in Lösung auf der NMR-Zeitskala bestätigt. Das 31P NMR-Spektrum des Rohprodukts der Zugabe von 0.5 Äquivalenten CuI[(PPh3)3] zeigt ein einzelnes Signal bei δ=−4.9 ppm für freies PPh3,24 was auf die Dissoziation des Phosphan-Liganden und die Bildung des Cuprats 5 hindeutet.
In der Tat ergibt die Reaktion von CuCl mit zwei Äquivalenten von 3 ein identisches Produkt. Im Gegensatz dazu zeigt das 31P NMR-Spektrum des Goldkomplexes 4 ein ins Tieffeld verschobene Signal bei δ=52.2 ppm, was den Verbleib von PPh3 im Produkt bestätigt. In allen fünf Komplexen werden ähnliche 11B NMR-Signale beobachtet (4: 37.9 ppm, 5: 34.7 ppm, 6: 34.4 ppm, 7: 32.9 ppm, 8: 34.0 ppm), die im Vergleich zum Vorläufer, Lithiumdiboriranid 3, zu etwas höherem Feld verschoben sind.
Das 119Sn NMR Spektrum von 8 zeigt ein scharfes Singulett (ν1/2=13.2 Hz) bei δ=−38.0 ppm, was im deutlichen Gegensatz zu den verbreiterten Signalen der literaturbekannten stannyl-verbrückten Boran-Cluster steht.25 Die Abwesenheit der Kopplung zwischen dem 119Sn-Kern und dem Bor-Quadrupolkern deutet auf einen überwiegenden p-Charakter der Bindung hin. Die 13C NMR-Verschiebungen der Ringkohlenstoffatome liegen alle näher an der von Diboriranid 3 als an derjenigen von Diboriran 2 (4: 147.8 ppm, 5: 153.9 ppm, 6: 151.1 ppm, 7: 144.0 ppm, 8: 144.5 ppm, bestimmt zwischen −40 °C und −70 °C, siehe Hintergrundinformationen), was einen ähnlich ionischen Charakter der Wechselwirkung zwischen dem B2C-Ring und dem Metallzentrum erahnen lässt.
Analyse der Einkristall-Röntgenstrukturen
Einkristalle des nicht-klassischen Diborirans 2 sowie aller Diboriranidkomplexe 3 bis 8 wurden durch Kristallisation aus den entsprechenden Lösungsmitteln erhalten (Bedingungen in den Hintergrundinformationen).26 Die Röntgenbeugungsstudien bestätigen die B2C-Ringsysteme, bei denen die B−B-Bindungen durch das Wasserstoffatom bzw. die eingebauten Metallfragmente verbrückt werden (Abbildung 1). Das Cuprat 5 zeigt zwei η2-gebundene Diboriranide, beide edge-on an das spirozyklische Kupfer-Zentrum gebunden.
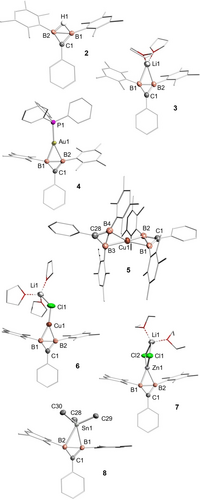
Molekülstrukturen von Diboriran 2 und Diboriranid-Metallkomplexen 3 bis 8 im Einkristall: Golddiboriranid 4, Bis(diboriranid)-cuprat 5, Kupferdiboriranid 6, Zinkdiboriranid 7 und trimethylstannyl-verbrücktes Diboriranid 8. Die meisten Wasserstoffatome, das vom Lösungsmittel separierte Gegenkation von 5 und die fehlgeordneten Lösungsmittelmoleküle wurden der Vereinfachung halber weggelassen. Thermische Ellipsoide bei 50 %.26
Die beiden B2C-Ebenen bilden einen angenähert rechten Winkel (B1,B2,C1 und B3,B4,C28: 84.1(2)°). Das solvent-separierte Lithium-Kation von 5 wird von vier thf-Molekülen koordiniert. Der B2C-Ring, die Phenyl-ipso-Kohlenstoffatome und die von der B−B Einheit verbrückten Atome liegen in allen Komplexen 3 bis 8 annähernd in einer Ebene; die größte Abweichung mit 0.23 Å ergibt sich für Li1 von Diboriranid 3 (Tabelle 2). Die Koordinationsumgebungen der Boratome entsprechen somit ungefähr einer tetragonal-planaren Geometrie und stellen daher weitere Beispiele für Verletzungen der van't Hoff/Le Bel-Regel dar.27, 28 Der B−B-Bindungsabstand von 1.769(2) Å im nicht-klassischen Diboriran 2 liegt im typischen Bereich von B−B-Bindungen mit einem verbrückten Wasserstoff17, 29 und ist mithin viel länger als derjenige in Lithiumdiboriranid 3 (1.630(4) Å). Letzterer Abstand ist nur geringfügig länger als bei neutralen B=B-Doppelbindungen,30 was mit der zyklischen Delokalisierung der π-Elektronen in Einklang steht. Die B−B Bindung in Diboriranid 3 ist aber kürzer als bei den meisten dianionischen Beispielen,31 was das Fehlen von Coulomb-Abstoßung widerspiegelt. Der kleine Diederwinkel (16.3(2)°) zwischen der Phenylgruppe und der Diboriran-Ebene in Diboriranid 3 ist mit der cyclischen Delokalisierung der π-Elektronen im Phenyl-Ring im Einklang, obwohl der Wert etwas größer als der im nicht-klassischen Diboriran 2 (1.2(1)°) ist. Während die Durylgruppen an den Boratomen von Diboriran 2 nur leicht von der idealen Anordnung in einem gleichschenkligen Dreieck abweichen (Tabelle 2; B1−B2−CDur 155.4(1)° und B2−B1−CDur 157.2(1)°), wird die Verzerrung in den Diboriranidkomplexen 3 bis 7 zunehmend größer (159.4(1)° bis 169.5(2)°). Im Fall des homoleptischen Cuprats 5 nähert sich der Winkel sogar der Linearität an, was auf die erhöhte Elektronendichte am Kupferzentrum zurückgeführt werden könnte. Der Diboriranid-Goldkomplex 4 zeigt eine nahezu lineare Anordnung des PPh3-Liganden und der η2-gebundenen B−B-Einheit (P1−Au1-(Schwerpunkt)B1,B2 176.0(4)°). Die B−B σ-Bindung (B1−B2 1.809(4) Å) ist viel länger als in Lithiumdiboriranid 3 (B1−B2 1.630(4) Å), aber deutlich kürzer als in einem verwandten Azadiboriridin-Goldkomplex (1.889 Å).32 Gleichzeitig sind die Au−B-Abstände in 4 (B1−Au1 2.214(2) Å, B2−Au1 2.242(2) Å) im Vergleich zum genannten Azadiboridin−Au(I)−Komplex (2.118 Å) länger, was möglicherweise auf den elektronenziehenden Chlor-Liganden am Gold-Zentrum des letzteren zurückzuführen ist. Der Au−B Abstand in 4 ist eher mit denen in Boryl- (2.21–2.30 Å)33 und Diborenkomplexen (2.21–2.22 Å)34 vergleichbar, jeweils ohne elektronegative Substituenten an den Gold Atomen. Es sei darauf hingewiesen, dass der Azadiboriridin-Ligand nur von begrenztem Vergleichswert ist, da die Delokalisierung der beiden π-Elektronen im B2N-Heterocyclus aufgrund der höheren Elektronegativität des Stickstoffzentrums weniger effektiv ist. Im Vergleich zum Goldkomplex 4 verlängert die Koordination mit Kupfer die B−B-Abstände weniger stark: Für das homoleptische Cuprat 5 (B1−B2 1.690(4), B3−B4 1.702(4) Å) liegen sie im Bereich heteroleptischer Kupferkomplexe von dianionischen Diboranen(4) (1.68–1.73 Å),35 dem einzigen anderen Beispiel für ein Cuprat mit mindestens einem B−B-Liganden.
Verbindung |
B−B [Å] |
B−X [Å] |
B-Cring [Å] |
B-CDur [Å] |
B−B-CDur [°]a |
B-Cring-B [°] |
Diederwinkel [°]b |
Abweichung aus der Ebene [Å]c |
|---|---|---|---|---|---|---|---|---|
2 (X=H) |
1.769(2) |
1.278(2) |
1.442(2) |
1.564(2) |
155.4(1) |
75.6(1) |
1.2(1) |
0.01 (H1) |
|
|
1.309(2) |
1.442(2) |
1.560(2) |
157.2(1) |
|
|
|
3 (X=Li) |
1.630(4) |
2.402(6) |
1.454(4) |
1.570(3) |
159.3(2) |
68.2(2) |
16.3(2) |
0.23 (Li1) |
|
|
2.389(6) |
1.455(4) |
1.571(3) |
159.4(2) |
|
|
|
4 (X=Au) |
1.809(4) |
2.142(2) |
1.442(3) |
1.577(3) |
167.6(2) |
77.8(2) |
12.9(1) |
0.06 (C1) |
|
2.242(2) |
1.440(3) |
1.588(3) |
166.8(2) |
|
|
|
|
5 (X=Cu) |
1.690(4) |
2.150(3) |
1.445(4) |
1.577(4) |
168.2(2) |
71.5(1) |
35.2(3) |
0.16 (B2) |
|
|
2.140(3) |
1.448(4) |
1.567(4) |
167.7(2) |
|
|
|
|
1.702(4) |
2.147(3) |
1.448(4) |
1.567(4) |
169.5(2) |
71.9(2) |
1.5(2) |
0.20 (B4) |
|
|
2.148(3) |
1.449(4) |
1.573(4) |
165.2(2) |
|
|
|
6 (X=Cu) |
1.728(5) |
2.093(4) |
1.450(5) |
1.584(4) |
165.0(3) |
73.3(2) |
13.2(2) |
0.02 (C1) |
|
|
2.071(4) |
1.444(5) |
1.578(4) |
166.1(3) |
|
|
|
7 (X=Zn)d |
1.719(3) |
2.186(2) |
1.443(2) |
1.577(2) |
161.4(1) |
73.2(1) |
8.2(2) |
0.10 (B1) |
|
|
2.199(2) |
1.440(2) |
1.581(2) |
163.0(1) |
|
|
|
8 (X=Sn) |
1.799(2) |
2.462(2) |
1.453(2) |
1.568(2) |
160.1(1) |
77.5(1) |
10.6(1) |
0.08 (B1) |
|
|
2.636(2) |
1.419(2) |
1.559(2) |
174.6(1) |
|
|
|
Der B−Cu Abstand in 5 (B1−Cu1 2.150(3) Å und B2−Cu1 2.140(3) Å, B3−Cu1 2.147(3) Å, B4−Cu1 2.148(3) Å) ist ähnlich zu denen von neutralen (2.10–2.15 Å)36 und dianionischen (2.14–2.23 Å)35 B=B π-Komplexen. Die Festkörperstruktur des heteroleptischen Cuprats 6, das alternativ durch Zugabe von 5 zu einem zweiten CuCl-Äquivalent erhalten werden kann, zeigt, dass die Koordinationssphäre des Kupfers durch das Chloratom von LiCl vervollständigt wird. Das Lithium-Kation ist wiederum zusätzlich durch drei thf-Moleküle koordiniert. Im Einklang mit der Koordination zum elektronegativen und dadurch schwach donierenden Chloratom am Kupferzentrum, ist die B−B-Bindung in 6 deutlich länger (B1−B2 1.728(5) Å) und die B−Cu-Bindungen (B1−Cu1 2.093(4), B2−Cu1 2.071(4) Å) kürzer als in 5. Diese Beobachtung wird durch die Molekülstruktur des Zinkkomplexes 7 im Einkristall gestützt, der ebenso wie 6 ein Äquivalent LiCl in der Koordinationssphäre des Metallzentrums enthält. Die B−B Bindung in 7 (B1−B2 1.719(3) Å) ist fast identisch mit derjenigen in 6. Die Bor-Zink Abstände (B1−Zn1 2.186(2) Å, B2−Zn1 2.199(2) Å) in Zinkkomplex 7 sind bedeutend kürzer als in π-Komplexen der neutralen Diborene mit Zinkdihalogeniden (2.29–2.36 Å)37 und somit eine Verdeutlichung der verstärkten Coulomb-Anziehung. Die Verlängerung der B−B Bindung scheint ein direktes Maß für die σ-Donierung zum d-Block-Metall in den Komplexen 4 bis 7 zu sein. Obwohl sterische Effekte nicht völlig ausgeschlossen werden können, ist die σ-Donierung durch das Diboriranid an Zn und Cu ungefähr gleich, jedoch deutlich geringer als an Au.
Überraschenderweise zeigt die Röntgenbeugungsstudie an einem Einkristall des zinnverbrückten Diboriranids 8 auch eine edge-on Koordination des Zinnatoms an der B−B-Einheit, was zu einer erweiterten Fünffach-Koordination am Sn1-Zentrum führt, wie bei den literaturbekannten Ph3Sn-verbrückten Pentaboran(9)-Clustern.24 Die B−B Bindung (B1−B2 1.799(2) Å) ist sogar etwas kürzer als in Goldkomplex 4. Im Gegensatz zu den d-Block-Diboriranidkomplexen, ist das Zinnatom jedoch deutlich zu einem der Boratome geneigt: die B−Sn Bindungslängen unterscheiden sich signifikant (B1−Sn1: 2.462(2); B2−Sn1 2.636(2) Å) und sind gleichzeitig länger als eine typische B−Sn Einfachbindung in elektronenpräzisen Stannylboranen (2.28–2.32 Å).38
Während sich der kleinere B1−B2−CDur Winkel von 160.1(1)° im Bereich anderer Diboriranid-Metallkomplexe 4 bis 7 findet, ist der größere B2−B1−CDur Winkel mit 174.6(1)° ziemlich nahe an der Linearität. Die Strukturparameter sprechen für einen erheblichen Beitrag der Methylenboran-Resonanzstruktur 8′ (Schema 5). Zwar gibt es keinen Hinweis auf eine solche Absenkung der Symmetrie in Lösung, doch könnte dies durchaus auf einen schnellen Austausch auf der 1H NMR-Zeitskala selbst bei −40 °C zurückzuführen sein.

Zinnverbrückter Diboriranidkomplex 8 und Methylenboran-Resonanzstruktur 8′.
DFT-Berechnungen
Die elektronische Struktur von 2 und die der Diboriranid-Metallkomplexe 3, 4, 5, 7 und 8 wurde mit DFT-Rechnungen auf B3LYP/def2tzvpp-Niveau untersucht. Die Kohn–Sham-Molekülorbitale (MOs) wurden aus BP86/def2SVP-optimierten Strukturen berechnet. Während die optimierten Strukturen von 2, 3, 4, 5, 7 und 8 recht gut mit den Kristallstrukturen übereinstimmen, wurde der experimentell ermittelte Cl−Cu−BB(Centroid)-Winkel im Mono(diboriranid)cuprat 6 durch die Berechnungen nicht reproduziert, was vermutlich auf Packungseffekte im Festkörper zurückzuführen ist (siehe Hintergrundinformationen). Daher wurden die MOs von 6 aus einer Single-Point-Berechnung abgeleitet, bei der die experimentell aus der Festkörperstruktur gewonnenen Koordinaten verwendet werden.
Während im Falle des Diborirans 2 die allbindende Kombination der π-Orbitale des B2C-Rings das HOMO darstellt, ist die σ-Donierung zum Li+-Gegenion in 3 über das entsprechende π-Orbital angehoben (Abbildung 2 und Hintergrundinformationen). Die Natural Bond Orbital (NBO) Analyse ergibt eine 3c2e-Wechselwirkung mit nahezu perfekter π-Symmetrie sowohl für 2 als auch für 3 (mindestens 99.7 % p-Charakter für alle beteiligten Atome). Darüber hinaus weist das nicht-klassische Diboriran 2 die erwartete BHB 3c2e σ-Wechselwirkung auf, die annähernd aus sp3-Hybriden an den Borzentren besteht (siehe Hintergrundinformationen). Der Austausch der BHB 3c2e σ-Bindung in Diboriranid 3 zugunsten einer klassischen 2e2c σ-Bindung wird auch durch die Erhöhung des Wiberg-Bindungsindexes der B−B-Bindung von Diboriran 2 (0.53) zu Diboriranid 3 (1.06) bestätigt. Gleichzeitig nehmen die positiven Ladungen an den Boratomen gemäß der Natural Population Analyse (NPA; 2: B1: +0.49, B2: +0.48; 3: B1: +0.20, B2: +0.19) ab, was die höhere Elektronendichte im B2C-Ringsystem in Diboriranid 3 im Vergleich zu Diboriran 2 verdeutlicht. Wie erwartet, befindet sich der Großteil der negativen Ladung am Kohlenstoffatom des Ringsystems (2: −0.62, 3: −0.60).
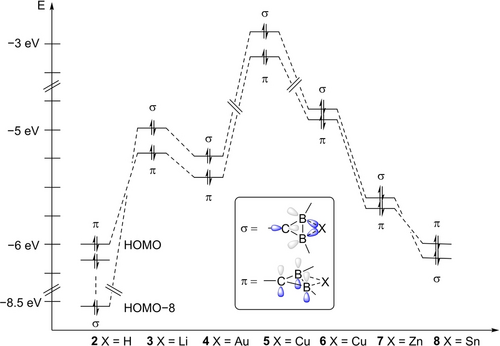
Relative Energien der HOMOs und HOMOs−1 von Diboriran 2 und Diboriranid-Derivaten 3 bis 8.
Das HOMO des Gold(I)komplexes 4 (Abbildung 3) ist die antibindende Kombination des σ-Orbitals der B−B Einheit und des  Orbitals des Metallzentrums. Das HOMO−1 entspricht dem, über den B2C Ring delokalisierten, allbindenden aromatischen π-System, mit nur geringem Anteil des Goldatoms, was die praktisch ausschließliche σ-Koordination weiter unterstreicht. Das LUMO von 4 setzt sich hauptsächlich aus einem antibindenden phosphor-zentrierten Orbital des PPh3-Liganden mit stabilisierenden Wechselwirkungen des π-Systems der drei Phenylgruppen des Phosphors zusammen.
Orbitals des Metallzentrums. Das HOMO−1 entspricht dem, über den B2C Ring delokalisierten, allbindenden aromatischen π-System, mit nur geringem Anteil des Goldatoms, was die praktisch ausschließliche σ-Koordination weiter unterstreicht. Das LUMO von 4 setzt sich hauptsächlich aus einem antibindenden phosphor-zentrierten Orbital des PPh3-Liganden mit stabilisierenden Wechselwirkungen des π-Systems der drei Phenylgruppen des Phosphors zusammen.
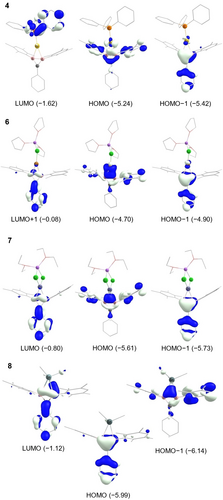
Ausgewählte Grenzorbitale der Diboriranid-Metallkomplexe 4 und 6 bis 8 (Energie in eV, Konturwert der Orbitale=0.05)
Im Gegensatz zum Goldkomplex 4 weisen sowohl die homoleptischen als auch die heteroleptischen Cuprate 5 bzw. 6 ein LUMO auf, das aus der konstruktiven Wechselwirkung des π*-Systems am B2C-Ring mit dem am Kohlenstoff gebundenen Phenylring resultiert.
Das HOMO der beiden Cupratkomplexe 5 und 6 ähnelt dem des Goldkomplexes 4 und besteht aus einer antibindenden Kombination des σ-Orbitals der B−B-Einheit und des  Orbitals des Metallzentrums. Auch hier stellt das HOMO−1 das allbindende π-System des B2C-Rings mit geringen Beiträgen der Kupferzentren dar. Während das LUMO von Cuprat 6 aus σ*-Orbitalen an den Lösungsmittelmolekülen besteht (siehe Hintergrundinformationen), entspricht das LUMO+1 von 6 dem LUMO von Bis(diboriranid) 5, das hauptsächlich aus dem π*-System an den Boratomen und dem Phenylring besteht. Das HOMO von Zinkat 7 stellt die Donierung von σ-Elektronen der Boratome zum Zinkatom dar. Im Gegensatz zu den entsprechenden Orbitalen der oben besprochenen Komplexe zeigt es keine Beiträge eines zinkzentrierten Orbitals, obwohl das HOMO−1 auch hier dem Diboriranid π-System entspricht.
Orbitals des Metallzentrums. Auch hier stellt das HOMO−1 das allbindende π-System des B2C-Rings mit geringen Beiträgen der Kupferzentren dar. Während das LUMO von Cuprat 6 aus σ*-Orbitalen an den Lösungsmittelmolekülen besteht (siehe Hintergrundinformationen), entspricht das LUMO+1 von 6 dem LUMO von Bis(diboriranid) 5, das hauptsächlich aus dem π*-System an den Boratomen und dem Phenylring besteht. Das HOMO von Zinkat 7 stellt die Donierung von σ-Elektronen der Boratome zum Zinkatom dar. Im Gegensatz zu den entsprechenden Orbitalen der oben besprochenen Komplexe zeigt es keine Beiträge eines zinkzentrierten Orbitals, obwohl das HOMO−1 auch hier dem Diboriranid π-System entspricht.
Besonders hervorzuheben ist, dass sich die energetische Reihenfolge der besetzten Grenzorbitale im Me3Sn-verbrückten Diboriranid 8 umkehrt: Das HOMO repräsentiert nun das π-System und das HOMO−1 die σ-Donierung zum Zinn-Zentrum (Abbildung 2). Das LUMO von 8 stellt das π*-System an den Boratomen dar und hat eine vergleichsweise niedrige Energie (−1.12 eV). Die höhere Energie des π-Orbitals von 8 unterstreicht erneut die Störung der zyklischen Delokalisierung durch einen signifikanten Beitrag der Resonanzstruktur 8′ (Schema 5).
Um die Aromatizität des Diboriranes 2 und der Diboriranid-Komplexe 3 bis 8 weiter zu untermauern, wurden die kernunabhängige chemische Verschiebungen (NICS) im geometrischen Schwerpunkt der B2C Ringe berechnet (B3LYP/def2TZVP, siehe Tabelle 3). Die für NICS(0) erhaltenen Werte ähneln denen des Cyclopropenium-Kations, die wir zum Vergleich auf demselben Niveau berechnet haben (NICS(0)=−23.2).39 Um den Einfluss lokalisierter Ringströme, sowie die Abschirmungen durch das σ-Gerüst zu minimieren, wurden die NICS auch 1 Å oberhalb und unterhalb der B2C-Ringebene berechnet.40 Alle NICS(1/−1) Werte liegen im Bereich von −10.6 bis −13.3 und sind damit nur geringfügig positiver als die des Cyclopropenium Kations (NICS(1)=−14.9).39 Die NICS Werte unterstreichen damit die 2π-Aromatizität der Ringsysteme in 2 bis 8 und seine grundsätzliche Unabhängigkeit von der Art des koordinierten Metalls.
Verbindung |
NICS(0) |
NICS(1/−1) |
|---|---|---|
2 |
−25.3 |
−12.6/−12.8 |
3 |
−19.5 |
−12.1/−12.7 |
4 |
−19.9 |
−10.6/−11.7 |
5 |
−19.9 |
−12.4/−12.7 |
|
−20.1 |
−12.9/−13.2 |
6 |
−20.4 |
−11.9/−12.5 |
7 |
−23.3 |
−12.2/−12.7 |
8 |
−22.8 |
−13.3/−10.7 |
Bemerkenswert ist, dass selbst die Koordination der Me3Sn-Gruppe in 8 keine nachteiligen Auswirkungen auf den magnetisch induzierten Ringstrom zu haben scheint.
Zusammenfassung
Wir haben eine einfache Synthesestrategie vorgestellt, mit der sich Diborirane in zwei Schritten aus einem leicht zugänglichen 1,2-Dichlordiboran(4) herstellen lassen. Im Gegensatz zu zuvor berichteten Diboriranen ist eine Phenylgruppe an das Ringkohlenstoffatom gebunden, deren Koplanarität zum ersten Mal eine π-Konjugation mit der B2C-Ringebene ermöglicht und damit neue Perspektiven für die Einbindung nicht-klassischer Diboriran-Motive in erweiterte π-Systeme bietet. Die nahezu planare anti-van't Hoff/Le Bel-Geometrie an den Bor-Zentren bleibt bei der Reduktion zu Lithiumdiboriranid 3 und - was noch wichtiger ist - auch bei der Komplexierung mit verschiedenen d-Block-Elementen, nämlich Gold (4), Kupfer (5, 6) und Zink (7), erhalten. Das Diboriranid bindet an die p- und d-Block-Metallkomplexe in derselben Ebene, im Wesentlichen unter ausschließlicher σ-Koordination, so dass das π-System weitestgehend ungestört bleibt. Jedoch deuten im Fall des stannyl-verbrückten Diboriranids 8, kristallographische Ergebnisse darauf hin, dass die cyclische Delokalisierung des π-Systems abgeschwächt ist. Einer der beiden Sn−B-Abstände ist erheblich verlängert, um die Bindung bis zu einem gewissen Grad zu lokalisieren und damit den Grad der Hyperkoordination im Zinnzentrum zu verringern, die in Abwesenheit elektronegativer Substituenten als ungünstig angesehen wird. Die Anwendungsbreite der neuen Methode wird derzeit von uns untersucht, insbesondere im Hinblick auf die Toleranz gegenüber funktionellen Gruppen und die weitere Ausdehnung des π-Systems.
Danksagung
Wir bedanken uns für die Finanzierung durch die Universität des Saarlandes. Wir danken Dr. Diego Andrada für die Unterstützung bei den Berechnungen, hilfreiche Diskussionen und den Zugang zu seinem Computational Cluster. Wir danken dem Service Center X-ray Diffraction, das mit finanzieller Unterstützung der Universität des Saarlandes und der Deutschen Forschungsgemeinschaft (INST 256/506-1) eingerichtet wurde. Open Access Veröffentlichung ermöglicht und organisiert durch Projekt DEAL.
Interessenkonflikt
Die Autoren erklären, dass keine Interessenkonflikte vorliegen.
Open Research
Data Availability Statement
Die Daten, die die Ergebnisse dieser Studie unterstützen, sind in den Hintergrundinformationen zu diesem Artikel verfügbar.




