Direkte Regioselektive Dehydrierung von α-Substituierten Cyclischen Ketonen
Abstract
Wir berichten über eine hochregioselektive, katalytische einstufige Dehydrierung von α-substituierten cyclischen Ketonen in Gegenwart von 2,3-Dichlorbenzo-5,6-dicyano-1,4-benzochinon (DDQ). Die exzellente Regioselektivität beruht auf einer Phosphorsäure-katalysierten Enolisierung, die selektiv das thermodynamisch bevorzugte Enol liefert. Die anschließende Oxidation ermöglicht einen zuverlässigen Zugang zu mehreren α-Aryl- und α-Alkyl-substituierten α,β-ungesättigten Ketonen.
Die Dehydrierung von Carbonylen zu den entsprechenden α,β-ungesättigten Verbindungen ist eine häufig angewandte Transformation in der Synthese komplexer Moleküle und Naturstoffe.1 Eine allgemeine zweistufige Strategie beruht auf der Aktivierung von Ketonen entweder als Enolat oder als Enolsilan (Abbildung 1-A), wobei die Deprotonierung unter thermodynamischer oder kinetischer Kontrolle die Regioselektivität des nachfolgenden Oxidationsvorgangs bestimmt. Die Entsättigung von Enolaten wird häufig in Gegenwart von Chalkogenhalogeniden durchgeführt (Reich, Trost, Mukaiyama), wohingegen Silylenolether oft in Gegenwart von Pd(OAc)2 oxidiert werden (Saegusa-Ito).2-5 Um toxische Oxidationsmittel auf Chalkogenbasis oder teure stöchiometrische Oxidationsmittel auf Palladiumbasis zu vermeiden, wurden große Anstrengungen unternommen um weniger toxische, billigere und katalytische Varianten dieser Reaktion zu entwickeln. Kürzlich entwickelten Baran und Mitarbeiter eine elektrochemische Entsättigung von vorgebildeten Enol-Äquivalenten.6 Ein frühes katalytisches Beispiel wurde von Larock und Mitarbeitern beschrieben, die sich auf die Seagusa-Ito-Oxidation von Silylenolethern unter Verwendung von katalytischen Mengen Pd(OAc)2 in Gegenwart von Sauerstoff als terminales Oxidationsmittel konzentrierten.7 Stahl et al. verbesserten die auf Palladium basierende Oxidationsstrategie weiter und ermöglichten eine direkte Oxidation von unaktivierten Ketonen unter Verwendung katalytischer Mengen Palladium-Katalysatoren in einer Sauerstoffatmosphäre (Abbildung 1-B),8 während Newhouse die Oxidation von vorgebildeten kinetischen Enolaten unter Verwendung von Diethylallylphosphat als Oxidationsmittel entwickelte.9 Kürzlich konnten Kang und Qu zeigen, dass die Kombination von FeCl3 mit 1,10-Phenanthrolin ein leistungsstarkes katalytisches System für TEMPO-vermittelte Entsättigungen darstellt.10
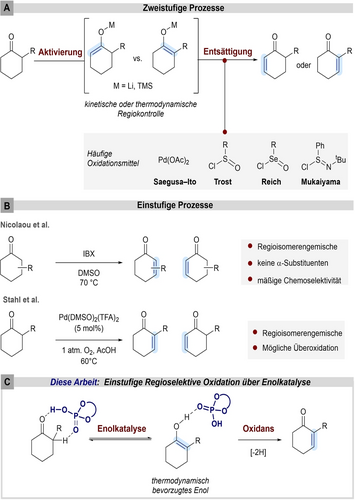
A) Zweistufige Prozesse zur Entsättigung cyclischer α-substituierter Ketone. B) Einstufige Ansätze. C) Diese Arbeit: einstufige regioselektive Oxidation durch Enolkatalyse.
Eine metallfreie, einstufige Dehydrierung von Ketonen wurde von Nicolaou unter Verwendung von hypervalenten Iodreagenzien beschrieben (Abbildung 1-B).11 Obwohl diese einstufigen Methoden die Entsättigungsreaktion erheblich verbessert haben und häufig in Totalsynthesen eingesetzt werden, schränken eine Vielzahl von Nachteilen ihre allgemeine Anwendbarkeit noch immer ein. So kann beispielsweise eine unzureichende Regiokontrolle zu geringen Ausbeuten und zur erschwerten Isolation führen. Darüber hinaus sind Schutzgruppen für funktionelle Gruppen oft oxidationsempfindlich, was die Anwendbarkeit oxidativer Entsättigungsmethoden auf unfunktionalisierte Substrate reduziert. Nach unserem Wissen ist die hochregioselektive Entsättigung bisher ausschließlich für enzymkatalytische Systeme bekannt, wobei jedoch lediglich unbefriedigende Umsetzungen erzielt werden konnten.12
Um zur Lösung der obengenannten Probleme beizutragen haben wir die Phosphorsäure-basierte Enolkatalyse als Plattform zur Entwicklung eines neuen, regioselektiven Ansatzes ins Auge gefasst. Die Enolkatalyse ermöglicht die Aktivierung von Ketonen in Kombination mit einer hohen Regiokontrolle hin zum thermodynamisch stabileren Enol wie bereits in enantioselektiven Aldol-, α-Aminierungs-, α-Hydroxylierungs-, Michael- und Aryloxylierungsreaktionen gezeigt werden konnte.13-18 Darüber hinaus konnten Schmittel et al. das geringere Oxidationspotenzial von Enolen im Vergleich zu den jeweils zugehörigen Ketonen nachweisen.19, 20 Wir gingen daher davon aus, dass die Kombination der Enolkatalyse mit dem Einsatz eines geeigneten Oxidationsmittels einen neuen Ansatzpunkt für die Entwicklung einer katalytischen einstufigen Ketonentsättigung bieten und die bisherige Problematik der Regioselektivität überwinden könnte (Abbildung 1-C).
Ein erstes Screening der Reaktionsbedingungen wurde mit 2-Phenylcyclohexanon (1 a) als Modellsubstrat in Gegenwart von Diphenylphosphorsäure (DPP) als Katalysator und einer Auswahl an Oxidationsmitteln durchgeführt (für weitere Informationen siehe Hintergrundinformationen). Insbesondere 2,3-Dichlor-5,6-dicyano-p-benzochinon (DDQ), ein weit verbreitetes Dehydrierungsmittel, erwies sich als geeignetes Oxidationsmittel für die von uns verfolgte enolkatalysierte Entsättigungsstrategie.21-24 Das gewünschte Enon 2 a und das entsprechende α-aryloxylierte Produkt 3 a wurden aus dem Keton 1 a (Eintrag 1, Tabelle 1) erhalten, wenn auch mit unvollständiger Umsetzung.17, 25 Bemerkenswert ist, dass die Reaktion nicht in Abwesenheit des Phosphorsäurekatalysators abläuft (Eintrag 2), was die anfänglich postulierte Phosphorsäure-vermittelte Enolisierung als Aktivierungsmodus bekräftigt. Nach der ausführlichen Evaluierung der Reaktionsbedingungen einschließlich der Untersuchung verschiedener Lösungsmittel (Einträge 3–6), anderer Additive, Oxidationsmittel und Reaktionstemperaturen (für weitere Informationen siehe Hintergrundinformationen), blieb die Ausbeute des gewünschten Enons unbefriedigend und es wurden immer noch erhebliche Mengen des Nebenprodukts 3 a erhalten. Versuche, das Nebenprodukt 3 a in situ in das gewünschte Enon 2 a umzuwandeln blieben erfolglos. Interessanterweise hatte die Anwendung von kommerziell erhältlichen enantiomerenangereicherten BINOL-basierten Phosphorsäuren (CPA) einen bemerkenswerten Effekt auf die Produktverteilung und begünstigte die Bildung des gewünschten ungesättigten Enons 2 a (Einträge 7–9).
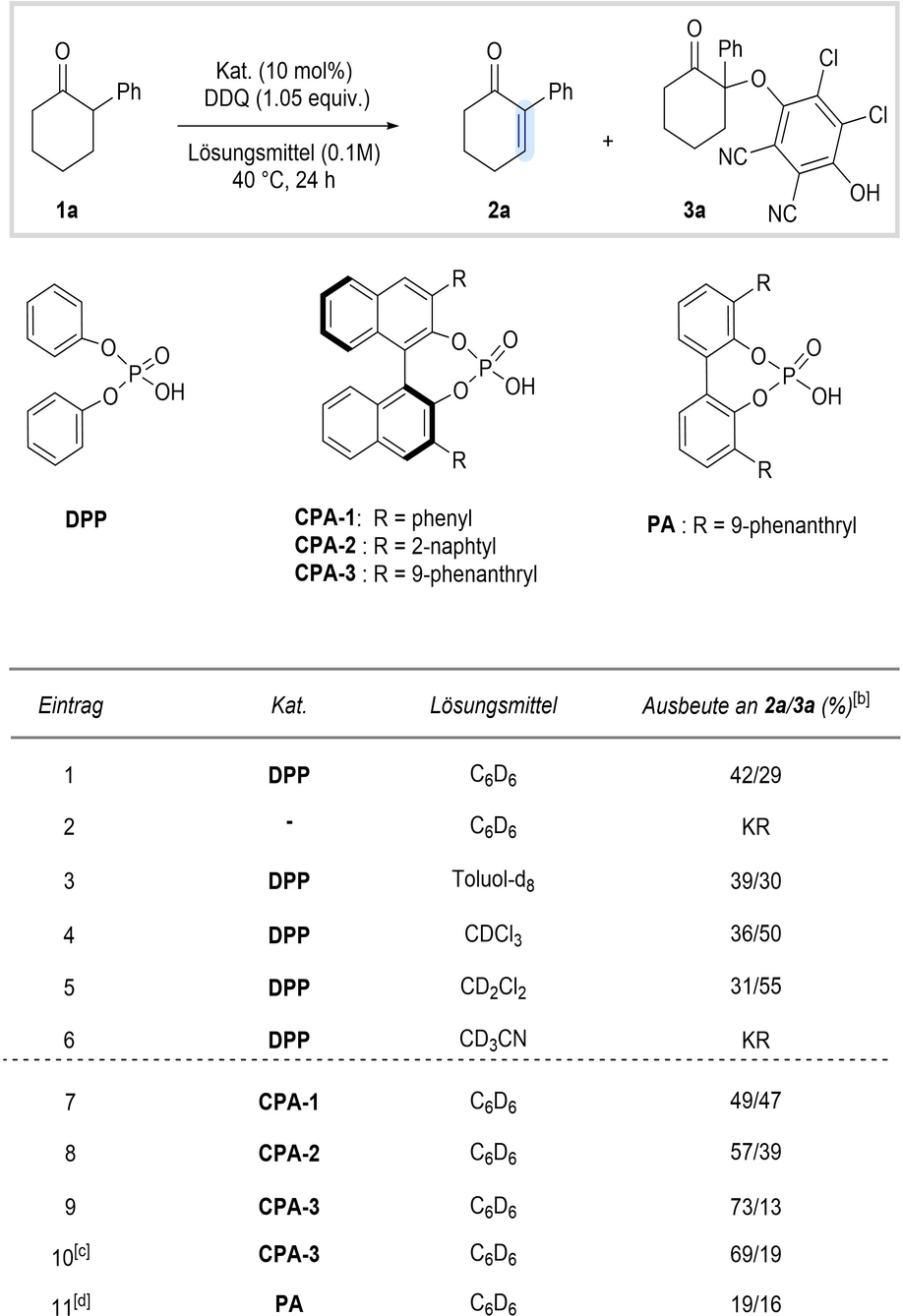
- [a] Die Reaktionen wurden im 0.05-mmol-Maßstab durchgeführt. [b] Die Ausbeuten wurden per 1H NMR unter Verwendung von Dibrommethan als internem Standard bestimmt. [c] Die Reaktion wurde mit racemischem CPA-3 durchgeführt. [d] Es wurde eine verringerte Löslichkeit des Katalysators beobachtet.
Der Katalysator CPA-3, der den 3,3′-(9-Phenanthryl)-Substituenten enthält, erwies sich als überlegenes Katalysatormotiv, entweder enantiomerenrein (Eintrag 9) oder als Racemat (Eintrag 10). Eine auf dem Biphenylgerüst basierende Phosphorsäure (PA) wurde ebenfalls untersucht, was jedoch aufgrund der geringen Löslichkeit des Katalysators zu deutlich geringeren Ausbeuten führte (für weitere Informationen siehe Hintergrundinformationen).
Mit der kommerziell erhältlichen Phosphorsäure CPA-3 wurde nun der potentielle Anwendungsbereich sowie die Generalität der Entsättigungsmethode untersucht (Tabellen 2 und 3). α-Phenylcyclopentanon (2 b) und α-Phenylcycloheptanon (2 c) durchliefen problemlos die gewünschte Oxidation, wenn auch mit etwas geringerer Ausbeute für das 7-Ring basierte Substrat (Tabelle 2, Eintrag 2–3). Die geringere Ausbeute für das 7-Ring basierte Substrat kann mit einem höheren Energiebedarf für den Übergangszustand zur Enolisierung erklärt werden, was folglich zu einer verminderten Reaktivität führt. α-Arylcyclohexanone mit elektronenarmen und elektronenreichen Substituenten sind gut geeignet und liefern die gewünschten Produkte in hohen Ausbeuten (Einträge 4–6). Außerdem toleriert diese Methode strukturell größere α-Substituenten, wie beispielhaft in den Einträgen 7 und 8 gezeigt. Darüber hinaus werden aliphatische α-Substituenten gut toleriert (Tabelle 3), wie das Beispiel des Enons 2 i (Eintrag 1) zeigt.
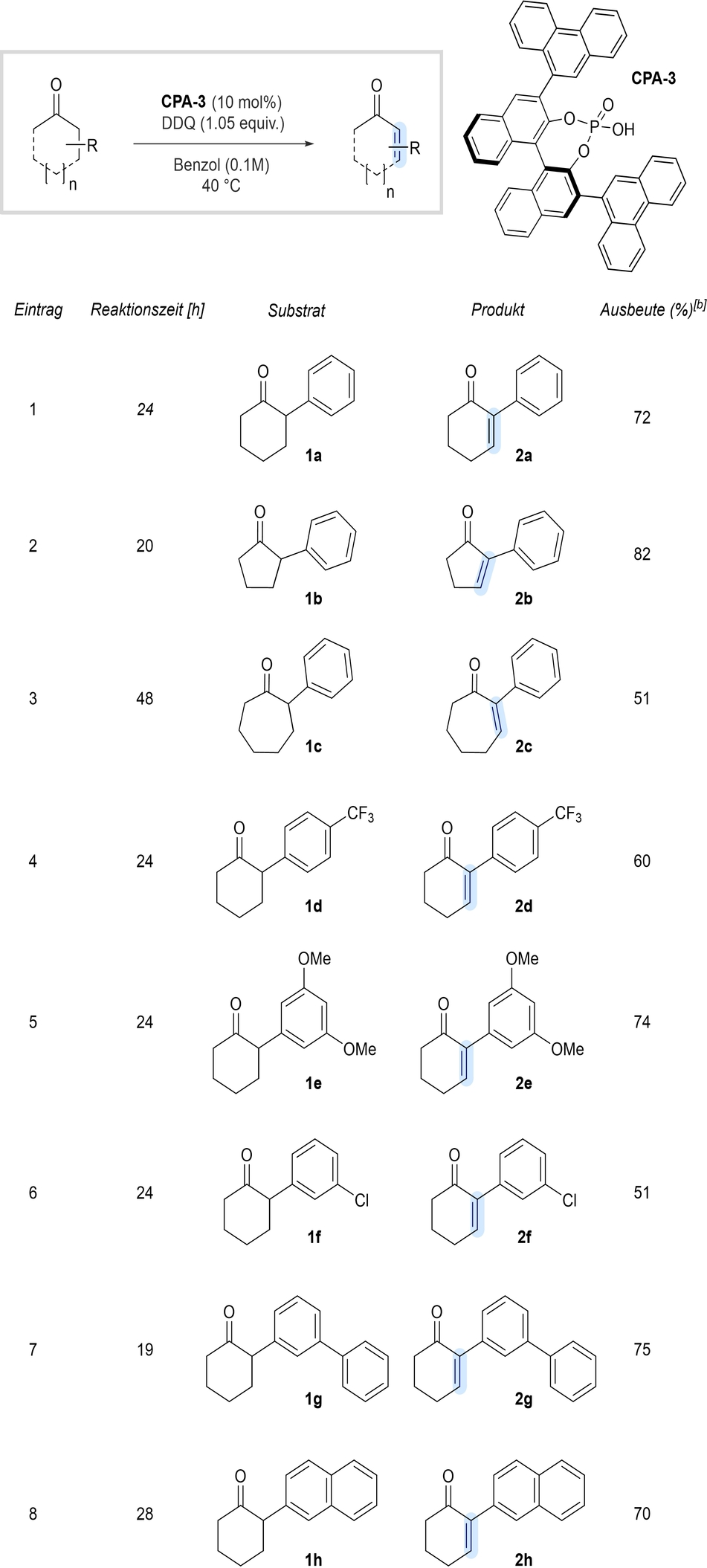
- [a] Die Reaktionen wurden im 0.5 mmol-Maßstab durchgeführt. [b] Isolierte Ausbeuten (r.r>20 : 1).
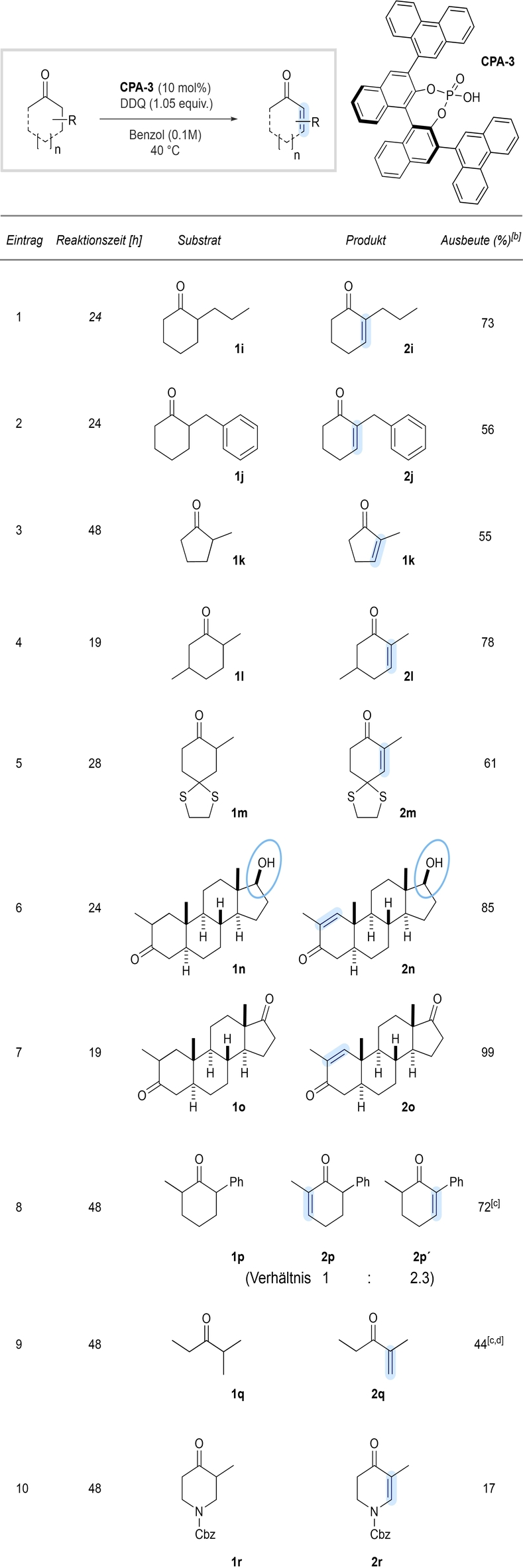
- [a] Die Reaktionen wurden im 0.5 mmol Maßstab durchgeführt. [b] Isolierte Ausbeuten (r.r>20 : 1). [c] NMR-Ausbeuten. [d] Die Reaktion wurde in Toluol-d8 (0.1 M), 48 h bei 60 °C durchgeführt.
Oxidationsempfindliche Molekülstrukturen wie beispielsweise Benzyl- (Eintrag 2) oder Dithioacetal-Substituenten (Eintrag 5) sind kompatibel und die entsprechenden Substrate konnten problemlos zu den gewünschten Enonen 2 j bzw. 2 m umgesetzt werden. Bemerkenswerterweise wurde das Enon 2 l als einzelnes Regioisomer, ausgehend von 2,4-Dimethylcyclohexanon (1 l), erhalten (Eintrag 4). Wir waren weiterhin an der Oxidation α-substituierter Steroidgerüste interessiert. So konnte das Steroid 1 n, das einen ungeschützten sekundären Alkohol am D-Ring trägt, selektiv und insbesondere ohne unerwünschte Alkoholoxidation entsättigt werden (Eintrag 6). Der A-Ring des α-methylierten Diketons 1 o konnte weiterhin selektiv dehydriert werden und lieferte das ungesättigte Produkt 2 o mit 99 % Ausbeute (Eintrag 7).26 2,6-substituierte Substrate wie beispielsweise 2-Phenyl-6-methylcyclohexanon 1 p lieferten ein Gemisch aus zwei regioisomeren Produkten, bei denen die Enolisierung an der α-Phenyleinheit begünstigt zu sein scheint. Bei dem acyclischen Substrat 1 q kommt es ebenfalls zu der gewünschten Entsättigung an der höher substituierten Position, wenn auch unter modifizierten Reaktionsbedingungen sowie mit geringerer Ausbeute. Substrate mit Stickstoffsubstituenten, wie das Cbz-geschützte Piperidinon 1 r, lieferten aufgrund unerwünschter Nebenreaktionen deutlich geringere Ausbeuten des gewünschten Enons.
Um den Mechanismus unserer neuen Oxidationsreaktion zu untersuchen und zu klären, ob der vorgeschlagene Enolkatalysepfad tatsächlich abläuft, wurden zunächst Radikaluhr- und NMR-Experimente durchgeführt. Zunächst wurden die Substrate 1 p und 1 q unseren Reaktionsbedingungen ausgesetzt (Abbildung 2-A). Würde die Reaktion, wie für verwandte α-Aryloxylierungsreaktionen vorgeschlagen, über einen protonengekoppelten Elektronentransfer (PCET) ablaufen,13 so könnte die Bildung eines alpha-Ketoradikals zu einer Fragmentierungs- oder Cyclisierungsreaktion führen um α-Allylcyclohexanon bzw. ein spirocyclisches Produkt zu bilden. Stattdessen wurden nur die entsprechenden ungesättigten Produkte in guter Ausbeute erhalten, was gegen den denkbaren radikalischen Reaktionswegs spricht. Anschließend wurden NMR-Studien zur Untersuchung der Frage, ob DDQ-Addukte wie das Keton 3 a21 relevante Zwischenprodukte sind, mit dem Modellsubstrat 1 a und dem optimisierten Katalysator CPA-3 oder mit DPP (Abbildung 2-B) durchgeführt. Die Datenlage zeigt, dass das Addukt 3 a kein Zwischenprodukt ist, sondern in einer Parallelreaktion gebildet wird. Das kinetische Profil in Gegenwart beider Katalysatoren passt zu den experimentellen Ergebnissen und die NMR-Ausbeuten der Produktbildung stimmen mit den isolierten Ausbeuten überein. Die Anreicherung und der anschließende Zerfall anderer Zwischenprodukte, die sich in einem polaren Reaktionsweg bilden können, konnten nicht nachgewiesen werden. Die 31P NMR -Reaktionsverfolgung deutet jedoch auf einen langsamen Zerfall der Phosphorsäuren zu nicht identifizierten Spezies hin (für weitere Informationen siehe Hintergrundinformationen).
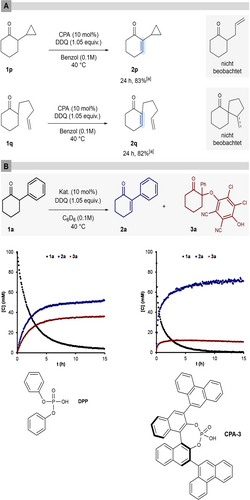
A) Untersuchung der Substrate 1 q und 1 r in der Umsetzung unter Standardbedingungen. B) 1H NMR -Reaktionsverfolgung mit CPA-3 sowie DPP.[a] Isolierte Ausbeuten (r.r.>20 : 1).
Basierend auf diesen Ergebnissen schlagen wir einen Reaktionsmechanismus vor, bei dem der Phosphorsäurekatalysator einen gleichzeitigen Protonen- sowie Hydridtransfer durchführt, ähnlich zur phosphorsäure-katalysierten Transferhydrierung durch Hantzsch-Ester.27 Der Phenanthrylsubstituent des Katalysators könnte einen solchen Übergangszustand durch π-π Wechselwirkung mit DDQ stabilisieren.19 Die DFT-Optimierung eines Komplexes zwischen CPA-3, dem Enol von 1 a, und DDQ auf dem B3LYP-D3/def2-SVP-Theorieniveau (Abb. 3) stimmt mit diesem Modell überein. Beide Reaktanten sind durch den bifunktionellen CPA-Katalysator über zwei nahe Wasserstoffbrückenbindungen eng miteinander verbunden. Der Gesamtkomplex bildet eine sandwichartige Struktur, die DDQ aufgrund der engen π-π Kontakte zu den 3,3′-Phenanthrylgruppen des BINOLs sowie dem elektronenreichen phenylsubstituierten Enolanteil (3.35 Å bzw. 3.00 Å) stabilisiert. Möglicherweise findet ein konkurrierender protonengekoppelter Elektronentransfer (PCET) des in situ erzeugten Enols mit DDQ statt, der nach radikalischer Rekombination die Bildung des unerwünschten aryloxylierten Nebenprodukts erklärt.
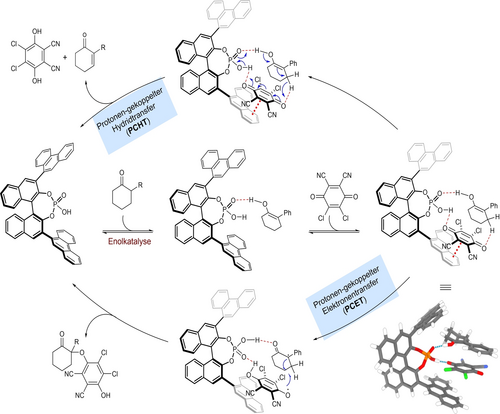
Plausible katalytische Pfade. B3LYP-D3/def2-SVP-optimierte Struktur des tertiären Komplexes zwischen CPA-3, 1 a-Enol und DDQ. R3PO-enol 1.59 Å, R3POH-DDQ 1.52 Å. π-π Abstände: Phenanthryl-DDQ 3.35 Å, DDQ-enol/Ph 3.00 Å.
Natürlich sollten an dieser Stelle alternative Mechanismen nicht ausgeschlossen werden und wir möchten insbesondere auf die detaillierten Studien von Mayr und Mitarbeitern über DDQ-vermittelte Oxidationen verweisen.28
Zusammenfassend berichten wir über einen einstufigen Prozess zur selektiven Entsättigung cyclischer Ketone, der auf Phosphorsäure-katalysierter Enolisierung beruht. Die Methode liefert selektiv höher substituierte α,β-ungesättigte Aryl- und alkylsubstituierte Enone in guter Ausbeute, ohne dass eine Überoxidation zu Phenolen zu beobachten ist. Oxidationsempfindliche funktionelle Gruppen wie z.B. Alkohole oder Dithioacetale werden gut toleriert. Wir gehen davon aus, dass die hier beschriebene Methode bestehende Verfahren ergänzen und in der chemischen Synthese von Nutzen sein kann.
Danksagung
Großzügige Unterstützung durch die Deutsche Forschungsgemeinschaft (Leibniz-Preis an B.L. und Exzellenzcluster Ruhr Explores Solvation, RESOLV) und den Europäischen Forschungsrat (ERC, Horizon 2020 Forschungs- und Innovationsprogramm der Europäischen Union “C−H Acids for Organic Synthesis, CHAOS” Advanced Grant Agreement No. 694228) wird dankend anerkannt. Open Access Veröffentlichung ermöglicht und organisiert durch Projekt DEAL.
Interessenkonflikt
Die Autoren erklären, dass keine Interessenkonflikte vorliegen.
Open Research
Data Availability Statement
Die Daten, die die Ergebnisse dieser Studie unterstützen, sind auf begründete Anfrage beim Autor erhältlich.




