Reversible elektrochemische Abscheidung Kalium-verbrückter molekularer Vanadiumoxide: Ein neuer Ansatz zur Multielektronenspeicherung
Abstract
Molekulare Metalloxide, so genannte Polyoxometallate (POMs), sind ausgezeichnete Katalysatoren, die kürzlich Beachtung als Materialien für Energieumwandlungs- und -speichersysteme gefunden haben, aufgrund ihrer Eigenschaft, mehrere Elektronen speichern und austauschen zu können. In dieser Studie berichten wir erstmals über die redox-getriebene, reversible Elektrodeposition von molekularen Vanadiumoxid-Clustern, die zur Abscheidung von dünnen Filmen führt. Die eingehende Untersuchung des Abscheidemechanismus zeigt eine Abhängigkeit der Reversibilität vom Reduktionspotential. Untersuchungen mittels der elektrochemischen Quarzkristall-Mikrowaage und Studien mittels Röntgen-Photoelektronenspektroskopie (XPS) geben Aufschluss über das Redoxverhalten und die Oxidationsstufen des Vanadiums in den abgeschiedenen Filmen in Abhängigkeit vom gewählten Potential während der Abscheidung. Es konnte eine Multielektronenreduktion des Polyoxovanadat-Clusters bestätigt werden, welche eine durch K+-Ionen unterstützte reversible Bildung von Kaliumvanadiumoxid-Dünnschichten ermöglicht. Im positiven (anodischen) Potentialbereich wird eine Re-oxidierung des Polyoxovanadats und ein vollständiges Entfernen (Stripping) des dünnen Films beobachtet für Filme, die bei einem Potential von höher als −500 mV vs. Ag/Ag+ abgeschieden wurden, während die Elektroabscheidung bei einem negativeren kathodischen Potential die elektrochemische Reversibilität des Prozesses verringert und das Potential für das Stripping erhöht. Das Potential dieser Filme und der mögliche Einsatz der abgeschiedenen Filme für die Anwendung in Kalium-Ionen-Batterien wird gezeigt.
Einleitung
Die stetig wachsende Nachfrage nach elektrochemischen Energiespeichersystemen für mobile Anwendungen, Netzspeicher und Elektrofahrzeuge erfordert es, neue Materialien für effektive und energiedichte elektrochemische Energiespeicher zu entwickeln.1 Metalloxide sind eine, sowohl aus chemischer Sicht, geeignete als auch aus wirtschaftlicher Perspektive umsetzbare Materialklasse für Energiespeicher-Technologien, wie zum Beispiel Batterien,2 Brennstoffzellen3 und der Wasserelektrolyse.4
Molekulare Metalloxide, so genannte Polyoxometallate (POMs), vereinen die physikochemische Ähnlichkeiten von Festkörpermetalloxiden mit einer molekular definierten Struktur (Abbildung 1).5 POMs sind anionische Metall-Oxo-Cluster aus hochvalenten Übergangsmetallen der fünften und sechsten Gruppe (häufig Molybdän (Mo), Wolfram (W) und Vanadium (V)), die sich spontan in Lösung durch Selbstorganisation bilden.5b Insbesondere POMs auf der Basis von Mo und W haben bereits in der Katalyse und Sensorik,6 in der Energieumwandlung und -speicherung,7 sowie zunehmend auch als Bausteine für supramolekulare Strukturen und nanostrukturierte Bausteine große Beachtung gefunden.8 Molekulare Vanadiumoxide (Polyoxovanadate, POVs) hingegen haben erst kürzlich aufgrund ihrer vielseitigen Elektrochemie erhebliche Aufmerksamkeit erlangt.9 Darüber hinaus hat die gezielte Synthese von heterometall-funktionalisierten POVs systematische Studien zur kontrollierten strukturellen10 elektrochemischen Steuerung11 von POVs ermöglicht, was zu Anwendungen in (Post-)Li-Ionen Batterien,12 in der Katalyse zur Wasseroxidation13 und als Metalloxid-Oberflächenmodellen geführt hat.14
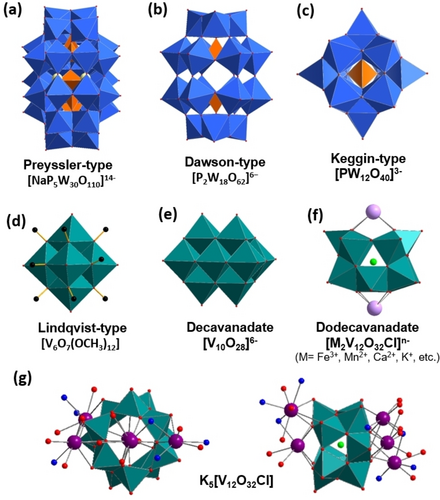
Polyhedrische Darstellung von POM-Anionen, die bisher für Studien zur POM-Kation-Interaktion Verwendung gefunden haben. (a) Preyssler-Polyoxoanion, [NaP5W30O110]14−; (b) Dawson-Anion [P2M18O62]6−; (c) Keggin-Anion [PM12O40]3−; (d) Lindqvist-Alkoxid-Cluster [V6O7(OCH3)12]; (e) Decavanadat-Anion [V10O28]6−; (f) Dodecavanadat-Anion [V12O32Cl]n−; (g) Drauf- und Seitenansicht von K5{V12}. Farbschema: W (blau), O (rot), V (türkis), C (schwarz), P (orange), Cl (grün), metallische Koordination (pink), K (violett).
Wie die Wechselwirkungen zwischen Alkali-Kationen und POMs die Struktur und das elektrochemische Verhalten von POMs, insbesondere von POVs, beeinflussen können wurde vor Kurzem untersucht.15 Matson und Mitarbeiter zeigten die Wechselwirkung eines POV-Alkoxid-Clusters vom Lindqvist-Typ ([V6O7(OCH3)12], Abbildung 1d) mit unterschiedlichen harten und weichen Kationen. Harte Ionen (z. B. Li+) wiesen eine spezifische Bindung und eine starke Wechselwirkung mit POV-Clustern auf, wohingegen gezeigt werden konnte, dass weichere Kationen (z. B. n-Butylammoniumkationen oder K+) eine unspezifische Bindung und schwächere Wechselwirkungen mit POV-Clustern eingehen. Weiterhin konnte gezeigt werden, dass die Art und Konzentration der ladungsausgleichenden Kationen das Redoxverhalten von [V6O7(OCH3)12] in Lösung steuern.15a In diesem Zusammenhang untersuchten Schimpf und Mitarbeiter anhand eines [NaP5W30O110]14−-Clusters (Abbildung 1a), einem Polyoxoanion des Preyssler Typs, wie die Konzentration von K+-Ionen die Phase des Polyoxowolframat-basierten Koordinationsnetzwerkes beeinflussen.16 Kürzlich wurde von der Kationen-gesteuerten, reversiblen Speicherung von bis zu 18 Elektronen bei Polyoxowolframaten des Dawson-Typs (Abbildung 1b) in Lösung berichtet.17
Als letzter Schritt für den Einsatz von POMs in technologischen Anwendungen müssen die löslichen Spezies in feste Materialien überführt werden, wobei deren Immobilisierung auf funktionalen Substraten eine besondere Herausforderung darstellt. Während sich die meisten Strategien auf eine Einkapselung oder auf elektrostatische Wechselwirkungen konzentrieren, ermöglicht das Aufbringen von supramolekularen Filmen einen Bottom-Up-Ansatz für funktionelle (Nano-)Materialien.18 Außerdem bietet eine elektrochemische Abscheidung des Films ein kontrollierbares Filmwachstum. Zum Beispiel wurde ein [H3PW12O40]-Cluster (Abbildung 1c) vom Keggin-Typ auf Titandioxid (TiO2)/Kohlenstoff Nanoröhrchen-Kompositstrukturen elektrochemisch abgeschieden und der abgeschiedene Film zur photokatalytischen Degradation von Nitrobenzol verwendet.19 Hwu und Mitarbeiter berichteten vor Kurzem über elektrochemisch gesteuertes Kristallwachstum von Decavanadat-basierten, (Abbildung 1e) organisch-anorganischen Hybridmaterialien.20 Die dabei angelegten Potentiale wurden als Triebkraft zur Nukleation verwendet, um so die Abscheidung eines organischen Polyoxometallat-Gerüsts (polyoxometalate-organic framework, POMOF) zu ermöglichen.
Kürzlich zeigten wir bereits die Polymerisation und Bildung von 1D-Ketten von Dodecavanadat-Clustern (Abbildung 1f), welche über Erdalkalimetallionen verbrückt sind.11d, 21 Dodecavanadat-Cluster leiten sich von (H2NMe2)2[V12O32Cl]3− (=(H2NMe2)2{V12}) ab, wobei zwei offene Bindungsstellen durch organische (H2NMe2)+-Kationen besetzt sind. Eine oder beide Stellen können hierbei durch Metallionen des s-,21 d-,22 or f-Blocks23 ersetzt werden, wodurch die magnetischen, (photo)katalytischen und elektrochemischen Eigenschaften gesteuert werden können.
Dieser Ansatz wurde durch den Einsatz von K+-Ionen erweitert,21 was zu komplexen 3D-Gerüsten durch die Koordination der K+-Ionen innerhalb und benachbart zur vorbestimmten Bindungsstelle führte. Hierdurch konnten mehr als zwei K+-Ionen pro Cluster koordiniert werden, womit sich die Summenformel K5(CH3CN)3[V12O32Cl] (=K5{V12}), Abbildung 1g) ergibt. Im Gegensatz zu früheren dimetallisch-funktionalisierten Clustern ist keine Reduktion notwendig, um ein weiteres Heterometallion in die Struktur zu integrieren. In dieser Studie wird nun die mögliche Reduktion von K5{V12} und die damit einhergehende elektrochemische Abscheidung aufgrund einer verstärkten Wechselwirkung zwischen negativ geladenem POM und dem ladungsausgleichenden K+-Kation untersucht.
Dementsprechend zeigen wir hier die reduktive Abscheidung von POV abgeleiteten dünnen Filmen, welche durch den Einbau von Alkalikationen gesteuert wird. Die detaillierte, elektrochemische Untersuchung der zugrunde liegenden Prozesse deutet auf eine Multielektronenreduktion des Clusters hin. Die elektrochemischen Untersuchungen werden durch die Charakterisierung der erhaltenen Filme in Hinsicht auf Morphologie und Schichtdicke ergänzt.
Ergebnisse und Diskussion
Elektrochemische Charakterisierung
Im Vergleich mit verwandten difunktionalisierten {V12}-Analoga stellen die vollständig oxidierten Vanadium-Zentralatome und die komplexe dreidimensionale Struktur des K5{V12} die markantesten Unterschiede dar.21 Wir nehmen an, dass durch die Reduktion des Clustergerüsts die elektrostatische Anziehung zwischen K+-Ionen und dem Vanadat-Cluster erhöht wird und so die Löslichkeit verringert wird, und somit zur Abscheidung dünner Filme führt. Folglich wurde das elektrochemische Verhalten von K5{V12} in wasserfreiem, sauerstofffreiem Acetonitril mit 0.1 M (nBu4N)PF6 als Elektrolytsalz untersucht, welches bereits als Standard-Elektrolyt unserer vorhergehenden Studien diente.11d Für die meisten hier aufgeführten Messungen wurde eine Glaskohlenstoff-Elektrode (Ø: 3 mm) in einem Drei-Elektroden-Aufbau verwendet (wobei ein Pt-Draht als Gegenelektrode diente und ein Ag-Draht in einer Glassfritte, gefüllt mit Elektrolyt, als Quasireferenzelektrode verwendet wurde). Das zyklische Voltammogramm (CV) von K5{V12} in einem Potentialfenster von −250–500 mV vs. Ag/Ag+ (Abbildung 2a) zeigt einen Reduktionsprozess bei einem Potential von −120 mV vs. Ag/Ag+, welcher einem Abscheidungsprozess entspricht. Tatsächlich ist ein abgeschiedener Film auf der Arbeitselektrode sichtbar. Weiterhin ist ein scharfer Oxidationspeak im CV bei Epeak=−50 mV vs. Ag/Ag+ zu beobachten, was auf das Stripping des abgeschiedenen Materials hindeutet. Bei einem negativeren Potential von −500 mV vs. Ag/Ag+ wird eine weitere Reduktion des Clusters ersichtlich. Die beobachtete Oxidation im positiven Potentialbereich ist anodisch um ∼30 mV verschoben und es tritt ein neuer Oxidationspeak bei Epeak=220 mV vs. Ag/Ag+ auf, was darauf hindeutet, dass der zweite Reduktionsschritt die Reversibilität verringert und das Potential des Stripping-Prozesses leicht erhöht. Dieses Verhalten steht im Einklang mit der Reduktion des Clusters und dem damit verbundenen Ladungsausgleich, da der Elektronentransfer mit dem Kationentransfer gekoppelt ist, wobei die reduzierten Cluster eine höhere Affinität für K+-Ionen aufweisen und daher schwieriger wieder zu oxidieren sind. Eine weitere Vergrößerung des kathodischen Bereiches bis −900 mV vs. Ag/Ag+ ergab eine anodische Verschiebung der Oxidationspotentiale um 130 mV wobei ein unvollständiges Stripping des abgeschiedenen Films beobachtet wurde.
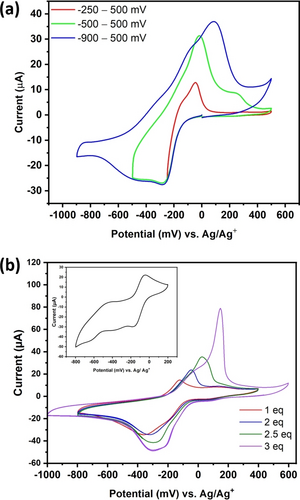
a) CVs von K5{V12} in wasserfreiem, O2-freiem Acetonitril mit 0.1 M (nBu4N)PF6, c([K5{V12}])=0.5 mM. b) CVs von {V12}; (H2NMe2)2[V12O32Cl]3− (mit 0.1 M (nBu4N)PF6) mit unterschiedlichen Konzentrationen von KPF6; Vorschubrate: 100 mV s-1; Inset: CV von {V12}; (H2NMe2)2[V12O32Cl]3− in Acetonitril in Abwesenheit von K+-Ionen.
Wir gehen davon aus, dass bei einem Potential von kleiner als −500 mV vs. Ag/Ag+ eine weitere Reduktion im abgeschiedenen Film stattfindet, was zu strukturellen Veränderungen der Vanadat-Cluster führt, welche den Film stabilisieren und die Reversibilität des Strippings beeinflussen. Interessanterweise zeigen die CVs der nicht-funktionalisierten {V12} in Elektrolyten mit (nBu4N)PF6 einen quasi-reversiblen Redoxprozess bei E1/2=−150 mV vs. Ag/Ag+ aber keine Abscheidung eines Films.11d Dies deutet darauf hin, dass die Anwesenheit von K+-Ionen notwendig für den Abscheideprozess ist. Basierend auf diesen Ergebnissen wurden weitere Untersuchungen des elektrochemischen Verhaltens von {V12} bei unterschiedlichen K+-Konzentrationen durchgeführt. Das CV der nicht-funktionalisierten Spezies (H2NMe2)2[V12O32Cl]3− in Acetonitril (mit 0.1 M (nBu4N)PF6) zeigt einen quasi-reversiblen Redoxprozess bei E1/2=−150 mV vs. Ag/Ag+ (Abbildung 2b, Inset) und zusätzliche irreversible Reduktionsprozesse bei niedrigeren Potentialen, was darauf hindeutet, dass sich der Cluster durch weitere Reduktionschritte zersetzt. Durch die Zugabe von 1 Äquivalent KPF6 entsteht ein breiter Reduktionspeak bei −350 mV vs. Ag/Ag+ mit einer Schulter bei ∼−170 mV vs. Ag/Ag+, sowie ein weiterer Oxidationspeak bei Epeak=−123 mV vs. Ag/Ag+ (Abbildung 2b). Hier ist anzumerken, dass die Abwesenheit eines irreversiblen Reduktionspeaks bei niedrigeren Potentialen auf eine Stabilisierung der reduzierten Cluster in Anwesenheit von K+-Ionen hindeutet, wodurch dessen Zersetzung verhindert wird. Bei der Zugabe von 2 Äquivalenten KPF6 wurde eine Peakverschiebung in Richtung kleinerer kathodischer Potentiale beobachtet. Die nachfolgenden Zugaben resultierten in einem Anstieg des kathodischen Stroms. Dies deutet daraufhin, dass die vermehrte Anwesenheit von K+-Ionen die reduktive elektrochemische Abscheidung erleichtert. Der Anstieg des kathodischen Stroms ist mit einer Peakverbreiterung verbunden, was auf eine Überlappung mehrerer Reduktionsprozesse des Clusters innerhalb eines kleinen Potentialbereichs schließen lässt.15a Zusätzlich ist eine Verschiebung der Oxidationspeaks zu höheren anodischen Potentialen ersichtlich, was ebenfalls mit einem Anstieg des anodischen Stroms in Folge jeder KPF6-Zugabe einhergeht. Diese Verschiebung könnte auf die stärkere Interaktion zwischen der reduzierten Form des Clusters und der K+-Ionen zurückzuführen sein, welche die elektrochemische Reversibilität des Oxidationsprozesses verringert.
Elektrochemische Abscheidung des Films
Um das in den CVs beobachtete Abscheidungsverhalten von K5{V12} bei der Reduktion näher zu untersuchen, wurde eine Elektrolyse in einer 0.5 mM Acetonitril-Lösung von K5{V12} (mit 0.1 M (nBu4N)PF6) bei −250 mV vs. Ag/Ag+ durchgeführt. Nach der Elektrolyse (∼6 h) ist in den UV/Vis-Spektren der Lösung (Supporting Information, Abbildung S1) keine Intervalenz-Ladungstransfer-Absorption (intervalence charge transfer, IVCT) im UV/Vis-bis-Nah-IR-Bereich zu erkennen, so dass keine nachweisbaren Mengen an reduzierten Vanadaten (d. h. VIV-haltig) in der Lösung vorlagen. Gleichzeitig konnte auf der Glaskohlenstoff-Elektrode eine Filmbildung beobachtet werden. Dies ist ein weiterer Beleg dafür, dass die Reduktion von K5{V12} zur Filmbildung führt, während in der Elektrolytlösung unter Berücksichtigung der Nachweisgrenze (limit of detection, LOD) der Methode keine reduzierten Spezies nachgewiesen werden konnten. Das Abscheideverhalten und die Reversibilität des Prozesses wurde im Folgenden mittels elektrochemischer Quarzkristall-Mikrowaage (EQCM) untersucht, um das Verhältnis zwischen abgeschiedener Masse und übertragener Ladung bei drei verschiedenen Potentialen, −250 mV, −500 mV und −900 mV vs. Ag/Ag+, zu bestimmen. Das Anlegen eines konstanten Potentials von −250 mV vs. Ag/Ag+ führte zu einem linearen Anstieg der abgeschiedenen Masse pro übertragener Ladung (Supporting Information, Abbildung S2). Die Steigung des Masse-Ladungs-Verhältnisses deutet auf die Abscheidung von etwa einem K8.64[V12O32Cl] pro 3.46 Elektronen hin (die Summenformel wurde aus den XPS-Daten abgeleitet).
Im nächsten Schritt wurden CVs bei drei verschiedenen kathodischen Potentialgrenzen in Kombination mit EQCM untersucht (Abbildung 3a–c). Die CVs mit einer Potentialgrenze von −250 mV vs. Ag/Ag+ zeigen eine vollständige Reversibilität mit dem erwarteten Abscheidungs- und Stripping-Verhalten, das durch die Zunahme und Abnahme der beobachteten Massenänderung sichtbar ist. Bei einer Änderung der kathodischen Potentialgrenze auf −500 mV vs. Ag/Ag+ wurde jedoch eine Abweichung vom linearen Verhalten der übertragenen Ladung gegenüber der abgeschiedenen Masse beobachtet (Abbildung 3d). Dies deutet darauf hin, dass der abgeschiedene Film weiter reduziert wurde, wodurch eine offensichtlich höhere Elektronenzahl pro abgeschiedenes Cluster erhalten wird (4.9 Elektronen pro K9.36[V12O32Cl], Summenformel aus XPS-Daten abgeleitet). Es ist anzumerken, dass bis zu einer Potentialgrenze von −500 mV vs. Ag/Ag+ während der Messung die abgeschiedenen Filme noch vollständig wieder oxidiert (gestrippt) werden können (auch sichtbar im Massogramm). Es wird allerdings ein zusätzlicher oxidativer Peak sichtbar; dies stimmt mit den obigen CV-Messungen überein. Im Falle, dass eine kathodische Potentialgrenze von −900 mV vs. Ag/Ag+ gewählt wurde, zeigt die Kurve der abgeschiedenen Masse pro Ladung eine deutliche Abflachung, was darauf schließen lässt, dass der abgeschiedene Film eine weitere Reduktion als dominanten elektrochemischen Prozess durchläuft (6.32 Elektronen pro K11.64[V12O32Cl], Summenformel aus XPS-Daten abgeleitet). Außerdem wird die abgeschiedene Masse im anodischen Bereich (bis 500 mV vs. Ag/Ag+) der Messung nicht mehr vollständig oxidiert (gestrippt), was auf eine irreversible elektrochemische Abscheidung hindeutet, die möglicherweise auf strukturelle Veränderungen während der weiteren Reduktion des Films zurückzuführen ist. Beim fünften Zyklus wurde ein starker Stromrückgang beobachtet, der mit dem Fehlen einer Frequenzänderung einherging. Dieses Verhalten lässt darauf schließen, dass die Elektrodenoberfläche des Quarzsensors durch einen isolierenden Film blockiert wurde.
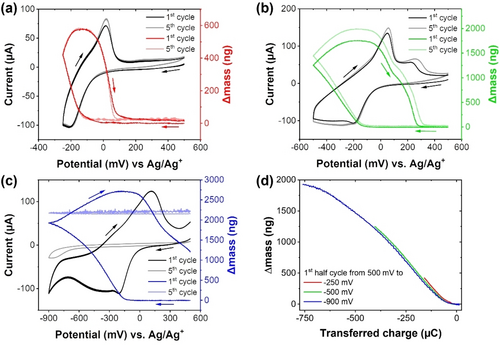
EQCM Messungen kombiniert mit zyklischer Voltammetrie von K5{V12} (0.5 mM in Acetonitril mit 0.1 M (nBu4N)PF6 (Vorschubrate=100 mV s−1) in den Potentialbereichen von a) 500 mV bis −250 mV, b) 500 mV bis −500 mV und c) 500 mV bis −900 mV vs. Ag/Ag+ mit den entsprechenden Massogrammen für den ersten und fünften Messzyklus. d) Abgeschiedene Masse aufgetragen gegen die übertragene Ladung während des ersten kathodischen Halbzyklus für alle drei in a), b) und c) dargestellten Potentialbereiche.
Anschließend wurde eine gepulste Abscheidung (pulsed electrochemical deposition, PED) mit den drei unterschiedlichen Potentialen −250 mV, −500 mV bzw. −900 mV vs. Ag/Ag+ durchgeführt, um den Einfluss des Reduktionspotentials auf die Filmbildung genauer zu untersuchen. Alle gepulsten Experimente verlaufen in zwei Schritten: Zunächst wurde ein Potential von 0 mV vs. Ag/Ag+ für 60 Sekunden an die Arbeitselektrode angelegt, so dass sich eine Konzentration der gelösten Cluster-Ionen in der Nähe der Elektrodenoberfläche entsprechend der Lösung einstellt (toff). Dann wurde das gewünschte Reduktionspotential, z. B. −250 mV vs. Ag/Ag+, für einen Zeitraum von 120 Sekunden angelegt (ton), um die Cluster zu reduzieren. Diese beiden Schritte wurden abwechselnd wiederholt, um insgesamt 10 aufeinanderfolgende Reduktionspulse zu erhalten. Die allmählich abnehmende Stromantwort über die 10 Reduktionspulse beim potentiostatischen Pulsprofil mit −250 mV vs. Ag/Ag+ (siehe Supporting Information, Abbildung S3) weist auf die Filmbildung und dem damit verbundenen eingeschränkten Elektronentransfer zur weiteren Reduktion der Cluster hin. Die Pulssequenz mit einem kathodischen Potential von −500 mV vs. Ag/Ag+ zeigt einen höheren Reduktionsstrom. Dies kann auf die Abscheidung von mehr K5{V12}-Clustern und möglicherweise auf eine zusätzliche Reduktion des bereits abgeschiedenen Materials zurückgeführt werden. Bei einer weiteren Verringerung des kathodischen Potentials auf −900 mV vs. Ag/Ag+ ist ein schneller Abfall der Stromantwort zu beobachten. Dieses Verhalten kann durch eine geringere Leitfähigkeit des abgeschiedenen Films erklärt werden. Gleichzeitig deutet eine geringere oxidative Stromantwort darauf hin, dass die Abscheidung größtenteils irreversibel ist und der abgeschiedene Film nicht wieder vollständig oxidiert werden kann. Diese Ergebnisse stimmen mit unseren EQCM-Ergebnissen überein, die eine irreversible POM-Abscheidung zeigen, wenn ein negativeres Abscheidungspotential als −500 mV vs. Ag/Ag+ verwendet wird. Zusammenfassend lässt sich sagen, dass eine vollständig reversible elektrochemische Abscheidung von K5{V12} bis zu einem kathodischen Potential von −500 mV vs. Ag/Ag+ möglich ist, während bei negativeren Potentialen eine irreversible Abscheidung stattfindet. Diese Veränderung könnte auf chemische und/oder strukturelle Veränderungen der abgeschiedenen Filme bei hinreichend niedrigen Potentialen zurückzuführen sein. Die dünnen Filme wurden mittels Rasterelektronenmikroskopie (REM), energiedispersiver Röntgenspektroskopie (EDX), Fourier-Transformations-Infrarot-Spektroskopie mit abgeschwächter Totalreflexion (FTIR-ATR) und Röntgen-Photoelektronenspektroskopie (XPS) charakterisiert, um so mögliche strukturelle und chemische Unterschiede der Filme, die bei unterschiedlichen Potentialen abgeschieden wurden, zu ermitteln.
Charakterisierung der elektrochemisch abgeschiedenen Filme
REM-Bilder der drei bei −250 mV, −500 mV und −900 mV vs. Ag/Ag+ abgeschiedenen Filme zeigen, dass sich gleichförmige Filme mit ähnlicher Morphologie bilden (Supporting Information, Abbildung S4b–d). EDX-Elementanalysen (Supporting Information, Abbildung S5) deuten darauf hin, dass eine gleichmäßige Verteilung von Vanadium, Kalium, Sauerstoff und Chlor, wie sie von den K5{V12}-Clustern erwartet werden, vorliegen (Supporting Information, Abbildung S4b–d). Zur Bestimmung der Filmdicke und der Oberflächenrauigkeit (arithmetische mittlere Höhe, Sa) wurden Rasterkraftmikroskopie (AFM) Messungen in Acetonitril für die drei gepulst abgeschiedenen Filme durchgeführt. Abbildung 4a–c zeigen die Topografie der Filme, wobei jeweils in definierten Bereichen der Film entfernt wurde, um die Filmdicke zu bestimmen. Insbesondere die Abscheidung bei −250 mV vs. Ag/Ag+ führte zu gleichmäßigen Schichten mit Rauheitswerten (Sa) von 9±2 nm (n=5, ausgewertet wurden Flächen von 625 μm2), während die bei negativeren Potentialen (−500 und −900 mV vs. Ag/Ag+) abgeschiedenen Schichten weniger gleichmäßig erscheinen (Sa=45±13 nm und 32±19 nm; n=4 bzw. 5, ausgewertet wurden Flächen von 625 μm2). Extrahierte Linienprofile (Abbildung 4d–f), die aus den Topografiebildern extrahiert wurden (in Abbildung 4a–c mit gestrichelten Linien gekennzeichnet), zeigen Schichtdicken von 73±27 nm (−250 mV vs. Ag/Ag+), 71±27 nm (−500 mV vs. Ag/Ag+) und 37±18 nm (−900 mV vs. Ag/Ag+) (n=30, Profile aus jeweils drei verschiedenen Bereichen wurden ausgewertet).
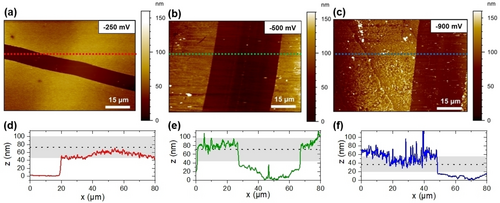
AFM-Aufnahmen (Topografie) von K5{V12}-Filmen, die auf Glaskohlenstoff-Elektroden mittels PED abgeschieden wurden; a) −250 mV, b) −500 mV und c) −900 mV vs. Ag/Ag+; die Bilder wurden im Kontaktmodus in Acetonitril aufgenommen. Entsprechende Linienprofile (d–f), die aus den Topografiebildern an der durch die gestrichelten Linien markierten Stellen extrahiert wurden; die gestrichelten schwarzen Linien stellen die durchschnittlichen Filmdicken dar, wobei die Standardabweichungen als graue Flächen eingezeichnet sind (n=30 Profile).
Die geringere Schichtdicke des bei −900 mV vs. Ag/Ag+ abgeschiedenen Films könnte auf die Bildung eines Films zurückzuführen sein, der den Elektronentransfer und damit die weitere Abscheidung effektiv blockiert; dies ist auch im Einklang mit den EQCM-Messungen. Darüber hinaus deutet dieses abweichende Verhalten im Vergleich zu den anderen Filmen auf eine strukturelle Veränderung des Films hin, auf die auch die Veränderung der Filmmorphologie zurückzuführen sein könnte.
Außerdem wurden Untersuchungen mittels FTIR-ATR-Spektroskopie durchgeführt, um weitere Einblicke in die strukturelle Stabilität und mögliche strukturelle Veränderungen der K5{V12}-basierten Filme zu erhalten. Bei den Filmen, welche bei −250 mV und −500 mV vs. Ag/Ag+ abgeschieden wurden, wurde eine Verschiebung (um ∼20 cm−1) der charakteristischen V−O−V (820 cm−1, 767 cm−1, 686 cm−1 und 633 cm−1)24 und V=O (988 cm−1)24b Banden zu niedrigeren Wellenzahlen und eine leichte Schulter beobachtet, die möglicherweise von einer Peak Aufspaltung aufgrund der weiteren Reduktion des Films bei −500 mV vs. Ag/Ag+ herrührt (Supporting Information, Abbildung S6). Die nur geringen Veränderungen deutet darauf hin, dass die grundliegende Molekülstruktur von {V12} erhalten bleibt, während die Clusterumgebung (d. h. die an dem Cluster gebundenen K+-Ionen) im Vergleich zur nativen Verbindung möglicherweise anders angeordnet sind. Die IR-Spektren des bei −900 mV vs. Ag/Ag+ abgeschiedenen Films zeigen geringfügige Unterschiede im Vergleich zu den Filmen, die bei positiveren Potentialen abgeschieden wurden; die Verschiebung der Peaks ist weniger ausgeprägt (∼10 cm−1 zu niedrigeren Wellenzahlen), während die Aufspaltung der 988 cm−1-Bande weiterhin auftritt. Außerdem wurden neue Banden bei 1033 cm−1 und 736 cm−1 beobachtet. Letztere könnte auf weitere strukturelle Veränderungen der abgeschiedenen Spezies hinweisen, während die Bande bei 1033 cm−1 auf die Abscheidung neuer Vanadiumoxid-Spezies hindeuten könnte, die ein Grund für die beobachtete Irreversibilität der Abscheidung sein könnte.
Zusätzlich wurde UV/Vis-Spektroskopie eingesetzt, um mögliche Änderungen im Absorptionsspektrum vor und nach der Abscheidung von K5{V12} zu untersuchen. Zu diesem Zweck wurde ein, auf einer Glaskohlenstoff-Elektrode bei −250 mV vs. Ag/Ag+, abgeschiedener Film in eine frische Elektrolytlösung, die 0.1 M KPF6 enthielt, getaucht (um einen Kationenaustausch mit nBu4N+ zu vermeiden). Danach wurde ein Pulspotential von 500 mV vs. Ag/Ag+ (über einen Zeitraum von insgesamt 20 Minuten) angelegt, so dass der Film wieder oxidiert und damit aufgelöst wurde. Diese Lösung wurde dann mittels UV/Vis-Spektroskopie untersucht (Supporting Information, Abbildung S7). Die Spektren zeigen, dass die charakteristischen Absorptionssignale des nativen K5{V12} in Lösung vorhanden sind. Dies deutet darauf hin, dass die strukturelle Integrität von K5{V12} während der Abscheidung und des anschließenden Strippens erhalten bleibt. Außerdem wurden keine IVCT-Banden im Vis-Bereich beobachtet, so dass auf eine vollständige Oxidation zu VV-Spezies geschlossen werden kann.11d, 21
Weiterhin wurden die Filme mittels XPS untersucht, um Einblicke in die elementare Zusammensetzung und die Oxidationszustände der abgeschiedenen K5{V12}-Filme zu erhalten. Die XPS-Spektren der bei −250 mV, −500 mV und −900 mV vs. Ag/Ag+ abgeschiedenen Filme zeigen Peaks, die V, K, O, Cl und C entsprechen (siehe Supporting Information, Abbildung S8a). Darüber hinaus sind in den Spektren kleine N- und F-Peaks zu erkennen, die von Resten des Elektrolyten und des Lösungsmittels aus dem Abscheidungsprozess herrühren. Die XPS-Daten für den nativen K5{V12}-Cluster zeigen nur Peaks für VV-Zentren (siehe Supporting Information, Abbildung S8b), wohingegen die bei −250 mV vs. Ag/Ag+ abgeschiedenen Filme ein scharfes Signal in der V2p3/2 Region bei Bindungsenergien von ∼517 eV (Zuordnung zu V5+)25 und schwache Signale bei ∼516 eV (Zuordnung zu V4+) aufweisen,26 was die Reduktion des Clusters während der Abscheidung bestätigt (Supporting Information, Abbildung S8c–e). Für die bei −250 mV vs. Ag/Ag+ abgeschiedenen Filme beträgt das Vanadium-zu-Kalium-Verhältnis 1 : 0.72, womit jeder {V12}-Cluster im Durchschnitt mit ca. 8.6 K+-Ionen interagiert, was einem durchschnittlichen Reduktionsgrad von 3.6 Elektronen pro {V12} entspricht (da die native Verbindung fünf K+-Ionen pro {V12} aufweist). Das geschätzte V4+ : V5+-Verhältnis aus dem Kurvenfitting der V2p3/2 Region beträgt 0.3 : 1. Dies entspricht einer Reduktion der {V12}-Cluster im Durchschnitt mit 3.6 Elektronen. Der bei −500 mV vs. Ag/Ag+ abgeschiedene Film zeigte ein etwas höheres V : K-Verhältnis (1 : 0.78), und somit 9.4 K+-Ionen pro {V12} und einem resultierenden Reduktionsgrad von 4.4 Elektronen pro {V12}. Das V4+ : V5+-Verhältnis (0.4 : 1) entspricht einem Reduktionsgrad von 4.8 Elektronen pro {V12}. Diese Daten stimmen hervorragend mit den EQCM-Ergebnissen überein, die zeigen, dass der Film nach der elektrochemischen Abscheidung weiter reduziert wird. Die XPS-Daten für den bei −900 mV vs. Ag/Ag+ abgeschiedenen Film zeigen den größten K+-Gehalt (V : K, 1 : 0.97, entsprechend 11.6 K+ pro {V12} und einem Reduktionsgrad von 6.6 Elektronen pro {V12}), was wiederum sehr gut mit den EQCM-Ergebnissen übereinstimmt und auf weitere Reduktionsprozesse bei diesem Potential hindeutet. Überraschenderweise weist dieser Film das niedrigste Verhältnis von V4+ zu V5+ (0.18 : 1) auf. Während sich die derzeitigen Arbeiten auf die reversible elektrochemische Abscheidung und das Strippen der molekularen Vanadiumoxide konzentrieren, sollen in zukünftigen Untersuchungen auch die Struktur der irreversibel abgeschiedenen Schichten untersucht werden.
Machbarkeitsstudien: K5{V12}-Filme als mögliches Batterie-elektrodenmaterial

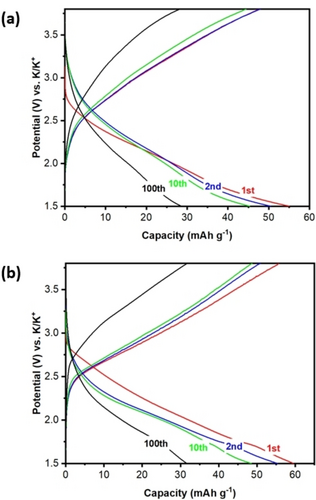
Ausgewählte Zyklen des galvanostatischen Ladens und Entladens der auf kohlenstoffbeschichteten Al-Folien abgeschiedenen Filme; a) −250 mV und b) −500 mV vs. Ag/Ag+ via PED; im Potentialbereich von 1.5 bis 3.8 V vs. K+/K bei 50 mA g−1.
wobei Q der reversiblen Lade-/Entladekapazität, n der Anzahl der übertragenen Elektronen, Mw der molekularen Masse und F der Faraday-Konstanten entspricht.
Der bei −500 mV vs. Ag/Ag+ abgeschiedene Film zeigt eine etwas höhere Kapazität von 59 mAh g−1. Dies entspricht der Speicherung von 3.37 Elektronen pro K9.36[V12O32Cl]. Der bei −900 mV vs. Ag/Ag+ abgeschiedene Film weist dagegen eine deutlich geringere Kapazität von ∼11 mAh g−1 auf (siehe Abbildung S10, Supporting Information) mit einer Speicherung von nur 0.68 Elektronen pro K11.64[V12O32Cl]. Diese niedrige Speicherkapazität könnte auf die stärker isolierende Eigenschaft des Films zurückzuführen sein, die den Elektronentransfer effektiv behindert; auch dieses Verhalten steht im Einklang mit unseren EQCM-Messungen. Vergleichbare Ergebnisse erzielten Pyo und Mitarbeiter mit einem Komposit auf Basis von Kalium-Vanadium-Oxiden (KVP2O7), die als Hochspannungskathode für PIBs getestet wurden und eine maximale Entladekapazität von 60 mAh g−1 aufwiesen.27
Alle abgeschiedenen Filme zeigten einen Kapazitätsabfall, der auf eine teilweise Auflösung von K5{V12} im Batterieelektrolyten oder auf strukturelle Umlagerungen aufgrund der Interkalation/Deinterkalation von K+-Ionen im Elektrodenmaterial zurückzuführen sein könnte. Zukünftige Arbeiten sollen verbesserte Abscheidungsverfahren bringen, die auf stabile und homogene Dünnfilme mit anpassbarer Morphologie und Dicke abzielen, um die Gesamtkapazität zu erhöhen und dem beobachteten Kapazitätsabfall entgegenzuwirken.
Zusammenfassung
Wir zeigen hier ein erstes Beispiel einer reversiblen elektrochemischen Abscheidung von molekularen Vanadiumoxid-Clustern als neuen Ansatz zur Speicherung von multiplen Elektronen. Wir konnten zeigen, dass sich auf Elektrodenoberflächen gleichmäßige Filme auf Basis von Kalium-stabilisierten, reduzierten {V12}-Clustern bilden lassen. Innerhalb eines bestimmten Potentialbereichs ist die Abscheidung des Films vollständig reversibel, so dass eine elektrochemische Elektronenspeicherung in Betracht gezogen werden kann. Mechanistische Strukturuntersuchungen ergaben, dass bei zunehmend negativen Abscheidungspotentialen (z. B. wie hier −900 mV vs. Ag/Ag+) strukturelle Veränderungen des Films auftreten, die die Reversibilität des Abscheidungsprozesses beeinflussen. Erste Untersuchungen der Elektronenspeicherkapazität der abgeschiedenen Filme als zukünftiges aktives Kathodenmaterial in BIBs zeigen vielversprechende Ergebnisse und werden hoffentlich weitere Untersuchungen dieser Materialklasse für elektrochemische Energiespeichersysteme vorantreiben.
Information zu Experimenten
Eine detaillierte Beschreibung der verwendeten Methoden und Instrumentierung dieser Arbeit ist in der Supporting Information wiedergegeben.
Danksagung
Diese Arbeit ist ein Beitrag zur Forschung am CELEST (Center for Electrochemical Energy Storage Ulm-Karlsruhe) und wurde von der Deutschen Forschungsgemeinschaft (DFG) im Rahmen der Exzellenzstrategie – EXC 2154 – Projektnummer 390874152 (Exzellenzcluster POLiS) und dem TRR234 “CataLight” (Projektnummer: 364549901) gefördert. Finanzielle Unterstützung durch die Universität Ulm, die Helmholtz-Gemeinschaft (HGF) wird dankend anerkannt. M. A. dankt dem Land Baden-Württemberg für ein Margarete-von-Wrangell-Stipendium und der Baden-Württemberg Stiftung (Elite Programm für Postdocs). S. G. bedankt sich für die finanzielle Unterstützung durch ein Promotionsstipendium des Fonds der Chemischen Industrie (FCI). Dr. Thomas Diemant wird für XPS-Messungen gedankt. Open Access Veröffentlichung ermöglicht und organisiert durch Projekt DEAL.
Interessenkonflikt
Die Autoren erklären, dass keine Interessenkonflikte vorliegen.
Open Research
Data Availability Statement
Die Daten, die die Ergebnisse dieser Studie unterstützen, sind auf begründete Anfrage beim Autor erhältlich.




