Chalkogenide durch Reduktion ihrer Dioxide in ultra-alkalischen Medien
Abstract
Aus der Reaktion von Chalkogendioxiden ChO2 (Ch=Se, Te) mit As2O3 in einem 30-molaren KOH-Hydroflux bei etwa 200 °C wurden Kristalle von Kaliumtrichalkogeniden K2Ch3 mit Abmessungen bis zu 2 cm erhalten. Arsentrioxid wirkt hierbei als Elektronendonor und wird zu Arsenat(V) oxidiert. Setzt man SeO2 und TeO2 zusammen ein, so bildet sich das neue Heterochalkogenid-Anion (TeSe2)2−. Die Verbindung K2TeSe2 kristallisiert isotyp zu K2S3 und K2Se3. Sowohl die unerwartete Redoxreaktion als auch die Fällung hygroskopischer Verbindungen aus einer wässrigen Lösung werden auf eine stark reduzierte Aktivität des Wassers zurückgeführt. Die Reaktionen wurden mit Raman- und UV/Vis-Spektroskopie untersucht. Je nach As2O3-Konzentration dominieren in den Lösungen farblose Monochalkogenide Ch2− oder orangefarbene Se22− und violette Te22− Anionen.
Einleitung
Die Geschichte der Alkalimetallselenide und -telluride reicht mindestens bis zum Beginn des letzten Jahrhunderts zurück, als die Gruppen von Zintl und Klemm solche Verbindungen durch Reaktionen in flüssigem Ammoniak bei −78 °C erhielten.1-3 Es gelang ihnen, Einkristalle zu isolieren und die Kristallstrukturen mehrerer Alkalimetallchalkogenide A2Ch (A=Li – K, Ch=Se, Te) zu bestimmen, die Ch2− Anionen mit geschlossener Schale enthalten. Vierzig Jahre später wurden Einkristalle des Triselenids K2Se3 unter Ammonothermalbedingungen (150 °C, 500 bar) in einem Autoklaven aus den Elementen synthetisiert.4 Gleichzeitig wurde das erste Tritellurid K2Te3 aus den Elementen bei etwa 600 °C in einer verschweißten Eisenampulle hergestellt.5 Trichalkogenid-Anionen Ch32− sind gewinkelte Moleküle (Se32− 102.5°; Te32− 104.4°)4, 5 mit einer negativen (formalen) Ladung an beiden endständigen Atomen. Mit ähnlichen Verfahren wurden Einkristalle mehrerer Oligoselenide und -telluride synthetisiert, z. B. K2Ch2,6 K5Ch3 (Ch=Se, Te)7, 8 und auch das Heterotrichalkogenid K2TeSe3.9 Alternativ wurden Kaliumchalkogenide, wie β-K2Se2 oder K2Se4, durch Solvothermalsynthese in einem organischen Lösungsmittel, z. B. N,N-Dimethylformamid (DMF) oder Ethan-1,2-diamin, erhalten.10 Da die Ausgangsstoffe und Reaktionsprodukte sauerstoff- und feuchtigkeitsempfindlich sind, ist bei allen beschriebenen Verfahren eine konsequente Handhabung unter Inertgas zum Ausschluss von Wasser erforderlich.
Dementsprechend waren wir sehr überrascht, solch empfindliche Verbindungen mit reduzierten Chalkogenspezies aus einem wässrigen Medium ausgehend von Chalkogen(IV)-Oxiden zu erhalten. Wir hatten die neue Hydroflux-Methode angewandt,11 bei der ein hochkonzentriertes Gemisch aus Alkalimetallhydroxid, in der Regel Natrium- oder Kaliumhydroxid, und Wasser mit einem molaren Verhältnis q(A)=n(H2O):n(AOH) nahe eins (d. h. 30 bis 50 molar) als Reaktionsmedium verwendet wird. Der Hydroflux ermöglicht die einfache und schnelle Synthese von kristallinen Metalloxiden und -hydroxiden in nahezu quantitativer Ausbeute.12, 13 Bei Hydrofluxreaktionen ist zumeist eine Reaktionszeit von 10 Stunden bei etwa 200 °C ausreichend. Die Reaktion wird in einem Edelstahlautoklaven mit einem PTFE-Einsatz durchgeführt, welcher den ultraalkalischen Bedingungen widersteht und Wasserverlust verhindert. Da die Aktivität des Wassers in solchen wässrigen Salzschmelzen drastisch reduziert ist, ist der Druck, der sich bei der Reaktion entwickelt, viel geringer als unter hydrothermalen Bedingungen. Tendenziell werden im Hydrofluxmedium höhere Oxidationsstufen, als für ein verdünntes wässriges System zu erwartet wäre, begünstigt. So wurde zum Beispiel die Oxidation von Arsen(III) und Chrom(III) bis zur jeweils maximalen Oxidationsstufe beobachtet.14, 15
Im Folgenden berichten wir über die Reduktion von SeO2 und TeO2 durch As2O3 in einem KOH-Hydroflux, wobei Kristallen von K2Se3, K2Te3 und dem neuen Heterotrichalkogenid K2TeSe2 erhalten wurden.
Ergebnisse und Diskussion
Um die Reaktionen in den Hydrofluxsystemen zu verstehen, ist ein kurzer Blick auf die Chemie der Chalkogene unter reduktiven Bedingungen in verschiedenen anderen Medien hilfreich.
 (1)
(1)Werden vorsynthetisierte Alkalimetalltelluride in DMF gelöst, bilden sich unabhängig vom A:Te-Verhältnis und der Art des Alkalimetalls A die gleichen tiefviolett gefärbten Lösungen.18
 (2)
(2) (3)
(3)Bei Raumtemperatur und einem pH-Wert von 14 ist die Produktseite beider Gleichgewichte begünstigt.19, 20 Im Bereich zwischen pH 5 und pH 7 wurde eine annähernd gleichbleibende Konzentration von Se22− und Se32−-Anionen beobachtet.21 Die protonierten Selenide HSe− (pKa=15.0) und HSe2− (pKa=9.3) wurden sogar in 1 m KOH-Lösungen beobachtet; bei Verdoppelung der Basenkonzentration lagen dann beide Anionen im Wesentlichen deprotoniert vor.19, 23
In unseren Experimenten wurden die Synthesen von Seleniden und Telluriden unter Hydrofluxbedingungen in einem Edelstahlautoklaven mit PTFE-Einsatz durchgeführt. Das Reaktionsmedium bestand aus einem Kaliumhydroxid-Hydroflux mit q(K)=n(H2O):n(KOH)=1.9 (d. h. etwa 30 molar). Bei Raumtemperatur ist dies eine klare Lösung mit einem kleinen Rest an festem KOH. Die Ausgangsstoffe SeO2, TeO2 und As2O3 sind in stark alkalischen Medien gut löslich. Die Verwendung anderer Reduktionsmittel, z. B. V2O3, VO2 oder Sb2O3, ist ebenfalls möglich, aber sie zeigen unterschiedliche Löslichkeit im Hydroflux. Beispielsweise ist V2O3 in stark alkalischen Lösungen relativ schlecht löslich, das Oxidationsprodukt VO43− hingegen gut. Bei Sb2O3 verhält es sich umgekehrt. Sowohl As2O3 als auch As2O5 sind im Hydrofluxmedium gut löslich. Daher wurde As2O3 hauptsächlich als Reduktionsmittel eingesetzt. Die beobachtete Löslichkeit dieser Oxide unter Hydroflux-Bedingungen ist ähnlich jener in verdünnten alkalischen Lösungen.24-26
Für die Synthese von K2Te3 wurde das molare Verhältnis q(Te)=n(As2O3):n(TeO2)=1.2 verwendet. Nach dem Verschließen des Autoklavs wurde das Gemisch 48 Stunden lang bei 200 °C umgesetzt, bevor es innerhalb von 24 h auf Raumtemperatur abgekühlt wurde. Das Reaktionsprodukt bestand aus großen, schwarzen, stäbchenförmigen Kristallen von K2Te3 (Abbildung 1) und einer blassvioletten Lösung. Experimente mit q(Te) von 1.0 oder 0.75 führten ebenfalls zur Kristallisation von K2Te3. Trotz des substöchiometrischen Gehalts des Reduktionsmittels in diesen Experimenten (Gleichung siehe unten) gab es keine Anzeichen für die Bildung von elementarem Tellur. In Experimenten mit q(Te)-Verhältnissen größer als 1.2 bildete sich kein K2Te3.

Ausgewählte Kristalle von K2Te3 (oben), K2Se3 (unten links) und K2Se2Te (unten rechts), die aus Hydroflux-Synthesen erhalten wurden.
Wesentlich kürzere Reaktionszeiten verringerten die Ausbeute an K2Te3, während sich die violette Farbe der Lösung verstärkte. Die violetten Lösungen reagieren mit Wasser oder Luft unter Ausfällung von elementarem Tellur. Die spektroskopische Analyse dieser violetten Lösung deutet auf das Ditellurid-Ion Te22− hin (siehe unten).
Die Synthesen von Seleniden aus SeO2 unter Hydroflux-Bedingungen erfolgten nach der gleichen Methode. Für die Synthese von K2Se3 wurde das molare Verhältnis q(Se)= n(As2O3):n(SeO2)=1.2 mit einer Eduktkonzentration von etwa c(SeO2)=1 mol L−1 gewählt. Damit war c(SeO2) etwa zehnmal höher als die für die Kristallisation von K2Te3 benötigte c(TeO2). Das Reaktionsprodukt bestand aus einer tiefroten Lösung und großen K2Se3-Kristallen (Abbildung 1). Bei Versuchen mit niedrigeren Eduktkonzentrationen wurde nur eine tiefrote Lösung, jedoch kein festes Produkt erhalten. Die rote Lösung enthielt Diselenid-Anionen Se22− (siehe unten).
 (4)
(4)Ein Gemisch mit TeO2 und SeO2 ergab weder ein Gemisch aus K2Se3 und K2Te3 noch einen Mischkristall, der beide Anionen in einem Festkörper vereint, sondern K2TeSe2. Der geringe Unterschied in der Elektronegativität (Pauling: Se 2.5; Te 2.1) reicht aus, um den beiden Elementen ihre Rolle gemäß der Ladungsverteilung im heteroatomaren Ch32− Anion zuzuweisen. Die erhöhte intramolekulare Polarität im Diselenotellurat(II) −(Se−II-TeII-Se−II)− im Vergleich zum Triselenid−(Se−I-Se0-Se−I)− wird durch die Oxidationsstufen symbolisiert, aber sicher auch überbetont.
K2TeSe2 wurde unter ähnlichen Reaktionsbedingungen wie die homoatomaren Trichalkogenide synthetisiert, wobei SeO2 und TeO2 im molaren Verhältnis 2:1 verwendet wurden. Die Zugabe eines Überschusses von etwa 5 % SeO2 trug dazu bei, die Kristallisation von K2Te3 zu vermeiden, das im Hydroflux weniger löslich ist als K2Se3. Als Reduktionsmittel wurden 1.3 Äquivalente As2O3 hinzugefügt (basierend auf 2/3 SeO2 + 1/3 TeO2). Ähnlich wie bei der Synthese von K2Se3 sind relativ hohe Eduktkonzentrationen erforderlich, um Kristalle von K2TeSe2 zu erhalten.
 (5)
(5)Die Redoxreaktion wird durch die hohe Konzentration von Hydroxid-Ionen auf der Seite der Edukte begünstigt. Außerdem ist der Hydroflux stark hygroskopisch. Das ursprünglich enthaltene Wasser, aber auch das durch die Reaktion gebildete Wasser sind stark an den Hydroxid-Ionen gebunden. Dadurch wird die Aktivität des Wassers stark vermindert, was nicht nur den Dampfdruck senkt und die Reaktion antreibt, sondern offensichtlich auch die Hydrolyse der wasserempfindlichen Trichalkogenide verhindert. Andererseits verdünnt die Reaktion den Hydroflux, so dass er sich beim Abkühlen auf Raumtemperatur nicht verfestigt. Das Waschen des Reaktionsprodukts mit einem protischen Lösungsmittel, z. B. einem Alkohol, erhöht die Aktivität des Wassers stark und führt dadurch zur Zersetzung von K2Ch3. Ähnliche Beobachtungen wurden auch bei anderen wasserempfindlichen Produkten aus Hydrofluxsynthesen gemacht, z. B. K2[Fe2O3(OH)2] oder Tl3IO.27, 28 Auch mehrere aprotische, polare Lösungsmittel, z. B. DMF, erwiesen sich als ungeeignet für die Aufarbeitung der Produkte, da Kaliumhydroxid in ihnen weniger löslich ist als die Trichalkogenide. Daher wurden die Produkte unter inerten Bedingungen mit Hilfe einer Schlenk-Fritte filtriert. Die Ausbeuten in Bezug auf das verwendete ChO2 betrugen 90 % für K2Te3, 60 % für K2Se3 und 80 % für K2Se2Te, was mit der Löslichkeit der verschiedenen Chalkogenide zusammenhängt. Das anhaftende KOH und die Feuchtigkeitsempfindlichkeit von K2Ch3 machen eine Lagerung und Handhabung der Kristalle unter inerten Bedingungen (Argon) erforderlich. Die Röntgen-Pulverdiffraktogramme isolierter Kristalle zeigten einphasige Produkte, wobei im Rasterelektronenmikroskop kleine Reste des Hydrofluxes sichtbar waren (Abbildung S1 bis S4, Tabelle S1, Hintergrundinformationen).
Röntgenbeugungsexperimente an schwarzen Einkristallen von K2Se3 (Cmc21) und K2Te3 (Pnma) bestätigten die bekannten Strukturen.4, 5 Für die neue Verbindung K2TeSe2 wurde eine orthorhombische Struktur in der nicht-zentrosymmetrischen Raumgruppe Cmc21 (Nr. 36) mit den Gitterparametern a=783.42(4) pm, b=1045.64(6) pm und c=777.13(4) pm bei 100(1) K gefunden. Einzelheiten zu den Strukturbestimmungen und den Atomparametern der drei Verbindungen finden sich in den Tabellen S2 bis S8 in den Hintergrundinformationen. Ausgewählte Bindungslängen und -winkel sind in Tabelle S9 aufgeführt.
K2TeSe2 kristallisiert isotyp zu K2Se3 und K2S3 (Abbildung 2). Das angewinkelte Diselenotellurat(II)-Anion, (TeSe2)2−, besitzt kristallographische C2v-Symmetrie mit zwei gleichen Se-Te Bindungslängen von 256.2(1) pm und einem Se-Te-Se Winkel von 97.6(1)°. Das (TeSe2)2−-Anion wurde bereits (2,2,2-crypt-K)2(TeSe2)⋅en (en=Ethylendiamin)29 und [Mn(en)3](TeSe2)30 beobachtet und weist darin Te-Se-Bindungslängen von etwa 250 pm und 250.3(1) pm sowie Se-Te-Se Winkel von 111.3(1)° bzw. 102.6(1)° auf. In diesen Strukturen sind die (TeSe2)2−-Anionen weit voneinander getrennt und interagieren darüber hinaus mit den Wasserstoffatomen der organischen Liganden. Die größeren Se-Te-Se Winkel stehen im Einklang mit den kürzeren Te-Se Bindungslängen, die die Abstoßung zwischen den terminalen Atomen erhöhen. In K2TeSe2 deuten kurze intermolekulare Abstände von 333.4(1) pm auf sekundäre Bindungen TeII⋅⋅⋅Se−II hin, die zusammen mit stärkeren Wechselwirkungen zwischen Kationen und Anionen für die verlängerte primäre Te-Se Bindung verantwortlich sein könnten. In den Alkalimetalltrichalkogeniden A2Ch3 (A=K-s; Ch=S-Te) mit homonuklearen Anionen, welche eine geringere intramolekulare Polarität als (TeSe2)2− aufweisen, liegen die kürzesten intermolekularen Abstände zwischen 344 pm und 386 pm.31
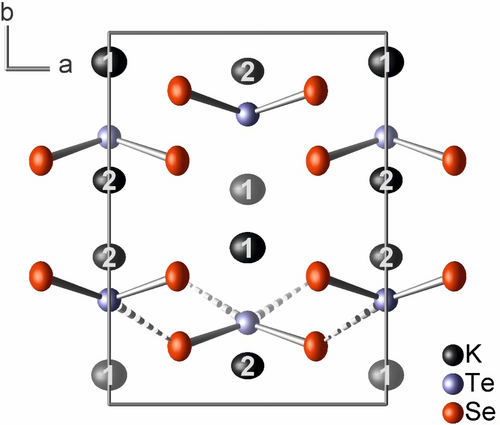
Kristallstruktur von K2TeSe2 projiziert entlang der [001]-Richtung. Die sekundäre TeII⋅⋅⋅Se−II Bindungen sind gepunktet dargestellt. Die Ellipsoide umfassen 99.99 % der Wahrscheinlichkeitsdichte der Atome bei 100(1) K.58
Neben K2TeSe2 kristallisieren die folgenden Verbindungen im K2S3-Strukturtyp: A2Ch3 (A=K-Cs; Ch=S, Se), Cs2Te3 und Cs2TeS2.4, 31-33 Der Bindungswinkel in den Ch32− Anionen nimmt von den Sulfiden (mittlerer Winkel von 106.,0°) über die Selenide (mittlerer Winkel von 103.1°) bis hin zu den Telluriden (100.1° in Cs2Te3) ab,31 was auf einen abnehmenden s-Orbitalbeitrag zur Bindung bei den schwereren Hauptgruppenelementen zurückgeführt werden kann. Trotz der kleineren endständigen Atome hat das Anion in Cs2TeS2 einen etwas größeren Bindungswinkel (99.4°) als (TeSe2)2− in K2TeSe2, was auf die höhere Elektronegativität und damit die höhere Partialladung der Schwefelatome im Vergleich zu Selen zurückzuführen sein dürfte.
In der Kristallstruktur von K2TeSe2 bilden die (TeSe2)2−-Anionen Doppelschichten parallel zu (010) (Abbildung 2), wobei die Telluratome in das Innere der Doppelschicht zeigen. Die Kaliumatome trennen die Doppelschichten. Die Polarität der Struktur ist offensichtlich, da alle (TeSe2)2−-“Pfeilspitzen” in ein und dieselbe Richtung entlang [001] zeigen (Abbildung S5). Die beiden Kaliumatome K1 und K2 sind jeweils von sechs Selenatomen in Form verzerrter trigonaler Prismen mit Cs-Symmetrie koordiniert (Abbildung 3). Innerhalb dieser Polyeder reichen die K-Se Bindungslängen von 338.9(1) pm bis 360.9(1) pm bzw. von 338.3(1) pm bis 349.6(1) pm (Tabelle S8). An dem etwas größeren Polyeder um K1 sind sechs (TeSe2)2−-Anionen beteiligt, während nur fünf Anionen das trigonale Prisma um K2 bilden. Die Summe der Volumina der [KSe6]-Polyeder ist für K2TeSe2 etwa 5 % größer als für K2Se3. Die [KSe6]-Prismen von K1 und K2 teilen sich eine quadratische Fläche, die nicht von einem Telluratom bedeckt ist (K⋅⋅⋅Te 340.8(1) bis 390.7(1) pm). Die [K2Se8]-Doppelprismen haben gemeinsame Ecken und Kanten und bilden ein dreidimensionales Gerüst. In K2TeSe2 ist der kürzeste K⋅⋅⋅K Abstand mit 366.7(1) pm sogar kürzer als in K2Se3 [369.4(1) pm], aber nicht so kurz wie in K2S3 [359.2(2) pm].4 In K2Te3, das in einem eigenen Strukturtyp kristallisiert, beträgt der kürzeste Abstand zwischen den Kationen 441.0(1) pm.
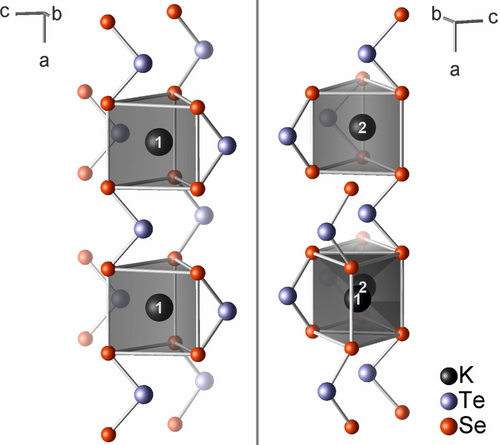
Zwei Ansichten der Koordinationspolyeder der Kaliumkationen in K2TeSe2. Die beiden Kaliumatome teilen sich die nicht abgedeckte quadratische Fläche ihres trigonalen Prismas.
Um weitere Einblicke in die chemischen Prozesse im Hydroflux zu erhalten und dabei Informationen über die gelösten Chalkogenid-Anionen Chn2− (n=1, 2, 3) zu erlangen, wurden die Reaktionslösungen mittels UV/Vis- und Raman-Spektroskopie analysiert. Die Reaktionsbedingungen waren q(K)=1.9 und 200 °C, wie bei den obigen Synthesen, aber die Reaktionszeit betrug nur fünf Stunden. Die Eduktkonzentration der Synthesen für die UV/Vis-Messungen betrug etwa 0.01 mol L−1, während die Konzentration für die Raman-Messungen etwa 30-mal höher war. Die Analysen wurden unter Umgebungsbedingungen in Luft und bei Raumtemperatur durchgeführt. Bei den UV/Vis-Messungen lag die untere Grenze der Wellenlänge wegen der starken Absorption durch das Hydroflux-Medium bei etwa 240 nm. Raman- und UV/Vis-Spektren jedes einzelnen Reaktanten, der in einem Hydroflux mit q(K)=1.9 gelöst ist, finden sich in den Abbildungen S6 bis S11.
Violette Lösungen wurden ausgehend von einem molaren Verhältnis von As2O3 und TeO2 von q(Te)=1 erhalten. Bei diesem Verhältnis stellt die vollständige Oxidation von Arsen(III) zu Arsen(V) vier Elektronen pro Tellur(IV)-Atom bereit. Das UV/Vis-Spektrum einer solchen Probe zeigt eine Absorptionsbande mit einem Maximum bei 522 nm (Abbildung 4), die im Vergleich zu den bereits bekannten Absorptionsmaxima für Ditellurid-Anionen Te22− von 508 bis 512 nm leicht zu niedrigeren Frequenzen verschoben ist.34-37 In verdünnten alkalischen Lösungen wurde das violette Te22− in verschiedenen Versuchsaufbauten beobachtet und charakterisiert, z. B., als Produkt der ungewollten Oxidation von Monotellurid-Lösungen durch eingedrungenen Sauerstoff,34, 35 nach der Oxidation von Monotellurid-Lösungen in einer photochemischen Zelle durch Bestrahlung von CdTe,35 in einer Elektrolyse, die von einer Monotellurid-Lösung ausgeht,35 oder während einer Elektrolyse, bei der Monotellurid erzeugt wird, welches mit elementarem Tellur unter Bildung des Ditellurid-Anions weiterreagiert.36, 37 Auch zeigt das Absorptionsspektrum des in Hexan gelösten isoelektronischen Iodmoleküls I2 eine ähnliche Bande mit einem Maximum bei etwa 520 nm.34, 38
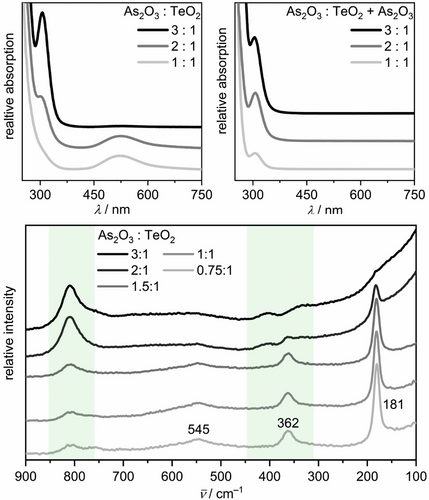
UV/Vis- (oben links) und Raman-Spektren (unten) von Telluridlösungen, die mit unterschiedlichen q(Te)-Verhältnissen synthetisiert wurden. Absorptionsspektren von Tellurid-Lösungen nach Zugabe von gelöstem As2O3 bei Raumtemperatur sind dargestellt (oben rechts). Die Wellenzahlbereiche, in denen As-O Schwingungen des AsO43− Anions auftreten, sind grün unterlegt.
Die Raman-Spektren von Experimenten mit q(Te)=0.75, 1 oder 1.5 (d. h. 3, 4, 6 Elektronen pro TeIV) zeigen eine Schwingungsbande bei 181 cm−1 (Abbildung 4), die in einem für Oligotelluride typischen Energiebereich auftritt.17, 39-41 Wir fanden keine Literaturdaten für Te-Te-Schwingungen von Telluriden in wässrigen Lösungen. K2Te2, gelöst in DMF, zeigt eine Schwingung bei 164 cm−1.17 Die Raman-aktiven Schwingungen des Pentatellurid-Ions Te52− in Aceton liegen bei 170 cm−1 und 195 cm−1.39 Die Te-Te-Banden in As-Te und Se-Te-Gläsern treten bei 155 cm−1 und 175 cm−1 auf.40, 41 Folglich ordnen wir die Bande bei 181 cm−1 der Schwingung des Te22−-Anions zu, was im Einklang mit den Ergebnissen der UV/Vis-Messungen ist. Die bei 362 cm−1 und 545 cm−1 beobachteten Banden stellen den ersten bzw. zweiten Oberton der Schwingungsbande bei 181 cm−1 dar. Das Vorhandensein dieser Obertöne und die hohe Intensität der Te-Te-Schwingungsbande im Vergleich zu den Spektren der Selenide werden durch Raman-Resonanz des 532 nm Lasers mit der Absorptionsbande bei 522 nm verursacht.
Wird die Menge des Reduktionsmittels erhöht, verblasst die violette Farbe der Lösung, bis eine farblose Lösung aus den Synthesen erhalten wird. Die vollständige Entfärbung der Lösung wurde mit q(Te)=3 (d. h. 12 Elektronen pro TeIV) beobachtet. Diese Lösungen sowie die Proben, bei denen gelöstes As2O3 bei Raumtemperatur zu den violetten Te22− Lösungen hinzugefügt wurde, zeigten im UV/Vis eine einzige symmetrische Absorptionsbande mit einem Maximum bei 324 nm (Abbildung 4). Dies stimmt gut mit dem literaturbekannten Wert von 325 nm für Te2− in verdünnten alkalischen Lösungen überein.34, 36 In den entsprechenden Raman-Spektren war keine Bande im typischen Energiebereich der Te-Te-Schwingungen nachweisbar, was für das Monotellurid-Anion Te2− als vorherrschende Spezies zu erwarten ist. Das protonierte Monotellurid-Anion HTe− (270 nm)34 wurde in unseren Experimenten nicht beobachtet. Dies ist für ultraalkalische Medien zu erwarten, da die zweite Dissoziationskonstante pKa2 von Tellurwasserstoff H2Te mit 12.2 angegeben wird.42
In keiner der Lösungen konnte das Tritellurid-Anion Te32− spektroskopisch nachgewiesen werden. Dieses hat eine UV/Vis-Absorptionsbande bei 376 nm in DMF,18 und eine Lösung von K2Te3 in flüssigem Ammoniak oder DMF zeigt eine Schwingungsbande bei etwa 162 cm−1.17 Im Hydrofluxmedium lassen die langsame Kristallisation von K2Te3 während der Synthese bei 200 °C und seine Unlöslichkeit bei Raumtemperatur auf ein Gleichgewicht zwischen den Telluridarten ähnlich Gleichung (1) schließen, in welchem das Tritellurid-Anion nicht begünstigt ist. Die Ausfällung von K2Te3 wird also nicht durch eine hohe Konzentration von Te32− verursacht, sondern durch ein sehr kleines Löslichkeitsprodukt. Diese Beobachtungen stehen im Einklang mit berichteten elektrochemischen Experimenten zur reduktiven Auflösung einer Tellurkathode: Während sich bei pH 9 hauptsächlich Te2−-Anionen bildeten, dominierten oberhalb von pH 12 die Te22−-Anionen.43
In niedrig konzentrierten alkalischen Lösungen wurde die Absorptionsbande des Diselenid-Anions Se22− bei etwa 430 nm beobachtet.19, 20, 23 Se32− und Se42− absorbieren bei 530 nm bzw. 470 nm.19 Das UV/Vis-Spektrum (Abbildung 5) einer orangefarbenen Lösung, die mit q(Se)=1 im Hydroflux synthetisiert wurde, zeigte eine symmetrische Absorptionsbande mit einem Maximum bei 440 nm, die wir mit Bezug auf die oben zitierte Literatur Se22− zuordnen. Bei höheren q(Se)-Verhältnissen von 2 oder 3 wurde die Bildung des Monochalkogenid-Anions im UV/Vis beobachtet, ähnlich wie bei den Telluriden.

UV/Vis- (oben links) und Raman-Spektren (unten) von Selenidlösungen, die mit unterschiedlichen q(Se)-Verhältnissen synthetisiert wurden. Absorptionsspektren von Selenid-Lösungen nach Zugabe von gelöstem As2O3 bei Raumtemperatur sind dargestellt (oben rechts). Die Wellenzahlbereiche, in denen As-O Schwingungen des AsO43− Anions auftreten, sind grün unterlegt.
Raman-Spektren von gelösten Oligoseleniden sind kaum bekannt. In Aceton zeigt das Se62−-Anion Schwingungsbanden bei 235 cm−1, 285 cm−1 und 405 cm−1.39 In niedrig konzentrierten alkalischen Lösungen ergab die Oxidation von H2Se mit H2O2 Selenspezies mit durchschnittlichen Oxidationszuständen von −1, −0.67 und −0.5, d. h. Sen2− (n=2, 3, 4) und Raman-Banden bei 269 cm−1 und 324 cm−1.22 Die Bande bei 269 cm−1 wurde aufgrund der Raman-Resonanz einer Messung mit einem 476 nm-Laser dem Se42−-Anion zugeordnet,22 da das Se42−-Anion eine Absorptionsbande bei 470 nm besitzt.19 Ein mit einem 457 nm Laser erzeugtes Raman-Spektrum zeigte eine noch größere Intensität der Bande bei 269 cm−1.22 DFT-Berechnungen hatten zwei aktive Raman-Schwingungsmoden bei 299 cm−1 und 106 cm−1 für das Se42−-Anion und eine Raman-Bande bei 273 cm−1 für Se22− vorausgesagt.22 Für glasartiges Selen wurde die Se-Se-Streckschwingungsmode bei 250 cm−1 mit einer Schulter bei 235 cm−1 angegeben,44 was den As-Se (238 cm−1, 252 cm−1)45 und Se-Te-Gläsern (220 cm−1 bis 280 cm−1) ähnelt.41
Die Raman-Spektren (Abbildung 5) von Lösungen aus Hydroflux-Reaktionen mit q(Se) von 0.75, 1 oder 1.5 zeigten eine Schwingungsbande mit einem Maximum bei 265 cm−1. Dies könnte auf höhere Oligoselenide hindeuten, obwohl die Transmissions-UV/Vis-Spektren ausschließlich Se22− für q(Se)=1 ergaben. Allerdings musste bei Verwendung von Standard-Quarzküvetten die Konzentration in der UV/Vis-Spektroskopie etwa 30-mal niedriger sein als für die Raman-Messungen. Um eine konzentrationsabhängige Produktbildung auszuschließen, haben wir ein UV/Vis-Spektrum im Reflexionsmodus an derselben Selenid-Lösung gemessen, die auch für die Raman-Spektroskopie verwendet wurde. Dieses zeigte nur eine Absorptionsbande bei 435 nm, die das Vorhandensein von hauptsächlich Se22−-Anionen bestätigte (Abbildung S12). Aus diesem Grund und wegen des Fehlens zusätzlicher Schwingungsbanden22 ordnen wir die 265 cm−1 Bande in den Raman-Spektren der Experimente mit q(Se)=0.75, 1 oder 1.5 dem Diselenid-Anion Se22− zu, was ebenfalls gut zum berechneten Wert von 273 cm−1 passt.22
In allen unseren Experimenten wurde die Diselenidbande bei 265 cm−1 von einer winzigen Bande bei 323 cm−1 begleitet, die vermutlich durch Se2− verursacht wird.22 Beide Schwingungsbanden hatten immer das gleiche Intensitätsverhältnis, trotz unterschiedlicher q(Se). In vorangegangenen Studien wurde berichtet, dass sich das Se2−-Radikal unter dem intensiven Laserlicht aus den Oligoseleniden Sen2− mit n=2–4 bildet.19, 22 Allerdings ist Se22− ein unwahrscheinlicher Präkursor, da ein Elektron abstrahiert werden müsste. Außerdem wäre die Anregung von Se22− mit einem 530 nm Laser wegen seiner Absorptionsbande bei 440 nm sehr ineffizient. Der plausibelste Präkursor für Se2− ist Se42−, da seine Zersetzung eine symmetrische Bindungsspaltung beinhaltet und seine Absorptionsbande bei 470 nm näher an der Wellenlänge des Lasers liegt.19, 22 Bei der Dissoziation von Se32− würde neben Se2− auch das Se− Radikal entstehen, das in wässrigen Lösungen beobachtet worden war.46 In unseren Experimenten lässt sich das Vorhandensein geringer Mengen anderer Oligoselenide als Se22− durch Gleichung (2) und (3) erklären. Außerdem ist bekannt, dass das Se2−-Radikal eine Absorptionsbande zwischen 490 und 520 nm hat,47-49 die zu einer Intensitätssteigerung seiner Schwingungsbande bei 323 cm−1 durch Raman-Resonanz führt, so dass die tatsächliche Konzentration des Se2−-Radikals erwartungsgemäß niedrig ist. Bei Umstellung der Strahlungsquelle auf einen 1064 nm Laser verschwand die Schwingungsbande bei 323 cm−1, während die Se22−-Bande mit unveränderter Intensität bestehen blieb (Abbildung S13).
Im UV/Vis-Spektrum des Versuchs mit q(Se)=3 (Abbildung 5) wies das Monoselenid-Anion Se2− eine Absorptionsbande bei 262 nm auf, die nahe dem angegebenen Wert von 270 nm liegt.19, 20 Das gleiche Ergebnis wurde für eine Lösung mit höherer Eduktkonzentration erhalten, die für die Raman-Spektroskopie verwendet wurde (Abbildung S14). Die Raman-Spektren bestätigten, dass keine Spezies mit Se-Se-Bindung vorlag.
Wurde bei Raumtemperatur eine Hydrofluxlösung von As2O3 mit demselben q(K) zu einer orangefarbenen Diselenidlösung mit q(Se)=1 hinzugegeben, verschwanden die Farbe und die Absorptionsbande des Se22−-Anions. In diesem Fall überlagerte die starke Absorption der überschüssigen AsO33−-Ionen unterhalb von 300 nm das Signal des Monoselenid-Anions Se2− (Abbildung S6).
Da sich die Schwingungsbanden von AsO43− und SeO32− überschneiden, haben wir auch Sb2O3 als Reduktionsmittel verwendet. Die umgesetzte Lösung mit n(Sb2O3):n(SeO2)=0.75 zeigte die Raman-Bande von Se22− bei 265 cm−1 (Abbildung S15). Die zusätzliche Schwingungsbande bei 810 cm−1 stimmt gut mit dem Raman-Spektrum von SeO2, das in einem Hydroflux gelöst worden ist, überein. Die Koexistenz von SeO32− und Se22− Anionen bestätigt die Beobachtung, dass in unseren Experimenten kein elementares Selen gebildet wurde.
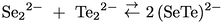 (6)
(6)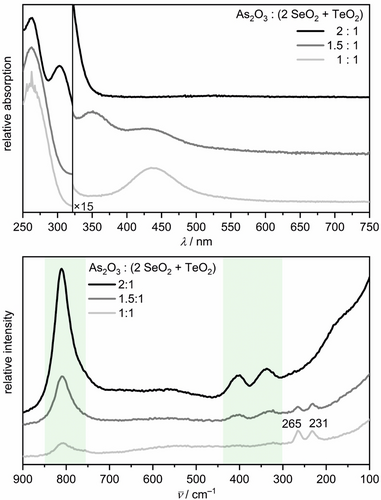
UV/Vis- (oben) und Raman-Spektren (unten) von Chalkogenid-Lösungen, die mit unterschiedlichen q(SeTe)-Verhältnissen synthetisiert wurden. Die Wellenzahlbereiche, in denen As-O Schwingungen des AsO43− Anions auftreten, sind grün unterlegt.
Die Raman-Spektren (Abbildung 6) für q(SeTe)=1 und 1.5 zeigen die Se22−-Bande bei 265 cm−1 und eine zusätzliche Bande bei 231 cm−1, die im typischen Energiebereich der Se-Te-Schwingungen auftritt und daher dem (SeTe)2−-Anion zugeordnet wird.41, 51-54 Die Se-Te-Streckschwingungen in Se-Te-Gläsern wurden zwischen 205 cm−1 und 216 cm−1 beobachtet.52, 53 Eine ähnliche Verschiebung zu niedrigeren Energien wurde für Se-Se und Te-Te-Schwingungen im festen Zustand in Relation zu Se22− und Te22−-Anionen in wässrigen Lösungen beobachtet. DFT-Berechnungen an gemischten Trichalkogeniden Ch32− (Ch=Se, Te) hatten einen Bereich von 218 cm−1 bis 230 cm−1 für Se-Te-Streckschwingungen vorhergesagt.41 In [Zn(NH3)4](TeSe3) treten sie bei 217 cm−1 und 231 cm−1,54 in Na2TeSe3 bei 213 cm−1 und 238 cm−1 auf.51
Die Schwingungsbanden der Se22− und (SeTe)2−-Anionen sind deutlich zu erkennen. Die Se22−-Bande war intensiv für q(SeTe)=1, aber schwächer für q(SeTe)=1.5. Die im Raman-Spektrum noch schwach erkennbaren Te-O-Schwingungen des TeO32−-Anions zeigten, dass TeO2 bei q(SeTe)=1 nur teilweise reduziert worden war (Abbildung S16). Die Annahme von (SeTe)2−-Anionen, die sich aus einer 2:1 Lösung von SeO2 und TeO2 gebildet haben, wird indirekt durch die im Raman-Spektrum sichtbaren verbleibenden Se22−-Anionen untermauert. Das Raman-Spektrum des Experiments mit q(SeTe)=1.5 wies eine insgesamt geringere Intensität der Chalkogenid-Schwingungsbanden auf als dasjenige mit q(SeTe)=1, da die Kristallisation von K2Se2Te die Konzentration der gelösten Chalkogenid-Anionen verringerte.
Das UV/Vis-Spektrum des Experiments mit q(SeTe)=2 zeigte die Absorptionsbanden von Se2− bei 261 nm und Te2− bei 305 nm, was darauf hindeutet, dass die hohe Menge an As2O3 die Chalkogenid(IV)-Oxide vollständig reduziert hatte. Dementsprechend wurde keine Raman-Bande im Bereich der Ch-Ch-Schwingungen gefunden.
Beim Mischen von vorsynthetisierten Se22− und Te22−-Lösungen bei Raumtemperatur zeigte das resultierende Gemisch eine starke (SeTe)2−-Bande bei 231 cm−1 und eine kleinere Se22−-Bande bei 265 cm−1 (Abbildung S17). Die Kristallisation von K2Te3 hatte die Te22−-Konzentration verringert, während die Konzentration für die Ausfällung von K2Se3 zu niedrig war. Dieses Experiment bestätigt das Gleichgewicht in Gleichung (6).
Die Chalkogenid-Lösungen sind empfindlich gegenüber feuchter Luft. Die farblosen Monotellurid-Lösungen begannen beim geringsten Kontakt mit Sauerstoff zu oxidieren, was zu violetten Lösungen führte, die Te22− enthielten, aus denen sich dann elementares Tellur absetzte. Letzteres lässt sich an den Te-Te-Schwingungsbanden bei 120 cm−1 und 139 cm−1 erkennen (Abbildung S18).55 Die Reaktion findet an der Oberfläche der Flüssigkeit statt, so dass diese für kurze Zeit an der Luft gehandhabt werden kann. Bei Zugabe von As2O3-Lösung wird das elementare Tellur wieder zu Telluriden reduziert (Abbildung S19).
Die Selenid-Lösungen sind weniger reaktiv. Monoselenid-Lösungen zeigten die orange Farbe von Se22− erst nach mehreren Stunden an Luft. Wenn Diselenid-Lösungen mit Wasser verdünnt und an der Luft exponiert wurden, bildete sich zunächst ein roter Film auf der Oberfläche der Flüssigkeit, der nach einigen Stunden ein graues Pulver ergab, welches Se-Se-Schwingungsbanden bei 140 cm−1 und 235 cm−1 zeigte (Abbildung S18).56, 57 Höhere Oligochalkogenide konnten nicht nachgewiesen werden.
Experimente zum Reduktionspotenzial von As und As2O3 ergaben unerwartete Ergebnisse, z. B. dass elementares Arsen nicht in der Lage ist, Ch22− zu Ch2− zu reduzieren, und dass überschüssige AsIIIO33−-Anionen anscheinend zu Arsen und AsVO43− disproportionieren (siehe Hintergrundinformationen).
Fazit
Lösungen von Mono- und Dichalkogenid-Anionen Ch2−, Ch22− (Ch=Se, Te) und (SeTe)2− sind durch Reduktion des entsprechenden ChO2 mit As2O3 unter Hydrofluxbedingungen zugänglich. Wird eine unterstöchiometrische Menge As2O3 zugegeben, besteht das Reaktionsprodukt aus einem Gemisch von ChO32− und Ch22−-Anionen. Spektroskopisch wurden jedoch weder elementare Chalkogene noch Oligochalkogenid-Anionen beobachtet, die größer als Ch22− sind. Die Zugabe von As2O3 im Überschuss ergibt farblose Lösungen von Monochalkogenid-Anionen Ch2−. Große Einkristalle von K2Ch3 wurden erhalten, wenn die As2O3-Menge eine durchschnittliche Oxidationsstufe des Chalkogens von −0.67 (Ch32−) nicht unterschreitet. Für die Kristallisation von K2Se3 oder K2Se2Te sind höhere Eduktkonzentrationen erforderlich als für K2Te3.
Die Herstellung von Chalkogeniden mit Hilfe der Hydroflux-Methode stellt eine attraktive Alternative zu den bisher verwendeten Syntheserouten dar. Die erforderliche Ausrüstung ist billiger und das Verfahren ist einfacher und sicherer. Die unerwartete Bildung von Chalkogeniden aus Chalkogen-Dioxiden ist auf die ultra-alkalischen Bedingungen zurückzuführen. Das Wasser im Reaktionsgemisch ist stark an das Hydroxid gebunden. Seine reduzierte Aktivität verhindert die Hydrolyse der Trichalkogenide, verschiebt aber auch die aus verdünnten alkalischen Lösungen bekannten Redoxgleichgewichte.24 Eine Übertragung des Ansatzes auf andere Systeme sollte möglich sein.
Acknowledgements
Die Autoren danken Prof. Dr. E. Brunner, TU Dresden, für die Möglichkeit, die Raman- und UV/Vis-Spektrometer zu nutzen. Diese Arbeit wurde von der Deutschen Forschungsgemeinschaft (DFG, Projekt-ID 438795198) finanziell unterstützt. Open Access Veröffentlichung ermöglicht und organisiert durch Projekt DEAL.
Conflict of interest
Die Autoren erklären, dass keine Interessenkonflikte vorliegen.




