Tetraimidoschwefelsäure H2S(NtBu)4 – isovalenzelektronisch zu H2SO4
Professor Bernt Krebs gewidmet
Abstract
Das zur Schwefelsäure H2SO4 isovalenzelektronische Imido-Analogon H2S(NtBu)4 wurde synthetisiert, isoliert und mittels NMR-Spektroskopie sowie hochaufgelöster Röntgenstrukturanalyse und Ladungsdichteuntersuchungen charakterisiert. Letzteres zeigt stark polarisierte Sδ+-Nδ−-Bindungen mit praktisch keinem Doppelbindungscharakter. Die leicht zu polarisierenden S-N-Bindungen sind eine vorteilhafte und vielseitige Eigenschaft der Schwefel-Stickstoff-Liganden, mit der sie sich unterschiedlichen elektronischen Anforderungen verschiedener Metallkationen anpassen können.
Der isovalenzelektronische Austausch von Sauerstoffatomen in klassischen SOnm−-Polyoxoschwefelanionen durch NR-Imidogruppen führt zu molekularen, löslichen Polyimidoschwefel-Spezies S(NR)nm−, n=2, 3, 4 und m=0, 2 (Schema 11-5). Diese sind multifunktionale Liganden in der Metallkoordination.6, 7 Zweifellos ist die Schwefel-Stickstoff-Bindung dabei eine der vielseitigsten in der Koordinationschemie wie auch in den Materialwissenschaften. Dies folgt aus der breiten Palette an Oxidationszuständen des Schwefels (−II bis +VI), die ihrerseits den Metall-zu-Ligand-Ladungstransfer erleichtert, dem großen Radius, der hohe Koordinationszahlen ermöglicht, und der beträchtlich kovalenten, wenn auch polaren Natur der S-N-Bindung. Die Synthese des polymeren (SN)x8 und die Entdeckung seiner hochtemperatursupraleitenden Eigenschaften9 waren sicherlich Meilensteine der SN-Chemie, die kürzlich durch die Synthese des stickstoffarmen Schwefelnitridoxids N{S(O)2O(O)2S}3N vorangetrieben wurde.10 Zusätzlich zeigten sich schwefelzentrierte Liganden als vorteilhafte Donoren11 in Einzelmolekülmagneten (SMMs). Ladungsdichteuntersuchungen halfen dabei, die Elektronenkonfiguration von Metallzentren in SMMs experimentell zu bestimmen.12 In der Vergangenheit haben wir bereits solche Liganden erfolgreich in d-Block-SMMs eingesetzt.13 Dies wiederum ermutigte uns, Tetraimidoschwefelsäure H2S(NtBu)4 als bedeutenden Eckpfeiler und Baustein in der SN-Chemie zu synthetisieren und zu isolieren.
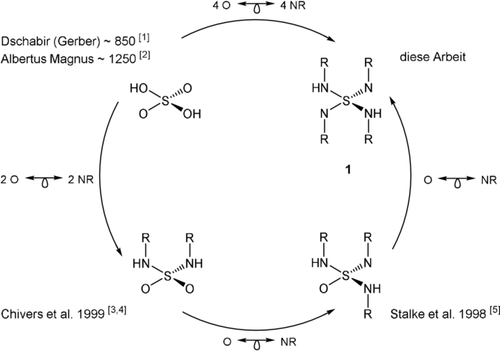
Von der Schwefelsäure zur Tetraimidoschwefelsäure durch isovalenzelektronischen Austausch von O durch NR.
Schonende Protonierung des lithiierten Tetraimidosulfats [(thf)4Li2(NtBu)4S]5 mit tBuNH3Cl in THF bei Raumtemperatur14 ergab das lange gesuchte Lehrbuchmolekül H2S(NtBu)4 (1) (Schema 1), ein isovalenzelektronisches Imidoanalogon der Schwefelsäure H2SO4,15 des wichtigsten Massenprodukts der chemischen Industrie.16 Es zeigte sich, dass diese Verbindung sowohl bei niedrigen Temperaturen in Lösung als auch im Festkörper instabil ist. Nur bei Temperaturen unterhalb −35 °C kann diese Verbindung ohne signifikante Zersetzung mehrere Monate gelagert werden. Bei höheren Temperaturen entsteht zunehmend S(NtBu)3 (2), das Analogon zum SO3 und Edukt zur H2SO4.17 Ähnliche Löslichkeiten machen eine fraktionierende Kristallisation unmöglich, und bei Hochvakuumsublimation konnte nur S(NtBu)3 isoliert werden.
Das zweite Hauptprodukt der Zersetzung ist tert-Butylamin (siehe Schema S1 und Abbildung S17). Das Verhältnis von 1 und 2 kann mittels 1H-NMR-Spektroskopie und Integration der entsprechenden Signale ermittelt werden, da sie sich in ihrer chemischen Verschiebung von 1.28 ppm und 1.51 ppm für 1 und 1.44 ppm für 2 (Abbildung S11) ausreichend unterscheiden. Das Signal der beiden äquivalenten stickstoffgebundenen Protonen von 1 findet sich bei 3.06 ppm, und die 15N-1H-HSQC- (Abbildung S15) und 15N-1H-HMBC-NMR-Spektren (Abbildung S16) zeigen, dass sie sich in der gleichen Stickstoffumgebung wie die tBu-Gruppen mit einer Resonanzverschiebung von 1.28 ppm befinden. Die tBu-Gruppen bei 1.51 ppm zeigen hierbei keine NH-Wechselwirkung. Zusätzlich sind die chemischen Verschiebungen anhand der 15N-NMR-Analyse der Stickstoffatome in 1 (−253.2 ppm für N und −257.4 ppm für NH) verschieden von denen in 2. Trotz aller präparativen Schwierigkeiten konnten wir schließlich reines 1 kristallisieren, isolieren und sogar eine hochaufgelöste Strukturanalyse durchführen. Verbindung 1 kristallisiert in der Raumgruppe C2/c ohne Anzeichen einer N(H)/N-Wasserstoffatom-Fehlordnung (Abbildung 1). Deshalb würde die Strukturformel [(tBuN)2S(HNtBu)2] die unterschiedliche Natur der zwei Substituenten durch die feststehenden Wasserstoffatompositionen hervorheben und damit besser der tatsächlichen Struktur entsprechen. Die asymmetrische Einheit besteht aus einem halben Molekül. Die zweite Hälfte wird durch eine zweizählige Achse entlang der Winkelhalbierenden des N-S-N- bzw. (H)N-S-N(H)-Winkels erzeugt. Das Schwefelatom zeigt daher eine tetraedrische Koordination, ausgebildet durch die zwei NtBu-Imido- und (H)NtBu-Amido-Gruppen.
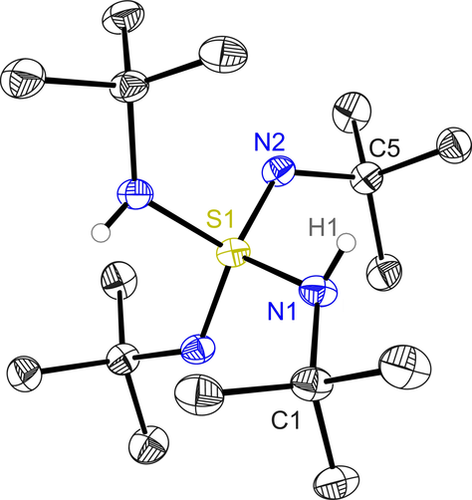
Kristallstruktur von H2S(NtBu)4 (1). Die anisotropen Auslenkungsparameter entsprechen einer Aufenthaltswahrscheinlichkeit von 50 %. Kohlenstoffgebundene Wasserstoffatome wurden weggelassen. Ausgewählte Bindungslängen [Å] und -winkel [°]: S1-N1 1.6482(3), S1-N2 1.5273(3), N1-C1 1.4902(3), N2-C5 1.4776(3); N1-S1-N1a 113.00(2), N1-S1-N2 100.750(13), N2-S1-N2a 127.83(2), N1-S1-N2a 107.392(13).
Der größte Bindungswinkel wird von den zwei Imidogruppen (N2-S1-N2A 127.83(2)°) eingeschlossen, der kleineste jeweils von den Amido/Imido-Gruppen (N1-S1-N2 100.750(13)°). Intra- bzw. intermolekulare Wasserstoffbrücken sind unmöglich, da das N1(H)-Wasserstoffatom nicht dem freien Elektronenpaar an N2 zugewandt ist. Die Imido-Bindungslänge von S1-N2 mit 1.5273(3) Å und die Amido-Bindungslänge von S1-N1 mit 1.6482(3) Å stimmen sehr gut mit bereits in der Gasphase22, 23 und mit hochaufgelösten Röntgendaten im Festkörper bestimmten Längen in S(NtBu)3 (2),19 S(NtBu)2 (3)20 und CH2{S(NtBu)2(NHtBu)}2 (4)21 überein (Tabelle 1). Zur Klärung der Ladungsdichteverteilung in 1 und vor allem der Bindungssituation der unterschiedlichen S-N-Bindungen, die entscheidend für das Verhalten der Einzelmolekülmagnete (SMMs) ist, wurden eine Multipolverfeinerung nach dem Hansen-und-Coppens-Modell24 und eine auf der Quantum Theory of Atoms in Molecules (QTAIM) basierende topologische Analyse25 durchgeführt. Wichtige Parameter zur Charakterisierung der Bindung sind die Elektronendichte ρ(r) (ED), die Laplacefunktion ∇2ρ(r) (zweite Ableitung von ρ(r)) und die Elliptizität ϵ am bindungskritischen Punkt (BCP). Die Beschaffenheit der S-N-Bindung ist von besonderem Interesse, vor allem in Hinblick auf den Einfach- und Doppelbindungscharakter sowie die Polarität. Außerdem ist die ED-Verteilung um das zentrale Schwefelatom sehr interessant, da sie eine Schlüsselgröße des Liganden ist, der zu SMMs führt.
Verbindung |
Bindung |
ρ(rBCP) [e Å−3] |
∇2ρ(rBCP) [e Å−5] |
dBP [Å] |
dBCP-A1 [Å] |
dBCP-A2 [Å] |
ϵ |
Lit. |
|---|---|---|---|---|---|---|---|---|
H2S(NtBu)4 (1) |
S1-N1(H) |
1.808(6) |
−14.8(3) |
1.64860(15) |
0.805(3) |
0.843(2) |
0.43 |
diese Arbeit |
|
S1-N2 |
2.173(4) |
−21.2(3) |
1.5429(2) |
0.740(2) |
0.789(3) |
0.32 |
|
S(NtBu)3 (2) |
S1-N1 |
2.27(3) |
−10.56(8) |
1.513 |
0.738 |
0.775 |
0.22 |
|
S(NtBu)2 (3) |
S1-N1 |
1.93(3) |
−9.44(8) |
1.546 |
0.681 |
0.865 |
0.07 |
|
|
S1-N2 |
2.24(3) |
−9.38(7) |
1.531 |
0.788 |
0.743 |
0.07 |
|
CH2{S(NtBu)2(NHtBu)}2 (4) |
S1-N1(H) |
1.89(2) |
−13.41(7) |
1.650 |
0.780 |
0.870 |
0.11 |
|
|
S1-N2 |
2.31(3) |
−16.60(9) |
1.530 |
0.718 |
0.812 |
0.10 |
|
|
S1-N3 |
2.37(3) |
−16.44(9) |
1.520 |
0.718 |
0.802 |
0.06 |
- [a] dBP: Bindungspfadlänge, dBCP-A1/2: Abstand des BCP zum Atom A1/2, ρ(rBCP): Elektronendichte am BCP, ∇2ρ(rBCP): Wert der Laplacefunktion am BCP, ϵ: Wert der Elliptizität am BCP. Die Standardabweichungen wurden mittels 20 Kreuzvalidierungssets abgeschätzt.18
Die ED am BCP gibt erste Hinweise. Ein BCP ist definiert als das lokale Minimum der Elektronendichte entlang des Bindungspfads (BP), des Pfads entlang der höchsten Ladungsdichte zwischen zwei Atomen. Ein Bindungspfad ist eine hinreichende und notwendige Bedingung für eine chemische Bindung. Es sollte allerdings betont werden, dass diese Wechselwirkung weder attraktiv26 noch eine klassische Zwei-Zentren-zwei-Elektronen-Bindung sein muss.27
Ausgewählte Eigenschaften der S-N-Bindungen von 1–4 sind in Tabelle 1 zusammengestellt. Für alle Verbindungen lässt sich feststellen, dass die Position des BCP (dBCP) in Richtung des elektropositiven Schwefelatoms verschoben ist. Dies ist ein deutlicher Hinweis auf ein elektronisch verarmtes Schwefelatom und einen polaren Bindungscharakter der S-N-Bindung. In 1 ist der BCP der Amido-S1-N1(H)-Bindung etwas weniger in Richtung des Schwefelatoms verschoben, sodass hier eine geringere Polarisierung als in der Imido-S1-N2-Bindung anzunehmen ist. Diese Beobachtung stimmt gut mit den Werten für Verbindung 4 überein, in der ebenfalls eine S1-N1(H)- neben einer S-N-Bindung vorliegt. Durch die Werte von ρ(r) und ∇2ρ(r) am BCP wird der kovalente Bindungscharakter der S-N-Bindungen bestätigt, der bereits für das Schwefeltriimid 2 und das Schwefeldiimid 3 gefunden wurde. Dennoch müssen sie als polare Einfachbindungen mit praktisch keinem Doppelbindungscharakter interpretiert werden. Die Elektronendichten an den S-N-BCPs in 1 sind nicht identisch und um 0.37 [e Å−3] höher bei der Imidobindung. Abbildung 2 zeigt den molekularen Graphen der beiden unabhängigen Bindungen. Anhand dieser Darstellung wird deutlich, dass beide Bindungspfade nicht geradlinig entlang der S-N-Kernverbindunglinie verlaufen, sondern eine deutliche Krümmung aufweisen, die für polare Bindungen symptomatisch sind.28 Auch die Elliptizität beider S-N-Bindungen ist sogar im Vergleich mit 2 und 3 ungewöhnlich hoch (0.43 bzw. 0.32). In einer unpolaren C-C-Bindung würde dieser Wert normalerweise aufgrund der π-Dichte, die ober- und unterhalb der zylindrischen σ-Bindung akkumuliert ist, mit einem Doppelbindungscharakter in Verbindung gebracht werden können. Die Situation ist hier aber eine andere: Um die hohe positive Ladung des Schwefelatoms auszugleichen, neigen sich die freien Elektronenpaare in die Bindungsregion und deformieren die ansonsten zylindrische σ-Dichte (Abbildung 3, oben). Interessanterweise liegt die Summe aller vier S-N-Bindungslängen in 1 (6.351 Å) innerhalb des Bereichs, der bereits für alle anderen [S(NtBu)4]2−-Tetraimidoanionen, unabhängig vom koordinierten Metall (von 6.343 Å für CuII bis 6.395 Å für Li/Zn) gefunden worden ist.29 Die SN4-Einheit reagiert offensichtlich flexibel auf unterschiedliche elektronische Anforderungen durch verschiedene Metallkationen, indem sich das Schwefelatom innerhalb einer ansonsten fast fixierten tetraedrischen N4-Umgebung leicht verschieben lässt.30 Diese experimentellen Ergebnisse unterstreichen somit die Annahme einer stark polaren S-N-Einfachbindung und nicht einer durch Valenzaufweitung und d-Orbitalbeteiligung gebildeten S-N-Mehrfachbindung.20 Die Analyse der Laplacefunktion in der nichtbindenden Region der Stickstoffatome bekräftigt das Argument, dass es sich bei der S-N2-Bindung nicht um eine Doppelbindung handelt. Es konnten eine Valenzschalenladungskonzentration (VSCC) in der apikalen Position des Amidstickstoffatoms N1 (∇2ρ(r)max(LP1)=−57.4 e Å−5) wie auch zwei VSCCs am Imidostickstoffatom N2 (∇2ρ(r)max(LP2)=−57.3 e Å−5, ∇2ρ(r)max(LP3)=−47.9 e Å−5, Abbildung 3, unten) gefunden werden. VSCCs in nichtbindenden Regionen deuten auf freie Elektronenpaare (LPs) hin. Die beiden VSCCs am Imido-Stickstoffatom N2 zeigen eine stark verzerrte tetraedrische Anordnung, wobei sich beide gleichermaßen zum elektropositiveren Schwefelatom neigen. Die Geometrie an N1 inklusive des LP beschreibt ein verzerrtes Tetraeder mit LP1 in der apikalen Position. Die Isoflächendarstellung von LP2 und LP3 zeigt deutlich die zum Schwefelatom hin verzerrte Elektronendichte.
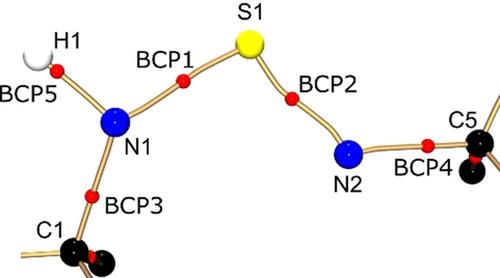
Bindungspfade (bronzefarben) und BCPs (rote Kugeln) der zentralen Einheit in 1.
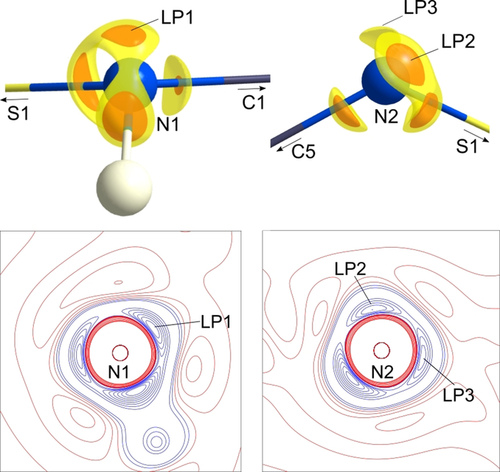
∇2ρ(r) auf einem Isolevel von −52 e Å−5 (orange) und −35 e Å−5 (gelb) an N1 und N2 in 1 (oben) und Konturdiagramme der Ladungskonzentration in der H1-N1-LP1- und LP2-N2-LP3-Ebene. Die Konturlinien sind bei ±(1, 3, 20, 25, 30, 35, 40, 45, 50, 55, 70, 100, 115, 135) e Å−5 gezeichnet, blaue Konturen zeigen negative und rote positive Werte an.
Uns ist erstmals die Synthese und Isolierung von H2S(NtBu)4 (1), einem isovalenzelektronischen Imido-Analogon der Schwefelsäure H2SO4 gelungen. Weiterhin waren wir in der Lage, dieses Lehrbuchmolekül mittels NMR-Spektroskopie und hochaufgelöster Röntgenstrukturanalyse zu charakterisieren. Eine detaillierte Analyse der experimentellen Elektronendichte mit den topologischen Parametern ρ(r), ∇2ρ(r) und ϵ beschreibt die zwei unterschiedlichen S-N-Bindungen in Verbindung 1. Es konnte festgestellt werden, dass die Amido-S-N(H)- und die Imido-S-N-Bindungen stark polarisierte Einfachbindungen sind. Die Analyse des Laplacian lässt eine nicht symmetrische, zum Schwefelatom geneigte Anordnung der VSCCs an den Stickstoffatomen erkennen. Dies und nicht der Mehrfachbindungscharakter führt zu hohen Bindungselliptizitäten. Die hohe Polarisierbarkeit ermöglicht dabei die nützliche Eigenschaft, dass sich die gesamte SN4-Einheit an die unterschiedlichen elektronischen Anforderungen verschiedener koordinierter Metalle anpassen kann.31 Diese Art der Flexibilität in Hinblick auf elektronische Ligand/Metall-Wechselwirkungen deutet auf ein vielversprechendes System für die Bildung von Einzelmolekülmagneten hin. Die zweifache N(H)-Funktionalität öffnet den Zugang zu löslichen (hetero)bimetallischen Komplexen.
Experimentelles
Synthese von H2S(NtBu)4 (1): Ein Gemisch aus [(thf)4Li2(NtBu)4S] (100.0 mg, 0.1616 mmol) und tBuNH3Cl (39.0 mg, 0.356 mmol) wurde in Tetrahydrofuran (2 mL) bei Raumtemperatur gelöst. Nach Rühren für 2 min wurde das Lösungsmittel unter reduziertem Druck entfernt. Der Rückstand wurde in n-Pentan (1 mL) gelöst, und die Lösung wurde filtriert, um LiCl zu entfernen. Das Filtrat wurde erneut eingeengt, mit MeCN (0.2 mL) gewaschen und bei −35 °C gelagert. Die Kristallisation startete innerhalb von Minuten, wobei farblose Kristalle, geeignet für die Röntgenstrukturanalyse, erhalten werden konnten. Das Produkt wurde isoliert und unter reduziertem Druck getrocknet. Ausbeute: 44.1 mg (69 %); 1H-NMR (500.13 MHz, 283 K, C6D6): δ [ppm]=1.28 (s, 18 H, 2 HNC(CH3)3), 1.51 (s, 18 H, 2 NC(CH3)3), 3.06 (s, 2 H, 2 HNC(CH3)3); 13C{1H}-NMR (125.76 MHz, 283 K, C6D6): δ [ppm]=30.6 (s, HNC(CH3)3), 32.96 (s, NC(CH3)3), 52.95 (s, NC(CH3)3), 53.81 (s, HNC(CH3)3); 15N-NMR (50.70 MHz, 283 K, C6D6): δ [ppm]=−257.41 (NC(CH3)3), −253.19 (HNC(CH3)3).
Alle Experimente wurden unter Inertgasbedingungen mit N2- oder Ar-Atmosphäre und unter Verwendung von Schlenktechniken oder in einer Ar-Trockenbox durchgeführt. Lösungsmittel wurden über Natrium oder Kalium getrocknet, vor der Verwendung destilliert und über Molekularsieb (3 Å) gelagert. Edukte wurden kommerziell erworben und ohne weitere Reinigung verwendet. [(thf)4Li2(NtBu)4S] wurde nach einer literaturbekannten Methode synthetisiert.5 NMR-Spektren wurden an einem Bruker Avance III HD 500 aufgenommen und anhand des deuterierten Lösungsmittelsignals referenziert. Der Einkristall zur hochaufgelösten Röntgenstrukturanalyse wurde unter Kühlung mithilfe des X-Temp2-Geräts ausgewählt.32 Der Datensatz wurde an einer Bruker-SRA-TXS-Mo-Drehanode mit Spiegeloptiken und einem APEX-II-Detektor mit einem D8-Goniometer aufgenommen. Die Daten wurden mit SAINTv8.38A integriert.33 Eine Multi-Scan-Absorptionskorrektur und eine 3 λ-Korrektur35 wurden mit SADABS34 durchgeführt. Die Struktur wurde mit SHELXT36 gelöst und gegen F2 mit SHELXL37 in der graphischen Benutzeroberfläche ShelXle38 verfeinert. Anschließend wurden eine Multipolverfeinerung und eine topologische Analyse mit dem XD2006-Programmpaket durchgeführt.39 Kristalldaten für 1 bei 100(2) K, Mr=318.56 g mol−1, 0.25×0.26×0.35 mm, monoklin, C2/c, a=17.133(3) Å, b=8.612(2) Å, c=15.278(2) Å, β=117.14(2)°, V=2006.1(7) Å3, Z=4, μ(Mo-Kα)=0.163 mm−1, 2θmax=90.74°, R1(F2)=0.0248, wR1(F2)=0.0273, Restdichte: 0.187 bis −0.123 e Å−3. Die Hinterlegungsnummer 2023910 erlaubt Zugriff auf die ausführlichen kristallographischen Daten zu dieser Veröffentlichung. Die Daten sind kostenlos beim Access-Structures-Service des Cambridge Crystallographic Data Centre und des Fachinformationszentrums Karlsruhe erhältlich: www.ccdc.cam.ac.uk/structures.
Acknowledgements
D. S. dankt der Deutschen Forschungsgemeinschaft für die Finanzierung (STA 334/28-1). Alle Autoren danken Ivo Leito und Märt Lõkov von der Universität Tartu für den Versuch, den pKa-Wert von 1 zu bestimmen. Open Access Veröffentlichung ermöglicht und organisiert durch Projekt DEAL.
Conflict of interest
Die Autoren erklären, dass keine Interessenkonflikte vorliegen.




