Synthese eines gegenanionstabilisierten Bis(silylium)ions
Professor Paul Knochel zum 65. Geburtstag gewidmet
Abstract
Es wird über die Darstellung eines Moleküls mit zwei alkylverknüpften Silyliumionzentren ausgehend vom entsprechenden Bis(hydrosilan) mittels zweifacher Hydridabstraktion berichtet. Die Länge der konformativ flexiblen Alkylbrücke ist entscheidend, denn sonst bleibt die Hydridabstraktion auf der Stufe eines cyclischen bissilylierten Hydroniumions stehen. Für den Fall einer Ethylenbrücke ist die offene Form der Hydroniumionzwischenstufe energetisch zugänglich und geht eine weitere Hydridabstraktion ein. Das daraus hervorgehende Bis(silylium)ion wurde NMR-spektroskopisch und strukturell charakterisiert. Verwandte Systeme auf der Grundlage von starren Naphthalen-n,m-diylplattformen können nur dann in die Dikationen überführt werden, wenn die positiv geladenen Silyliumioneinheiten voneinander entfernt sind (1,8 gegenüber 1,5 und 2,6).
Ein gängiger Weg der Stabilisierung von Silyliumionen ist deren Lewis-Paarbildung mit σ-basischen Molekülen unter Bildung von Oniumionen.1 Unter bestimmten Voraussetzungen, d. h., ohne eine solche Lewis-Base im Reaktionsmedium, ist selbst eine Si-H-Bindung in der Lage, ein Silyliumion in Form einer 3-Zentren-2-Elektronen-Si-H-Si-Bindung zu stabilisieren (Schema 1, oben).2, 3, 4 Im intermolekularen Fall ist das eine schwache Wechselwirkung, und das Hydrosilan in diesen Hydroniumionen wird normalerweise durch den als Lösungsmittel verwendeten Aromaten verdrängt.2 Die Situation sieht anders aus, wenn eine angebundene Si-H-Bindung geometrisch erreichbar ist (Schema 1, unten). Es wurden bereits mehrere cyclische Hydroniumionen beschrieben. Deren spektroskopische und kristallographische Charakterisierung belegte, dass diese in dem Sinne frei vorliegen, dass weder das Lösungsmittel noch das Gegenanion an eines der beiden Siliciumatome koordiniert.3
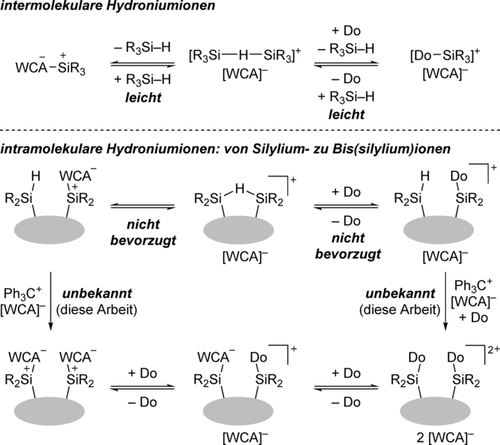
Inter- und intramolekulare Hydroniumionen sowie die Erzeugung von Bis(silylium)ionen ausgehend von solchen cyclischen Systemen. WCA=schwach koordinierendes Anion. Do=Donor, typischerweise ein Lösungsmittelmolekül.
Diese Systeme sind sogar ziemlich stabil, und die Abstraktion eines weiteren Hydrids mit dem Tritylsalz Ph3C[B(C6F5)4] hin zum Bis(silylium)ion ist, wenn überhaupt, nur langsam. Ein wahrscheinlicher Grund ist, dass die an der besagten 3-Zentren-2-Elektronen-Bindung beteiligte Si-H-Bindung stereoelektronisch nicht verfügbar ist. Ein Versuch von Müller und Mitarbeitern ermöglichte die Isolierung einer solchen Spezies nicht (Schema 2, oben).3c Das anvisierte Dikation war zu reaktiv und zersetzte das Boratgegenanion sofort. Die räumliche Nähe der beiden kationischen Zentren an der starren Naphthalen-1,8-diylplattform ist vermutlich Teil des Problems. Müller hatte zuvor über ein weiteres Sechsringsystem mit einem aliphatischen Rückgrat berichtet (Schema 2, unten).3a Wir gingen davon aus, dass kleinere oder aufgeweitete Ringgrößen für die Bildung der Si-H-Si-Einheit weniger günstig wären (grauer Kasten), was eine donorvermittelte Ringöffnung und damit letztlich eine leichte Hydridabstraktion ermöglichen könnte (Schema 1, unten). Der aliphatische Linker könnte das Dikation zugleich mit der notwendigen konformativen Flexibilität ausstatten, um die positiven Ladungen unterzubringen und sich an die Lewis-Paarbildung mit sperrigen Donormolekülen anzupassen. Wir stellen hier die Synthese eines Bis(silylium)ions vor, womit der Anfang für eine neue Klasse zweizähniger5 Siliciumsuperelektrophile6 mit Anwendungsmöglichkeiten in der Katalyse7 oder als Rezeptoren gemacht wird.8
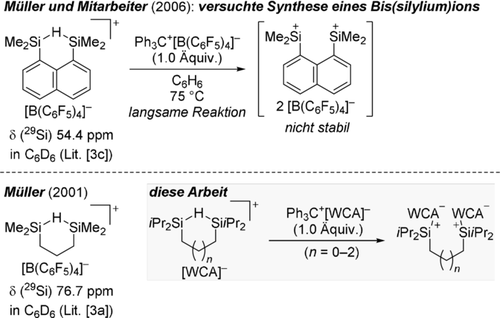
Versuchte und geplante Synthese von gegenanionstabilisierten Bis(silylium)ionen.
Die Wahl der Substituenten am Siliciumatom ist für die erfolgreiche Erzeugung von heteroleptischen Silyliumionen kritisch, da Umverteilungsreaktionen von Substituenten oft zu komplexen Mischungen führen.9 Die für diese Untersuchungen erforderlichen alkylsubstituierten Vorstufen sind von Natur aus mit diesem Problem behaftet, aber Isopropyl- und tert-Butylgruppen erschweren solche Prozesse für gewöhnlich.9c, 9d Aus diesem Grund entschieden wir uns für die Bis(hydrosilane) 1–3 mit iPr2Si-Einheiten (Schema 3, oben); deren einfache Darstellung ist in den Hintergrundinformationen zusammengefasst. Die chemische Stabilität des Gegenanions ist in der Chemie von Silyliumionen von größter Bedeutung.10 Das zuvor von Müller eingesetzte [B(C6F5)4]− ist für die gegebene Aufgabe ungeeignet.3c, 11 Unsere Wahl fiel auf [CHB11Cl11]−,12 welches zu den am wenigsten koordinierenden und widerstandsfähigsten Carboratgegenanionen zählt.10, 13 Die Reaktion der Vorläufer 1–3 mit dem entsprechenden Tritylsalz Ph3C[CHB11Cl11] in C6D6 ergab eine zweiphasige Suspension, die die Silyliumionen 4+–6+ enthielt (Schema 3, oben). Die Phasen wurden für die weitere Charakterisierung getrennt, und der Rückstand wurde mit ein paar Tropfen C6D6 und n-Pentan gewaschen. Der Rest wurde dann vollständig in 1,2-C6D4Cl2 gelöst, und die homogene Lösung wurde mittels NMR-Spektroskopie analysiert (Schema 3). Die direkte Durchführung dieser Reaktionen in 1,2-C6D4Cl2 war bei weitem nicht so sauber.
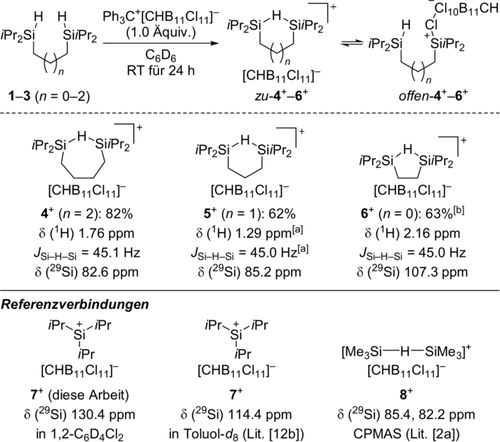
Synthese und NMR-spektroskopische Charakterisierung von cyclischen Hydroniumionen. Falls nicht anders erwähnt, wurden die NMR-Spektren in 1,2-C6D4Cl2 aufgenommen. CPMAS=Kreuzpolarisation und Rotation im magischen Winkel. [a] Bestimmt mit einem 1H/29Si-1D-CLIP-HSQMBC-NMR-Experiment. [b] Die Molekülstruktur von zu-6+ wurde mittels Röntgenbeugung ermittelt, die Qualität ist für eine Veröffentlichung jedoch nicht ausreichend (siehe die Hintergrundinformationen). Die CIF-Datei wurde beim Cambridge Crystallographic Data Centre als eine persönliche Mitteilung hinterlegt (CCDC 1990361).
Die gemessenen 29Si-NMR-Daten wurden mit denen für eigens hergestelltes iPr3Si+ (7+)12b und das bekannte [(Me3Si)2(μ-H)]+ (8+)2a jeweils mit [CHB11Cl11]− als Gegenanion verglichen (Schema 3, unten). Die chemischen Verschiebungen der Silyliumionen 4+ und 5+ mit einer Butylen- (n=2) oder einer Propylenverknüpfung (n=1) ähnelten denen von Reed's acyclischem Hydroniumion 8+[2a] (δ(29Si) ca. 84 ppm) und Müller's System (vgl. Schema 2, unten).3a Daraus schlussfolgerten wir, dass diese am besten als die cyclischen Systeme zu-4+ bzw. zu-5+ formuliert werden. Im Gegensatz dazu waren die Siliciumatome im ethylenverknüpften Silyliumion 6+ (n=0) mit δ(29Si)=107.3 ppm deutlich entschirmter. Dieser Wert liegt zwischen jenen für die verwandten Hydroniumionen und δ(29Si)=130.4 ppm für iPr3Si[CHB11Cl11] (7+) in 1,2-C6D4Cl2 und könnte damit ein gemitteltes Resonanzsignal sein. Um zu erfahren, ob das auf ein Gleichgewicht zwischen geschlossenen und gegenanion- oder lösungsmittelstabilisierten offenen Formen von 6+ zurückgeht, führten wir theoretische Rechnungen auf dem Niveau B3LYP-D3(BJ)/cc-PVTZ+(PCM, Benzol)//B3LYP-D3(BJ)/6-31G(d,p)+(PCM, Benzol) durch.14, 15, 16 Ganz allgemein zeigten diese Berechnungen, dass von jenen drei Formen die geschlossene das energetische Minimum ist, während die Lösungsmitteladdukte der offenen Formen energiereicher als die des Gegenanions sind (C6H6 oder 1,2-C6H4Cl2 gegenüber [CHB11Cl11]−). Wichtig ist, dass nur zwischen zu-6+ und offen-6+ ein geringer Unterschied in der freien Energie gefunden wurde (ΔG=1.3 kcal mol−1). Das bedeutet, dass die gegenanionstabilisierte offene Form von 6+ in Benzollösung energetisch zugänglich ist. Umgekehrt existieren offen-4+ und offen-5+ nicht in Lösung (ΔG=3.9 bzw. 5.5 kcal mol−1). Dieser Trend trat auch, aber noch ausgeprägter für das NMR-Lösungsmittel 1,2-C6D4Cl2 auf (ΔG=8.1 für 4+, 9.4 für 5+ und 4.7 kcal mol−1 für 6+). Das stimmt mit temperaturabhängigen NMR-Messungen überein, die keinen Hinweis auf eine Änderung des Stabilisierungsmodus gaben (nur geschlossene Formen). Die berechneten NMR-Verschiebungen passen zu den experimentell gefundenen (siehe die Hintergrundinformationen).
Auf der Grundlage obiger Beweisführung sagten wir voraus, dass ethylenverbrücktes 6+ eher eine weitere Hydridabstraktion eingehen wird als 4+ und 5+ mit längeren Alkylbrücken. Tatsächlich reagierten 4+ und 5+ nicht mehr mit Ph3C[CHB11Cl11]. Die Reaktion von 6+ mit dem Tritylsalz war jedoch extrem langsam und lieferte das gewünschte Bis(silylium)ion 92+ in kleinen Mengen zusammen mit Nebenprodukten (Schema 4). Die direkte Umsetzung von Bis(hydrosilan) 3 mit 2.0 Äquiv. an Ph3C[CHB11Cl11] hingegen ergab das Dikation 92+ in 78 % Ausbeute (grauer Kasten). Wir erklären diesen drastischen Unterschied mit der geringen Löslichkeit der Reaktanden in C6D6; präformiertes, festes 6+ ist weniger geneigt, eine Hydridabstraktion einzugehen, als vor Ort gebildetes, gelöstes 6+.17 Das neue Bis(silylium)ion wurde vollständig mittels NMR-Spektroskopie charakterisiert, und seine Molekülstruktur wurde durch Röntgenbeugung an einem Einkristall ermittelt (Abbildung 1).18 Anders als beim schon bekannten lösungsmittelstabilisierten iPr3Si+-Ion 7+ (Schema 3, unten) werden die kationischen Siliciumzentren jeweils durch eines der Chloratome des Gegenanions stabilisiert. Die anti-Konformation der koordinierten Siliciumzentren ist wahrscheinlich die Konsequenz sowohl sterischer Hinderung als auch Abstoßung der Ladungen. Der mittlere C-Si-C-Winkel ist 116.4° und damit näher an einer trigonal planaren (120.0°) als an einer tetraedrischen (109.5°) Koordinationsgeometrie. Die Si-Cl-Bindung (2.341 Å) ist länger als eine typische kovalente Si-Cl-Bindung (2.072 Å) und sogar länger als die im 1,2-C6D4Cl2-stabilisierten iPr3Si+ (7+) (2.33 Å).2a
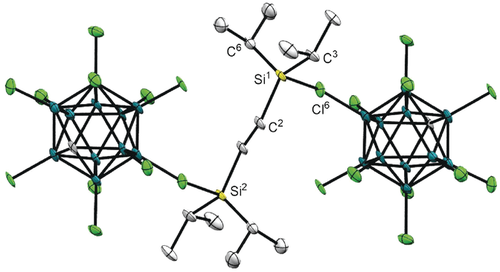
Molekülstruktur des Bis(silylium)ions 92+ (thermische Ellipsoide mit 50 % Aufenthaltswahrscheinlichkeit gezeigt; Wasserstoffatome zur besseren Übersicht nicht gezeigt). Ausgewählte Bindungslängen [Å] und -winkel [°]: Si1-Cl6 2.3411(15), Si1-C2 1.866(4), Si1-C3 1.855(5), Si1-C6 1.858(4) und C2-Si1-C3 112.68(19), C2-Si1-C6 116.25(19), C3-Si1-C6 120.2(2).
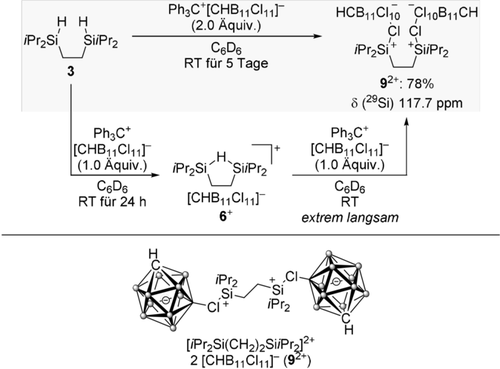
Ein- und zweistufiger Zugang zum Bis(silylium)ion.
Wir wandten uns dann einer Neuauflage der Untersuchung von Müllers Naphthalen-1,8-diylsystem zu, waren aber ebenfalls nicht in der Lage, das entsprechende Bis(silylium)ion zu erzeugen (vgl. Schema 2, oben).3c Die Vorstufe 10 wurde mit verschiedenen Tritylsalzen Ph3C[WCA] in die stabilen Hydroniumionen 11+ in hohen Ausbeuten überführt (Schema 5, oben). Die Arylsubstitution bringt typischerweise eine Hochfeldverschiebung von ungefähr Δδ(29Si)=20 ppm mit sich.9b, 9c Bezogen auf δ(29Si)=85.2 ppm für 5+ stimmt ca. δ(29Si)=63.5 ppm für 11+ unabhängig vom schwach koordinierenden Gegenanion hervorragend damit überein.
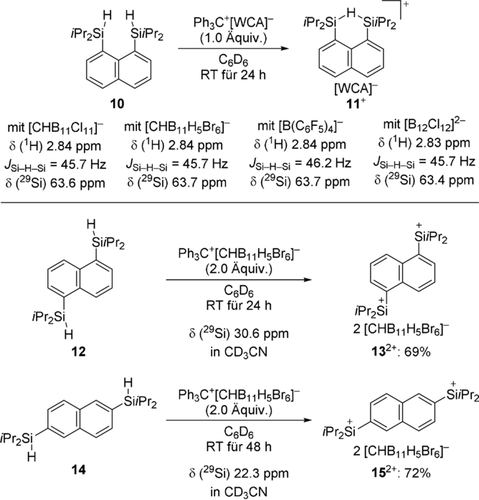
Regioisomere naphthalinbasierte Bis(hydrosilane) als Vorläufer für Bis(silylium)ionen. Falls nicht anders erwähnt, wurden die NMR-Spektren in 1,2-C6D4Cl2 aufgenommen.
Da das peri-Substitutionsmuster möglicherweise die Ausbildung einer weiteren positiven Ladung vereitelt, unterwarfen wir die regioisomeren Bis(hydrosilane) 12 und 14 der einstufigen Reaktionsvorschrift (Schema 5, unten). Wir mussten allerdings feststellen, dass das Gegenanion hier einen tiefgreifenden Effekt auf die Bildung der Dikationen dieser Regioisomere hatte; 132+ und 152+ bildeten sich nicht mit [CHB11Cl11]− als das Gegenanion. Die Reaktion von 12 und 14 mit 2.0 Äquiv. an Ph3C[CHB11H5Br6] ergab wiederum die Bis(silylium)ionen 132+ bzw. 152+ in guten Ausbeuten. Wegen ihrer schlechten Löslichkeit selbst in sehr polaren aromatischen Lösungsmitteln wurden diese Bis(silylium)ionen als ihre Acetonitriladdukte NMR-spektroskopisch charakterisiert.
Die vorliegende Arbeit zeigt auf, dass die Erzeugung der seit langem gesuchten Bis(silylium)ionen unter der Voraussetzung möglich ist, dass die zwei positiven Ladungen einander ausweichen können. Das lässt sich einerseits durch konformative Flexibilität des Verbindungsstücks zwischen diesen Zentren oder andererseits durch einen geeigneten vordefinierten Abstand in starren Systemen gewährleisten. Die Länge des flexiblen Linkers ist entscheidend, da genau das die Stabilität intermediär gebildeter, cyclischer Hydroniumionen festlegt. Für den Fall eines Ethylenglieds liegt die offene Form eines solchen Hydroniumions im Gleichgewicht vor, um in der Folge eine weitere Hydridabstraktion einzugehen. Das neue Bis(silylium)ion wurde mittels NMR-Spektroskopie und Röntgendiffraktometrie charakterisiert. Zukünftige Arbeiten werden sich mit der Anwendung dieser superelektrophilen, zweizähnigen Lewis-Säuren in der Katalyse oder als Rezeptoren befassen.5
Acknowledgements
A.R. dankt der Berlin Graduate School of Natural Sciences und Engineering für ein Doktorandenstipendium (2018–2021). Q.W. und G.W. danken der Alexander von Humboldt Stiftung (2017–2019) bzw. dem China Scholarship Council (2019–2020) für Postdoktorandenstipendien. Diese Arbeit wurde auch von der Deutschen Forschungsgemeinschaft (DFG) im Rahmen von Deutschlands Exzellenzstrategie – EXC 2008–390540038 – UniSysCat gefördert. Alle theoretischen Rechnungen wurden am Hochleistungsrechenzentrum (HPCC) der Universität Nanjing durchgeführt. Wir bedanken uns auch bei Dr. Sebastian Kemper (TU Berlin) für seine kompetente Unterstützung bei den NMR-Messungen. M.O. dankt der Einstein Stiftung Berlin für eine Stiftungsprofessur.
Conflict of interest
Die Autoren erklären, dass keine Interessenkonflikte vorliegen.




