Stereoselektive Metall-freie Synthese von β-Aminothioestern mit tertiären und quartären Stereozentren†
Dr. Annette Bahlinger
ETH Zürich, Laboratorium für Organische Chemie, D-CHAB, Wolfgang Pauli-Strasse 10, 8093 Zürich (Schweiz) http://www.wennemers.ethz.ch
Diese Autoren haben zu gleichen Teilen zu der Arbeit beigetragen.
Search for more papers by this authorDr. Sven P. Fritz
ETH Zürich, Laboratorium für Organische Chemie, D-CHAB, Wolfgang Pauli-Strasse 10, 8093 Zürich (Schweiz) http://www.wennemers.ethz.ch
Diese Autoren haben zu gleichen Teilen zu der Arbeit beigetragen.
Search for more papers by this authorCorresponding Author
Prof. Helma Wennemers
ETH Zürich, Laboratorium für Organische Chemie, D-CHAB, Wolfgang Pauli-Strasse 10, 8093 Zürich (Schweiz) http://www.wennemers.ethz.ch
ETH Zürich, Laboratorium für Organische Chemie, D-CHAB, Wolfgang Pauli-Strasse 10, 8093 Zürich (Schweiz) http://www.wennemers.ethz.chSearch for more papers by this authorDr. Annette Bahlinger
ETH Zürich, Laboratorium für Organische Chemie, D-CHAB, Wolfgang Pauli-Strasse 10, 8093 Zürich (Schweiz) http://www.wennemers.ethz.ch
Diese Autoren haben zu gleichen Teilen zu der Arbeit beigetragen.
Search for more papers by this authorDr. Sven P. Fritz
ETH Zürich, Laboratorium für Organische Chemie, D-CHAB, Wolfgang Pauli-Strasse 10, 8093 Zürich (Schweiz) http://www.wennemers.ethz.ch
Diese Autoren haben zu gleichen Teilen zu der Arbeit beigetragen.
Search for more papers by this authorCorresponding Author
Prof. Helma Wennemers
ETH Zürich, Laboratorium für Organische Chemie, D-CHAB, Wolfgang Pauli-Strasse 10, 8093 Zürich (Schweiz) http://www.wennemers.ethz.ch
ETH Zürich, Laboratorium für Organische Chemie, D-CHAB, Wolfgang Pauli-Strasse 10, 8093 Zürich (Schweiz) http://www.wennemers.ethz.chSearch for more papers by this authorS.P.F. dankt der Deutschen Forschungsgemeinschaft für ein Forschungsstipendium (FR3418/1-1). Wir danken dem Schweizerischen Nationalfonds und Bachem für ihre Unterstützung. Dank gilt auch der Universität Basel, wo Teile dieser Arbeit ausgeführt wurden.
Abstract
β-Aminothioester sind wichtige Bausteine für die Synthese bioaktiver Moleküle. Hier wurden organokatalytische Mannich-Reaktionen entwickelt, die direkten und stereoselektiven Zugang zu β2- und β2,3,3-Aminothioestern ausgehend von simplen Bausteinen bieten. Mechanistische Untersuchungen zeigen, dass der stereochemische Verlauf der Reaktion durch die Wahl des Substrates kontrolliert wird. Die linearen Produkte, die benachbarte tertiäre und quartäre Stereozentren enthalten, konnten durch stereoselektive Decarboxylierung und Entschützung weiter zu β2,3-Bausteinen funktionalisiert werden. Außerdem demonstrieren wir den großen präparativen Wert der β-Aminothioester durch die Anwendung in einer Kupplungsreagens-freien Peptidsynthese.
Supporting Information
As a service to our authors and readers, this journal provides supporting information supplied by the authors. Such materials are peer reviewed and may be re-organized for online delivery, but are not copy-edited or typeset. Technical support issues arising from supporting information (other than missing files) should be addressed to the authors.
| Filename | Description |
|---|---|
| ange_201310532_sm_miscellaneous_information.pdf12.1 MB | miscellaneous_information |
Please note: The publisher is not responsible for the content or functionality of any supporting information supplied by the authors. Any queries (other than missing content) should be directed to the corresponding author for the article.
References
- 1
- 1aC. T. Walsh, R. V. O’Brien, C. Khosla, Angew. Chem. 2013, 125, 7238–7265;
10.1002/ange.201208344 Google ScholarAngew. Chem. Int. Ed. 2013, 52, 7098–7124;
- 1bA. Hill, Nat. Prod. Rep. 2006, 23, 256–320;
- 1cJ. Staunton, K. J. Weissman, Nat. Prod. Rep. 2001, 18, 380–416.
- 2
- 2aS. H. Gellman, Acc. Chem. Res. 1998, 31, 173–180;
- 2bR. P. Cheng, S. H. Gellman, W. F. DeGrado, Chem. Rev. 2001, 101, 3219–3232;
- 2cD. Seebach, J. Gardiner, Acc. Chem. Res. 2008, 41, 1366–1375.
- 3Mannich-Reaktionen von MAHTs:
- 3aA. Ricci, D. Pettersen, L. Bernardi, F. Fini, M. Fochi, R. P. Herrera, V. Sgarzani, Adv. Synth. Catal. 2007, 349, 1037–1040;
- 3bY. Pan, C. W. Kee, Z. Jiang, T. Ma, Y. Zhao, Y. Yang, H. Xue, C.-H. Tan, Chem. Eur. J. 2011, 17, 8363–8370;
- 3cN. Hara, S. Nakamura, M. Sano, R. Tamura, Y. Funahashi, N. Shibata, Chem. Eur. J. 2012, 18, 9276–9280;
- 3dF. Zhong, C. Jiang, W. Yao, L.-W. Xu, Y. Lu, Tetrahedron 2013, 54, 4333–4336.
- 4N. Utsomi, S. Kitagaki, C.-F. Barbas III, Org. Lett. 2008, 10, 3405–3408.
- 5M. C. Kohler, J. M. Yost, M. R. Garnsey, D. M. Coltart, Org. Lett. 2010, 12, 3376–3379.
- 6Beispiele von Metall-katalysierten Mannich-Reaktionen mit Thioesterenolaten:
- 6aM. Hatano, K. Moriyama, T. Maki, K. Ishihara, Angew. Chem. 2010, 122, 3911–3914;
10.1002/ange.201000824 Google ScholarAngew. Chem. Int. Ed. 2010, 49, 3823–3826;
- 6bM. Benaglia, M. Cinquini, F. Cozzi, Eur. J. Org. Chem. 2000, 563–572.
10.1002/(SICI)1099-0690(200002)2000:4<563::AID-EJOC563>3.0.CO;2-M CAS Web of Science® Google Scholar
- 7Eine aktuelle Übersicht über den stereoselektiven, katalytischen Aufbau quartärer Stereozentren in acyclischen Verbindugen: J. P. Das, I. Marek, Chem. Commun. 2011, 47, 4593–4623.
- 8F. G. Bordwell, Acc. Chem. Rev. 1988, 21, 456–463.
- 9Thioester sind mindestens 100-mal reaktiver als Oxoester: W. Yang, D. G. Drueckhammer, J. Am. Chem. Soc. 2001, 123, 11004–11009.
- 10Ausgewählte Beispiele von Reaktionen von MAHTs mit anderen Elektrophilen:
- 10aG. Lalic, A. D. Aloise, M. D. Shair, J. Am. Chem. Soc. 2003, 125, 2852–2853;
- 10bJ. Lubkoll, H. Wennemers, Angew. Chem. 2007, 119, 6965–6968;
10.1002/ange.200702187 Google ScholarAngew. Chem. Int. Ed. 2007, 46, 6841–6844;
- 10cH. Y. Bae, J. H. Sim, J.-W. Lee, B. List, C. E. Song, Angew. Chem. 2013, 125, 12365–12369; Angew. Chem. Int. Ed. 2013, 52, 12143–12147.
- 11P. Clerici, H. Wennemers, Org. Biomol. Chem. 2012, 10, 110–113.
- 12Weiterführende Berichte über Cinchona-Alkaloid-Harnstoffverbindungen:
- 12aJ. Ye, D. J. Dixon, P. S. Hynes, Chem. Commun. 2005, 4481–4483;
- 12bB. Vakulya, S. Varga, A. Csámpai, T. Soós, Org. Lett. 2005, 7, 1967–1969;
- 12cS. H. McCooey, S. J. Connon, Angew. Chem. 2005, 117, 6525–6528;
10.1002/ange.200501721 Google ScholarAngew. Chem. Int. Ed. 2005, 44, 6367–6370;
- 12dB.-J. Li, L. Jiang, M. Liu, Y.-C. Chen, L.-S. Ding, Y. Wu, Synlett 2005, 603–606; Übersichten:
- 12eS. J. Connon, Synlett 2009, 354–376;
- 12fW.-Y. Siau, J. Wang, Catal. Sci. Technol. 2011, 1, 1298–1310.
- 131 Mol-% Katalysator war ausreichend, um das Produkt in guter Ausbeute und mit einer Enantioselektivität von 97 % ee zu erhalten; allerdings war die Diastereoselektivität niedriger (15:1), und die Reaktionszeit betrug mehr als einen Tag.
- 14Die analytischen Daten der anderen Additionsprodukte sind vergleichbar mit denen von 3 e und 4 e (siehe Hintergrundinformationen).
- 15Experimente mit MTMs ohne Kombination von Benzyl- und Phenylester erzielten Additionsprodukte mit niedrigeren Stereoselektivitäten.
- 16
- 16aP. R. Schreiner, A. Wittkopp, Org. Lett. 2002, 4, 217–220;
- 16bM. C. Etter, Z. Urbanczyk-Lipkowska, S. M. Zia-Ebrahimi, T. W. Panunto, J. Am. Chem. Soc. 1990, 112, 8415–8426.
- 17Die absolute Konfiguration wurde durch eine Struktur von 5 e im Kristall bestimmt. Eine plausible Erklärung für die syn-Selektivität ist Koordination des NH-Carbamats und des Thioesterenolats, gefolgt von Protonierung der sterisch weniger gehinderten Seite. Im Fall von 4 e ist der ee-Wert nach Decarboxylierung zu 5 e gleich geblieben. HPLC-Chromatogramme der übrigen anti-konfigurierten Produkte 5 zeigen entweder nur ein einziges oder zwei Signale in einem Verhältnis von ≥93:7, was nahe legt, dass die Enantiomerenüberschüsse erhalten oder nur zu einem Bruchteil geringer werden (siehe Hintergrundinformationen).
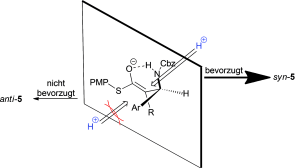
- 18Y. Kiso, K. Ukawa, T. Akita, J. Chem. Soc. Chem. Commun. 1980, 101–102.
- 19
- 19aN. S. McGrath, R. T. Raines, Acc. Chem. Res. 2011, 44, 752–761;
- 19bC. P. R. Hackenberger, D. Schwarzer, Angew. Chem. 2008, 120, 10182–10228;
10.1002/ange.200801313 Google ScholarAngew. Chem. Int. Ed. 2008, 47, 10030–10074.
- 20
- 20aS. L. Pedersen, A. P. Tofteng, L. Malik, K. J. Jensen, Chem. Soc. Rev. 2012, 41, 1826–1844;
- 20bT. Kimmerlin, D. Seebach, J. Peptide Res. 2005, 65, 229–260.
- 21
- 21aJ. K. Murray, B. Farooqi, J. D. Sadowsky, M. S. Wesley, A. Freund, L. M. Smith, J. Chen, S. H. Gellman, J. Am. Chem. Soc. 2005, 127, 13271–13280;
- 21bE. Juaristi, V. A. Soloshonok, Enantioselective Synthesis of Beta-Amino Acids, 2. Aufl., Wiley-VCH, Weinheim, 2005;
- 21cP. I. Arvidsson, J. Frackenpohl, D. Seebach, Helv. Chim. Acta 2003, 86, 1522–1553.
Citing Literature
This is the
German version
of Angewandte Chemie.
Note for articles published since 1962:
Do not cite this version alone.
Take me to the International Edition version with citable page numbers, DOI, and citation export.
We apologize for the inconvenience.




