Direktoxidation von Cycloalkanen zu Cycloalkanonen mit Sauerstoff in Wasser†
Svenja Staudt
Department Chemie und Pharmazie, Universität Erlangen-Nürnberg, Henkestraße 42, 91054 Erlangen (Deutschland)
Search for more papers by this authorEdyta Burda
Department Chemie und Pharmazie, Universität Erlangen-Nürnberg, Henkestraße 42, 91054 Erlangen (Deutschland)
Search for more papers by this authorCarolin Giese
Fakultät für Chemie, Universität Bielefeld, Universitätsstraße 25, 33615 Bielefeld (Deutschland)
Search for more papers by this authorChristina A. Müller
Lehrstuhl für Biotechnologie, RWTH Aachen, Worringerweg 1, 52074 Aachen (Deutschland)
Search for more papers by this authorDr. Jan Marienhagen
Lehrstuhl für Biotechnologie, RWTH Aachen, Worringerweg 1, 52074 Aachen (Deutschland)
Search for more papers by this authorProf. Dr. Ulrich Schwaneberg
Lehrstuhl für Biotechnologie, RWTH Aachen, Worringerweg 1, 52074 Aachen (Deutschland)
Search for more papers by this authorProf. Dr. Werner Hummel
Institut für Molekulare Enzymtechnologie der Heinrich-Heine-Universität Düsseldorf, Forschungszentrum Jülich, Stetternicher Forst, 52426 Jülich (Deutschland)
Search for more papers by this authorProf. Dr. Karlheinz Drauz
Innovation Management Chemicals, International Scientific Relations, Evonik Degussa GmbH, Rodenbacher Chaussee 4, 63457 Hanau-Wolfgang (Deutschland)
Search for more papers by this authorCorresponding Author
Prof. Dr. Harald Gröger
Department Chemie und Pharmazie, Universität Erlangen-Nürnberg, Henkestraße 42, 91054 Erlangen (Deutschland)
Fakultät für Chemie, Universität Bielefeld, Universitätsstraße 25, 33615 Bielefeld (Deutschland)
Department Chemie und Pharmazie, Universität Erlangen-Nürnberg, Henkestraße 42, 91054 Erlangen (Deutschland)===Search for more papers by this authorSvenja Staudt
Department Chemie und Pharmazie, Universität Erlangen-Nürnberg, Henkestraße 42, 91054 Erlangen (Deutschland)
Search for more papers by this authorEdyta Burda
Department Chemie und Pharmazie, Universität Erlangen-Nürnberg, Henkestraße 42, 91054 Erlangen (Deutschland)
Search for more papers by this authorCarolin Giese
Fakultät für Chemie, Universität Bielefeld, Universitätsstraße 25, 33615 Bielefeld (Deutschland)
Search for more papers by this authorChristina A. Müller
Lehrstuhl für Biotechnologie, RWTH Aachen, Worringerweg 1, 52074 Aachen (Deutschland)
Search for more papers by this authorDr. Jan Marienhagen
Lehrstuhl für Biotechnologie, RWTH Aachen, Worringerweg 1, 52074 Aachen (Deutschland)
Search for more papers by this authorProf. Dr. Ulrich Schwaneberg
Lehrstuhl für Biotechnologie, RWTH Aachen, Worringerweg 1, 52074 Aachen (Deutschland)
Search for more papers by this authorProf. Dr. Werner Hummel
Institut für Molekulare Enzymtechnologie der Heinrich-Heine-Universität Düsseldorf, Forschungszentrum Jülich, Stetternicher Forst, 52426 Jülich (Deutschland)
Search for more papers by this authorProf. Dr. Karlheinz Drauz
Innovation Management Chemicals, International Scientific Relations, Evonik Degussa GmbH, Rodenbacher Chaussee 4, 63457 Hanau-Wolfgang (Deutschland)
Search for more papers by this authorCorresponding Author
Prof. Dr. Harald Gröger
Department Chemie und Pharmazie, Universität Erlangen-Nürnberg, Henkestraße 42, 91054 Erlangen (Deutschland)
Fakultät für Chemie, Universität Bielefeld, Universitätsstraße 25, 33615 Bielefeld (Deutschland)
Department Chemie und Pharmazie, Universität Erlangen-Nürnberg, Henkestraße 42, 91054 Erlangen (Deutschland)===Search for more papers by this authorFür die großzügige Unterstützung und Förderung dieser Arbeit im Rahmen des Sonderforschungsbereichs SFB583 “Redoxaktive Metallkomplexe” sei der Deutschen Forschungsgemeinschaft (DFG) gedankt. E.B. dankt der Graduate School of Molecular Science der Universität Erlangen-Nürnberg für die Unterstützung ihrer Forschungsarbeiten.
Graphical Abstract
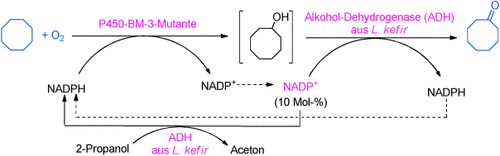
Es braucht nicht viel, um Cycloalkane direkt zu den entsprechenden cyclischen Ketonen zu oxidieren: molekularen Sauerstoff als Oxidationsmittel, Wasser als Lösungsmittel, den Cofaktor NADP+ (und ein wenig 2-Propanol zu dessen Reduktion) sowie zwei katalytische Enzyme – eine hydroxylierende P450-Monooxygenase und eine Alkohol-Dehydrogenase (siehe Schema).
References
- 1Als “Dream Reactions” werden nachhaltige Synthesemethoden mit hoher Atomökonomie und Effizienz bezeichnet. Übersichten zu nachhaltigen Synthesemethoden:
- 1aP. Anastas, J. C. Warner, Green Chemistry: Theory and Practice, Oxford University Press, Oxford, 1998;
- 1bR. A. Sheldon, I. Arends, U. Hanefeld, Green Chemistry and Catalysis, Wiley-VCH, Weinheim, 2007.
10.1002/9783527611003 Google Scholar
- 2Übersicht über die industrielle Herstellung von Bulkchemikalien: K. Weissermel, H.-J. Arpe, Industrial Organic Chemistry, 4. Aufl., Wiley-VCH, Weinheim, 2003.
10.1002/9783527619191 Google Scholar
- 3T. Schiffer, G. Oenbrink, Ullmann’s Encyclopedia of Industrial Chemistry, 6. Aufl., Elektronische Fassung, Wiley-VCH, 2000.
10.1002/14356007.a08_205 Google Scholar
- 4
- 4aJ. Teles, B. Rößler, R. Pinkos, T. Genger, T. Preiss (BASF SE), Eur. Patent EP 1663932, 2008;
- 4bJ. Teles, B. Rössler, R. Pinkos, G. Tebben, C. Müller (BASF SE), Eur. Patent EP 2041060, 2009.
- 5Vorab zu dieser Veröffentlichung wurde von einigen von uns auch eine Patentanmeldung zu diesem Konzept der Doppeloxidation (mit einigen sehr frühen, einleitenden Experimenten) eingereicht: H. Gröger, E. Burda, U. Schwaneberg, J. Marienhagen, K. Drauz (Evonik Degussa GmbH), PCT Patentanm. WO2010/070086A2, 2010.
- 6A. J. Willetts, C. J. Knowles, M. S. Levitt, S. M. Roberts, H. Sandeya, N. F. Shipston, J. Chem. Soc. Perkin Trans. 1 1991, 1608–1610.
- 7In bahnbrechenden Arbeiten der Gruppen von Adam, Schmid, Schwaneberg, Urlacher und Arnold wurde die Eignung einer P450-Monooxygenase aus Bacillus megaterium und entsprechender Mutanten für Hydroxylierungen von Alkanen und Cycloalkanen demonstriert. Ausgewählte Arbeiten:
- 7aW. Adam, Z. Lukacs, C. R. Saha-Möller, B. Weckerle, P. Schreier, Eur. J. Org. Chem. 2000, 2923–2926;
- 7bD. Appel, S. Lutz-Wahl, P. Fischer, U. Schwaneberg, R. D. Schmid, J. Biotechnol. 2001, 88, 167–171;
- 7cE. T. Farinas, U. Schwaneberg, A. Glieder, F. H. Arnold, Adv. Synth. Catal. 2001, 343, 601–606;
- 7dS. C. Maurer, H. Schulze, R. D. Schmid, V. Urlacher, Adv. Synth. Catal. 2003, 345, 802–810;
- 7eS. C. Maurer, K. Kühnel, L. A. Kaysser, S. Eiben, R. D. Schmid, V. B. Urlacher, Adv. Synth. Catal. 2005, 347, 1090–1098;
- 7fJ. Kuper, T. S. Wong, D. Roccatano, M. Wilmanns, U. Schwaneberg, J. Am. Chem. Soc. 2007, 129, 5786–5788.
- 8Übersichtsartikel:
- 8aV. B. Urlacher, R. D. Schmid, Curr. Opin. Chem. Biol. 2006, 10, 156–161;
- 8bV. B. Urlacher, S. Eiben, Trends Biotechnol. 2006, 24, 324–330;
- 8cV. B. Urlacher, M. Girhard in Enzyme Catalysis in Organic Synthesis, Band 3, 3. Aufl. (Hrsg.: ), Wiley-VCH, Weinheim, 2012, Kap. 30, S. 1227–1267;
- 8dR. Fasan, ACS Catal. 2012, 2, 647–666.
- 9Übersichten mit industriellen Beispielen enzymatischer Oxidationen:
- 9aA. Liese, K. Seelbach, C. Wandrey, Industrial Biotransformations, 2. Aufl., Wiley-VCH, Weinheim, 2006;
10.1002/3527608184 Google Scholar
- 9bU. T. Bornscheuer, G. W. Huisman, R. J. Kazlauskas, S. Lutz, J. C. Moore, K. Robins, Nature 2012, 485, 185–194.
- 10E. Weber, A. Seifert, M. Antonovici, C. Geinitz, J. Pleiss, V. B. Urlacher, Chem. Commun. 2011, 47, 944–946.
- 11M. Bordeaux, A. Galarneau, F. Fajula, J. Drone, Angew. Chem. 2011, 123, 2123–2127; Angew. Chem. Int. Ed. 2011, 50, 2075–2079.
- 12R. Fasan, Y. T. Meharenna, C. D. Snow, T. L. Poulos, F. H. Arnold, J. Mol. Biol. 2008, 383, 1069–1080.
- 13F. E. Zilly, J. P. Acevedo, W. Augustyniak, A. Deege, U. W. Häusig, M. T. Reetz, Angew. Chem. 2011, 123, 2772–2776; Angew. Chem. Int. Ed. 2011, 50, 2720–2724.
- 14R. Fasan, M. M. Chen, N. C. Crook, F. H. Arnold, Angew. Chem. 2007, 119, 8566–8570;
10.1002/ange.200702616 Google ScholarAngew. Chem. Int. Ed. 2007, 46, 8414–8418.
- 15S. Staudt, C. A. Müller, J. Marienhagen, C. Böing, S. Buchholz, U. Schwaneberg, H. Gröger, Beilstein J. Org. Chem. 2012, 8, 186–191.
- 16Zudem zeigte sich diese Mutante, bei der in Position 87 L-Phenylalanin durch L-Valin ersetzt wurde, in früheren Arbeiten bereits als vorteilhaft bei folgenden weiteren Anwendungen:
- 16aUmwandlung der P450-Monoxygenase BM-3 in eine regio- und stereoselektive Arachidonsäure-Epoxygenase: S. Graham-Lorence, G. Truan, J. A. Peterson, J. R. Falck, S. Wei, C. Helvig, J. H. Capdevila, J. Biol. Chem. 1997, 272, 1127–1135;
- 16bHydroxylierung von aromatischen Substraten mit gesteigerter Enzymaktivität: W. T. Sulistyaningdyah, J. Ogawa, Q.-S. Li, C. Maeda, Y. Yano, R. D. Schmid, S. Shimizu, Appl. Microbiol. Biotechnol. 2005, 67, 556–562.
- 17Zur Herstellung der R-Alkoholdehydrogenase aus Lactobacillus kefir: A. Weckbecker, W. Hummel, Biocatal. Biotransform. 2006, 24, 380–389.
- 18Ausgewählte Beispiele für Anwendungen der R-Alkoholdehydrogenase aus Lactobacillus kefir in der asymmetrischen Ketonreduktion:
- 18aC. W. Bradshaw, W. Hummel, C.-H. Wong, J. Org. Chem. 1992, 57, 1532–1536;
- 18bH. Gröger, F. Chamouleau, N. Orologas, C. Rollmann, K. Drauz, W. Hummel, A. Weckbecker, O. May, Angew. Chem. 2006, 118, 5806–5809;
10.1002/ange.200503394 Google ScholarAngew. Chem. Int. Ed. 2006, 45, 5677–5681.
- 19Alternativ kann auch direkt NADPH eingesetzt werden, wobei hier leicht verminderte Produktbildungen erhalten wurden: S. Staudt, E. Burda, C. Giese, H. Gröger, unveröffentlichte Ergebnisse. Eine Erklärung für die höhere Produktbildung in Anwesenheit der (geringen) 2-Propanol-Mengen von 0.25 Vol.-% könnte sein, dass dadurch Verluste an NADPH infolge der bekannten ungewünschten Nebenreaktion von P450-Monooxygenasen (NADPH-Verbrauch unter Bildung von H2O2 und NADP+; diese NADPH-Verluste können durch die so genannte “coupling efficiency” auch beschrieben und quantifiziert werden) durch die Regenerierung von NADPH mit 2-Propanol kompensiert werden können.
- 20Bei Verwendung von 10 Mol-% an Cofaktor als (hohe) “Standardmenge” wurden bezogen auf den Cofaktor nur niedrige Umsatzzahlen (Cofaktor-bezogene TON) von <1 erhalten, während beim Einsatz von 1 Mol-% Cofaktor diese Umsatzzahl bereits bei >1 liegt (Cofaktor-bezogene TON mit Cyclodecan als Substrat: 2). Die weitere Optimierung der Cofaktormenge und Erhöhung der Cofaktor-bezogenen TON ist Gegenstand aktueller Arbeiten zur Prozessentwicklung.
- 21In diesem Versuch wurde direkt der Cofaktor NADPH eingesetzt, während in den anderen, in Tabelle 1 und Schema 5 dargestellten Versuchen, dieser in situ aus NADP+ und 2-Propanol für die einleitende Hydroxylierung erzeugt wurde.
Citing Literature
This is the
German version
of Angewandte Chemie.
Note for articles published since 1962:
Do not cite this version alone.
Take me to the International Edition version with citable page numbers, DOI, and citation export.
We apologize for the inconvenience.