Eine asymmetrische organokatalytische Domino-Michael-Aldol- Reaktion: enantioselektiver Zugang zu chiralen Cycloheptanonen, Tetrahydrochromenonen und polyfunktionalisierten Bicyclo[3.2.1]octanen†
Magnus Rueping Prof. Dr.
Institut für Organische Chemie, RWTH Aachen, Landoltweg 1, 52056 Aachen (Deutschland), Fax: (+49) 241-809-2127
Search for more papers by this authorAlexander Kuenkel Dipl.-Chem.
Institut für Organische Chemie, RWTH Aachen, Landoltweg 1, 52056 Aachen (Deutschland), Fax: (+49) 241-809-2127
Search for more papers by this authorFrancisco Tato Dr.
Institut für Organische Chemie, RWTH Aachen, Landoltweg 1, 52056 Aachen (Deutschland), Fax: (+49) 241-809-2127
Search for more papers by this authorJan W. Bats Dr.
Institut für Organische Chemie und Chemische Biologie, Universität Frankfurt, Frankfurt am Main (Deutschland)
Search for more papers by this authorMagnus Rueping Prof. Dr.
Institut für Organische Chemie, RWTH Aachen, Landoltweg 1, 52056 Aachen (Deutschland), Fax: (+49) 241-809-2127
Search for more papers by this authorAlexander Kuenkel Dipl.-Chem.
Institut für Organische Chemie, RWTH Aachen, Landoltweg 1, 52056 Aachen (Deutschland), Fax: (+49) 241-809-2127
Search for more papers by this authorFrancisco Tato Dr.
Institut für Organische Chemie, RWTH Aachen, Landoltweg 1, 52056 Aachen (Deutschland), Fax: (+49) 241-809-2127
Search for more papers by this authorJan W. Bats Dr.
Institut für Organische Chemie und Chemische Biologie, Universität Frankfurt, Frankfurt am Main (Deutschland)
Search for more papers by this authorWir danken Evonik Degussa und der Deutschen Forschungsgemeinschaft (Schwerpunktprogramm Organokatalyse) für die finanzielle Unterstützung sowie dem Fonds der Chemischen Industrie für ein Stipendium für A.K.
Abstract
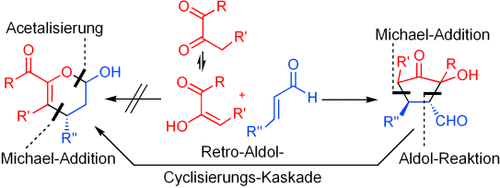
1,2-Dione im Blick: Eine neue diastereo- und enantioselektive Lewis-Base-katalysierte Domino-Michael-Aldol-Reaktion setzt α,β-ungesättigte Aldehyde mit 1,2-Dionen zu chiralen Bicyclo[3.2.1]octan-6-carbaldehyden um. Die Produkte entstehen in guten Ausbeuten und exzellenten Enantioselektivitäten (90–98 % ee) und können weiter in bicyclische Diole und Triole überführt werden. Eine ebenfalls neuartige Retro-Aldol-Cyclisierung bietet einen einfachen Zugang zu präparativ wertvollen Tetrahydrochromenonen (siehe Schema).
Supporting Information
Detailed facts of importance to specialist readers are published as ”Supporting Information”. Such documents are peer-reviewed, but not copy-edited or typeset. They are made available as submitted by the authors.
| Filename | Description |
|---|---|
| ange_200900754_sm_miscellaneous_information.pdf2.7 MB | miscellaneous information |
Please note: The publisher is not responsible for the content or functionality of any supporting information supplied by the authors. Any queries (other than missing content) should be directed to the corresponding author for the article.
References
- 1Ausgewählte Beispiele für die Verwendung von 1,2-Dionen in der organischen Synthese:
- 1aA. F. Parsons, D. Williams, Tetrahedron 2000, 56, 7217;
- 1bC. Wolf, S. Liu, J. Am. Chem. Soc. 2006, 128, 10996;
- 1cC. W. Lindsley, D. D. Wisnoski, Y. Wang, W. H. Leister, Z. Zhao, Tetrahedron Lett. 2003, 44, 4495;
- 1dX. Li, R. Vince, Bioorg. Med. Chem. 2006, 14, 2942;
- 1eH. Maruoka, N. Kashige, F. Miake, T. Yamaguchi, Chem. Pharm. Bull. 2005, 53, 1359;
- 1fZ. Zhao, D. D. Wisnoski, S. E. Wolkenberg, W. H. Leister, Y. Wang, C. W. Lindsley, Tetrahedron Lett. 2004, 45, 4873;
- 1gE. Dubost, D. Le Nouën, J. Streith, C. Tarnus, T. Tschamber, Eur. J. Org. Chem. 2006, 610;
- 1hD. Curiel, A. Cowley, P. D. Beer, Chem. Commun. 2005, 236;
- 1iY. Ding, J. Girardet, K. L. Smith, G. Larson, B. Prigaro, V. C. H. Lai, W. Zhong, J. Z. Wu, Bioorg. Med. Chem. Lett. 2005, 15, 675;
- 1jS. Wu, A. Fluxe, J. M. Janusz, J. B. Sheffer, G. Browning, B. Blass, K. Cobum, R. Hedges, M. Murawsky, B. Fang, G. M. Fadayel, M. Hare, L. Djandjighian, Bioorg. Med. Chem. Lett. 2006, 16, 5859;
- 1kI. Held, S. Xu, H. Zipse, Synthesis 2007, 1185;
- 1lS. Liu, C. Wolf, Org. Lett. 2007, 9, 2965;
- 1mA. Svennebring, P. Nilsson, M. Larhed, J. Org. Chem. 2007, 72, 5851;
- 1nB. M. Trost, G. M. Schroeder, J. Am. Chem. Soc. 2000, 122, 3785;
- 1oV. Nair, S. Vellalath, M. Poonoth, R. Mohan, E. Suresh, Org. Lett. 2006, 8, 507;
- 1pT. Schuster, M. Bauch, G. Dürner, M. Göbel, Org. Lett. 2000, 2, 179.
- 2
- 2aM. Rueping, E. Sugiono, E. Merino, Angew. Chem. 2008, 120, 3089;
10.1002/ange.200705110 Google ScholarAngew. Chem. Int. Ed. 2008, 47, 3046;
- 2bM. Rueping, E. Sugiono, E. Merino, Chem. Eur. J. 2008, 14, 6329;
- 2cM. Rueping, E. Merino, E. Sugiono, Adv. Synth. Catal. 2008, 350, 2127.
- 3Verwendung von 1,2-Dionen als Elektrophile in einer organokatalytischen Aldolreaktion: S. Samanta, C. Zhao, Tetrahedron Lett. 2006, 47, 3383.
- 4
- 4aM. Utaka, Y. Fujii, A. Takeda, Chem. Lett. 1985, 1123;
- 4bH. O. House, B. M. Trost, R. W. Magin, R. G. Carlson, R. W. Franck, G. H. Rasmusson, J. Org. Chem. 1965, 30, 2513;
- 4cH. Hagiwara, K. Sato, D. Nishino, T. Hoshi, T. Suzuki, M . Ando, J. Chem. Soc. Perkin Trans. 1 2001, 2946.
- 5Beispiele asymmetrischer Dominoreaktionen unter Lewis-Base-Katalyse:
- 5aT. Bui, C. F. Barbas III, Tetrahedron Lett. 2000, 41, 6951;
- 5bN. Halland, P. S. Aburel, K. A. Jørgensen, Angew. Chem. 2004, 116, 1292;
10.1002/ange.200353364 Google ScholarAngew. Chem. Int. Ed. 2004, 43, 1272;
- 5cJ. W. Yang, M. T. Hechavarria Fonsecca, B. List, J. Am. Chem. Soc. 2005, 127, 15036;
- 5dY. Huang, A. M. Walji, C. H. Larsen, D. W. C. MacMillan, J. Am. Chem. Soc. 2005, 127, 15051;
- 5eM. Marigo, T. Schulte, J. Franzén, K. A. Jørgensen, J. Am. Chem. Soc. 2005, 127, 15710;
- 5fW. Wang, H. Li, J. Wang, L. Zu, J. Am. Chem. Soc. 2006, 128, 10354;
- 5gR. K. Kunz, D. W. C. MacMillan, J. Am. Chem. Soc. 2005, 127, 3240;
- 5hM. Marigo, J. Franzén, T. B. Poulsen, W. Zhuang, K. A. Jørgensen, J. Am. Chem. Soc. 2005, 127, 6964;
- 5iS. Brandau, E. Maerten, K. A. Jørgensen, J. Am. Chem. Soc. 2006, 128, 14986;
- 5jL. Zu, H. Li, H. Xie, J. Wang, W. Jiang, Y. Tang, W. Wang, Angew. Chem. 2007, 119, 3806;
10.1002/ange.200700485 Google ScholarAngew. Chem. Int. Ed. 2007, 46, 3732;
- 5kJ. Wang, H. Li, H. Xie, L. Zu, X. Shen, W. Wang, Angew. Chem. 2007, 119, 9208; Angew. Chem. Int. Ed. 2007, 46, 9050;
- 5lH. Xie, L. Xu, H. Li, J. Wang, W. Wang, J. Am. Chem. Soc. 2007, 129, 10886;
- 5mR. Rios, J. Vesely, H. Sundén, G. Zhao, P. Dziedzic, A. Córdova, Adv. Synth. Catal. 2007, 349, 1028;
- 5nH. Li, L. Zu, H. Xie, J. Wang, W. Jiang, W. Wang, Org. Lett. 2007, 9, 1833;
- 5oB. Hong, R. Y. Nimje, A. A. Sadani, J. Liao, Org. Lett. 2008, 10, 2345;
- 5pD. Enders, M. R. M. Hüttl, C. Grondal, G. Raabe, Nature 2006, 441, 861;
- 5qD. Enders, M. R. M. Hüttl, J. Runsink, G. Raabe, B. Wendt, Angew. Chem. 2007, 119, 471;
10.1002/ange.200603434 Google ScholarAngew. Chem. Int. Ed. 2007, 46, 467;
- 5rY. Hayashi, T. Okano, S. Aratake, D. Hazelard, Angew. Chem. 2007, 119, 5010; Angew. Chem. Int. Ed. 2007, 46, 4922;
- 5sJ. L. Vicario, S. Reboredo, D. Badía, L. Carrillo, Angew. Chem. 2007, 119, 5260;
10.1002/ange.200700988 Google ScholarAngew. Chem. Int. Ed. 2007, 46, 5168;
- 5tE. Reyes, H. Jiang, A. Milelli, P. Elsner, R. G. Hazell, K. A. Jørgensen, Angew. Chem. 2007, 119, 9362;
10.1002/ange.200704454 Google ScholarAngew. Chem. Int. Ed. 2007, 46, 9202;
- 5uD. Hazelard, H. Ishikawa, D. Hashizume, H. Koshino, Y. Hayashi, Org. Lett. 2008, 10, 1445;
- 5vO. Penon, A. Carlone, A. Mazzanti, M. Locatelli, L. Sambri, G. Bartoli, P. Melchiorre, Chem. Eur. J. 2008, 14, 4788;
- 5wD. Enders, C. Wang, J. W. Bats, Angew. Chem. 2008, 120, 7649;
10.1002/ange.200802532 Google ScholarAngew. Chem. Int. Ed. 2008, 47, 7539;
- 5xS. Bertelsen, R. L. Johansen, K. A. Jørgensen, Chem. Commun. 2008, 3018.
- 6Übersichtsartikel über Dominoreaktionen:
- 6aL. F. Tietze, Chem. Rev. 1996, 96, 115;
- 6bJ. Wasilke, S. J. Obrey, R. T. Baker, G. C. Bazan, Chem. Rev. 2005, 105, 1001;
- 6cD. J. Ramón, M. Yus, Angew. Chem. 2005, 117, 1628;
10.1002/ange.200460548 Google ScholarAngew. Chem. Int. Ed. 2005, 44, 1602;
- 6dJ. Zhu, H. Benaymé, Multicomponent Reactions, Wiley-VCH, Weinheim, 2005;
10.1002/3527605118 Google Scholar
- 6eL. F. Tietze, G. Brasche, K. Gericke, Domino Reactions in Organic Synthesis, Wiley-VCH, Weinheim, 2006;
10.1002/9783527609925 Google Scholar
- 6fH. Guo, J. Ma, Angew. Chem. 2006, 118, 362; Angew. Chem. Int. Ed. 2006, 45, 354;
- 6gH. Pellissier, Tetrahedron 2006, 62, 2143;
- 6hK. C. Nicolaou, D. J. Edmonds, P. G. Bulger, Angew. Chem. 2006, 118, 7292;
10.1002/ange.200601872 Google ScholarAngew. Chem. Int. Ed. 2006, 45, 7134;
- 6iC. J. Chapman, C. G. Frost, Synthesis 2007, 1.
- 7Übersichtsartikel über organokatalytische Dominoreaktionen:
- 7aD. Enders, C. Grondal, M. R. M. Hüttl, Angew. Chem. 2007, 119, 1590;
10.1002/ange.200603129 Google ScholarAngew. Chem. Int. Ed. 2007, 46, 1570;
- 7bX. Yu, W. Wang, Org. Biomol. Chem. 2008, 6, 2037.
- 8Ausgewählte Beispiele unserer Gruppe:
- 8aM. Rueping, T. Theissmann, A. P. Antonchick, Synlett 2006, 1071;
- 8bM. Rueping, A. P. Antonchick, T. Theissmann, Angew. Chem. 2006, 118, 3765;
10.1002/ange.200600191 Google ScholarAngew. Chem. Int. Ed. 2006, 45, 3683;
- 8cM. Rueping, C. Azap, Angew. Chem. 2006, 118, 7996;
10.1002/ange.200603199 Google ScholarAngew. Chem. Int. Ed. 2006, 45, 7832;
- 8dM. Rueping, A. P. Antonchick, Angew. Chem. 2007, 119, 4646;
10.1002/ange.200701158 Google ScholarAngew. Chem. Int. Ed. 2007, 46, 4562;
- 8eM. Rueping, A. P. Antonchick, C. Brinkmann, Angew. Chem. 2007, 119, 7027;
10.1002/ange.200702439 Google ScholarAngew. Chem. Int. Ed. 2007, 46, 6903;
- 8fM. Rueping, B. J. Nachtsheim, S. A. Moreth, M. Bolte, Angew. Chem. 2008, 120, 603;
10.1002/ange.200703668 Google ScholarAngew. Chem. Int. Ed. 2008, 47, 593;
- 8gM. Rueping, T. Theissmann, S. Raja, J. W. Bats, Adv. Synth. Catal. 2008, 350, 1001;
- 8hM. Rueping, A. P. Antonchick, Angew. Chem. 2008, 120, 5920;
10.1002/ange.200801435 Google ScholarAngew. Chem. Int. Ed. 2008, 47, 5836;
- 8iM. Rueping, A. P. Antonchick, Angew. Chem. 2008, 120, 10244; Angew. Chem. Int. Ed. 2008, 47, 10090;
- 8jM. Rueping, W. Ieawsuwan, Adv. Synth. Catal. 2009, 351, 78.
- 9Für interessante Einblicke in die Struktur von Enamin- und Iminiumsalzen, siehe
- 9aD. Seebach, A. K. Beck, D. M. Badine, M. Limbach, A. Eschenmoser, A. M. Treasurywala, R. Hobi, W. Prikoszovich, B. Lindner, Helv. Chim. Acta 2007, 90, 425;
- 9bD. Seebach, A. K. Beck, D. M. Badine, M. Limbach, A. Eschenmoser, A. M. Treasurywala, R. Hobi, Helv. Chim. Acta 2007, 90, 1999;
- 9cU. Groselj, W. B. Schweizer, M.-O. Ebert, D. Seebach, Helv. Chim. Acta 2009, 92, 1.
- 10I. Pérez-Castro, O. Caamaño, M. D. García, F. Fernández, C. López, Synthesis 2007, 1385.
- 11Beispiele für Retro-Aldolreaktionen:
- 11aK. Murakami, H. Ohmiya, H. Yorimitsu, K. Oshima, Tetrahedron Lett. 2008, 49, 2388;
- 11bD. Gangani Niyaduropola, I. R. Davies, R. Wisedale, S. D. Bull, Eur. J. Org. Chem. 2007, 5487;
- 11cK. Oisaki, D. Zhao, M. Kanai, M. Shibasaki, J. Am. Chem. Soc. 2007, 129, 7439;
- 11dA. Stelmakh, T. Stellfeld, M. Kalesse, Org. Lett. 2006, 8, 3485;
- 11eL. Peng, M. Ma, X. Zhang, S. Zhang, J. Wang, Tetrahedron Lett. 2006, 47, 8175;
- 11fM. E. Jung, S. J. Min, Tetrahedron Lett. 2004, 45, 6753;
- 11gF. Clerici, M. L. Gelmi, S. Pelligrino, T. Pilati, J. Org. Chem. 2003, 68, 5286;
- 11hK. L. Granberg, K. M. Edvinsson, K. Nilsson, Tetrahedron Lett. 1999, 40, 755;
- 11iN. Acton, A. Brossi, Helv. Chim. Acta 1980, 63, 1396.
- 12CCDC-725318 (8) und CCDC-725317 (7), CCDC-641969 enthalten die ausführlichen kristallographischen Daten zu dieser Veröffentlichung. Die Daten sind kostenlos beim Cambridge Crystallographic Data Centre über www.ccdc.cam.ac.uk/ data request/cif erhältlich.
Citing Literature
This is the
German version
of Angewandte Chemie.
Note for articles published since 1962:
Do not cite this version alone.
Take me to the International Edition version with citable page numbers, DOI, and citation export.
We apologize for the inconvenience.