Cobalt(II)-katalysierte Kreuzkupplungen von Arylkupferreagentien mit Arylbromiden oder -chloriden†
Tobias J. Korn Dipl.-Chem.
Department Chemie, Ludwig-Maximilians-Universität München, Butenandtstraße 5–13, Haus F, 81377 München, Deutschland, Fax: (+49) 89-2180-77680
Search for more papers by this authorPaul Knochel Prof. Dr.
Department Chemie, Ludwig-Maximilians-Universität München, Butenandtstraße 5–13, Haus F, 81377 München, Deutschland, Fax: (+49) 89-2180-77680
Search for more papers by this authorTobias J. Korn Dipl.-Chem.
Department Chemie, Ludwig-Maximilians-Universität München, Butenandtstraße 5–13, Haus F, 81377 München, Deutschland, Fax: (+49) 89-2180-77680
Search for more papers by this authorPaul Knochel Prof. Dr.
Department Chemie, Ludwig-Maximilians-Universität München, Butenandtstraße 5–13, Haus F, 81377 München, Deutschland, Fax: (+49) 89-2180-77680
Search for more papers by this authorWir danken dem Fonds der Chemischen Industrie, der Deutschen Forschungsgemeinschaft und den Merck Research Laboratories für die finanzielle Unterstützung. T.J.K. dankt der DFG und dem CNRS für ein Stipendium. Wir danken Chemetall und BASF für großzügige Chemikalienspenden.
Graphical Abstract
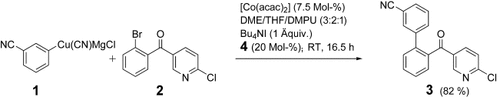
Kupferorganische Verbindungen (1), hergestellt durch Transmetallierung von funktionalisierten aromatischen Grignard-Reagentien mit CuCN⋅2 LiCl, gehen mit [Co(acac)2] als Katalysator sowie Bu4NI und 4-Fluorstyrol (4) als Additiven Kreuzkupplungen mit Arylbromiden (2) und -chloriden ein, die elektronenziehende Gruppen tragen. Dabei entstehen Biphenylderivate (3) und heterocyclische Analoga in guten Ausbeuten.
Supporting Information
Hintergrundinformationen zu diesem Beitrag sind im WWW unter http://www.wiley-vch.de/contents/jc_2001/2005/z500099_s.pdf zu finden oder können beim Autor angefordert werden.
Please note: The publisher is not responsible for the content or functionality of any supporting information supplied by the authors. Any queries (other than missing content) should be directed to the corresponding author for the article.
References
- 1
- 1a Metal-catalyzed Cross-coupling Reactions (Hrsg.: ), 2. Aufl., Wiley-VCH, Weinheim, 2004;
- 1bJ. Tsuji, Transition Metal Reagents and Catalysts: Innovations in Organic Synthesis, Wiley, Chichester, 1995;
- 1c“Cross-Coupling Reactions. A Practical Guide”: Top. Curr. Chem. 2002, 219;
- 1d Handbook of Organopalladium Chemistry for Organic Synthesis (Hrsg.: ), Wiley-Interscience, New York, 2002;
- 1e Transition Metals for Organic Synthesis (Hrsg.: ), Wiley-VCH, Weinheim, 1998.
- 2
- 2aC. Dai, G. C. Fu, J. Am. Chem. Soc. 2001, 123, 2719;
- 2bA. F. Littke, G. C. Fu, J. Am. Chem. Soc. 2001, 123, 6989;
- 2cA. F. Littke, L. Schwarz, G. C. Fu, J. Am. Chem. Soc. 2002, 124, 6343;
- 2dA. F. Littke, G. C. Fu, Angew. Chem. 2002, 114, 4350;
10.1002/1521-3757(20021115)114:22<4350::AID-ANGE4350>3.0.CO;2-0 Google ScholarAngew. Chem. Int. Ed. 2002, 41, 4176;10.1002/1521-3773(20021115)41:22<4176::AID-ANIE4176>3.0.CO;2-U CAS PubMed Web of Science® Google Scholar
- 2eI. D. Hills, M. R. Netherton, G. C. Fu, Angew. Chem. 2003, 115, 5927;
10.1002/ange.200352858 Google ScholarAngew. Chem. Int. Ed. 2003, 42, 5749;
- 2fA. C. Frisch, A. Zapf, O. Briel, B. Kayser, N. Shaikh, M. Beller, J. Mol. Catal. A 2004, 214, 231;
- 2gA. Tewari, M. Hein, A. Zapf, M. Beller, Synthesis 2004, 935;
- 2hF. Rataboul, A. Zapf, R. Jackstell, S. Harkal, T. Riermeier, A. Monsees, U. Dingerdissen, M. Beller, Chem. Eur. J. 2004, 10, 2983;
- 2iM. Kumada, Pure Appl. Chem. 1980, 52, 669;
- 2jT.-Y. Luh, Acc. Chem. Res. 1991, 24, 257;
- 2kS. Sengupta, M. Leite, D. S. Raslan, C. Quesnelle, V. Snieckus, J. Org. Chem. 1992, 57, 4066;
- 2lA. F. Indolese, Tetrahedron Lett. 1997, 38, 3513;
- 2mE. Shirakawa, K. Yamasaki, T. Hiyama, Synthesis 1998, 1544;
- 2nA. Sophia, E. Karlström, K. Itami, J.-E. Bäckvall, J. Am. Chem. Soc. 2000, 122, 6950;
- 2oJ. Montgomery, Acc. Chem. Res. 2000, 33, 467;
- 2pR. Giovaninni, P. Knochel, J. Am. Chem. Soc. 1998, 120, 11 186;
- 2qB. H. Lipshutz, Adv. Synth. Catal. 2001, 343, 313;
- 2rB. H. Lipshutz, G. Bulwo, F. Fernandez-Lazaro, S.-K. Kim, R. Lowe, P. Mollard, K. L. Stevens, J. Am. Chem. Soc. 1999, 121, 11 664.
- 3
- 3aM. Tamura, J. K. Kochi, J. Am. Chem. Soc. 1971, 93, 1487;
- 3bM. Tamura, J. K. Kochi, Synthesis 1971, 93, 303;
10.1055/s-1971-35043 Google Scholar
- 3cM. Tamura, J. K. Kochi, J. Organomet. Chem. 1971, 31, 289;
- 3dM. Tamura, J. K. Kochi, Bull. Chem. Soc. Jpn. 1971, 44, 3063;
- 3eM. Tamura, J. K. Kochi, Synthesis 1971, 303;
- 3fJ. K. Kochi, Acc. Chem. Res. 1974, 7, 351;
- 3gS. Neumann, J. K. Kochi, J. Org. Chem. 1975, 40, 599;
- 3hR. S. Smith, J. K. Kochi, J. Org. Chem. 1976, 41, 502;
- 3isiehe auch: G. Molander, B. Rahn, D. C. Shubert, S. E. Bonde, Tetrahedron Lett. 1983, 24, 5449;
- 3jG. Cahiez, S. Marquais, Pure Appl. Chem. 1996, 68, 669;
- 3kG. Cahiez, S. Marquais, Tetrahedron Lett. 1996, 37, 1773;
- 3lG. Cahiez, H. Avedissian, Synthesis 1998, 1199;
- 3mH. Shinokubo, K. Oshima, Eur. J. Org. Chem. 2004, 2081;
- 3nM. A. Fakhfakh, X. Franck, R. Hocquemiller, B. Figadère, J. Organomet. Chem. 2001, 624, 131;
- 3oM. Hocek, H. Dvoráková, J. Org. Chem. 2003, 68, 5773;
- 3pB. Hölzer, R. W. Hoffmann, Chem. Commun. 2003, 732;
- 3qW. Dohle, F. Kopp, G. Cahiez, P. Knochel, Synlett 2001, 1901;
- 3rM. Hojo, Y. Murakami, H. Aihara, R. Sakuragi, Y. Baba, A. Hosomi, Angew. Chem. 2001, 113, 641;
10.1002/1521-3757(20010202)113:3<641::AID-ANGE641>3.0.CO;2-V Google ScholarAngew. Chem. Int. Ed. 2001, 40, 621;10.1002/1521-3773(20010202)40:3<621::AID-ANIE621>3.0.CO;2-O CAS PubMed Web of Science® Google Scholar
- 3sM. Nakamura, A. Hirai, E. Nakamura, J. Am. Chem. Soc. 2001, 123, 978;
- 3tE. Alvarez, T. Cuvigny, C. H. du Penhoat, M. Julia, Tetrahedron 1998, 54, 119;
- 3uV. Finandanese, G. Marchese, V. Martina, L. Ronzini, Tetrahedron Lett. 1984, 25, 4805.
- 4I. Sapountzis, W. Lin, C. C. Kofink, C. Despotopoulou, P. Knochel, Angew. Chem. 2005, 117, 1682;
10.1002/ange.200462013 Google ScholarAngew. Chem. Int. Ed. 2005, 44, 1654.
- 5
- 5aFür einen Überblick über Eisen-katalysierte Reaktionen siehe: C. Bolm, J. Legros, J. Le Paih, L. Zani, Chem. Rev. 2004, 104, 6217;
- 5bA. Fürstner, A. Leitner, M. Méndez, H. Krause, J. Am. Chem. Soc. 2002, 124, 13 856;
- 5cA. Fürstner, A. Leitner, Angew. Chem. 2002, 114, 632; Angew. Chem. Int. Ed. 2002, 41, 609;
- 5dA. Fürstner, A. Leitner, Angew. Chem. 2003, 115, 320;
10.1002/ange.200390071 Google ScholarAngew. Chem. Int. Ed. 2003, 42, 308;
- 5eG. Seidel, D. Laurich, A. Fürstner, J. Org. Chem. 2004, 69, 3950;
- 5fB. Scheiper, M. Bonnekessel, H. Krause, A. Fürstner, J. Org. Chem. 2004, 69, 3943;
- 5gA. Fürstner, D. De Souza, L. Parra-Rapado, J. T. Jensen, Angew. Chem. 2003, 115, 5516;
10.1002/ange.200352413 Google ScholarAngew. Chem. Int. Ed. 2003, 42, 5355;
- 5hM. Nakamura, K. Matsuo, S. Ito, E. Nakamura, J. Am. Chem. Soc. 2004, 126, 3686;
- 5iT. Nagano, T. Hayashi, Org. Lett. 2004, 6, 1297;
- 5jR. Martin, A. Fürstner, Angew. Chem. 2004, 116, 4045; Angew. Chem. Int. Ed. 2004, 43, 3955;
- 5kR. B. Bedford, D. W. Bruce, R. M. Frost, J. W. Goodby, M. Hird, Chem. Commun. 2004, 2822.
- 6C. K. Reddy, P. Knochel, Angew. Chem. 1996, 108, 1812; Angew. Chem. Int. Ed. Engl. 1996, 35, 1700.
- 7T. J. Korn, G. Cahiez, P. Knochel, Synlett 2003, 1892.
- 8
- 8aH. Avedissian, L. Bérillon, G. Cahiez, P. Knochel, Tetrahedron Lett. 1998, 39, 6163;
- 8bG. Cahiez, H. Avedissian, Tetrahedron Lett. 1998, 39, 6159.
- 9
- 9aFür einen Überblick siehe: H. Shinokubo, K. Oshima, Eur. J. Org. Chem. 2004, 2081;
- 9bT. Fujioka, T. Nakamura, H. Yorimitsu, K. Oshima, Org. Lett. 2002, 4, 2257;
- 9cT. Tsuji, H. Yorimitsu, K. Oshima, Angew. Chem. 2002, 114, 4311;
10.1002/1521-3757(20021104)114:21<4311::AID-ANGE4311>3.0.CO;2-7 Google ScholarAngew. Chem. Int. Ed. 2002, 41, 4137;10.1002/1521-3773(20021104)41:21<4137::AID-ANIE4137>3.0.CO;2-0 CAS PubMed Web of Science® Google Scholar
- 9dK. Wakabayashi, H. Yorimitsu, K. Oshima, J. Am. Chem. Soc. 2001, 123, 5374;
- 9eH. Ohmiya, T. Tsuji, H. Yorimitsu, K. Oshima, Chem. Eur. J. 2004, 10, 5640;
- 9fY. Ikeda, T. Nakamura, H. Yorimitsu, K. Oshima, J. Am. Chem. Soc. 2002, 124, 6514;
- 9gK. Mizutani, H. Shinokubo, K. Oshima, Org. Lett. 2003, 5, 3959.
- 10
- 10aP. Gomes, C. Gosmini, J. Périchon, Org. Lett. 2003, 5, 1043;
- 10bP. Gomes, C. Gosmini, J. Périchon, Synthesis 2003, 1909.
- 11
- 11aB. H. Lipshutz, S. Sengupta, Org. React. 1992, 41, 135;
- 11bR. J. K. Taylor, Organocopper Reagents, Oxford University Press, Oxford, 1994;
- 11cN. Krause, Modern Organocopper Chemistry, Wiley-VCH, Weinheim, 2002.
10.1002/3527600086 Google Scholar
- 12P. Knochel, M. C. P. Yeh, S. C. Berk, J. Talbert, J. Org. Chem. 1988, 53, 2390.
- 13Nach einer Reaktionszeit von 24 h wurde ein Umsatz von nur 47 % beobachtet.
- 14
- 14aM. Piber, A. E. Jensen, M. Rottländer, P. Knochel, Org. Lett. 1999, 1, 1323;
- 14bS. W. Wright, D. L. Hageman, L. D. McClure, J. Org. Chem. 1994, 59, 6095;
- 14cJ.-F. Nguefack, V. Bollit, D. Sinou, Tetrahedron Lett. 1996, 37, 5527;
- 14dN. A. Powell, S. D. Rychnovsky, Tetrahedron Lett. 1996, 37, 7901;
- 14eK. Nakamura, H. Okubo, M. Yamaguchi, Synlett 1999, 549;
- 14fW. A. Herrmann, C. Brossmer, C.-P. Reisinger, T. H. Riermeier, K. Öfele, M. Beller, Chem. Eur. J. 1997, 3, 1357.
- 15A. E. Jensen, P. Knochel, J. Org. Chem. 2002, 67, 79.
- 16Nach 4 h Reaktionszeit bei 80 °C wurde ein Umsatz von 29 % und nach 21 h bei 80 °C ein Umsatz von 42 % beobachtet.
- 17Außer DMPU beschleunigten auch NMP (N-Methylpyrrolidinon) und DMAC (N,N-Dimethylacetamid) die Reaktion, DMPU hatte allerdings den stärksten Effekt.
Citing Literature
This is the
German version
of Angewandte Chemie.
Note for articles published since 1962:
Do not cite this version alone.
Take me to the International Edition version with citable page numbers, DOI, and citation export.
We apologize for the inconvenience.