Hochenantioselektive Diels-Alder-Reaktion eines photochemisch erzeugten o-Chinodimethans mit Olefinen†
Benjamin Grosch Dipl.-Chem.
Lehrstuhl für Organische Chemie I, Technische Universität München, Lichtenbergstraße 4, 85747 Garching, Deutschland, Fax: (+49) 89-2891-3315
Search for more papers by this authorCaroline N. Orlebar
Inorganic Chemistry Laboratory, University of Oxford, South Parks Road, Oxford OX1 3QR (Großbritannien)
Search for more papers by this authorEberhardt Herdtweck Dr.
Lehrstuhl für Anorganische Chemie, Technische Universität München, Deutschland
Search for more papers by this authorWerner Massa Prof. Dr.
Fachbereich Chemie, Philipps-Universität Marburg, Hans-Meerwein-Straße, 35032 Marburg, Deutschland
Search for more papers by this authorThorsten Bach Prof. Dr.
Lehrstuhl für Organische Chemie I, Technische Universität München, Lichtenbergstraße 4, 85747 Garching, Deutschland, Fax: (+49) 89-2891-3315
Search for more papers by this authorBenjamin Grosch Dipl.-Chem.
Lehrstuhl für Organische Chemie I, Technische Universität München, Lichtenbergstraße 4, 85747 Garching, Deutschland, Fax: (+49) 89-2891-3315
Search for more papers by this authorCaroline N. Orlebar
Inorganic Chemistry Laboratory, University of Oxford, South Parks Road, Oxford OX1 3QR (Großbritannien)
Search for more papers by this authorEberhardt Herdtweck Dr.
Lehrstuhl für Anorganische Chemie, Technische Universität München, Deutschland
Search for more papers by this authorWerner Massa Prof. Dr.
Fachbereich Chemie, Philipps-Universität Marburg, Hans-Meerwein-Straße, 35032 Marburg, Deutschland
Search for more papers by this authorThorsten Bach Prof. Dr.
Lehrstuhl für Organische Chemie I, Technische Universität München, Lichtenbergstraße 4, 85747 Garching, Deutschland, Fax: (+49) 89-2891-3315
Search for more papers by this authorDieses Projekt wurde von der Deutschen Forschungsgemeinschaft (Ba 1372-4/3) und dem Fonds der Chemischen Industrie (FCI) gefördert. B.G. dankt dem FCI für ein Kekulé-Stipendium, E.H. dankt Frau Helena Keller für ihre Mitarbeit.
Graphical Abstract
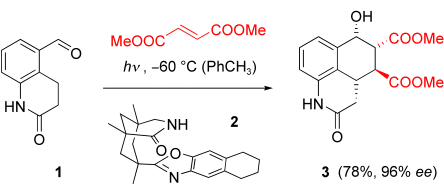
Vier stereogene Zentren auf einen Streich lassen sich mit nahezu perfekter Kontrolle der Absolut- und Relativkonfiguration in einer photochemisch induzierten Diels-Alder-Reaktion mit dem Substrat 1 aufbauen. Der Träger der chiralen Information ist dabei ein Lactam (2), das durch Wasserstoffbrücken das Substrat in einer chiralen Umgebung fixiert und so die Konfiguration der neu gebildeten stereogenen Zentren im Produkt 3 lenkt.
References
- 1Übersichten:
- 1aJ. L. Segura, N. Martin, Chem. Rev. 1999, 99, 3199–3246;
- 1bH. Nemoto, K. Fukumoto, Tetrahedron 1998, 54, 5425–5464;
- 1cJ. L. Charlton, M. M. Alauddin, Tetrahedron 1987, 43, 2873–2889;
- 1dG. Quinkert, H. Stark, Angew. Chem. 1983, 95, 651–669; Angew. Chem. Int. Ed. Engl. 1983, 22, 637–655.
- 2N. C. Yang, C. Rivas, J. Am. Chem. Soc. 1961, 83, 2213.
- 3Übersichten:
- 3aA. C. Weedon in The Chemistry of Enols (Hrsg.: ), Wiley, New York, 1990, S. 591–638;
- 3bP. G. Sammes, Tetrahedron 1976, 32, 405–422.
- 4
- 4aE. F. Zwicker, L. I. Grossweiner, N. C. Yang, J. Am. Chem. Soc. 1963, 85, 2671–2672;
- 4bG. Porter, M. F. Tchir, J. Chem. Soc. A 1971, 3772–3777;
- 4cR. Haag, J. Wirz, Helv. Chim. Acta 1977, 60, 2595–2607;
- 4dJ. Gebicki, A. Krantz, J. Chem. Soc. Perkin Trans. 1 1984, 1623–1627;
- 4eW. C. Agosta, R. A. Caldwell, J. Jay, L. J. Johnston, B. R. Venepalli, J. C. Scaiano, M. Singh, S. Wolff, J. Am. Chem. Soc. 1987, 109, 3050–3057.
- 5Beispiele:
- 5aB. J. Arnold, S. M. Mellows, P. G. Sammes, J. Chem. Soc. Perkin Trans. 1 1973, 1266–1270;
- 5bG. Quinkert, W.-D. Weber, U. Schwartz, H. Stark, H. Baier, G. Dürner, Liebigs Ann. Chem. 1981, 2335–2371;
- 5cG. Quinkert, U. Schwartz, H. Stark, W.-D. Weber, F. Adam, H. Baier, G. Frank, G. Dürner, Liebigs Ann. Chem. 1982, 1999–2040;
- 5dM. B. Glinski, T. Durst, Can. J. Chem. 1983, 61, 573–575;
- 5eD. I. Macdonald, T. Durst, J. Org. Chem. 1986, 51, 4749–4750;
- 5fJ. L. Charlton, G. L. Plourde, K. Koh, A. S. Secco, Can. J. Chem. 1989, 67, 574–579;
- 5gJ. L. Charlton, K. Koh, J. Org. Chem. 1992, 57, 1514–1516;
- 5hK. C. Nicolaou, D. Gray, Angew. Chem. 2001, 113, 783–785;
10.1002/1521-3757(20010216)113:4<783::AID-ANGE7830>3.0.CO;2-X Google ScholarAngew. Chem. Int. Ed. 2001, 40, 761–763;10.1002/1521-3773(20010216)40:4<761::AID-ANIE7610>3.0.CO;2-0 CAS PubMed Web of Science® Google Scholar
- 5iK. C. Nicolaou, D. Gray, J. Tae, Angew. Chem. 2001, 113, 3787–3790;
10.1002/1521-3757(20011001)113:19<3787::AID-ANGE3787>3.0.CO;2-M Google ScholarAngew. Chem. Int. Ed. 2001, 40, 3675–3678;10.1002/1521-3773(20011001)40:19<3675::AID-ANIE3675>3.0.CO;2-G CAS PubMed Web of Science® Google Scholar
- 5jK. C. Nicolaou, D. Gray, J. Tae, Angew. Chem. 2001, 113, 3791–3795;
10.1002/1521-3757(20011001)113:19<3791::AID-ANGE3791>3.0.CO;2-J Google ScholarAngew. Chem. Int. Ed. 2001, 40, 3679–3683.10.1002/1521-3773(20011001)40:19<3679::AID-ANIE3679>3.0.CO;2-T CAS PubMed Web of Science® Google Scholar
- 6Beispiele für die Selektivitätslenkung durch Wasserstoffbrücken in thermischen Diels-Alder-Reaktionen:
- 6aA. Wittkopp, P. R. Schreiner, Chem. Eur. J. 2003, 9, 407–414;
- 6bC. Palomo, M. Oiarbide, J. M. Garcia, A. Gonzalez, A. Lecumberri, A. Linden, J. Am. Chem. Soc. 2002, 124, 10 288–10 289;
- 6cE. J. Corey, T. W. Lee, Chem. Commun. 2001, 1321–1329;
- 6dT. Schuster, M. Kurz, M. W. Göbel, J. Org. Chem. 2000, 65, 1697–1701;
- 6eA. Robertson, D. Philp, N. Spencer, Tetrahedron 1999, 55, 11 365–11 384, zit. Lit.
- 7
- 7aL.-F. Tietze, H. Meier, E. Voß, Synthesis 1988, 274–277;
- 7bI. I. Kolodkina, K. V. Levshina, S. I. Sergievskaya, A. I. Kravchenko, Zh. Org. Khim. 1966, 2, 63–69;
- 7cM. Tominaga, E. Yo, H. Ogawa, S. Yamashita, Y. Yabuuchi, K. Nakagawa, Chem. Pharm. Bull. 1986, 34, 682–693.
- 8T. Bach, H. Bergmann, B. Grosch, K. Harms, E. Herdtweck, Synthesis 2001, 1395–1405.
- 9Repräsentative Vorschrift: Eine Lösung von Aldehyd 1 (0.29 mmol, 50 mg) und chiralem Komplexierungsreagens 3 (0.69 mmol, 241 mg) in Toluol (150 mL) wurde bei Raumtemperatur durch zwanzigminütiges Einleiten eines stetigen Argonstroms entgast und anschließend auf −60 °C abgekühlt. Im Argongegenstrom wurde Fumarsäuredimethylester (14.3 mmol, 2.1 g) zugegeben. Die Lösung wurde nach zehnminütigem Rühren über 30 min bei −60 °C bestrahlt (Lichtquelle: Hg-Hochdrucklampe Original Hanau TQ 150, Duranfilter) und anschließend auf Raumtemperatur erwärmt. Das Toluol wurde im Vakuum entfernt und das Rohprodukt säulenchromatographisch (CH2Cl2:MeOH=97:3) aufgetrennt. Isoliert wurden das Komplexierungsreagens 3 (224 mg, 93 %) sowie die Produkte exo-4 c (12 mg, 13 %) und endo-4 c (59 mg, 65 %). Ausgewählte analytische Daten für endo-4 c: 1H-NMR (360 MHz, CD3OD): δ=2.46 (dd, 2J=16.0 Hz, 3J=14.2 Hz, 1 H, CHH), 2.57 (dd, 2J=16.0 Hz, 3J=5.0 Hz, 1 H, CHH), 3.03–3.09 (m, 2 H, COCH2CHCH), 3.22 (dd, 3J=11.8 Hz, 3J=3.4 Hz, 1 H, CHOHCH), 3.34 (s, 1 H, NH), 3.75 (s, 3 H, OCH3), 3.77 (s, 3 H, OCH3), 5.07 (d, 3J=3.4 Hz, 1 H, CHOH), 6.86 (d, 3J=7.9 Hz, 1 H, CHAr), 7.08 (d, 3J=7.5 Hz, 1 H, CHAr), 7.24 ppm (virt. t, 3J ≅ 3J=7.7 Hz, 1 H, CHAr); 13C-NMR (90.6 MHz, CD3OD): δ=34.6 (CH2), 34.7, 41.8, 48.5 (CH), 50.8, 50.9 (OCH3), 66.6 (CHOH), 114.7 (CArH), 120.4 (CAr,q), 124.0, 127.7 (CArH), 135.9, 136.6 (CAr,q), 170.7, 172.0, 174.5 ppm (CO); HR-MS (EI): ber. für C16H17NO6: 319.10559, gef.: 319.10573.
- 10
- 10aT. Bach, H. Bergmann, K. Harms, Angew. Chem. 2000, 112, 2391–2393;
Angew. Chem. Int. Ed. 2000, 39, 2302–2304;
10.1002/1521-3773(20000703)39:13<2302::AID-ANIE2302>3.0.CO;2-6 CAS PubMed Web of Science® Google Scholar
- 10bT. Bach, H. Bergmann, J. Am. Chem. Soc. 2000, 122, 11 525–11 526;
- 10cT. Bach, H. Bergmann, K. Harms, Org. Lett. 2001, 3, 601–603;
- 10dT. Bach, H. Bergmann, B. Grosch, K. Harms, J. Am. Chem. Soc. 2002, 124, 7982–7990.
- 11
- 11aT. Bach, T. Aechtner, B. Neumüller, Chem. Commun. 2001, 607–608;
- 11bT. Bach, T. Aechtner, B. Neumüller, Chem. Eur. J. 2002, 8, 2464–2475;
10.1002/1521-3765(20020603)8:11<2464::AID-CHEM2464>3.0.CO;2-S CAS PubMed Web of Science® Google Scholar
- 11cT. Bach, B. Grosch, T. Strassner, E. Herdtweck, J. Org. Chem. 2003, 68, 1107–1116.
- 12Röntgenstrukturanalyse von exo-4 c: C16H17NO6, Mr=319.31; farblose Prismen (0.43×0.25×0.20 mm3); orthorhombisch, P212121 (Nr. 19), a=9.0770(1), b=9.6510(1), c=16.2439(1) Å, V=1423.00(2) Å3, Z=4, ρber.=1.490 g cm−3; F000=672; μ=0.115 mm−1; Flack-Parameter ε=−0.1(6). Die Messung erfolgte auf einem Nonius-Kappa-CCD-System (NONIUS MACH3) mit Oxford-Cryosystems-Kühlung am Fenster einer Drehanode (NONIUS FR591) und mit graphitmonochromatisierter MoKα-Strahlung (λ=0.71073 Å). 46 619 Reflexe im Bereich 2.45°<Θ<25.34° bei T=−170 °C. Nach LP- und gekoppelter Korrektur auf Absorption und Zersetzung verblieben (Rint=0.033) 2607 (2585: Io>2σ(Io)) unabhängige Reflexe. Die Struktur wurde durch eine Kombination von Direkten Methoden, Differenz-Fourier-Synthesen und Kleinste-Fehlerquadrate-Verfeinerungen mit voller Matrix gegen ∑w(Fo2−Fc2)2 gelöst. Verfeinert wurden alle “Schweratome” mit anisotropen und alle Wasserstofflagen mit individuellen isotropen Auslenkungsparametern. Die Rechnungen konvergierten bei R1=0.0222 (Io>2σ(Io)), wR2=0.0586 (alle Daten), GOF=1.071, 276 Variablen und Shift/Error <0.001. Eine abschließende Differenz-Fourier-Synthese blieb ohne Auffälligkeiten (Δemin/max=+0.17/−0.16 e Å−3). Die absolute Konfiguration, die sich im Trend bereits bei der Messung mit Mo-Strahlung abzeichnete, wurde exakt bestimmt über zehn ausgesuchte Friedel-Paare mit den signifikantesten berechneten Bijvoet-Differenzen. Mit Cu-Strahlung wurden in 20°-Stufen jeweils psi-Scans bei allen zugänglichen Winkeln vermessen (numerische Absorptionskorrektur). Bei allen zehn Paaren wurden die für die vorgegebene Konfiguration berechneten Vorzeichen durch das Experiment bestätigt. CCDC-209877 (exo-4 c) enthält die ausführlichen kristallographischen Daten zu dieser Veröffentlichung. Die Daten sind kostenlos über www.ccdc.cam.ac.uk/conts/retrieving.html erhältlich (oder können bei folgender Adresse in Großbritannien angefordert werden: Cambridge Crystallographic Data Centre, 12 Union Road, Cambridge CB2 1EZ; Fax: (+44) 1223-336-033; oder [email protected]); Data Collection Software for Nonius kappa-CCD devices, Delft (The Netherlands), 2001;
- 12aZ. Otwinowski, W. Minor, Methods Enzymol. 1997, 276, 307ff;
- 12bA. Altomare, G. Cascarano, C. Giacovazzo, A. Guagliardi, M. C. Burla, G. Polidori, M. Camalli, SIR92, J. Appl. Crystallogr. 1994, 27, 435–436;
- 12c International Tables for Crystallography, Vol. C, Tables 6.1.1.4, 4.2.6.8, and 4.2.4.2 (Hrsg.: A. J. C. Wilson), Kluwer Academic Publishers, Dordrecht (The Netherlands), 1992;
- 12dA. L. Spek, PLATON, A Multipurpose Crystallographic Tool, Universität Utrecht (Niederlande), 2001;
- 12eG. M. Sheldrick, SHELXL-97, Universität Göttingen, 1998.
- 13Wir danken Herrn Prof. Dr. S. Grimme (Universität Münster) herzlich für die Durchführung dieser Rechnungen:
- 13aR. Bauernschmitt, R. Ahlrichs, Chem. Phys. Lett. 1996, 256, 454–464;
- 13bF. Furche, R. Ahlrichs, A. Sobanski, F. Vögtle, C. Wachsman, E. Weber, S. Grimme, J. Am. Chem. Soc. 2000, 122, 1717–1724.
Citing Literature
This is the
German version
of Angewandte Chemie.
Note for articles published since 1962:
Do not cite this version alone.
Take me to the International Edition version with citable page numbers, DOI, and citation export.
We apologize for the inconvenience.