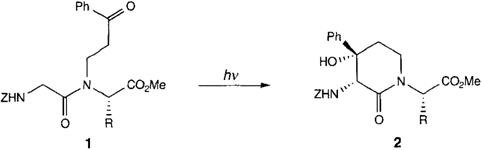
Selektive Photocyclisierung von Glycin in Dipeptiden†
Dr. Caroline Wyss
Institut Organische Chemie der Universität St.-Johanns-Ring 19, CH-4056 Basel (Schweiz) Telefax: Int. + 61/267–1105
Search for more papers by this authorRohit Batra Dipl.-Chem.
Institut Organische Chemie der Universität St.-Johanns-Ring 19, CH-4056 Basel (Schweiz) Telefax: Int. + 61/267–1105
Search for more papers by this authorDr. Christian Lehmann
Institut Organische Chemie der Universität St.-Johanns-Ring 19, CH-4056 Basel (Schweiz) Telefax: Int. + 61/267–1105
Search for more papers by this authorStefan Sauer Dipl.-Chem.
Institut Organische Chemie der Universität St.-Johanns-Ring 19, CH-4056 Basel (Schweiz) Telefax: Int. + 61/267–1105
Search for more papers by this authorCorresponding Author
Prof. Bernd Giese
Institut Organische Chemie der Universität St.-Johanns-Ring 19, CH-4056 Basel (Schweiz) Telefax: Int. + 61/267–1105
Institut Organische Chemie der Universität St.-Johanns-Ring 19, CH-4056 Basel (Schweiz) Telefax: Int. + 61/267–1105Search for more papers by this authorDr. Caroline Wyss
Institut Organische Chemie der Universität St.-Johanns-Ring 19, CH-4056 Basel (Schweiz) Telefax: Int. + 61/267–1105
Search for more papers by this authorRohit Batra Dipl.-Chem.
Institut Organische Chemie der Universität St.-Johanns-Ring 19, CH-4056 Basel (Schweiz) Telefax: Int. + 61/267–1105
Search for more papers by this authorDr. Christian Lehmann
Institut Organische Chemie der Universität St.-Johanns-Ring 19, CH-4056 Basel (Schweiz) Telefax: Int. + 61/267–1105
Search for more papers by this authorStefan Sauer Dipl.-Chem.
Institut Organische Chemie der Universität St.-Johanns-Ring 19, CH-4056 Basel (Schweiz) Telefax: Int. + 61/267–1105
Search for more papers by this authorCorresponding Author
Prof. Bernd Giese
Institut Organische Chemie der Universität St.-Johanns-Ring 19, CH-4056 Basel (Schweiz) Telefax: Int. + 61/267–1105
Institut Organische Chemie der Universität St.-Johanns-Ring 19, CH-4056 Basel (Schweiz) Telefax: Int. + 61/267–1105Search for more papers by this authorDiese Arbeit wurde vom Schweizerischen Nationalfonds zur Förderung der wissenschaftlichen Forschung und vom Bundesamt für Bildung und Wissenschaft gefördert. Frau Prof. M. Zehnder und Herrn M. Neuburger danken wir für die Durchführung der Kristallstrukturanalyse. C. W. dankt dem Stipendienfonds der Basler Chemischen Industrie für ein Stipendium. Wir danken der Firma Hoffmann-La Roche für die Bereitstellung des MOLOC-Kraftfeldprogramms.
Abstract
References
- 1 P. Wessig, P. Wettstein, B. Giese, M. Neuburger, M. Zehnder, Helv. Chim. Acta 1994, 77, 829. Zur Synthese des L-Prolinderivates siehe B. Giese, S. N. Müller, C. Wyss, H. Steiner, Tetrahedron: Asymmetry 1996, 7, 1261.
- 2 Eine O2-freie, auf 20–25°C gekühlte Lösung (100–200 mL Toluol) von 100–500 mg 9, 16 oder 18 wurde mit einer 150-W-Hg-Hochdrucktauchlampe (Heraeus TQ 150) 1.5–2.5 h bestrahlt. Die Produkte wurden chromatographisch getrennt und alle neuen Substanzen spektroskopisch sowie elementaranalytisch charakterisiert.
- 3 Die Konfigurationen von 11d mit der p-Nitrobenzolsulfonyl- statt der Z-Schutzgruppe sowie von den trans-Isomeren der glycinsubstituierten δ-Lactame 11a und 12a mit der Boc- statt der Z-Schutzgruppe wurden durch Röntgenstrukturanalyse aufgeklärt (Boc = tert-Butoxycarbonyl). Die kristallographischen Daten (ohne Strukturfaktoren) der in dieser Veröffentlichung be schriebenen Strukturen wurden als „supplementary publication no. CCDC-179–103”︁ beim Cambridge Crystallographic Data Centre hinterlegt. Kopien der Daten können kostenlos bei folgender Adresse angefordert werden: The Director, CCDC, 12 Union Road, GB-Cambridge CB21EZ (Telefax: Int. +1223/336–033; E-mail: [email protected]). Im 13C-NMR-Spektrum liegen die C-4- und C-5-Signale der δ-Lactamringe in 11b–d bei Δδ = 0.3–1.3 höherem Feld als die von 12b–d.
- 4 Die Regioselektivität der Dipeptidcyclisierung beträgt mit 9a 8:1 und mit 9b–d > 20:1 (25°C).
- 5 Die Rechnungen wurden auf dem PMP2/6–31G*//UHF/3–21G*-Niveau durchgeführt: Gaussian 94, Revision B.2: M. J. Frisch, G. W. Trucks, H. B. Schlegel, P. M. W. Gill, B. G. Johnson, M. A. Robb, J. R. Cheeseman, T. Keith, G. A. Petersson, J. A. Montgomery, K. Raghavachari, M. A. Al-Laham, V. G. Zakrzewski, J. V. Ortiz, J. B. Foresman, J. Cioslowski, B. B. Stefanov, A. Nanayakkara, M. Challacombe, C. Y. Peng, P. Y. Ayala, W. Chen, M. W. Wong, J. L. Andres, E. S. Replogle, R. Gomperts, R. L. Martin, D. J. Fox, J. S. Binkley, D. J. Defrees, J. Baker, J. P. Stewart, M. Head-Gordon, C. Gonzalez, J. A. Pople, Gaussian Inc., Pittsburgh, PA, 1995. Die bevorzugte H-Abstraktion aus Glycin in intermolekularen Reaktionen mit Peptiden wird analog diskutiert: C. J. Easton in Advances in Detailed Reaction Mechanism, Vol. 1 (Hrsg.: J. M. Coxon), Jai, Greenwich 1991, S. 83.
- 6 Die Rechnungen wurden mit Macro Model 4.5 und dem Amber*-Kraftfeld durchgeführt: D. Q. McDonald, W. C. Still, Tetrahedron Lett. 1992, 33, 7743.
- 7 Rechnungen mit dem Kraftfeldprogramm MOLOC ergaben, daß das cis-Isomer mindestens 1 kcal mol−1 stabiler ist als a) ein H-verbrücktes trans-Isomer mit axialer Phenylgruppe am δ-Lactamring sowie b) ein trans-Isomer mit äquatorialer Phenylgruppe ohne Wasserstoffbrückenbindungen.
- 8
Zum Kraftfeldprogramm MOLOC siehe:
K. Müller,
H. J. Ammann,
D. M. Doran,
P. R. Gerber,
K. Gubernator,
G. Schrepfer,
Bull. Soc. Chim. Belg.
1988,
97,
655.
10.1002/bscb.19880970806 Google ScholarKraftfeld: P. R. Gerber, K. Müller, J. Comput. Aided Mol. Design 1995, 9, 251. a) Peptid-Kraftfeld: P. R. Gerber, Biopolymers 1992, 32, 1003; b) in Computer Simulation of Biomolecular Systems, Vol. 2 (Hrsg.: W. F. van Gunsteren, P. K. Weiner, A. J. Wilkinson), ESCOM, Leiden, 1993, S. 213. Konformationsanalyse: a) P. R. Gerber, K. Gubernator, K. Müller, Helv. Chim. Acta 1988, 71, 1429; b) P. R. Gerber in Computer Simulation of Biomolecular Systems (Hrsg.: W. F. van Gunsteren, P. K. Weiner), ESCOM, Leiden, 1989, S. 183. Strukturüberlagerung: P. R. Gerber, K. Müller, Acta Crystallogr. Sect. A 1987, 43, 426.
- 9 Diese Interpretation bezieht sich auf die sterische Anordnung der Substituenten im Produkt und sollte deswegen nicht überbewertet werden. Weil sich beim Triplett-Singulett-Übergang des Diradikals die Radikalzentren annähern müssen und das Singulett-Diradikal möglicherweise direkt zum Produkt cyclisiert, könnten die für die Produkte berechneten sterischen und polaren Effekte schon im Übergangszustand eine große Rolle spielen. Für weitergehende Diskussion siehe: a) A. G. Griesbeck, H. Mauder, S. Stadtmüller, Acc. Chem. Res. 1994, 27, 70; b) I. V. Khudyakov, Y. A. Serebrennikov, N. J. Turro, Chem. Rev. 1993, 93, 537; c) P. J. Wagner, Acc. Chem. Res. 1983, 16, 461.
- 10 Übersichtsartikel: a) R. M. J. Liskamp, Recl. Trav. Chim. Pays-Bas 1994, 113, 1; b) G. Hölzemann, Kontakte (Darmstadt) 1991, 3.
- 11a) H. Yanagisawa, S. Ishihara, A. Ando, T. Kanazaki, S. Miyamoto, H. Koike, Y. Iijima, K. Oizumi, Y. Matsushita, T. Hata, J. Med. Chem. 1988, 31, 1430; b) E. Thorsett, E. E. Harris, S. D. Aster, J. P. Snyder, J. P. Springer, J. Hirshfeld, E. W. Tristram, A. A. Patehett, E. H. Ulm, T. C. Vassil, J. Med. Chem. 1986, 29, 251; c) R. M. Freidinger, D. Schwenk Perlow, D. F. Veber, J. Org. Chem. 1982, 47, 104.
- 12 Zur Herstellung von 17 wurde Valinbenzylester mit Benzoylmethylbromid umgesetzt und mit Z-geschütztem Glycin verknüpft. Die Strukturen von 18a und 18b wurden NMR-spektroskopisch zugeordnet. NOE-NMR-Experimente bewiesen die cis-Konfiguration, und die Lage des Signals für das quartäre C-4-Atom der γ-Lactame ist die gleiche wie die bei den δ-Lactamen.
Citing Literature
This is the
German version
of Angewandte Chemie.
Note for articles published since 1962:
Do not cite this version alone.
Take me to the International Edition version with citable page numbers, DOI, and citation export.
We apologize for the inconvenience.