Stabilisierung einer ungewöhnlichen monomeren Aryllithiumverbindung mit Li-C-σ-Bindung durch eine schwache Lithium-Benzol-Wechselwirkung†
Dr. Berthold Schiemenz
Department of Chemistry University of California Davis, CA 95616 (USA) Telefax: Int. +916/752–8995
Search for more papers by this authorCorresponding Author
Prof. Philip P. Power
Department of Chemistry University of California Davis, CA 95616 (USA) Telefax: Int. +916/752–8995
Department of Chemistry University of California Davis, CA 95616 (USA) Telefax: Int. +916/752–8995Search for more papers by this authorDr. Berthold Schiemenz
Department of Chemistry University of California Davis, CA 95616 (USA) Telefax: Int. +916/752–8995
Search for more papers by this authorCorresponding Author
Prof. Philip P. Power
Department of Chemistry University of California Davis, CA 95616 (USA) Telefax: Int. +916/752–8995
Department of Chemistry University of California Davis, CA 95616 (USA) Telefax: Int. +916/752–8995Search for more papers by this authorDiese Arbeit wurde von der National Science Foundation und vom Petroleum Research Fund, verwaltet von der American Chemical Society, gefördert. Wir bedanken uns außerdem für ein DAAD NATO-Postdoktorandenstipendium (B.S.).
Abstract
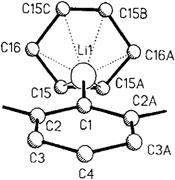
Nur durch sterische Effekte und schwache Solvatisierung durch Benzol wird die als Monomer vorliegende Aryllithiumverbindung 1 stabilisiert. Die präzedenzlose Struktur von 1 im Kristall ist rechts gezeigt; die ortho-Substituenten am η1 gebundenen Phenylring wurden der Übersichtlichkeit halber weggelassen. C6H6·LiC6H3-2.6-(2.4.6-iPr3C6H2)2 1
References
- 1 G. E. Coates, K. Wade, Organometallic Compounds, Methuen, London, 1967; J. L. Wardell in Comprehensive Organometallic Chemistry Vol. 1 (Hrsg.: E. W. Abel, F. G. A. Stone, G. Wilkinson), Pergamon, New York, 1982, Kap. 2.
- 2 W. N. Setzer, P. von R. Schleyer, Adv. Organomet. Chem. 1985, 24, 353; M. A. Beswick, D. S. Wright in Comprehensive Organometallic Chemistry II, Vol. 1 (Hrsg.: E. W. Abel, F. G. A. Stone, G. Wilkinson), Pergamon, New York, 1995, Kap. 1.
- 3 Bislang bekannte Strukturen von nicht komplexierten Alkyllithiumverbindungen: a) (LiMe)4: E. Weiss, E. C. A. Lucken, J. Organomet. Chem. 1964, 2, 197; b) (LiEt)4; H. Dietrich, J. Organomet. Chem. 1981, 205, 291; c) (Li/Pr)6; U. Siemeling, T. Redecker, B. Neumann, H.-G. Stammler, J. Am. Chem. Soc. 1994, 116, 5507; d) (Li nBu)6 und (Li tBu)4: T. Kottke, D. Stalke, Angew. Chem. 1993, 105, 619; Angew. Chem. Int. Ed. Engl. 1993, 32, 580; e) [LiCH2( c-CHCMe2CMe2)]4: A. Maercker, M. Bsata, W. Buchmeier, B. Engelen, Chem. Ber. 1984, 117, 2547; f) [Li( c-C6H11)]6 · 2C6H6, R. Zerger, W. Rhine, G. Stukky, J. Am. Chem. Soc. 1974, 96, 6048; g) (LiCH2SiMe3)6, B. Tecle, A. F. Maqsudur Rahman, J. P. Oliver, J. Organomet. Chem. 1986, 317, 267; h) [LiCH(SiMe3)2],: J. L. Atwood, T. Fjelberg, M. F. Lappert, N. T. Luong Thi, R. Shakir, A. J. Thorne, J. Chem. Soc. Chem. Commun. 1984, 1163; i) [LiC(SiMe3)3]2: W. Hiller, M. Layh, W. Uhl, Angew. Chem. 1991, 103, 339, Angew. Chem. Int. Ed. Engl. 1991, 30, 324.
- 4 Die Strukturen einer großen Zahl von nicht komplexierten Aryllithiumsalzen von cyclischen Verbindungen mit anionischem, delokalisiertem π-Elektronen-system und Li-C-π-Wechselwirkungen sind veröffentlicht worden. Keine dieser Strukturen enthält jedoch Li-C-σ-Bindungen. Siehe Lit. [2] für eine umfassende Diskussion.
- 5 Die Strukturen von (LiTrip)4, (LiC6H3-2,6-Mes2)2 und den gemischten Alkyl/Aryllithiumverbindungen sind beschrieben in: a) K. Ruhlandt-Senge, J. J. Ellison, R. J. Wehmschulte, F. Pauer, P. P. Power, J. Am. Chem. Soc. 1993, 115, 11353. Die Verbindungen zeigen eine Vielzahl von σ- und π-Wechselwirkungen mit den Arylgruppen. Charakteristisch für die Strukturen von (LiTrip)4 und (LiMes*LinBu)2 sind planare Li-Anordnungen; vgl. die tetraedrischen Li4-Anordnungen in (LiMe)4, (LiEt)4 und (LitBu)4. Im Gegensatz dazu steht die dimere Struktur von (LiC6H3-2,6-Mes2)2, in der die Li-C-Wechselwirkungen nur die ipso-Kohlenstoffatome des zentralen Benzol- und der Mesitylringe betreffen. Die Struktur der gemischten Lithiumphosphid/Aryllithiumverbindung [LiP(H)Mes*LiMes*]2 zeigt eine ähnliche η1-P/η6-C- und η1-C/η6-C-Koordination: b) S. Kurz, E. Hey-Hawkins, Organometallics 1992, 11, 2729.
- 6 Kristallstrukturen von 1 · C7H8 und 2 (T = 130 K, CuKα-Strahlung, Λ = 1.54178 Å): 1 · C7H8, C67H82Li2, M = 901.2, a = 19.906(6), b = 18.120(6), c = 17.251(4) Å, β = 114.49(2)°, monoklin, Z = 4, Raumgruppe P21/c, R = 0.074 für 5768 (I > 2σ(I)) Reflexe; 2, C42H50Li, M = 561.76, a = 10.929(2), b = 14.097(3), c = 24.581(5) Å, orthorhombisch, Z = 4, Raumgruppe Cmcm, R = 0.102 für 1379 (I > 2σ(I)) Reflexe. 1 hat keine kristallographisch erzwungene Symmetrie und kristallisiert mit einem fehlgeordneten Toluolmolekül (Besetzungszahl 0.5:0.5 in zwei Orientierungen) in der asymmetrischen Einheit. Die Daten für 2 erfordern zwei senkrecht aufeinanderstehende Spiegelebenen dutch die C(1) …︁ C(4) Achse, von denen eine die Ebene des C1-Ringes beinhallet. Die Kristalle von 2 zeigen Phasenübergänge und/oder brechen, wenn sie unter ca. −20°C gekühlt werden. Außerdem verlieren sie Lösungmittel. Diese Tatsache und die Fehlordnung in den para-iPr-Gruppen führt zu einem Datensatz von niedriger Qualität (sehr hohe Temperaturfaktoren für einige Atome und R = 0.102). Die Qualität der Strukturanalyse reicht trotzdem für die Diskassion im Text aus. Die kristallographischen Daten (ohne Strukturfaktoren) der in dieser Veröffentlichung beschriebenen Strukturen wurden als „supplementary publication no. CCDC-179–80”︁ beim Cambridge Crystallographic Data Centre hinterlegt. Kopien der Daten können kostenlos bei folgender Adresse angefordert werden: The Director, CCDC, 12 Union Road, GB-Cambridge CB2 1EZ (Telefax: Int. +1223/336–033; E-mail: [email protected]).
- 7 Einige Li-C-σ-gebundene Organoalkalimetallsalze, die aus Benzollösungen erhalten werden, können cokristallisiertes Benzol oder Benzol mit einer schwachen η1-η2 (aber nicht η6)-Wechselwirkung mit dem Metall enthalten. Ein frühes Beispiel dafür ist die klassische Struktur von Cyclohexyllithium, das als Hexamer (C6H11)6 · 2 C6H6 kristallisiert und zwei cokristallisierte Benzolmoleküle enthält.
- 8a) H. Schmidbaur, Angew. Chem. 1985, 97, 893; Angew. Chem. Int. Ed. Engl. 1985, 24, 893; b) P. Jutzi, Adv. Organomet. Chem. 1986, 26, 217.
- 9 C. Schade, P. von R. Schleyer, Adv. Organomet. Chem. 1987, 27, 169.
- 10
C. Eaborn,
P. B. Hitchcock,
K. Izod,
J. D. Smith,
Angew. Chem.
1995,
107,
756;
10.1002/ange.19951070629 Google ScholarAngew. Chem. Int. Ed. Engl. 1995, 34, 687.
- 11a) M. Pilz, J. Allwohn, P. Willershausen, W. Massa, A. Berndt, Angew. Chem. 1990, 102, 1085; Angew. Chem. Int. Ed. Engl. 1990, 29, 1030; b) H. Chen, R. A. Bartlett, H. V. R. Dias, M. M. Olmstead, P. P. Power, Inorg. Chem. 1991, 30, 2487.
- 12 B. Schiemenz, P. P. Power, Organometallics, 1996, 15, 958.
- 13 C. F. Du, H. Hart, K. D. Ng, J. Org. Chem. 1986, 51, 3162.
Citing Literature
This is the
German version
of Angewandte Chemie.
Note for articles published since 1962:
Do not cite this version alone.
Take me to the International Edition version with citable page numbers, DOI, and citation export.
We apologize for the inconvenience.