Der erste neutrale adamantanoide Eisen(III)-Chelatkomplex: spontane Bildung, Struktur und Elektrochemie†
Corresponding Author
Prof. Dr. Rolf W. Saalfrank
Institut für Organische Chemie der Universität Erlangen-Nürnberg Henkestraße 42, D-91054 Erlangen
Institut für Organische Chemie der Universität Erlangen-Nürnberg Henkestraße 42, D-91054 ErlangenSearch for more papers by this authorBernd Hörner Dipl.-Chem.
Institut für Organische Chemie der Universität Erlangen-Nürnberg Henkestraße 42, D-91054 Erlangen
Search for more papers by this authorDr. Dietmar Stalke
Institut für Anorganische Chemie der Universität Göttingen
Einkristall-Röntgenstrukturanalyse.
Search for more papers by this authorDr. Josef Salbeck Priv.-Doz.
Institut für Organische Chemie der Universität Regensburg
Elektrochemie.
Search for more papers by this authorCorresponding Author
Prof. Dr. Rolf W. Saalfrank
Institut für Organische Chemie der Universität Erlangen-Nürnberg Henkestraße 42, D-91054 Erlangen
Institut für Organische Chemie der Universität Erlangen-Nürnberg Henkestraße 42, D-91054 ErlangenSearch for more papers by this authorBernd Hörner Dipl.-Chem.
Institut für Organische Chemie der Universität Erlangen-Nürnberg Henkestraße 42, D-91054 Erlangen
Search for more papers by this authorDr. Dietmar Stalke
Institut für Anorganische Chemie der Universität Göttingen
Einkristall-Röntgenstrukturanalyse.
Search for more papers by this authorDr. Josef Salbeck Priv.-Doz.
Institut für Organische Chemie der Universität Regensburg
Elektrochemie.
Search for more papers by this author„Adamantanoide”︁ Chelatkomplexe, 3. Mitteilung. Diese Arbeit wurde von der Deutschen Forschungsgemeinschaft und dem Fonds der Chemischen Industrie gefördert. B. H. dankt dem Freistaat Bayern für ein Promotionsstipendium, J. S. Herrn Prof. J. Daub, Universität Regensburg, für die Unterstützung seiner Arbeiten. - Herrn Priv.-Doz. Dr. H. U. Hummel, Universität Erlangen-Nürnberg, danken wir für zahlreiche Ratschläge, Herrn Prof. Dr. R. Glaser, Ben-Gurion University of the Negev, Beersheva, Israel, für anregende Diskussion. Herrn Prof. Dr. F. Vögtle und Frau S. Schuth, Universität Bonn, danken wir für die Aufnahme des FAB-Massenspektrums, Herrn Prof. Dr. A. X. Trautwein, Herrn Dr. E. Bill und Herrn Dipl.-Phys. C. Butzlaff, Medizinische Universität zu Lübeck, für die Anfertigung eines Mößbauer-Spektrums sowie für magnetische Messungen. - 2. Mitteilung: [1]
Abstract
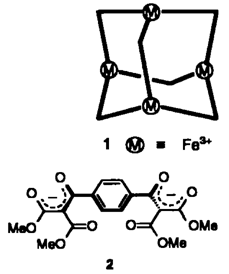
„Metallautismus”︁ - dieser Begriff charakterisiert treffend den Befund, daß im adamantanoiden Eisen(III)-Chelatkomplex 1 die vier Eisenzentren weder elektronisch noch magnetisch miteinander wechselwirken. Verbunden sind die vier Metallatome über sechs Chelatliganden 2, die durch Deprotonierung des Kondensationsprodukts aus Terephthaloylchlorid und Malonester erhältlich sind.
References
- 1 R. W. Saalfrank, A. Stark, M. Bremer, H.-U. Hummel, Angew. Chem. 1990, 102, 292–294; Angew. Chem. Int. Ed. Engl. 1990, 29, 311–314.
- 2 T. Weiske, T. Wong, W. Krätschmer, J. K. Terlouw, H. Schwarz, Angew. Chem. 1992, 104, 242–244; Angew. Chem. Int. Ed. Engl. 1992, 31, 183–185; H. Hopf, Angew. Chem. Int. Ed. Engl. 1991, 103, 1137–1139 bzw. Angew. Chem. Int. Ed. Engl. 1991, 30, 1117–118; C. Seel, K. Vögtle, Angew. Chem. Int. Ed. Engl. 1992, 104, 542–563 bzw. Angew. Chem. Int. Ed. Engl. 1992, 31, 528–549.
- 3 P. Baxter, J.-M. Lehn, A. DeCian, J. Fischer, Angew. Chem. 1993, 105, 92–95; Angew. Chem. Int. Ed. Engl. 1993, 32, 69–72; J.-M. Lehn in Perspectives in Coordination Chemistry (Hrsg.: A. F. Williams, C. Floriani, A. E. Merbach), VCH, Weinheim. 1992, S. 447–462.
- 4 Übersichten: J.-M. Lehn, Angew. Chem. 1988, 100, 91–116: Angew. Chem. Int. Ed. Engl. 1988, 27, 89–112; Angew. Chem. Int. Ed. Engl. 1990, 102. 1347–1362 bzw. Angew. Chem. Int. Ed. Engl. 1990, 29, 1304–1319.
- 5 R. W. Saalfrank, A. Stark, K. Peters, H. G. von Schnering, Angew. Chem. 1988, 100, 878–880; Angew. Chem. Int. Ed. Engl. 1988, 27, 851–853.
- 6 Synthese in Anlehnung an Lit. [7] ausgehend von Malonsäuredimethylester, Triethylamin, wasserfreiem Magnesium (II)-chlorid und Terephthaloylchlorid in Acetonitril bei-10 C (16 h) und Aufarbeiten mit 15proz. Salzsäure.
- 7 M. W. Rathke, M. A. Nowak, Synth. Commun. 1985, 15, 1039–1049: M. W. Rathke, M. A. Nowak, J. Org. Chem. 1985, 15. 2624–2626: M. W. Rathke, P. J. Cowan, J. Org. Chem. 1985, 50, 2622–2624.
- 8 1c (Arbeitsvorschrift): Man gibt bei 20 C 1.18 g (3 mmol) 2.2-Terephthaloyldimalonsäuretetramethylester [6] in 40 mL wasserfreiem THF (unter Stickstoff) zu 0.2 g (8 mmol) Natriumhydrid in 10 mL THF, rührt 1 h. tropft eine Lösung von 0.3 g (2 mmol) Eisen(III)-chlorid in 40 mL THF innerhalb von 15 min zu, rührt 16 h, filtriert die Lösung an der Luft durch ein Faltenfilter, engt das Filtrat auf 15 mL ein und setzt 50 mL Aceton zu. Nach 3 d können aus der Lösung rubinrote Mikrokristalle isoliert werden. Ausbeute: 0.73 g (57%). Zers. ab 150°C. IR (KBr): v˜ = 1720 cm−1 (C=O). FAB-MS (3-Nitrobenzylalkohol-Matrix): m/= m/z 2578 [Fe4L62 + H+], 2185 [Fe4L52 + H+]. 1793 [Fe4L42 + H+]. - Korrekte C,H,Fe-Analyse.
- 9 Kristalldaten von 1c: C108H96O60Fe4. C4H10O. C3H6O. H2O. Mr = 777.49, tetragonal, Raumgruppe P4n2, a = b = 21.631(1), c = 17.371(3) A, K = 8127.9(15) A3 Z = 8, Pber.= 1.271 Mgm−3, F(000) = 3240, λ = 0.71073 A, T = 180 μ,(Mok2) = 0.439 mm−1. Die Daten wurden auf einem Stoe-Siemens-AED Diffraktometer gesammelt. Intensitätsbestimmungen wurden an einem schockgekühlten Kristall im Öltropfen mit den Abmessungen 1.2 x 1.0 x 0.8 mm nach der 20/α-Methode im Bereich von 8° ≤ 20 ≤ 45° durchgeführt. Von den 7537 gesammelten Reflexen waren 5328 unabhängig und wurden nach einem semiempirischen Verfahren absorptionskorrigiert; höchstes Minimum und Maximum: 1.0 bzw. - 0.46 e Å−3, R1 = 0.068 und wR2 = 0.179 (alle Daten), die absolute Struktur wurde durch die Verfeinerung des Flack-Parameters (H. D. Flack, Acta Crystallogr. Sect. A 1983, 39, 876) auf 0.01(3) bestimmt. Die Struktur wurde durch Direkte Methoden gelöst (SHELXS-90) [10] und nach dem Kleinste-Fehlerquadrate Verfahren verfeinert (SHELXL 92) [11]. Alle Wasserstoffatompositionen wurden in der Differenzelektronendarstellung lokalisiert und nach dem Reitermodell verfeinert. Die U-Werte für chemisch äquivalente Wasserstoffatome wurden gemeinsam in Gruppen verfeinert. Weitere Einzelheiten zur Kristallstrukturuntersuchung können beim Direktor des Cambridge Crystallographic Data Centre, 12 Union Road, GB-Cambridge CB21EZ, unter Angabe des vollständigen Literaturzitats angefordert werden.
- 10 G. M. Sheldrick, Acta Crystallogr. Sect. A 1990, 46, 467–473.
- 11 G. M. Sheldrick, SHELXL-92, Universität Göttingen, 1992.
- 12 Vierkernige Eisen(II/III)-Komplexe: S. R. Boone, G. H. Purser, H.-R. Chang, M. D. Lowery, D. N. Hendrickson, C. G. Pierpont, J. Am. Chem. Soc. 1989, 111, 2292–2299; J. K. McCusker, J. B. Vincent, E. A. Schmitt, M. L. Mino, K. Shin, D. K. Coggin, P. M. Hagen, J. C. Huffman, G. Christou, D. N. Hendrickson, J. Am. Chem. Soc. 1989, 113, 3012–3021; K. S. Hagen, A. D. Watson, R. H. Holm, J. Am. Chem. Soc. 1983, 105, 3905–3913; M. A. Whitener, J. K. Bashkin, K. S. Hagen, J.-J. Girerd, E. Gamp, N. Edelstein, R. H. Holm, J. Am. Chem. Soc. 1986, 108, 5607–5620; J. L. Sessler, J. D. Hugdahl, V. Lynch, H. B. Davis, Inorg. Chem. 1991, 30, 334–336; Q. Chen, J. B. Lynch, P. Gomez-Romero, A. Ben-Hussein, G. B. Jamesoa, C. J. O'Conor, L. Que, Jr., Inorg. Chem. 1988, 27, 2673–2681.
- 13 Zur Topologie des vierkenigen Chelatkomplexes 1c (Brückenköpfe: Fe3+ -Ionen) vgl. auch die Verhältnisse bei sphärischen Tricyclen (Brükkenköpfe: N-Atome): Lit. [4]; F. P. Schmidtchen, Angew. Chem. 1977, 89, 751–752; Angew. Chem. Int. Ed. Engl. 1977, 16, 720–721; J.-M. Lehn, Pure Appl. Chem. 1977, 49, 857–870; E. Graf, J.-M. Lehn, J. Am. Chem. Soc. 1975, 97, 5022–5024; E. Weber, F. Vögtle, Kontakte (Darmstadt) 1981, (1), 24–36; E. Weber: Phase Transfer Catalysts, Properties and Applications (Merck-Schuchardt Publikationen 1987, S. 32–76; F. P. Schmidtchen, Nachr. Chem. Tech. Lab. 1988, 36, 8–1.
- 14
M. Becke-Goehring,
H. Hoffmann,
Komplexchemie,
Springer,
Berlin
1970,
S. 26ff.:
10.1007/978-3-642-87215-0 Google Scholarsiehe auch Nomenclature of Inorganic Chemistry (Hrsg.: G. J. Leigh). Blackwell, Oxford. 1991, S. 179 ff. (Bei oktaedrischen Komplexen des Typs MA1B1A2B2A3B3 treten fünf Enantiomerenpaare auf: J. Leong, K. N. Raymond J. Am. Chem. Soc. 1975, 97, 293–296.) Vgl. hierzu auch die von der IUPAC empfohlenen Deskriptoren OC-6-22 (für facial) und OC-6-21 (für meridional).
- 15 Amel System 5000 unit iR-Kompensation. Ungeteilte Zelle mit Pt-Scheibenelektrode. Potentialangaben vs. Fc/Fc+. Experimentelle Details zur Elektrochemie, Spektroelektrochemic und Voltabsorptometrie: J. Salbeck, J. Electronal. Chem. 1992, 340, 169–195.
- 16 Die Peakpotentialdifferenz ΔEp von 170mV wie auch die Peakbreite Ep - Ep/2 mit 135 mV bleiben bei einer Variation der Vorschubgeschwindigkeit im Bereich von 50-250 mVs−1 nahezu konstant. Im Bereich von 50-250 mVs−1 ist der Quotient aus Peakstrom ip und Wurzel aus der Vorschubgeschwindigkeit konstant. Die Verwendung von Tetrabutylammoniumhexafluorophosphat als Leitsalz führt zu wesentlich größerern Werten: ΔEp = 300 mV, Ep - Ep/2 = 200 mV bei 250 mVs−1.
- 17 Eine beliebige Anzahl nicht wechselwirkender identischer Redoxzentren in einem Molekül sollte ein Strom-Potential-Verhalten mit den gleichen Charakteristiken eines reversiblen Ein-Elektronen-Transfers zeigen (z.B. ΔEp = 58 mV). Dies gilt jedoch nur, wenn die Redoxzentren Nernst-Verhalten aufweisen [18]. Im Falle einer partiellen Durchtrittskontrolle tritt eine Signalverbreiterung ein. Mit unseren Ergebnissen vergleichbare Signalformen 0resultieren bei der Simulation von Cyclovoltammogrammen für einen formalen Zwei-Elektronen-Transfer bei entsprechenden Verhältnissen für die Geschwindigkeitskonstanten des Ladungstransfers [19].
- 18 J. B. Flanagan, S. Margel, A. J. Bard, F. C. Anson, J. Am. Chem. Soc. 1978, 100, 4248–4253.
- 19 K. Hinkelmann, J. Heinze, Ber, Bunsenges. Phys. Chem. 1987, 91, 243–249.
- 20 Zur Thematik Mehr-Elektronen-Transferprozesse vgl. Lit. [21-23].
- 21 D. E. Fenton, R. R. Schroeder, R. L. Lintvedt, J. Am. Chem. Soc. 1978, 100, 1931–1932; D. E. Fenton, R. L. Lintvedt, J. Am. Chem. Soc. 1978, 100, 6367–6375; D. T. Pierce, W. E. Geiger, J. Am. Chem. Soc. 1989, 111, 7636–7638; B. Tulyathan, W. E. Geiger, J. Am. Chem. Soc. 1985, 107, 5960–5967; J. Salbeck, J. Schöberl, J. Daub, Z. Phys. Chem. 1991, 171, 191–212.
- 22 E. Kimura, S. Joko, T. Koike, M. Kodama, J. Am. Chem. Soc. 1987, 109, 5528–5529.
- 23 W. F. Sokol, D. H. Evans, K. Niki, T. Yagi, J. Electroanal. Chem. 1980, 108, 107–115; K. Fan, H. Akutsu, K. Niki, N. Higuchi, Y. Kyogoku, J. Electroanal. Chem. 1990, 278, 295–306.
- 24 Die diamagnetischen Korrekturen wurden mit Pascal-Konstanten bestimmt: E. A. Budreaux, L. N. Mulay, Theory and Applications of Molecular Paramagnetism, J. Wiley, New York, 1976, A. Weiss, H. Witte, Magnetochemie, VCH, Weinheim, 1973.
- 25 F. E. Mabbs, D. J. Machin, Magnetism and Transition Metal Complexes, Chapman and Hall, London, 1973, A. Bencini, D. Gatteschi, EPR of Exchange Coupled Systems, Springer, Berlin, 1990.
Citing Literature
This is the
German version
of Angewandte Chemie.
Note for articles published since 1962:
Do not cite this version alone.
Take me to the International Edition version with citable page numbers, DOI, and citation export.
We apologize for the inconvenience.