Aromatische Borheterocyclen: Erzeugung von 1H-Borepin und Struktur von Tricarbonyl(1-phenylborepin)molybdän†‡
Corresponding Author
Prof. Dr. Arthur J. Ashe III
Department of Chemistry The University of Michigan Ann Arbor, MI 48109–1055 (USA)
Department of Chemistry The University of Michigan Ann Arbor, MI 48109–1055 (USA)Search for more papers by this authorDr. Jeff W. Kampf
Department of Chemistry The University of Michigan Ann Arbor, MI 48109–1055 (USA)
Search for more papers by this authorProf. Dr. Yasuhiro Nakadaira
Department of Chemistry The University of Electro-Communications Chofu, Tokyo 182 (Japan)
Search for more papers by this authorJennifer M. Pace
Department of Chemistry The University of Michigan Ann Arbor, MI 48109–1055 (USA)
Search for more papers by this authorCorresponding Author
Prof. Dr. Arthur J. Ashe III
Department of Chemistry The University of Michigan Ann Arbor, MI 48109–1055 (USA)
Department of Chemistry The University of Michigan Ann Arbor, MI 48109–1055 (USA)Search for more papers by this authorDr. Jeff W. Kampf
Department of Chemistry The University of Michigan Ann Arbor, MI 48109–1055 (USA)
Search for more papers by this authorProf. Dr. Yasuhiro Nakadaira
Department of Chemistry The University of Electro-Communications Chofu, Tokyo 182 (Japan)
Search for more papers by this authorJennifer M. Pace
Department of Chemistry The University of Michigan Ann Arbor, MI 48109–1055 (USA)
Search for more papers by this authorDiese Arbeit wurde von der Research Corporation und dem Petroleum Research Fund der American Chemical Society gefördert.
Professor William von E. Doering zum 75. Geburtstag gewidmet
Abstract
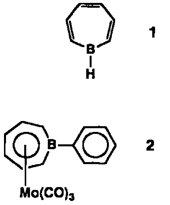
Ein siebengliedriges aromatisches Ringsystem enthält nach NMR-spektroskopischen Befunden 1H-Borepin 1, die langgesuchte Stammverbindung der Borepine. 1 kann durch C1-H-Austausch aus dem entsprechenden Chlorborepin und Tributylstannan erzeugt werden. Der Borepinring kann in Übergangsmetallkomplexen als η7-koordinierender Ligand fungieren, wie die Strukturdaten von 2 nahelegen.
References
- 1 M. E. Vol'pin, Russ. Chem. Rev. (Engl. Transl.) 1960, 29, 129.
- 2(a) J. M. Schulman, R. L. Disch, M. L. Sabio, J. Am. Chem. Soc. 1982, 104, 3785, J. Am. Chem. Soc. 1984, 106, 7696; (b) J. M. Schulman, R. L. Disch, M. L. Sabio, Tetrahedron Lett. 1983, 24, 1863; (c) N. L. Allinger, J. H. Siefert, J. Am. Chem. Soc. 1975, 97, 752.
- 3 E. E. van Tamelen, G. Brieger, K. G. Untch, Tetrahedron Lett. 1960, Nr. 8, 14.
- 4(a) A. J. Leusink, W. Drenth, J. G. Noltes, G. J. M. van der Kerk, Tetrahedron Lett. 1967, 1263; (b) G. Axelrad, D. Halpern, Chem. Cummun. 1971, 291; (c) A. J. Ashe III, J. W. Kampf, C. M. Kausch, H. Konishi, M. O. Kristen, J. Kroker, Organometallics 1990, 9, 2944.
- 5 A. T. Jeffries III, S. Gronowitz, Chem. Ser. 1973, 4, 183.
- 6(a) J. J. Eisch, J. E. Galle, J. Am. Chem. Soc. 1990, 97, 4436; (b) siehe jedoch: A. Geisberger, Dissertation, Universität Gießeb, 1990.
- 7 W. Schacht, D. Kaufmann, Angew. Chem. 1987, 99, 682; Angew. Chem. Int. Ed. Engl. 1987, 26, 665.
- 8(a) A. J. Ashe III, F. J. Drone, J. Am. Chem. Soc. 1987, 109, 1879; J. Am. Chem. Soc. 1988, 110, 6599; (b) A. J. Ashe III, F. J. Drone, C. M. Kausch, J. Kroker, S. M. Al-Taweel, Pure Appl. Chem. 1990, 513.
- 9 Y. Sugihara, T. Yagi, I. Murata, A. Imamura, J. Am. Chem. Soc. 1992, 114, 1479.
- 10 Y. Nakadaira, R. Sato, H. Sakurai, Chem. Lett. 1987, 1451.
- 11 R. Sato, Dissertation, Tohoku University, 1984; Y. Nakadaira, R. Sato, H. Sakurai, 6th Int. Symp. Novel Arom. Comp. Osaka, 1989, A-47.
- 12 Das gleiche Ergebnis erhält man mit nBu2SnH2 oder tBu2SnH2.
- 13 H. C. Brown, E. Negishi, J. Am. Chem. Soc. 1971, 93, 6682.
- 14 Die beobachteten Spektren können mit dem PANIC-Programm von Bruker simuliert werden, wobei folgende 1H−1H-Kopplungskonstanten von 1 erhalten werden: J(2,3) = 12.4, J(2,4) = 1.0, J(2,5) = 0.7, J(2,6) = 0, J(2,7) = 3.2, J(3,4) = 8.3, J(3,5) = 1.0, J(3,6) = J(3,7) = 0, J(4,5) = 11.1Hz.
- 15 Der Borolkomplex [CpCo(C4Ph4BH)] verhält sich ählnich: F. E. Hong, C. W. Eigenbrot, T. P. Fehlner, J. Am. Chem. Soc. 1989, 111, 949.
- 16 Y. Nakadaira, R. Sato, H. Sakurai, Organometallics 1991, 10, 435.
- 17 M. Karplus, J. Am. Chem. Soc. 1963, 85, 2870.
- 18 H. Günther, M. Gorlitz, H. Meizenheimer, Org. Magn. Reson. 1974, 6, 388.
- 19 G. E. Herberich, E. Bauer, J. Hengesbach, U. Kölle, G. Huttner, H. Lorenz, Chem. Ber. 1977, 110, 760.
- 20 7: Monoklin, Raumgruppe P21/n (Nr. 14) mit a = 12.406(4), b = 6.733(2), c = 16.390(4) Å, β = 95.11(2)°, V = 1363.6(5) Å3, Z = 4 (ρber. = 1.685 gcm−3), μ(MoKa) = 93.18 cm−1, 3997 Reflexe, 3777 mit FO ⩾ 0.6σ(F) zur Verfeinerung benutzt: R = 0.04.66, Rw = 0.04.52; GOF = 1.22. Weitere Einzelheiten zur Kristallstrukturuntersuchung können beim Direktor des Cambridge Crystallographic Data Centre, University Chemical Laboratory, Lensfield Road, GB-Cambridge CB21EW, unter Angabe des vollständigen Literaturzitats angefordert werden.
- 21(a) G. E. Herberich, W. Boveleth, B. Hessner, D. P. J. Köffer, M. Negele, R. Saive, J. Organomet. Chem. 1986, 308, 153; (b) W. Siebert, M. Bochmann, J. Edwin, C. Krüger, Y.-H. H. Tsay, Z. Naturforsch. B 1978, 33, 1410; (c) G. Huttner, W. Gatzke, Chem. Ber. 1974, 107, 3786; (d) G. E. Herberich, B. Hessner, S. Beswetherick, J. A. K. Howard, P. Woodward, J. Organomet. Chem. 1980, 192, 421; (e) G. E. Herberich, B. Hessner, M. Negele, J. A. K. Howard, J. Organomet. Chem. 1987, 336, 29.
Citing Literature
This is the
German version
of Angewandte Chemie.
Note for articles published since 1962:
Do not cite this version alone.
Take me to the International Edition version with citable page numbers, DOI, and citation export.
We apologize for the inconvenience.