Erzeugung eines konfigurationsstabilen, chiralen Benzyllithium-Derivates und kapriziöse Stereochemie seiner elektrophilen Substitution†‡
Corresponding Author
Dr. Dieter Hoppe
Institut für Organische Chemie der Universität, Olshausenstraße 40, W-2300 Kiel 1
Institut für Organische Chemie der Universität, Olshausenstraße 40, W-2300 Kiel 1Search for more papers by this authorDipl.-Chem. Axel Carstens
Institut für Organische Chemie der Universität, Olshausenstraße 40, W-2300 Kiel 1
Search for more papers by this authorDr. Thomas Krämer
Institut für Organische Chemie der Universität, Olshausenstraße 40, W-2300 Kiel 1
Search for more papers by this authorCorresponding Author
Dr. Dieter Hoppe
Institut für Organische Chemie der Universität, Olshausenstraße 40, W-2300 Kiel 1
Institut für Organische Chemie der Universität, Olshausenstraße 40, W-2300 Kiel 1Search for more papers by this authorDipl.-Chem. Axel Carstens
Institut für Organische Chemie der Universität, Olshausenstraße 40, W-2300 Kiel 1
Search for more papers by this authorDr. Thomas Krämer
Institut für Organische Chemie der Universität, Olshausenstraße 40, W-2300 Kiel 1
Search for more papers by this authorDiese Arbeit wurde von der Deutschen Forschungsgemeinschaft und dem Fonds der Chemischen Industrie gefördert.
Professor Hans Jürgen Bestmann zum 65. Geburtstag gewidmet
Abstract
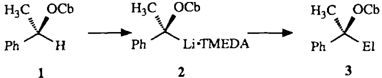
Je nach Elektrophil unter Retention oder Inversion der Konfiguration erfolgt die Substitution der in Lösung konfigurationsstabilen chiralen Benzyllithium-Verbindung 2, die durch Deprotonierung des entsprechenden optisch aktiven Benzylcarbamates 1 generiert wurde. Die Produkte 3 sind als Synthesebausteine von Interesse. Cb = C (=O)NiPr2.
References
- 1 D. J. Cram, C. A. Kingsberg, B. Rickborn, J. Am. Chem. Soc. 83 (1960) 3688–3696, zit. Lit.
- 2 H.-J. Gais, G. Hellmann, H. Günther, F. Lopez, H. J. Lindner, S. Braun, Angew. Chem. 101 (1989) 1061–1063; Angew. Chem. Int. Ed. Engl. 28 (1989) 1025–1027.
- 3[a] D. J. Cram, J. L. Mateos, F. Hauck, A. Langemann, K. R. Kopecky, W. D. Nielsen, J. Allinger, J. Am. Chem. Soc. 81 (1959) 5774–5784 sowie voranstehende Arbeiten dieser Gruppe; (b) L. A. Paquette, J. P. Gilday, C. S. Ra, J. Am. Chem. Soc. 109 (1987) 6858–6960.
- 4 A. G. Brook, J. D. Pescoe, J. Am. Chem. Soc. 93 (1971) 6224–6227.
- 5 A. Wright, R. West, J. Am. Chem. Soc. 96 (1974) 3227–3232.
- 6[a] A. I. Meyers, L. M. Fuentes, J. Am. Chem. Soc. 105 (1983) 117–118; (b) A. I. Meyers, L. M. Fuentes, Y. Kubota, Tetrahedron 40 (1984) 1361–1370; (c) A. I. Meyers, M. Boes, A. Dickmann, Angew. Chem. 96 (1984) 448–449; Angew. Chem. Int. Ed. Engl. 23 (1984) 458–460; (d) Übersicht: A. I. Meyers, D. A. Dickman, M. Boes, Tetrahedron 43 (1987) 5095–5108.
- 7 D. Seebach, I. M. P. Huber, Chimia 39 (1985) 233–234.
- 8[a] K. Rein, M. Goicoechea-Pappas, T. V. Anklekar, G. C. Hart, G. A. Smith, R. E. Gawley, J. Am. Chem. Soc. 111 (1989) 2211–2217; (b) M. F. Loewe, M. Boes, A. I. Meyers, Tetrahedron Lett. 26 (1985) 3295–3298.
- 9[a] D. Hoppe, T. Krämer, Angew. Chem. 98 (1986) 171–173; Angew. Chem. Int. Ed. Engl. 25 (1986) 160–162; (b) O. Zschage, J.-R. Schwark, D. Hoppe, Angew. Chem. Int. Ed. Engl. 102 (1990) 336–337 bzw. Angew. Chem. Int. Ed. Engl. 29 (1990) 296–297; (c) T. Krämer, J.-R. Schwark, D. Hoppe, Tetrahedron Lett. 30 (1989) 7037–7040.
- 10 Übersicht: D. Hoppe, Angew. Chem. 96 (1984) 930–946; Angew. Chem. Int. Ed. Engl. 23 (1984) 932–948.
- 11 D. Hoppe, A. Brönneke, Synthesis 1982, 1045–1048.
- 12 K. Laumen, M. P. Schneider, J. Chem. Soc. Chem. Commun. 1988, 598–600. Wir danken Professor Schneider und Dr. Laumen für ihre Hilfe bei der enzymatischen Esterhydrolyse.
- 13 W. H. Pirkle, M. S. Hoekstra, J. Org. Chem. 39 (1974) 3904–3906.
- 14 Zu einer Lösung von 1 mmol ( R)- 2 und 1.1 mmol TMEDA in 2 mL Hexan tropft man bei — 78 °C 1.1 mmol einer ca. 1.4 M sec-Butyllithium-Lösung in Cyclohexan-Isopentan und rührt 30 min bei dieser Temperatur. Zur gelben Lösung von (R)-3 gibt man bei — 78 °C 1.1 mmol des Elektrophils, rührt 30 min, läßt auf Raumtemperatur kommen, neutralisiert mit 2 mL 2N Salzsäure und extrahiert dreimal mit Ether. Die Reinigung erfolgt durch Flash-Chromatographie an Kieselgel mit Ether-Pentan (1:4 bis 1:8).
- 15 Wir schreiben der Lithiumverbindung 3 die ( R)-Konfiguration zu, da wir als „Fixpunkt”︁ von einer Deprotonierung unter Retention der Konfiguration ausgehen. Obwohl diese Annahme plausibel[9a] und theoretisch untermauert ist [16], wurde sie nach unserem Wissen nie streng bewiesen, da stets die absolute Konfiguration der Abfangprodukte, nicht aber die der metallorganischen Zwischenstufen selbst bestimmt wurde. Ein Gleichgewicht von monomerem 3 mit dimeren oder tetrameren Aggregaten bleibt zur Vereinfachung außer Betracht; vgl. dazu Zitate in [27].
- 16
Übersicht:
M. H. Abraham,
P. L. Grellier
in F. R. Hartley,
S. Patai (Hrsg.):
The Chemistry of the Metal-Carbon Bond,
Vol. 2,
Wiley, Chichester, Großbritannien
1985,
S. 25–149.
10.1002/9780470771747.ch2 Google Scholar
- 17 Alle neuen Verbindungen ergaben korrekte C,H-Elementaranalysen (C,H ± 0.3%).
- 18 1H-NMR-spektroskopisch bestimmt in ca. 0.1 M CDCl3-Lösuag mit 5–10 Mol-% Tris[(heptafluorhydroxymethylen)-D-campherato]europium(III) (Eu(hfpc)3).
- 19[a] M. Tramontini, L. Angiolini, C. Fouquey, J. Jaques, Tetrahedron 29 (1973) 4183–4187; (b) W. Kirmse, P. Feyen, Chem. Ber. 108 (1975) 71–78.
- 20 R)- 7 wurde mit einem aus ( R)-Atrolactinsäure erhaltenen Präparat korreliert; V. Prelog, Helv. Chem. Acta 36 (1953) 308–325.
- 21 E. Kaufmann, S. Sieber, P. von R. Schleyer, J. Am. Chem. Soc. 111 (1989) 4005–4008, zit. Lit.
- 22 Die ( R)-Konfiguration des Stannans (+)- 9 ist nicht rigoros gesichert; sie ergibt sich aus dem beobachteten Drehsinn durch Anwendung der Brewster-Regel [23]. In der Sequenz (+)- 9 → ( S)- 3 → (—)- 9 darf nur einer der beiden Schritte unter Inversion verlaufen, was mit der abgeleiteten Konfigurationszuordnung die Delithiostannylierung betrifft. Dies deckt sich auch mit der Tatsache, daß für Lithiodestannylierungen von α-Oxyalkylstannanen stets Retention festgestellt wurde [24, 25].
- 23[a] J. H. Brewster, Top. Stereochem. 2 (1967) 1–72; (b) Tetrahedron Lett. 20 (1959) 23–28.
- 24 D. Hoppe, F. Hintze, P. Tebben, Angew. Chem. 102 (1990) 1457; Angew. Chem. Int. Ed. Engl. 29 (1990) Nr. 12.
- 25[a] R. J. Linderman, A. Ghannam, J. Am. Chem. Soc. 112 (1990) 2392–2398; (b) P. C.-M. Chan, J. M. Chong Tetrahedron Lett. 31 (1990) 1985–1988, zit. Lit.
- 26 E. D. Jemmis, J. Chandrasekhar, P. von R. Schleyer, J. Am. Chem. Soc. 101 (1979) 527–533.
- 27[a] Röntgenstrukturanalysen von monomeren Benzyllithium-Solvensaddukten: W. Zarges, M. Marsch, K. Harms, G. Boche, Chem. Ber. 122 (1989) 2303–2309; (b) W. Zarges, M. Marsch, K. Harms, W. Koch, G. Frenking, G. Boche, Chem. Ber. 124 (1991), im Druck.
Citing Literature
This is the
German version
of Angewandte Chemie.
Note for articles published since 1962:
Do not cite this version alone.
Take me to the International Edition version with citable page numbers, DOI, and citation export.
We apologize for the inconvenience.