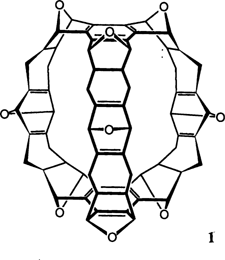
Trinacren – das Produkt einer strukturgerechten Synthese†
Peter R. Ashton
Department of Chemistry, The University GB-Sheffield S3 7HF (Großbritannien)
Search for more papers by this authorDr. Neil S. Isaacs
Department of Chemistry, The University Whiteknights, PO Box 224 GB-Reading RG6 2AD (Großbritannien)
Search for more papers by this authorDr. Franz H. Kohnke
Dipartimento di Chimica Organica e Biologica delľUniversitá di Messina Salita Sperone 31, I-98166 Messina (Italien)
Search for more papers by this authorProf. Guglielmo Stagno d'Alcontres
Dipartimento di Chimica Organica e Biologica delľUniversitá di Messina Salita Sperone 31, I-98166 Messina (Italien)
Search for more papers by this authorCorresponding Author
Dr. J. Fraser Stoddart
Department of Chemistry, The University GB-Sheffield S3 7HF (Großbritannien)
Department of Chemistry, The University GB-Sheffield S3 7HF (Großbritannien)Search for more papers by this authorPeter R. Ashton
Department of Chemistry, The University GB-Sheffield S3 7HF (Großbritannien)
Search for more papers by this authorDr. Neil S. Isaacs
Department of Chemistry, The University Whiteknights, PO Box 224 GB-Reading RG6 2AD (Großbritannien)
Search for more papers by this authorDr. Franz H. Kohnke
Dipartimento di Chimica Organica e Biologica delľUniversitá di Messina Salita Sperone 31, I-98166 Messina (Italien)
Search for more papers by this authorProf. Guglielmo Stagno d'Alcontres
Dipartimento di Chimica Organica e Biologica delľUniversitá di Messina Salita Sperone 31, I-98166 Messina (Italien)
Search for more papers by this authorCorresponding Author
Dr. J. Fraser Stoddart
Department of Chemistry, The University GB-Sheffield S3 7HF (Großbritannien)
Department of Chemistry, The University GB-Sheffield S3 7HF (Großbritannien)Search for more papers by this authorDiese Arbeit wurde von den UK Agricultural and Food und Engineering Research Councils sowie von der Universität von Messina (Italien) gefördert.
Abstract
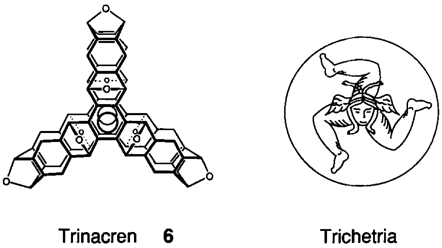
Eine vielversprechende – und wunderschöne – neue Hohlraumverbindung ist Trinacren 1, das nach einem alten Namen von Sizilien – Trinacrien – benannt ist. Die Synthese von 1 gelang in zwei Stufen durch sechs Diels-Alder-Reaktionen (2×3) hochsymmetrischer Vorstufen, wobei die zweite Stufe eine Hochdruckreaktion (10 kbar) ist. Das D3h-symmetrische 1 zeigt wie erwartet nur fünf 1H-NMR-Signale.
References
- 1 F. H. Kohnke, A. M. Z. Slawin, J. F. Stoddart, D. J. Williams, Angew. Chem. 99 (1987) 941 Angew. Chem. Int. Ed. Engl. 26 (1987) 892 P. R. Ashton, N. S. Isaacs, F. H. Kohnke, A. M. Z. Slawin, C. M. Spencer, J. F. Stoddart, D. J. Williams, Angew. Chem. Int. Ed. Engl. 100 (1988) 981 bzw. Angew. Chem. Int. Ed. Engl. 27 (1988) 966 J. F. Stoddart, Chem. Br. 24 (1988) 1203.
- 2 H. Hart, N. Raja, M. A. Meador, D. L. Ward, J. Org. Chem. 48 (1983) 4357 F. H. Kohnke, J. F. Stoddart, A. M. Z. Slawin, D. J. Williams, Acta Crystallogr. C44 (1988) 738, 742.
- 3 P. Vogel, A. Florey, Helv. Chim. Acta 57 (1974) 200 C. Mahain, P.-A. Carrupt, J.-P. Hagenbuch, A. Florey, P. Vogel, Helv. Chim. Acta 63 (1980) 1149 F. H. Kohnke, J. F. Stoddart, A. M. Z. Slawin, D. J. Williams, Acta Crystallogr. C44 (1988) 736.
- 4 Der Ubergang von„divalentem Benzol”︁, in Form des Bisdienophils 1, das zur Synthese von Gurtel-Verbindungen verwendet wurde, zu „trivalentem Benzol”︁, hier in Form des Trisdienophils 4 zum Aufbau eines molekularen Käfigs durch repetitive Diels-Alder-Reaktion benutzt, erinnert konzeptionell an den Ubergang von [18]Krone-6 (C. J. Pedersen, J. Am. Chem. Soc. 89 (1967) 7017) zum [2.2.2]-Cryptand (B. Dietrich, J.-M. Lehn, J.-P. Sauvage, Tetrahedron Lett. 1969, 2885, 2889), wobei zwei einander diagonal gegenuberliegende zweiwertige Sauerstoffatome durch dreiwertige Stickstoffatome ersetzt wurden, welche (in beiden Fällen) über -CH2CH2OCH2CH2OCH2CH2- Brucken verknupft waren. Man beachte, daß Naphthalin potentiell „tetravalent”︁ ist.
- 5 F. H. Kohnke, G. Stagno ďAlcontres, J. F. Stoddart, Abstr. 13th Int. Symp. Macrocyclic Chem., Hamburg, 4. – 8. September 1988, Gesellschaft Deutscher Chemiker, Frankfurt am Main 1988, S. 244.
- 6
Der Trivialname
Trinacren für 6 geht auf den alten Namen für Sizilien, nämlich Trinacrien, zuruck, was nach einer alten Legende von der Dreiecksform der Insel herruhrt. Als ob man diese Form noch unterstreichen wollte, war das Wappen von Trinacrien (A. Colocci, La Trinacria o Trichetria, Catania, Italien 1908) die Trichetrie, d. h. das Haupt (der Medusa) mit drei Beinen.
- 7 Das Trisdienophil wurde bisher (M. B. Springer, D. Wege, Tetrahedron Lett. 21 (1980) 3831) nur als Mischung des all-syn- (4) und anti-Isomeren (4a) in geringer Ausbeute ausgehend von 3,6-Dibromanthranilsäure erhalten.
- 8 Die regioselektive Synthese einer ganzen Reihe von Pyrrolderivaten (G. Ksander, G. Bold, R. Lattmann, C. Lehman, T. Fruh, Y.-B. Xiang, K. Inomata, H.-P. Buser, J. Schreiber, E. Zass, A. Eschenmoser, Helv. Chim. Acta 70 (1987) 1115 A. Eschenmoser, Angew. Chem. 100 (1988) 5 Angew. Chem. Int. Ed. Engl. 27 (1988) 5) wurde bemerkenswert leicht ausgehend von Substraten wie 2-Amino-2-propennitril bewerkstelligt, ohne daß dazu Reagenskontrolle nötig war. Es gibt daher inhärent einfache Synthesen für komplexe Strukturen. Weil die Synthesen von 3 und 6 auf hohe Diastereoselektivitäten in aufeinanderfolgenden Diels-Alder-Reaktionen beruhen, die von den Strukturen von Substrat und möglicherweise Produkt bestimmt werden, haben wir diese Art der Synthese nicht-naturlicher Produkte als strukturgerecht bezeichnet: P. R. Ashton, N. S. Isaacs, F. H. Kohnke, J. P. Mathias, J. F. Stoddart, Angew. Chem. 101 (1989) 1266 Angew. Chem. Int. Ed. Engl. 28 (1989) Nr. 9.
- 9 Die bicyclische Struktur der Diene und Dienophile 1, 2 und 4 ist ein notwendiger Bestandteil des Designs, nicht jedoch die Sauerstoffatome, die durch Schwefelatome oder durch Gruppen, wie etwa CH2 oder NR, ersetzt werden könnten, ohne daß notwendigerweise die gewunschten Diastereoselektivitäten in den [4 + 2]-Cycloadditionen leiden mußten.
- 10 Im Prinzip gibt es keinen Grund, den Begriff strukturgerechte Synthese auf organische Verbindungen zu beschränken. Die Existenz von Tonen und Zeolithen legt Zeugnis ab von der spontanen Ordnung anorganischer Substrate. Ohne Zweifel gibt es auch viele neue anorganisch-organische Verbindungen, in denen organische Substrate mit anorganischen in hochgeordneter Weise reagiert haben: J.-M. Lehn, A. Rigault, J. Siegel, J. Harrowfield, B. Chevier, D. Moras, Proc. Natl. Acad. Sci. USA 84 (1987) 2565 J.-M. Lehn, A. Rigault, Angew. Chem. 100 (1988) 1121 Angew. Chem. Int. Ed. Engl. 27 (1988) 1095.
- 11 Obschon Hexabrombenzol formal ein Trisarin-Äquivalent ist, bilden sich die Trisaddukte 4 und 4a nur in den sehr niedrigen Ausbeuten von 0.6 bzw. 1.8% bei einer stufenweisen Zugabe der Reagentien (Schema 3). Wir glauben, daß bei der Zugabe von 1.1 Äquivalenten, gefolgt von 2.2 Äquivalenten nBuLi ein Monoaddukt entsteht, und daß sich eine kleine Menge eines 1,3-Bisarins bildet nach der Lithiierung von para-Bromatomen und Elimnierung von Lithiumbromid. Gibt man nur 2.2 Äquivalente nBuLi in einem Schritt zu, dann entsteht als Hauptprodukt 9,10-Dibrom-1,4:5,8-diepoxy-1,4,5,8-tetrahydroanthracen – dessen anti-Isomer durch Röntgenstrukturanalyse charakterisiert wurde (A. M. Z. Slawin, D. J. Williams, unveröffentlichte Ergebnisse). Die Mehrfach-Lithiierung von Polyhalogenarenen zu Bisarinen wurde intensiv untersucht: H. Hart, G. C. Nwokogu, Tetrahedron Lett. 24 (1983) 5721 G. C. Nwokogu, H. Hart, Tetrahedron Lett. 24 (1983) 5725 H. Hart, C. Lai, G. C. Nwokogu, S. Shamouilian, A. Teuerstein, B. Zlotogorski, J. Am. Chem. Soc. 102 (1980) 6649 H. Hart, C. Lai, G. C. Nwokogu, S. Shamouilian, Tetrahedron 43 (1987) 5203. Zur Zeit beschäftigen wir uns mit der Verwendung von Hexahalogenbenzolen mit verschiedenen Halogenatomen, um mögliche Unterschiede in der Reaktivität gegenuber der Lithiierung auszunutzen und damit hochdiastereoselektiv Trisarine zu erzeugen. Eine effiziente Synthese des Trisdienophils 4 ist die grundlegende Voraussetzung um größere Mengen des Trinacrens 6 zu erhalten.
- 12 Statistisch bildet sich das anti-Isomer 4a dreimal häufiger als das all- syn-Isomer 4.
- 13 Nach P. G. Gassman, I. Gennick, J. Am. Chem. Soc. 102 (1980) 6864.
- 14 Cycloadditionen der ersten Dien-Einheit von 4 verlaufen gewöhnlich viel schneller (> 100 mal) als solche der zweiten Dien-Einheit: Y. Bessiére, P. Vogel, Helv. Chim. Acta 63 (1980) 232.
- 15 Die Tatsache, daß die Bruckenkopf-Methinprotonen im Hexahydrotriphenylentrisendoxid als Singulett erscheinen, beweist die endo-Konfiguration der Methin-Wasserstoffatome an den Stellen der Ringverknupfung: C. Mahaim, P. A. Carrupt, J.-P. Hagenbuch, A. Florey, P. Vogel, Helv. Chim. Acta 63 (1980) 1149.
- 16 N. S. Isaacs, A. V. George, Chem. Br. 23 (1987) 47.
- 17 J. F. Stoddart, Nature 334 (1988) 10.
Citing Literature
This is the
German version
of Angewandte Chemie.
Note for articles published since 1962:
Do not cite this version alone.
Take me to the International Edition version with citable page numbers, DOI, and citation export.
We apologize for the inconvenience.