Zuschrift
Full Access
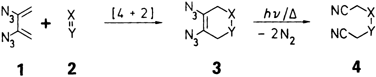
[4 + 2]-Cycloadditionen von 2,3-Diazido-1,3-butadienen: Ein neuer Zugang zu vicinalen Vinyldiaziden und 1,4-Dicyanverbindungen†
Dr. Klaus Banert,
Corresponding Author
Dr. Klaus Banert
Fachbereich 8, Organische Chemie II der Universität — Gesamthochschule Adolf-Reichwein-Straße, D-5900 Siegen
Fachbereich 8, Organische Chemie II der Universität — Gesamthochschule Adolf-Reichwein-Straße, D-5900 SiegenSearch for more papers by this authorDr. Klaus Banert,
Corresponding Author
Dr. Klaus Banert
Fachbereich 8, Organische Chemie II der Universität — Gesamthochschule Adolf-Reichwein-Straße, D-5900 Siegen
Fachbereich 8, Organische Chemie II der Universität — Gesamthochschule Adolf-Reichwein-Straße, D-5900 SiegenSearch for more papers by this author†
Reaktionen ungesättigter Azide, 4. Mitteilung. Diese Arbeit wurde von der Deutschen Forschungsgemeinschaft gefördert. Frau R. Stötzel sei für die Unterstützung bei einigen Synthesen gedankt. — 3. Mitteilung: [4].
Abstract
References
- 1
G. Smolinsky,
C. A. Pryde
in S. Patai (Hrsg.):
The Chemistry of the Azido Group,
Wiley-Interscience, London
1971,
S. 555;
10.1002/9780470771266.ch10 Google ScholarG. L'abbé, Angew. Chem. 87 (1975) 831; Angew. Chem. Int. Ed. Engl. 14 (1975) 775; A. Hassner in E. F. V. Scriven (Hrsg.): Azides and Nitrenes, Academic Press, Orlando, FL (USA) 1984, S. 35.10.1016/B978-0-12-633480-7.50006-7 Google Scholar
- 2 H. Priebe, Angew. Chem. 96 (1984) 728; Angew. Chem. Int. Ed. Engl. 23 (1984) 736.
- 3 K. Banert, Tetrahedron Lett. 26 (1985) 5261.
- 4 K. Banert, Chem. Ber., im Druck.
- 5 Reaktionen mit PTAD wurden in Chloroform, Reaktionen mit TCNE in Accton oder THF bei Raumtemperatur (eventuell unter Kühlung) durchgeführt. Diese Lösungsmittel wurden auch bei Thermolysen (20–60°C) und Photolysen (-10 bis -40°C, Quecksilberhochdruckbrenner, Duran-Gefäße) benutzt.
- 6 G. Smolinsky, C. A. Pryde, J. Org. Chem. 33 (1968) 2411.
- 7 J. H. Hall, J. Am. Chem. Soc. 87 (1965) 1147; D. S. Pearce, M.-S. Lee, H. W. Moore, J. Org. Chem. 39 (1974) 1362; A. Yabe, Bull. Chem. Soc. Jpn. 52 (1979) 789; Bull. Chem. Soc. Jpn. 54 (1981) 1176.
- 8 J. H. Hall, E. Patterson, J. Am. Chem. Soc. 89 (1967) 5856; M. E. Peek, C. W. Rees, R. C. Storr, J. Chem. Soc. Faraday Trans. 2 1974, 1260.
- 9 J. A. VanAllen, W. J. Priest, A. S. Marshall, G. A. Reynolds, J. Org. Chem. 33 (1968) 1100; H. W. Moore, M.-S. Lee, Tetrahedron Lett. 1971, 3645; D. S. Pearce, M. J. Locke, H. W. Moore, J. Am. Chem. Soc. 97 (1975) 6181.
- 10 Einfache vicinale Vinyldiazide (d.h. ohne direkt benachbarte elektronenziehende Substituenten oder ohne aromatische Struktur) waren bisher nicht isoliert, sondern nur als Zwischenstufen vorgeschlagen worden: A. Hassner, R. J. Isbister, A. Friederang, Tetrahedron Lett. 1969, 2939.
- 11 A. Mustafa, S. M. A. D. Zayed, S. Khattab, J. Am. Chem. Soc. 78 (1956) 145; W. I. Awad, S. M. A. R. Omran, F. Nagieb, Tetrahedron 19 (1963) 1591; W. L. Mosby, M. L. Silva, J. Chem. Soc. 1964, 3990; E. Winkelmann, Tetrahedron 25 (1969) 2427; H. W. Moore, D. L. Maurer, D. S. Pearce, M. S. Lee, J. Org. Chem. 37 (1972) 1984; P. Gangneux, E. Marechal, Bull. Soc. Chim. Fr. 1973, 1466; W. H. Gilligan, M. J. Kamlet, Tetrahedron Lett. 1978, 1675; U. Chandra Singh, M. S. Ramachandran, N. R. Subbaratnam, V. K. Kelkar, Spectrochim. Acta Part A 35 (1979) 663.
- 12 W. L. Mosby, M. L. Silva, J. Chem. Soc. 1965, 1003; R. Bolton, J. P. B. Sandall, J. Chem. Soc. Perkin Trans. 2 1978, 1288.
- 13 T. Gotoh, A. B. Padias, H. K. Hall Jr., J. Am. Chem. Soc. 108 (1986) 4920.
- 14 C. J. Ireland, J. S. Pizey, J. Chem. Soc. Chem. Commun. 1972, 4; C. J. Ireland, K. Jones, J. S. Pizey, S. Johnson, Synth. Commun. 6 (1976) 185.
- 15 C. L. Dickinson, D. W. Wiley, B. C. McKusick, J. Am. Chem. Soc. 82 (1960) 6132.
- 16 Wird ein Gemisch aus 13–15 mit TCNE umgesetzt, so bildet sich aufgrund der großen Reaktivitätsunterschiede zunächst >17, das sich leicht von 14 und 15 trennen läßt; auch 18 ist leicht von 15 zu trennen. NMR-Untersuchungen zeigen, daß die Ausbeuten an 17–20 ähnlich hoch sind wie die bei der Reaktion 1→4→5.
- 17 Aus 16 und TCNE bildet sich kein 21. Diese Verbindung wurde bereits synthetisiert: W. J. Middleton, R. E. Heckert, E. L. Little, C. G. Krespan, J. Am. Chem. Soc. 80 (1958) 2783.
- 18 Ausführliche kinetische Untersuchungen über Cycloadditionen der Kohlenwasserstoffe mit TCNE: C. Rücker, D. Lang, J. Sauer, H. Friege, R. Sustmann, Chem. Ber. 113 (1980) 1663. (E,E)-2,4-Hexadien wird hierbei erwartungsgemäß erheblich schneller umgesetzt als (E)-1,3-Pentadien.
Citing Literature
This is the
German version
of Angewandte Chemie.
Note for articles published since 1962:
Do not cite this version alone.
Take me to the International Edition version with citable page numbers, DOI, and citation export.
We apologize for the inconvenience.