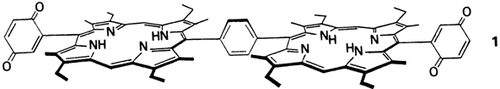
Synthese von 1,3- und 1,4-phenylenverknüpften bischinonsubstituierten Porphyrin-Dimeren†
Corresponding Author
Prof. Dr. Jonathan L. Sessler
Department of Chemistry, University of Texas Austin, TX 78 712 (USA)
Department of Chemistry, University of Texas Austin, TX 78 712 (USA)Search for more papers by this authorMartin R. Johnson
Department of Chemistry, University of Texas Austin, TX 78 712 (USA)
Search for more papers by this authorCorresponding Author
Prof. Dr. Jonathan L. Sessler
Department of Chemistry, University of Texas Austin, TX 78 712 (USA)
Department of Chemistry, University of Texas Austin, TX 78 712 (USA)Search for more papers by this authorMartin R. Johnson
Department of Chemistry, University of Texas Austin, TX 78 712 (USA)
Search for more papers by this authorDiese Arbeit wurde von der Robert A. Welch Foundation, der Camille and Henry Dreyfus Foundation (Distinguished New Faculty Grant 1984) und durch einen National Science Foundation (USA) Presidential Young Investigator Award gefördert.
Abstract
Alle bisher synthetisierten Modellverbindungen für das photosynthetische Reaktionszentrum (RC) variierten den Abstand zwischen Donor- und Acceptoreinheit. Da aber, wie die Strukturbestimmung des RCs ergab, auch die Orientierung der Makrocyclen zueinander wichtig ist, wurden erstmals Modelle mit verschiedenen fixierten Winkeln zwischen den Porphyrineinheiten synthetisiert: das lineare 1 und ein giebelartiges Analogon. Lösungen beider Verbindungen in Toluol zeigen bei 418 nm-Anregung keine Fluoreszenz.
References
- 1 J. Deisenhofer, O. Epp, K. Miki, R. Huber, H. Michel, J. Mol. Biol. 180 (1984) 385.
- 2 J. Weiser, H. A. Staab, Angew. Chem. 96 (1984) 602; Angew. Chem. Int. Ed. Engl. 23 (1984) 623; B. Morgan, D. Dolphin, Angew. Chem. Int. Ed. Engl. 97 (1985) 1000 bzw. Angew. Chem. Int. Ed. Engl. 24 (1985) 1003, zit. Lit.; P. Leighton, J. K. M. P, J. Chem. Soc. Chem. Commun. 1985, 24; J. R. Bolton, T.-F. Ho, S. Liauw, A. Siemiarczuk, C. S. K. Wan, A. C. Weedon, J. Chem. Soc. Chem. Commun. 1985, 559; M. R. Wasielewski, M. P. Niemczyk, W. A. Svec, E. B. Pewitt, J. Am. Chem. Soc. 107 (1985) 1080, 5562; J. A. Schmidt, A. Siemiarczuk, A. C. Geedon, J. R. Bolton, J. Am. Chem. Soc. 107 (1985) 6112; B. A. Leland, A. D. Joran, P. M. Felker, J. J. Hopfield, A. H. Zewail, P. B. Dervan, J. Phys. Chem. 89 (1985) 5571; C. Krieger, J. Weiser, H. A. Staab, Tetrahedron Lett. 26 (1985) 6055; J. Weiser, H. A. J, Tetrahedron Lett. 1985, 6059; A. Osuka, H. Furuta, K. Maruyama, Chem. Lett. 1986, 479; D. N. Beratan, J. Am. Chem. Soc. 108 (1986) 4321; D. Gust, T. A. Moore, L. R. Makings, P. A. Liddell, G. A. Nemeth, A. L. Moore, J. Am. Chem. Soc. 108 (1986) 8028.
- 3(a) Bisher ist lediglich ein Bericht über ein chinonsubstituiertes Porphyrin-Dimer erschienen: Y. Sakata, S. Nishitani, N. Nishimizu, S. Misumi, A. R. McLntosh, J. R. Bolton, Y. Kanda, A. Karen, T. Okada, N. Mataga, Tetrahedron Lett. 26 (1985) 5207; (b) Modellverbindungen für das photosynthetische Reaktionszentrum mit zwei oder mehr porphyrinartigen Makrocyclen (jedoch ohne Chinone): S. G. Boxer, Biochim. Biophys. Acta 726 (1983) 265, zit. Lit.; M. R. Wasielewski, M. P. Niemczyk, W. A. Svec, Tetrahedron Lett. 23 (1982) 3215; J. C. Mialocq, C. Giannotti, P. Maillard, M. Momenteau, Chem. Phys. Lett. 112 (1984) 87; G. M. Dubowchik, A. D. Hamilton, J. Chem. Soc. Chem. Commun. 1986, 665, 1391; R. L. Brookfield, H. Ellul, A. Harriman, G. Porter, J. Chem. Soc. Faraday Trans. 2 1986, 219. (c) Nach Einreichung dieser Arbeit wurde über die Synthese eines Analogons der unsubstituierten photosynthetischen Modellverbindung 4 berichtet: D. Heiler, G. McLendon, P. Rogalskyj, J. Am. Chem. Soc. 109 (1987) 604.
- 4 I. Tabushi, T. Sasaki, Tetrahedron Lett. 23 (1982) 1913; I. Tabushi, S.-I. Kugimiya, M. G. Kinnaird, T. Sasaki, J. Am. Chem. Soc. 107 (1985) 4192.
- 5(a) G. P. Arsenault, E. Bullock, S. F. MacDonald, J. Chem. Soc. 1960, 4384; (b) C. K. Chang, I. Abdalmuhdi, Angew. Chem. 96 (1984) 154; Angew. Chem. Int. Ed. Engl. 23 (1984) 164; (c) I. Abdalmuhdi, C. K. Chang, J. Org. Chem. 50 (1985) 411; (d) S. S. Eaton, G. R. Eaton, C. K. Chang, J. Am. Chem. Soc. 107 (1985) 3177.
- 6 J. L. Sessler, J. Hugdahl, M. R. Johnson, J. Org. Chem. 51 (1986) 2838.
- 7 J. L. Archibald, D. M. Walker, K. B. Shaw, A. Markovac, S. F. MacDonald, Can. J. Chem. 44 (1966) 345; D. H. R. Barton, S. Z. Zard, J. Chem. Soc. Chem. Commun. 1985, 1098.
- 8 Mit Ausnahme von 14 (zu schwer löslich zum Reinigen) und 12 (Charakterisierung nur spektroskopisch) lieferten alle neuen Porphyrine befriedigende spektroskopische, analytische und massenspektrometrische Daten; dipyrrolische Zwischenstufen wurden durch 1H-NMR-Spektren und hochaufgelöste Massenspektren charakterisiert.
- 9 R. Chong, P. S. Clezy, A. J. Liepa, A. W. Nichol, Austr. J. Chem. 22 (1969) 229.
- 10 C. K. Chang, I. Abdalmuhdi, J. Org. Chem. 48 (1983) 5388.
- 11 J. Dalton, L. R. Milgrom, J. Chem. Soc. Chem. Commun. 1979, 609; A. Harriman, R. J. Hosie, J. Chem. Soc. Faraday Trans. 2 1981, 1695; M. A. Bergkamp, J. Dalton, T. L. Netzel, J. Am. Chem. Soc. 104 (1982) 253; A. C. Chan, J. Dalton, L. R. Milgrom, J. Chem. Soc. Perkin Trans. 2 1982, 707.
Citing Literature
This is the
German version
of Angewandte Chemie.
Note for articles published since 1962:
Do not cite this version alone.
Take me to the International Edition version with citable page numbers, DOI, and citation export.
We apologize for the inconvenience.