Abstract
deAufgrund niedriger Ligningehalte eignen sich schwach verholzte Biomassearten, wie Biertreber und Grassilage, gut für den Einsatz in Bioraffinerien. Dafür kann die Biomasse auf verschiedene Arten fraktioniert bzw. aufgearbeitet und zu Wertstoffen umgesetzt werden. Am Beispiel von Biertreber wird eine Feststofffermentation mit Cellulomonas uda und eine hydrothermale sowie enzymatische Verzuckerung inklusive der Inhibitorbildung betrachtet. Für die Verwertung von Grassilage wird exemplarisch eine hydrothermale Vorbehandlung mit anschließender simultaner Verzuckerung und Fermentation aufgezeigt.
Abstract
enWeakly lignified biomass, like brewers' spent grain and grass silage, is good feedstock for biorefineries. The biomass can be separated and converted into valuable products in different ways. In this study, brewers' spent grain is used to investigate solid state fermentations with Cellulomonas uda. Additionally, hydrothermal pretreatment and subsequent enzymatic saccharification, as well as formation of inhibitory compounds, is demonstrated. Hydrothermal pretreatment combined with simultaneous saccharification and fermentation is shown as an example for the utilization of grass silage.
1 Einleitung
Zur Lösung aktueller Probleme, wie z. B. der globalen Erderwärmung, der Unterernährung in Teilen der Welt, der Luftverschmutzung und der Endlichkeit fossiler Rohstoffe, werden seit längerem auch in der Industrie Bioraffineriekonzepte diskutiert. Grundsätzlich bezeichnet eine Bioraffinerie, analog zur Erdölraffinerie, die Fraktionierung und separate Nutzung verschiedener, schwer zugänglicher Inhaltsstoffe eines biogenen Rohstoffs 1, 2. Während in einer Erdölraffinerie vornehmlich Alkane verschiedener Kettenlänge sowie weitere (unerwünschte) Komponenten des Rohöls getrennt werden müssen, steht bei einer Bioraffinerie die Auftrennung der Biomasse in verwertbare Intermediate (z. B. Zucker, Stärke, Cellulose, Hemicellulose, Lignin und Proteine) im Vordergrund. Die erhaltenen Fraktionen werden anschließend meist mittels fermentativer Methoden zu Wertstoffen, wie Kraftstoffen oder organischen Säuren, umgesetzt 3, 4. Die Reststoffe können in der Tiermast (Einzellerprotein), als Brennstoff (Reste der Biomasse) oder als Dünger (zurückbleibende Fermentationsmedien) verwendet werden, wodurch die Entstehung neuer Biomasse unterstützt werden kann.
Als Substrate für Bioraffinerien eignen sich alle cellulose-, hemicellulose-, stärke- und zuckerhaltigen Pflanzenbestandteile. Darüber hinaus können ölhaltige Pflanzen und Algen eingesetzt werden 5. Allerdings ist die Wissenschaft aufgrund der sogenannten Teller-Tank-Diskussion in den letzten Jahren davon abgekommen, (stärke- bzw. zuckerhaltige) Nutzpflanzen zum Zwecke der bioraffinerie-basierten Nutzung vorzuschlagen. Vielmehr liegt der Forschungsfokus aktuell auf agroindustriellen und städtischen Abfall- bzw. Nebenprodukten, für die es bislang keine oder nur unzureichende Anwendungsmöglichkeiten gibt, wie z. B. Zuckerrohr-Bagasse, organischer städtischer Abfall oder (Gersten-)Stroh 3, 4, 6. Biomasse eignet sich für den Einsatz in Bioraffinerien insbesondere, wenn es sich um schwach verholzte Biomasse mit geringem Ligninanteil handelt. Das phenolische Heteropolymer Lignin kann bei verholzten Strukturen bis zu 55 % der Biomasse ausmachen 7 und stellt für bioverfahrenstechnische Anwendungen einen sehr fordernden Rohstoff dar. Zwar kann Lignin durch Weißfäulepilze abgebaut werden 8 und wird als Zusatz in verschiedenen Materialien diskutiert 9, allerdings sind diese (potenziellen) Anwendungen rar gesät und haben bisher bis auf wenige Ausnahmen keine industrielle Relevanz. Die ökonomische Nutzung von Lignin ist bislang vornehmlich für die Synthese von Vanillin beschrieben 10. Daher werden in dieser Publikation potenzielle Nutzungsmöglichkeiten für die schwach verholzten Biomassearten Biertreber und Grassilage aufgezeigt, die hohe Cellulose- und Hemicellulosegehalte aufweisen.
2 Biertreber als Feedstock für Bioraffineriekonzepte
Jährlich entstehen ca. 39 Millionen Tonnen Biertreber als Nebenprodukt des Brauprozesses 11. Treber hat einen Anteil von 85 % an den gesamten anfallenden Nebenprodukten des Brauprozesses, lediglich 15 % entfallen auf Hopfen- und Hefebestandteile 12. Wegen hoher Kohlenhydrat- und Proteingehalte wird Treber vornehmlich als Futtermittel eingesetzt, wobei ein Marktwert von ca. 35 € t−1 angenommen werden kann 13. Aufgrund hoher Verfügbarkeit, niedrigem Marktwert und kurzer Haltbarkeit 14 ist es sinnvoll, weitere Anwendungsfelder für Treber, z. B. als Einsatzstoff für Bioraffinerien zur Produktion von Grund- und Feinchemikalien, zu untersuchen.
2.1 Zusammensetzung von Biertreber und bioverfahrenstechnische Nutzung der Bestandteile
Treber besteht sowohl aus festen als auch aus löslichen, anhaftenden Komponenten. Bei den festen Bestandteilen handelt es sich um lignocellulosehaltige Biomasse (Cellulose, Hemicellulose, Lignin), die durch eine Protein- und Lipidfraktion sowie durch weitere Bestandteile komplettiert wird (Abb. 1). Die Bestimmungsmethoden für Dextrin, strukturelle Kohlenhydrate, Lignin und Asche wurden an anderer Stelle beschrieben 15. Der N-Gehalt des Trebers wurde mittels Kjeldahl-Analyse bestimmt. Zur Berechnung des Proteinanteils aus dem N-Gehalt wurde ein Konversionsfaktor von 5,7 angewendet 16. Lipide wurden mittels Soxhlet-Extraktion ermittelt 16.

Die festen Bestandteile werden klassischerweise nach hydrothermaler/säurebasierter und enzymatischer Verzuckerung mittels fermentativer Methoden zu Wertstoffen umgesetzt 17-19. Den größten Anteil der löslichen Komponenten stellen Abbauprodukte der Stärke aus dem Brauprozess dar (Dextrin). Allerdings finden sich auch eine Vielzahl freier Aminosäuren, Peptid(fragmente) und Anionen- sowie Kationen unter den löslichen Bestandteilen 20. Die löslichen Komponenten können durch verschiedene Operationen, im Folgenden Upstream-Methoden genannt, vom Treberfeststoff abgetrennt werden, da aus der Fraktionierung zahlreiche Vorteile entstehen. Dazu eignen sich insbesondere Pressverfahren, z. B. mit Schnecken- oder Stempelpressen 15, 20. Die zuckerhaltige, flüssige Fraktion kann zur Produktion verschiedener Wertstoffe genutzt werden, u. a. können Milchsäure 20, Citronensäure 21 und Lipide bzw. Carotinoide 22 hergestellt werden. Da knapp 60 % des Trebers aus Zucker besteht (in Form von Dextrin, Hemicellulose und Cellulose) und der Ligninanteil mit knapp 15 % recht gering ausfällt, handelt es sich um einen interessanten Rohstoff für eine Vielzahl von bioverfahrenstechnischen Applikationen.
2.2 Feststofffermentationen von Biertreber mit Cellulomonas uda
Treber kann ohne vorherige hydrothermale Vorbehandlung in Feststofffermentationen zu Wertstoffen umgesetzt werden. Häufig kommen hierfür Pilze, wie z. B. Rhizopus microsporus, Mucor circinelloides oder Trametes versicolor zum Einsatz 23-25. In dieser Studie wurde das grampositive Bakterium Cellulomonas uda DSM 20108 verwendet, um den Treber zu verwerten. Dazu wurden die löslichen Anteile des Trebers abgepresst (Hochdrucktinkturenpresse HP 2 H, Fischer Maschinenfabrik GmbH, Neuss, Deutschland), so dass der Organismus nur die strukturellen Kohlenhydrate des Trebers nutzen konnte. Der Rückstand wurde bei 50 °C für 48 h getrocknet und mit einer Scheibenmühle (Fidibus Classik, Komo GmbH & Co. KG, Hopfgarten, Deutschland) gemahlen. Getrockneter, gemahlener Treber und Puffer wurden separat bei 121 °C für 30 min autoklaviert, um eine hydrothermale Aufschlussreaktion zu unterbinden. Daraufhin wurde der Treber genutzt, um 100 mL einer 5 Gew.%-igen Suspension mit 0,2 M MOPS-Puffer in einem 250 mL Kolben (Schikanenkolben mit GL 45 Gewinde, DWK Life Sciences, Wertheim/Main, Deutschland) herzustellen. Dieses Kulturmedium wurde anschließend mit einer Cryo-Kultur inokuliert. Während der ersten drei Fermentationstage wurde die Kultur aerob bei 30 °C, 120 rpm und einem Hub von 25 mm geschüttelt (Ecotron, Infors AG, Bottmingen, Schweiz). Dann wurde die Kultur mit einem Septum (Butylstopfen-massiv, Glasgerätebau Ochs Laborfachhandel e.K., Bovenden, Deutschland) verschlossen, zur Anaerobisierung für 2 h mit N2 gespült und weiter bei gleichen Bedingungen kultiviert. Dieses Vorgehen war analog zu vorherigen Kultivierungen von C. uda mit dem Substrat Cellulose 26.
Während der Fermentation von C. uda mit Biertreber wurden die fünf Produkte einer klassischen Gemischtsäuregärung Bernsteinsäure, Milchsäure, Ameisensäure, Essigsäure und Ethanol gebildet (Abb. 2A), die auch schon für das Wachstum mit Cellulose beschrieben wurden. Allerdings war keine strikte Trennung zwischen aerober Phase mit Zellwachstum aber ohne Produktbildung und anaerober Phase mit Bildung der Stoffwechselendprodukte zu erkennen 26. C. uda nutzte sowohl die Cellulose als auch die Hemicellulose aus dem Biertreber als Substrat, was sich in einer Abnahme des Celluloseanteils von 20,0 Gew.-% auf 15,1 Gew.-% und des Hemicelluloseanteils von 30,8 Gew.-% auf 17,4 Gew.-% wiederspiegelt (Abb. 2B). Die Expression von Cellulasen und Hemicellulasen durch C. uda wurde bereits in der Literatur beschrieben. Cellulasen sind vornehmlich in der aeroben Phase aktiv, wohingegen die Hemicellulasen vermehrt in der anaeroben Phase exprimiert werden 27, 28. Da dem Kulturmedium in diesem Experiment keinerlei Stickstoffquelle, wie z. B. Hefeextrakt, zugegeben wurde, scheint der Organismus auch die Proteinfraktion des Trebers zur Biosynthese zu nutzen und seine weiteren, komplexen Nährstoffansprüche 26 ausschließlich aus dem Treber decken zu können. Die, aus den strukturellen Kohlenhydraten freigesetzten, Zucker wurden unterschiedlich verwertet, wie aus Abb. 2B ersichtlich wird. Während Cellobiose nur in der aeroben Phase vorhanden war, akkumulierten Xylose (in geringem Maße) und Arabinose bis zu einer Konzentration von 0,8 g L−1 im Kulturüberstand vornehmlich in der anaeroben Phase. Cellulomonaden können alle drei genannten Zucker als Kohlenstoffquelle nutzen 28, 29, jedoch scheint Arabinose im Vergleich zu Cellobiose und Xylose in diesem Experiment ein weniger präferierter Zucker zu sein. Die Produkt- zu Substratausbeute wurde unter Berücksichtigung der verbrauchten strukturellen Kohlenhydrate, der akkumulierten Zucker und der gebildeten Produkte mit einem Wert von YPS = 0,91 gProdgSub−1 bestimmt.
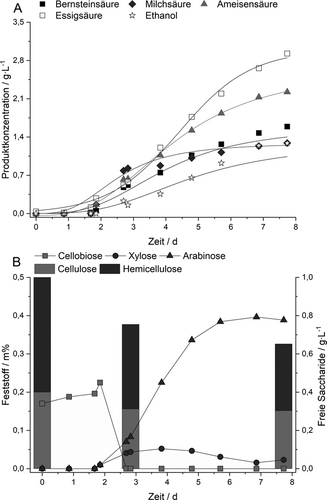
Trotz der guten Produktausbeute muss der Prozess hinsichtlich einer Lenkung des Produktspektrums zu einem Produkt, höheren Produkttitern und einer vollständigen Nutzung der strukturellen Kohlenhydrate optimiert werden. Allerdings konnte eine potenzielle Nutzung aufgezeigt werden, die Treber bei milden Reaktionsbedingungen in einem Schritt zu verschiedenen organischen Säuren und Ethanol umsetzen kann.
2.3 Hydrothermale Vorbehandlung von Biertreber
Im Gegensatz zur direkten Nutzung des Trebers in Feststofffermentationen kann die Lignocellulose nach geeigneten Vorbehandlungsmethoden, wie dem Liquid-Hot-Water- (LHW) oder dem Organosolv(OS)-Verfahren, in Submersfermentationen als Substrat verwendet und mikrobiologisch umgesetzt werden 15. Beim LHW-Verfahren wird die Biomasse bei hohen Temperaturen (160–240 °C) mit flüssigem Wasser unter entsprechend hohem Druck inkubiert, wodurch die strukturelle Integrität der Lignocellulose aufgebrochen wird. Durch die verstärkte Autoprotolyse von Wasser bei hohen Temperaturen und Drücken sowie durch die Abspaltung von Acetyl-Seitengruppen der Hemicellulose erfolgen ein Abfall des pH-Werts und dadurch eine sauer katalysierte Hydrolyse der Hemicellulose 30. In einem anschließenden enzymatischen Schritt können zuckerreiche Hydrolysate hergestellt werden, die den eingesetzten Mikroorganismen als Kohlenstoffquelle dienen 15.
In dieser Studie wurden unterschiedliche Upstream-Methoden zur Entfernung der löslichen Komponenten des Trebers (s. Sect. 2.1) vor der hydrothermalen Vorbehandlung eingesetzt. Einerseits wurde die lösliche Fraktion mit einer Tinkturenpresse (TP) bei 200 bar abgetrennt, andererseits kam eine Doppelschneckenpresse (SP) (Angel Juicer 8500S, Angel Juicer Deutschland LUBA GmbH, Bad Homburg v.d.H., Deutschland) zum Einsatz. Außerdem wurde eine Scheibenmühle zum Mahlen von Treber verwendet. Anschließend wurde für alle Upstream-Methoden ein LHW-Aufschluss bei 180 °C mit 15 min Haltezeit und einem Flottenverhältnis von 1:10 (Treber:Wasser) in einem Hochdrucklaborreaktor (BR-500, Berghof Products + Instruments GmbH, Eningen, Deutschland) durchgeführt. Die verwendeten Analysemethoden sind an anderer Stelle beschrieben 15. Um die Effektivität der hydrothermalen Behandlungen zu überprüfen, wurden die Rückstände in einer enzymatischen Hydrolyse mit 0,1 gEnzymlösunggTreber−1 (Enzymlösung: Ultraflo®Max und Ultraflo®Core, im Verhältnis 1:1, Novozymes A/S, Bagsvaerd, Dänemark) verzuckert. Die Umsetzung von 50 g L−1 Aufschlussrückstand erfolgte für 96 h in 0,1 M Na-Acetat-Puffer (pH 5) bei 50 °C und 25 rpm.
Die Zusammensetzungen der Aufschlussrückstände nach der hydrothermalen Behandlung sind in Abb. 3 aufgetragen. Im Vergleich mit der Zusammensetzung des unbehandelten Rohstoffs (linker Balken) ist zu sehen, dass alle eigesetzten Upstream-Methoden zu einer Anreicherung an Glucan von < 0,20 Gew.-% auf bis zu 0,38 Gew.-% im Rückstand führten. Diese Anreicherung fiel beim Einsatz des gemahlenen Trebers am geringsten aus. Zusätzlich wurde durch die LHW-Aufschlüsse ein Großteil der Hemicellulose entfernt, wobei dieser Effekt bei gemahlenem Treber besonders ausgeprägt war (von 32,8 Gew.-% auf 4,1 Gew.-%). Da bei einem LHW-Aufschluss wenig Lignin entfernt wird 31, entfielen auch in der vorgestellten Untersuchung entsprechend höhere Massenanteile auf diesen Bestandteil der Lignocellulose.
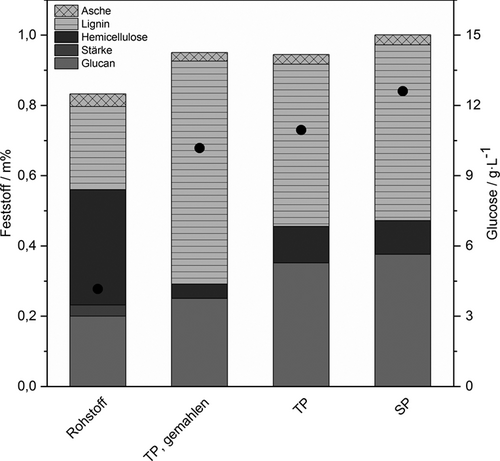
In Abhängigkeit von der Upstream-Methode wurden nach der enzymatischen Hydrolyse unterschiedliche Glucosekonzentrationen im Hydrolysat erreicht, die ebenfalls in Abb. 3 dargestellt sind. Mit 12,61 g L−1 wurde die höchste Glucosekonzentration beim Einsatz des Aufschlussrückstands, der mit der SP abgepresst wurde, erzielt. Dies entspricht, bezogen auf den Glucangehalt im Substrat, einer Ausbeute von ca. 70 %. Da die Aufschlussrückstände (und insbesondere die Glucangehalte der Rückstände), die mit der SP und der TP abgepresst wurden, vergleichbar waren, kann davon ausgegangen werden, dass die strukturelle Integrität der Lignocellulose bei der Vorbehandlung mit der SP aufgrund der Doppelwalzen stärker aufgebrochen wurde als beim Einsatz der TP. In der Literatur wurde beschrieben, dass Oberflächenvergrößerungen (durch mechanische Beanspruchung) die Zugänglichkeit des Glucans für die eingesetzten Enzyme erhöhen können 32. In dieser Studie konnte gezeigt werden, dass bereits die Wahl der Upstream-Methode einen Einfluss auf die Effektivität einzelner Unit Operations im Rahmen einer Bioraffinerie haben kann. Aus diesem Grund sollten alle Prozessschritte auf die jeweilige Verwendung der Biomasse abgestimmt sein, um ein holistisches Nutzungskonzept möglichst effektiv zu gestalten.
2.4 Bildung hydrothermaler Abbauprodukte
Hydrothermale Vorbehandlungen haben neben dem Aufbrechen der strukturellen Integrität der lignocellulosen Struktur in Biomasse den Effekt, dass entstehende Glucose-, Xylose-, und Arabinosemonomere zu hydrothermalen Abbauprodukten weiterreagieren können. Dabei entsteht aus Glucose in Dehydratisierungsreaktionen Hydroxymethylfurfural (HMF) und aus Xylose/Arabinose das hydrothermale Abbauprodukt Fufural. In der Literatur wurde bereits gezeigt, dass diese Verbindungen durch Hydrolysereaktionen weiter zu Essig- und Ameisensäure reagieren können 33. Die entstehenden hydrothermalen Abbauprodukte sind dafür bekannt, das Zellwachstum zahlreicher Mikroorganismen zu inhibieren und sollten deshalb möglichst gering gehalten werden 18, 34. Daher wurde in dieser Studie der Einfluss der Behandlungszeit, -temperatur sowie des Abpressens der wasserlöslichen Komponenten (s. Sect. 2.3) auf die Bildung hydrothermaler Abbauprodukte untersucht.
Dazu wurden LHW-Behandlungen in einem 23-mL-Aufschlussgefäß (Modell 4749, Parr Instrument GmbH, Frankfurt am Main, Deutschland) bei 160 °C und 180 °C durchgeführt. Als Lösungsmittel wurde vollentsalztes Wasser bei einem Flottenverhältnis von 1:5 (Treber:Wasser) eingesetzt, wobei die Behandlungszeit zwischen 180 min und 360 min variierte. Eine Durchmischung der Reaktanden wurde durch horizontale Rotation um eine Welle mit 50 rpm gesichert.
Die Menge freigesetzter Inhibitoren bei den gewählten Versuchsparametern sowie die zugehörigen pH-Werte im Aufschlussüberstand wurden, wie bereits beschrieben 15, analysiert und sind in Abb. 4 dargestellt. Alle hydrothermalen Vorbehandlungen, die mit abgepresstem Treber als Substrat durchgeführt wurden, zogen eine geringere Bildung an HMF nach sich als die entsprechenden Aufschlüsse mit unbehandeltem Treber. Der beobachtete Effekt wurde bereits in einer anderen Studie für LHW-Behandlungen bei 180 °C mit einer Behandlungszeit von 90 min beschrieben und resultiert aus der Entfernung der wasserlöslichen Glucose-Oligosaccharide (s. Sect. 2.1), die bei hydrothermalen Vorbehandlungen zu HMF reagieren können 15. Im Gegensatz dazu konnte in dieser Arbeit bei der Bildung der Inhibitoren Furfural, Essigsäure und Ameisensäure durch das Abpressen der wasserlöslichen Komponenten keine Verringerung erzielt werden.
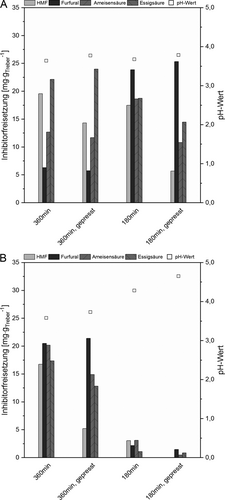
Zusätzlich konnte bezüglich der Bildung von Furfural festgestellt werden, dass bei den LHW-Behandlungen bei 180 °C und 360 min Behandlungszeit ca. 5 mgFurfuralgTreber−1 freigesetzt wurden, wohingegen bei der Behandlungszeit von 180 min die fünffache Menge (ca. 20 mgFurfuralgTreber−1) entstand (Abb. 4A). Im Gegensatz dazu wurde bei den LHW-Behandlungen bei 160 °C mit einer Behandlungszeit von 360 min ca. 20 mgFurfuralgTreber−1 detektiert (Abb. 4B). Außerdem wurde bei einer Behandlungszeit von 180 min mit ca. 2 mgFurfuralgTreber−1 deutlich weniger Furfural gebildet. Dies spricht dafür, dass Furfural bei einer Reaktionstemperatur von 180 °C mit ansteigender Behandlungszeit weitere Reaktionen eingeht. Ähnliche Beobachtungen wurden bereits bei der hydrothermalen Umsetzung von Arabinoxylan bei 240 °C mit Behandlungszeiten von 2, 5 und 10 min und bei der LHW-Behandlung von Maiskolben bei 180 °C und Behandlungszeiten von 5, 10 und 20 min in der Literatur beschrieben 35, 36. Als mögliche Reaktionsprodukte werden z. B. Ameisensäure oder Essigsäure genannt 33. Jedoch sprechen die ähnlichen pH-Werte in den Aufschlussüberständen und die geringen Unterschiede an Gesamtsäuren, die in der vorliegenden Arbeit gemessen wurden, gegen diese Umwandlung. Näherliegend ist eine Polymerisierung oder Kondensation beispielsweise an Bestandteile des enthaltenen Lignins, die in der Literatur vorgeschlagen werden 33, 37.
Werden die Summe der untersuchten organischen Säuren und die entsprechenden pH-Werte im Aufschlussüberstand betrachtet, scheinen weder die Variation der Reaktionstemperatur noch eine Änderung der Behandlungsdauer einen signifikanten Einfluss auf die freigesetzte Menge an Säuren zu haben. Lediglich die LHW-Behandlungen bei 160 °C für 180 min wiesen eine geringere Bildung an organischen Säuren und einen vergleichsweise hohen pH-Wert zwischen 4 und 5 auf. Zusätzlich konnte gezeigt werden, dass bei 180 °C und einer Behandlungszeit von 360 min die Bildung von Essigsäure forciert wurde. Verglichen mit den Aufschlüssen bei 180 °C (180 min) und bei 160 °C (360 min) entstand darüber hinaus wenig Ameisensäure.
Zusammenfassend ist festzuhalten, dass die Bildung von hydrothermalen Abbauprodukten über die Wahl der Prozessparameter deutlich beeinflusst werden kann. Somit ist es möglich für einen gewählten Organismus, der im letzten Schritt einer Bioraffinerie das gewünschte Zielprodukt herstellen soll, die möglichen Einstellungen der Aufschlussparameter einzugrenzen. Hierbei ist jedoch zu beachten, dass niedrige Inhibitorkonzentrationen gegebenenfalls mit geringen Aufschlusseffektivitäten einhergehen können, was in diesem Beitrag nicht thematisiert wurde.
3 Gras als Rohstoffquelle für Bioraffinerien
Gräser haben eine herausragende Stellung unter den weltweiten Kulturpflanzen. Sie stillen einen hohen Anteil unseres Nahrungsmittelbedarfs, entweder als Getreide oder als Futtermittel für Mich- und Mastvieh. Noch vor einem Jahrhundert hatten Gräser als Futtermittel für Pferde und andere Zugtiere, durch die ein Großteil der für Industrie und Mobilität benötigten Energie bereitgestellt wurde, auch eine herausragende Stellung als Energieträger. So wurde der Verbrauch eines Arbeitspferdes während der sechsmonatigen Saison im mittleren Westen der USA mit ca. 2,4 t Heu oder anderer krautiger Biomasse, 4,5 t Hafer und zusätzlichem frischem Gras durch Beweidung angegeben 38. Mit der steigenden Verwendung fossiler Energieträger haben die Bedeutung von Gräsern als Energielieferant und dadurch der Flächenbedarf für die Gewinnung von Gras beständig abgenommen. Dadurch wurden z. B. in den USA 32 Mio. Hektar für andere Nutzungen verfügbar. Durch die Suche nach erneuerbaren Energie- und Kohlenstoffquellen erlangen Gräser jetzt auch in ihrer Rolle als Energie- und Rohstofflieferant wieder wissenschaftliche Bedeutung.
Grünlandflächen, die in Deutschland zurzeit einen Anteil von ca. 28,3 % der landwirtschaftlichen Fläche ausmachen (Statistisches Bundesamt, 2019), bieten aufgrund der im Vergleich zu Ackerbauflächen geringeren Pachtpreise über eine Steigerung der Flächenleistung durch den Anbau von standortspezifischen Grassorten und einer optimierten Kaskaden- und Koppelnutzung ein großes Potenzial für eine enorme Steigerung der Wertschöpfung. Wegen des starken Rückgangs raufutterverzehrender Großvieheinheiten und eines veränderten Futterregimes mit einer silomais- und kraftfutterbetonten Fütterung hat das Grünland eine abnehmende Bedeutung für die Nutzung als Grundfutter und damit für die Ernährungssicherung 39. Da aber Grünlandflächen im Rahmen des sog. Greenings und aufgrund ihrer Bedeutung für den Klima-, Wasser, Boden- und Biodiversitätsschutz einem Schutzstatus unterliegen, müssen sie in den von Nutzungsauflassung bedrohten Gebieten alternativen wirtschaftlichen Verwertungsmöglichkeiten zugeführt werden. Außerdem weisen mehrjährige Gräser gegenüber konventionellen Energiefrüchten wie Getreide, Raps oder Mais zahlreiche Vorteile auf. Vor allem können Gräser im Gegensatz zu Getreide und Mais, die einer intensiven Landwirtschaft bedürfen, auch auf landwirtschaftlich weniger geeigneten Flächen angebaut werden. Außerdem ist bei einer höheren Energieproduktion und einer höheren Reduktion an Treibhausgasen im Vergleich zu einjährigen Energiepflanzen der Bedarf an Dünger und Pflanzenschutzmitteln geringer 40. Durch eine bessere Energieausbeute kann beispielsweise Miscanthus 61 % höhere Biomasseerträge liefern als Mais.
Als lignocellulotische Rohstoffe verfügen Gräser über Zellwände, die die Polysaccharide Cellulose und Hemicellulose enthalten. Die Cellulose von Gräsern unterscheidet sich nicht von der Cellulose in Typ-I-Zellwänden. Die Hemicellulose dagegen enthält Glucoarabinoxylane (20–30 % der Zellwand) anstelle von Xyloglucan, das nur 2–5 % der Zellwand ausmacht. Die Glucoronoarabinoxylane bestehen aus einem (1→4)-β-D-Xylan-Rückgrat mit t-α-L-Arabinofuranosyl-Einheiten und t-α-D-Glucuronsäuren an den O3- und O2-Positionen 41. Daneben können in bestimmten Entwicklungsstadien nichtcellulotische verzweigte mixed-linked-Glucane, vor allem Rhamnoglucane, bis zu 5 % der Zellwand ausmachen. An diesen sind in vielfältigen Konfigurationen und Größen Arabinane, Galactane und hochverzweigte Arabinoglycane gebunden 42.
Der Ligningehalt in Gräsern liegt – abhängig von der Art, dem betrachteten Gewebe und dem Alter der Pflanze – meist unter 10 %, häufig sogar unter 5 %, und somit wesentlich niedriger als in den meisten holzigen Pflanzen 43. Im Unterschied zur Zusammensetzung des Lignins von Dicoten enthält das Lignin von Gräsern erhebliche Mengen an Ferula- und p-Coumarsäure. Diese verankern über Esterbindungen mit den O5-Atomen der Arabinosyle das Lignin an der Hemicellulose. Da das Lignin aus Gräsern auch stärker kondensiert ist und einen höheren Phenylhydroxylgehalt hat, können mehr als 50 % des Lignins durch Alkali-Behandlung extrahiert werden 44.
3.1 Silage-Bioraffinerie
Eine Möglichkeit zur langfristigen Lagerung von Gras ist das Silieren. Damit steht der Rohstoff Gras ganzjährig für den Einsatz in Bioraffinerien bereit. Bei der Silierung wird das Gras, durch teilweise Umsetzung der enthaltenen Zucker zu Milchsäure, angesäuert und somit unter anaeroben Bedingungen konserviert 45, 46. Durch den Einsatz kommerziell erhältlicher Starterkulturen kann die Silierung optimiert werden. Aufgrund der Bildung organischer Säuren sinkt der pH-Wert von zuvor 6,0–6,5 auf 3,8–5,0. Dieser Gärprozess kann von einigen Tagen bis zu mehreren Wochen andauern. Nach Abschluss der Gärung ist die Silage unter Luftabschluss stabil. Analog zur treberbasierten Bioraffinerie 15, 20 besteht die Möglichkeit, dass in einem ersten Prozessschritt die Silage abgepresst wird und so ein Silagepresssaft gewonnen wird, der einerseits zur weiteren Verwendung in Fermentationen genutzt werden kann und andererseits bereits hohe Konzentrationen an Milchsäure, Aminosäuren und weiteren organischen Säuren enthält. Über derartige Verfahren ist bereits mehrfach berichtet worden. Gras- und Silagepresssaft wurden von Koller et al. als komplexe Stickstoff- und Phosphatquelle für die Herstellung von Poly(3-hydroxybutyrat) mit Wautersia eutropha 47 und von Anderson und Kiel für die Milchsäureherstellung eingesetzt, wobei mit Lactobacillus salivarius und Lactobacillus paracasei subsp. paracasei Ausbeuten von 0,9 bzw. 1,1 gMilchsäureggelöste Kohlenhydrate−1 erzielt wurden 49. Der Einsatz von Getreidesilagesaft bei der Produktion von Biomasse mit Kluyveromyces marxianus, Saccharomyces cerevisiae und Saccharomyces carlsbergiensis wurde von Hang et al. beschrieben. Bei aerobem Wachstum wurden ohne weitere Nährstoffzugaben Biomassekonzentrationen von 13,3, 12,6 und 12,7 g L−1 erreicht 48. Sieker et al. schilderten den Einsatz von Silagepresssaft für die fermentative Herstellung von Ethanol 50, 51. Da während der Silierung Milchsäure gebildet wird, ist die Aufarbeitung der Milchsäure aus Grassilage der zentrale Schritt der meisten Silage-Bioraffineriekonzepte. Dabei wird aber meist die Lignocellulosefraktion nicht weiter berücksichtigt bzw. zu Viehfutter, Biogas oder Isolationsmaterial weiterverarbeitet. Sieker et al. haben die Hydrolyse von Silagepresskuchen untersucht, da das dort angestrebte Konzept für die grüne Bioraffinerie die Gewinnung der, während der Silierung gebildeten, Milchsäure aus dem Silagepresssaft vorsah 50, 51.
3.1.1 Hydrolyse von Gras und Silage
Sollen alle in der Silage enthaltenen Kohlenhydrate zu Milchsäure umgesetzt werden, ist es sinnvoll, auf eine Fraktionierung der Silage in Presssaft und Presskuchen zu verzichten und die gesamte Milchsäure am Ende des Prozesses aus der Fermentationsbrühe abzutrennen. Hierzu müssen die strukturellen Kohlenhydrate aufgeschlossen und in eine für die Mikroorganismen verwertbare Form umgewandelt werden. Im Falle von grasartigen Rohstoffen reicht eine LHW-Vorbehandlung zur Verbesserung der enzymatischen Hydrolysierbarkeit aus (s. Sect. 2.3). Um eine vergleichende Bewertung der biotechnologischen Verwertbarkeit verschiedener Biomassearten zu ermöglichen, wurden pflanzliche Rohstoffe aus verschiedenen Quellen (landwirtschaftliche Betriebe, Dienstleistungszentrum ländlicher Raum, eigene Ernten usw.) gesammelt, vorbehandelt, enzymatisch hydrolysiert und daraufhin miteinander verglichen. Zur enzymatischen Hydrolyse wurden die Enzyme Cellic CTec2 und Cellic HTec2 (Novozymes A/S, Bagsværd, Dänemark) mit einer Beladung von 140 µL g−1 Cellic CTec2 und 160 µL g−1 Cellic HTec2 genutzt. Tab. 1 zeigt die entsprechenden Ergebnisse.
|
Rohstoff |
Vorbehandlung |
Glucose [g L−1] |
Xylose [g L−1] |
Fructose [g L−1] |
|---|---|---|---|---|
|
Rasenschnitt |
– |
0,6 |
0,4 |
0,4 |
|
LHW |
10,4 |
2,6 |
0,5 |
|
|
Winterweizen-Gesamtpflanzen-Silage |
– |
0,0 |
0,3 |
0,2 |
|
LHW |
12,9 |
4,8 |
1,3 |
|
|
Sida |
– |
0,0 |
0,0 |
0,0 |
|
LHW |
8,0 |
4,9 |
0,6 |
|
|
Silphie |
– |
1,1 |
0,0 |
0,1 |
|
LHW |
9,9 |
4,2 |
0,5 |
Für alle untersuchten Rohstoffe war die Anwendung einer LHW-Vorbehandlung bei 180 °C mit einer deutlich verbesserten Zuckerausbeute durch die anschließende enzymatische Hydrolyse verbunden. Eine Trocknung des Substrats vor dem LHW-Aufschluss hatte keine nachweisbaren Auswirkungen auf die Zuckerausbeute (Daten nicht dargestellt). Daher ist eine Trocknung im Zusammenhang mit einer Lagerung des Substrats vor der Weiterverwendung in Form eines LHW-Aufschlusses ohne Auswirkung auf die weitere Verwertung. Durch eine Steigerung der Temperatur auf 200 °C war eine Reduktion der Enzymbeladung auf ein Viertel der ursprünglichen Beladung ohne einen Rückgang der Zuckerkonzentrationen möglich (Abb. 5).

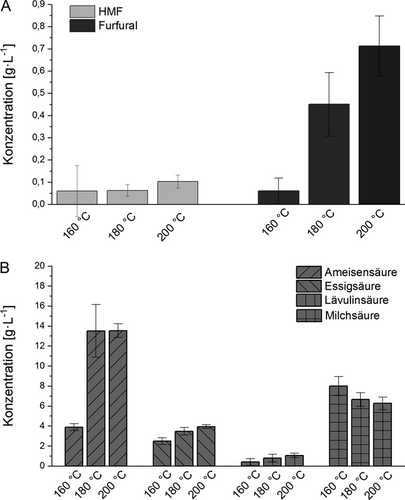
Allerdings wurden durch die hohen Temperaturen und den gesenkten pH-Wert, analog zu Treber, auch Monosaccharide weiter zu Inhibitoren wie HMF und Furfural oder organischen Säuren hydrolysiert. Die HMF-Konzentration variierte nur sehr wenig mit der Temperatur, was darauf hinweist, dass unter den im Vergleich zur z. B. sauren Hydrolyse relativ milden Bedingungen nur wenig Glucose weiter umgesetzt wurde (Abb. 6). Dagegen zeigte die Konzentration des gebildeten Furfurals einen starken Anstieg bei steigender Vorbehandlungstemperatur. Ebenso stieg die Konzentration organischer Säuren wie Ameisen-, Essig- und Lävulinsäure. Gleichzeitig war eine Abnahme der Milchsäure zu verzeichnen. Bezüglich der Inhibitorbildung und der Milchsäureabnahme wäre somit die Vorbehandlung bei einer niedrigen Temperatur angeraten. Diese würde aber in geringeren Glucoseausbeuten oder höheren Enzymeinsätzen resultieren. Eine Abwägung dieser gegenläufigen Tendenzen muss daher in der Beurteilung des Gesamtprozesses erfolgen.
3.1.2 Simultane Verzuckerung und Fermentation von Grassilage
Zur fermentativen Herstellung von Milchsäure aus Grassilage wurde Lactobacillus delbrueckii subsp. lactis als Produktionsstamm ausgewählt. Dieser erreicht hohe Milchsäureausbeuten und Konzentrationen. Darüber hinaus ist er thermotolerant und bildet Milchsäure auch bei Temperaturen über 50 °C 52, 53, was für Verfahren zur simultanen Verzuckerung und Fermentation (SSF), wie sie in diesem Fall durchgeführt wurden, vorteilhaft ist. Es hat sich allerdings herausgestellt, dass die in der Vorbehandlung gebildeten Inhibitoren die Milchsäurebildung fast vollständig unterbinden. Somit muss vor der Kultivierung ein Detoxifizierungsschritt durchgeführt werden (Abb. 7).
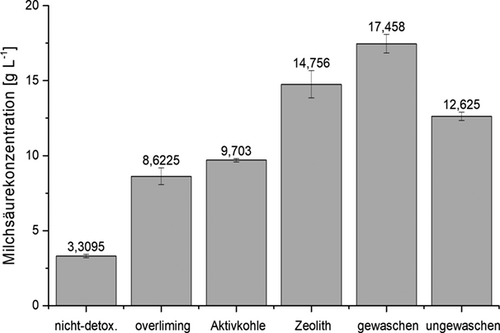
Durch alle hier verwendeten Detoxifizierungsansätze konnte die Milchsäurebildung gesteigert werden. Es hat sich jedoch herausgestellt, dass die effizienteste Vorgehensweise eine Fraktionierung der Silage in Presssaft und Presskuchen war. Bereits die Verwendung von Presskuchen im Vorbehandlungsschritt steigerte die Ausbeute auf 0,26 gMilchsäuregHydrolysatzucker−1. Dies beruht darauf, dass Bestandteile der Silage wie freie Monosaccharide, organische Säuren und Salze entfernt werden, die bei der Vorbehandlung entweder zu Inhibitoren umgesetzt werden können oder die Bildung von Inhibitoren begünstigen. Die höchste Milchsäureproduktion mit einer Ausbeute von 0,46 gMilchsäuregHydrolysatzucker−1 wurde bei der Fermentation des Hydrolysats aus gewaschenem Presskuchen erreicht, da hierdurch die bei der Vorbehandlung gebildeten Inhibitoren nahezu vollständig entfernt wurden. Da die Silage bereits Milchsäure enthält, die bei der Wäsche nach der Vorbehandlung verloren gehen würde, ist es wichtig, beim Pressen vor der Vorbehandlung möglichst viel dieser Milchsäure im Prozess zu belassen. Dabei wird die Silage zunächst gepresst, mit Wasser wieder angefeuchtet und anschließend ein zweites Mal gepresst. Die gewonnenen Presssäfte können anschließend entweder während der Fermentation oder in der Aufarbeitung in den Prozess zurückgeführt werden. Der resultierende Gesamtprozess ist in Abb. 8 dargestellt.

Um die Rohstoffvariabiliät zu testen, wurde die Vorbehandlung mit unterschiedlich gelagerten Silagen durchgeführt. Zum Einsatz kamen Ballen- und Fahrsilo-Silagen unterschiedlicher Landwirte. Je nach eingesetzter Silage kann es zu unterschiedlichen Gehalten an inhibitorischen Komponenten kommen. Durch den Detoxifizierungsschritt mit Waschung konnten diese Komponenten jedoch unabhängig von der Varianz nahezu vollständig entfernt werden. Die eingesetzten Silagen hatten unabhängig ihrer Lagerung in Ballenform oder als Fahrsilo ähnliche Zusammensetzungen. Es konnten 0,29 ± 0,04 gGlucosegFeststoff−1 und 0,21 ± 0,04 gXylosegFeststoff−1 ermittelt werden. Durch den LHW-Aufschluss konnte der Kohlenhydratgehalt in Form von Glucose um 70 % auf 0,49 ± 0,03 gGlucosegFeststoff−1 gesteigert werden. Die Hemicellulose konnte nahezu vollständig extrahiert werden. Auch in den entsprechenden enzymatischen Hydrolysaten konnten näherungsweise konstante Glucosekonzentrationen von 40,0 ± 2,9 g L−1 erzeugt werden. Dies entspricht ca. 82 % der maximal möglichen Glucoseausbeute. Die Rohstoffvariabilität sollte durch das Verfahren also insoweit minimiert sein, als das bis zu dem Schritt der Hydrolyse annähernd gleiche Cellulosegehalte in den eingesetzten LHW-extrahierten Silage-Presskuchen gegeben sind, die zu einer gleichen Konzentration an Glucose während der enzymatischen Hydrolyse führen. Der Einsatz der LHW-extrahierten, gewaschenen Silage-Presskuchen zur fermentativen Produktion von Milchsäure im Rahmen eines SSF ist somit grundsätzlich möglich. Ein beispielhafter Verlauf ist in Abb. 9 gezeigt.
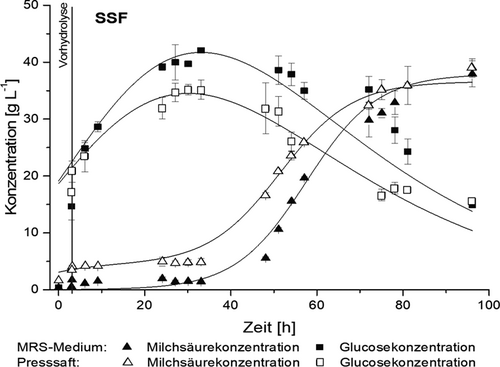
Verglichen werden in dem Fall zwei SSF-Prozesse, bei denen ein Prozess mit Presssaft (offene Symbole) und ein Prozess mit MRS-Medium (ohne Glucose, schwarze Symbole) durchgeführt wurden. Wie in der Abbildung ersichtlich ist, hatten beide Fermentationen ähnliche Verläufe, wobei durch den Einsatz des Presssafts die Milchsäurekonzentration zu Beginn erhöht war. Erreicht wurden in beiden Ansätzen ähnliche Milchsäurekonzentrationen von 38 g L−1 (SSF mit MRS-Medium) beziehungsweise 39 g L−1 (SSF mit Presssaft). Dies zeigt, dass Medienbestandteile wie Hefeextrakt vollständig durch den im Verfahren anfallenden Silagepresssaft ersetzt werden können, was zur Wirtschaftlichkeit des Verfahrens beiträgt.
4 Fazit
In dieser Arbeit wurden, mit Biertreber und Grassilage, zwei schwach verholzte Biomassearten im Hinblick auf ihre Verwertbarkeit in Bioraffinerien untersucht. Dabei wurde für Biertreber einerseits eine direkte Verwertung in Feststofffermentationen mit Cellulomonas uda bei milden Prozessbedingungen vorgeschlagen. Bei dieser Gemischtsäuregärung konnten hohe Ausbeuten für die Stoffwechselendprodukte (Bernsteinsäure, Milchsäure, Ameisensäure, Essigsäure und Ethanol) erzielt werden. Im Gegensatz dazu wurde die hydrothermale Vorbehandlung mit anschließender enzymatischer Hydrolyse zur Produktion von zuckerreichen Hydrolysaten untersucht. Der Fokus lag einerseits auf verschiedenen Upstreammethoden zur Zerkleinerung des Trebers, wobei sich die Verwendung einer Schneckenpresse als vorteilhaft herausgestellt hat. Andererseits wurde die Bildung hydrothermaler Abbauprodukte bei verschiedenen Prozessbedingungen beleuchtet.
Beim Einsatz von Grassilage hat sich die Fraktionierung in Silagepresssaft und -presskuchen mit anschließender Rückführung des Presssaftes in den Prozess als vorteilhaft gegenüber anderen Detoxifizierungsansätzen herausgestellt. Bei der Zugabe von Silagepresssaft zu Fermentationsmedien auf Basis von LHW-Hydrolysaten konnten mit Lactobacillus delbrueckii subsp. lactis essentielle Nährstoffe, wie sie in Komplexmedien enthalten sind (z. B. Pepton, Aminosäuren, Spurenelemente), bereitgestellt werden. Dadurch wurden ähnliche Milchsäurekonzentrationen erzielt, wie bei der Fermentation unter Zugabe des Standardmediums ohne Kohlenhydratquelle.
Acknowledgements
Diese Forschung wurde durch den Europäischen Fonds für regionale Entwicklung EFRE-Interreg (018-4-09-021) und das Bundesministerium für Landwirtschaft und Ernährung/Fachagentur für Nachwachsende Rohstoffe (FKZ 22018512) finanziert.
Wir bedanken uns herzlich bei Pascal Weingart (Technische Universität Kaiserslautern, Fachbereich Chemie, Erwin-Schrödinger-Straße 54, 67663 Kaiserslautern, Deutschland) für die Durchführung der Lipidmessungen von Biertreber.
Formelzeichen
-
- YPS [gProdgSub−1]
-
Produkt-/ Substratausbeute
Indizes
-
- Prod
-
Produkt
-
- Sub
-
Substrat
Abkürzungen
-
- HMF
-
Hydroxymethylfurfural
-
- LHW
-
liquid hot water
-
- MOPS-Puffer
-
3-(N-Morpholino)propansulfonsäure-Puffer
-
- MRS-Medium
-
De Man-, Rogosa- und Sharpe-Medium
-
- OS
-
Organosolv
-
- PK
-
Presskuchen
-
- SP
-
Doppelschneckenpresse
-
- SSF
-
simultane Verzuckerung und Fermentation
-
- TM
-
Trockenmasse
-
- TP
-
Tinkturenpresse




